Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Revista de Biología Tropical
On-line version ISSN 0034-7744Print version ISSN 0034-7744
Rev. biol. trop vol.57 suppl.1 San José Nov. 2009
Desarrollo embrionario y larva del sapo Incilius aucoinae (Bufonidae) en Golfito, Costa Rica
Susy Segura-Solís1 & Federico Bolaños2
1. Escuela de Biología, Universidad de Costa Rica. Dirección actual: Instituto Costarricense de Electricidad - Exploración subterránea; SSeguraS@ice.go.cr
2. Escuela de Biología, Universidad de Costa Rica, 11501-2060, San José, Costa Rica; bolanosv@biologia.ucr.ac.cr
Abstract: Embryonic development and larva of the toad Incilius aucoinae (Bufonidae) in Golfito, Costa Rica. The larva and developmental stages of Incilius aucoinae are described using specimens from Río Cañaza, Golfito, Costa Rica. We collected the individuals in January 1997, and January and February 1998. The total sample was 696 individuals, 317 eggs in 1-12 stages, 176 eggs with embryos in stages 15-16, and 204 tadpoles in stages 21-43. The average number of eggs per nest was 8 940 (n = 4). These eggs were laid in strings, attached to the river strata. Eggs in stages 1-12 had an average diameter of 1.75 (s = 0.38) mm and eggs with embryos in stages 15 -16 measured 1.33 (0.34) mm wide and 3.06 (1.46) mm long. The description of the tadpole based on UCR 19982 is as follows: dorsal, ventral surfaces, and tail are brown with dark brown spots. Length of tail 9.43 mm, body length 6.18 mm (total length 15.62). Translucent light brown small fins, dorsal fin with scattered spots, ventral fin without dark pigments. Dorsal-ventral flattened oval body with anteroventral snout. A few individuals had varied colors, from black (3.4%) to uniform (0.5-1.5%). Rev. Biol. Trop. 57 (Suppl. 1): 291-299. Epub 2009 November 30.
Key words: Incilius aucoinae, tadpole, amplexus, larval stages, Bufonidae, Golfito, Costa Rica.
La taxonomía y filogenia en los anfibios de América Central actualmente está sufriendo cambios drásticos y dinámicos, así mismo los renacuajos de un alto número de anuros, especialmente de aquellos que se reproducen en cuerpos de agua lótica, todavía no se conocen (Mendelson et al. 1999). Para Costa Rica Savage (2002) hace notar que hay especies de las que no se ha descrito el renacuajo; Livezey (1986) describió el renacuajo de Incilius coniferus, McDiarmid & Altig (1989) describieron el de Rhaebo haematiticus, Incilius holdridgei fue descrito por Novak & Robinson (1975), Incilius coccifer por McDiarmid & Foster (1981), Savage (1966) describió el de Incilius periglenes, Lips & Krempels (1995) el de Incilius fastidiosus y recientemente Köhler et al. (2000) describieron la larva de Incilius luetkenii.
Para el grupo de Incilius valliceps (de acuerdo a ONeill & Mendelson 2004) este es un resumen de cuáles larvas se conocen: el renacuajo de I. campbelli se recolectó recientemente pero no se ha descrito (Mendelson et al. 1999), en I. cavifrons la descripción (Shannon & Werler 1955) se hizo basada en un espécimen que no fue depositado en ningún museo (Mendelson et al. 1999); y ya están descritos los de I. cristatus (Altig 1970), I. macrocristatus (Korky & Webb 1973) e I. tutelarius (Mendelson et al. 1999). Para I. valliceps, Limbaugh & Volpe (1957) dan la descripción del desarrollo pero no hacen la descripción morfológica completa del renacuajo (Duellman & Trueb 1986). Este trabajo describe al renacuajo de I. aucoinae, no obstante aún queda por describir el de I. melanochlorus (Lips & Savage 1996, O´Neill & Mendelson 2004), así mismo el de I. spiculatus ni siquiera ha sido recolectado (Mendelson et al. 1999).
O´Neill & Mendelson (2004) recientemente reconocieron las poblaciones de la vertiente pacífica de I. melanochlorus (Savage 2002) como I. aucoinae. Éste sapo, como muchos otros anfibios, es muy poco conocido en aspectos ecológicos, reproductivos y morfológicos (estadios del desarrollo), habita en zonas de bosques lluviosos de los 20 a los 1 100 m de altitud (Mendelson et al. 1999). Esa distribución coincide aproximadamente con el área faunística Suroeste, propuesta por Savage (2002) y solamente hay un espécimen recolectado en la región de Chiriquí, Panamá (ONeill & Mendelson 2004).
Se presenta la descripción morfológica de 26 de los 46 estadios del desarrollo en I. aucoinae, información sobre los huevos, las nidadas y algunas relaciones con el entorno en que se desarrollaron.
Metodología
Los ejemplares fueron capturados en el río Cañaza, Golfito, Puntarenas, Costa Rica. La zona de estudio está en una sección de 360 m del río que se encuentra aguas arriba del Barrio Ureña 8°4040" N y 83°1128 W. La recolecta de huevos y larvas fue en enero de 1997 y enero-febrero de 1998.
Para determinar la cantidad de huevos puestos se capturó parejas de I. aucoinae en amplexo y se colocaron en una bolsa plástica transparente grande, se le puso sustrato de esa zona del río, agua y aire y la bolsa se dejó en el mismo sitio hasta la mañana. Se liberaron los adultos y los huevos se llevaron al laboratorio. Se contó el número de huevos, se pusieron en cuarios con sustrato del sitio en que se observó la pareja y a temperatura ambiente para seguir el desarrollo. Para la descripción de la morfología de huevos y larvas se tomaron 25-30 individuos de forma aleatoria cada 12 hr, para obtener representación de la mayor cantidad de estadios. El resto de los individuos que llegaron a la metamorfosis fueron liberados en el sitio donde la pareja fue capturada. Se clasificaron según el cuadro de estadios de desarrollo de huevos y larvas de anuros, propuesto por Gosner (1960) y sugerido como el sistema del desarrollode ranas y sapos por Duellman & Trueb (1986). Se preservaron en una solución de formalina al 5% y se depositaron en la colección de Herpetología del Museo de Zoología de la Universidad de Costa Rica, lotes UCR 19986 y UCR 19987 que incluyen todos los huevos y larvas exceptuando el ejemplar de referencia de la descripción del renacuajo, UCR 19982 que está en el estadio 30. Esta caracterización se hace siguiendo la descripción realizada por McDiarmid & Foster (1981) y con la terminología de Altig (1970). Además se utilizan otras referencias de la morfología y morfometría externa como la descripción del renacuajo de I. tutelarius (Mendelson et al. 1999) e I. luetkenii (Köhler et al. 2000).
Para tomar las medidas se fotografiaron los individuos en distintas posiciones, con un estereoscopio con cámara. Las imágenes se procesaron con el programa de cómputo "Scion Image", para realizar las mediciones, que se tomaron en milímetros al 0.001 mm más cercano. En los resultados para todas las mediciones se da el promedio con la desviación estándar en paréntesis y siempre se expresan en milímetros.
Resultados
Se observaron seis parejas en amplexo cuatro en la época reproductiva de 1997 y dos en la de 1998. En todas, el amplexo fue axilar, solo cuatro pusieron huevos y el macho los fertilizó. No hay relación entre los tamaños de machos y hembras (r = -0.357, p = 0.487) ni entre el tamaño de las hembras y el número de huevos puestos (r = 0.216, p = 0.784). Los huevos son puestos en una hilera. El número de huevos promedio por puesta fue de 8 940 (s = 1 300, ámbito = 7 489-10 639). Los huevos en estadios 1-12 tienen un promedio de diámetro de 1.75 (0.38, n = 317), mientras que cuando hay embriones en estadios 15 y 16 tienen un promedio de 1.33 (0.34, n = 176) de ancho y 3.06 (1.46, n = 176) de largo.
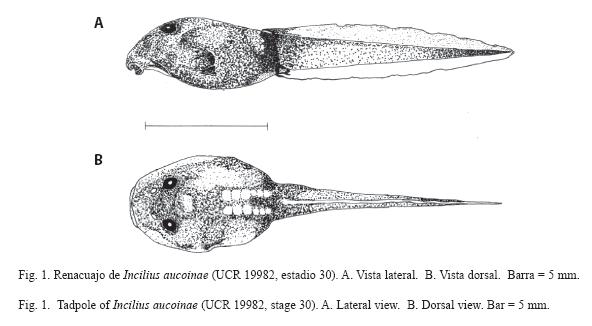
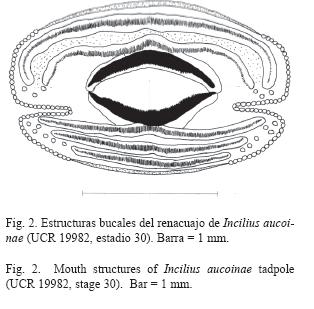
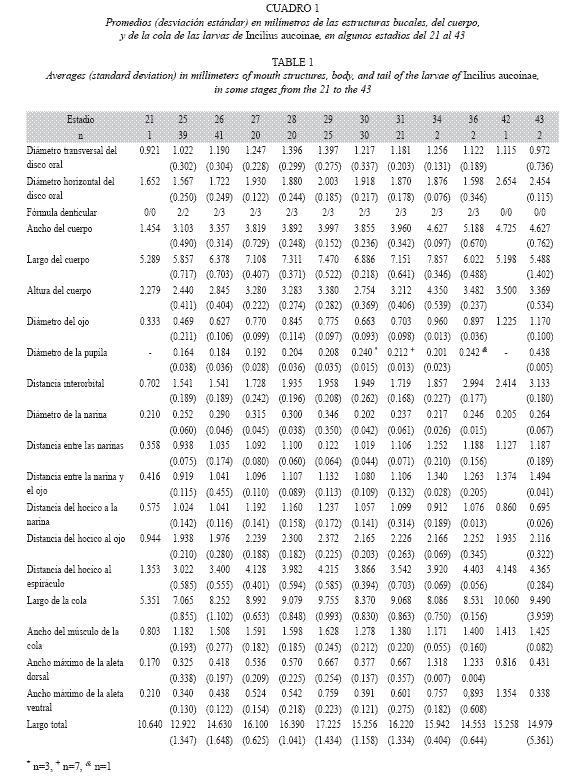
Descripción del renacuajo - UCR 1998 (Fig. 1 y 2): Longitudes redondeadas a dos decimales. Pequeño, longitud total 15.62 (cuerpo 6.18 y cola 9.43), cuerpo ovoide comprimido dorso-ventralmente (ancho 3.97 y alto 2.82).Ancho del músculo de la cola 1.54, ancho máximo de la aleta dorsal 0.72, ancho máximo de la aleta ventral 0.61 (Fig. 1A). Ojos dorsales, redondeados, diámetro 0.62, distanciados 1.71, diámetro de la pupila 0.26, distancia al hocico 2.03 y del ojo a la narina 0.92 (Fig. 1B). Narinas dorsales, ovaladas, parte más larga 0.34, separadas 1.00 y distancia al hocico 1.20. Espiráculo dispuesto lateralmente hacia abajo del eje longitudinal y del lado izquierdo, separado del hocico 3.30. Tubo anal derecho. Dorso, vientre y cola de color café y con puntos redondos de café oscuro en preservado. Disco oral pequeño con diámetro transversal 1.26 y horizontal 2.04, emarginado lateralmente y antero-ventral (Fig. 2). Con pico; dos filas de dentículos superiores y tres inferiores, todas completas. Fórmula papilar 1/1, algunas papilas individuales en otras partes de la boca, fila superior e inferior pequeñas e incompletas (Fig. 2).
Variación y desarrollo (Cuadro 1): Hay pico en todos los estadios, excepto en el 42 y 43. Disco oral (n= 199) emarginado en 99.0%, dos individuos en estadios 25 y 31 lo tienen completo. Papilas superiores (n= 189) incompletas en 92.6%, excepto 14 individuos (estadios 25-26 y 28-31), (n= 199) en una fila en 91.5%, excepto dos individuos con dos (estadios 25 y 30) y 15 donde estuvo ausente (estadios 25, 26, 29 y 31). Papilas inferiores (n= 191) incompletas en 82.7%, 33 individuos (todos los estadios) la tienen completa, (n= 199) en una fila en 91.5%, 7 individuos con dos (estadios 25 y 30) y en 10 no había (estadios 25, 29 y 31). Color dorsal (n=
204) café en 96.6% y negro en el resto. Puntos oscuros en 99.5%, un individuo es uniforme (estadio 31). Vientre (n= 204) café y con puntos en todos. Todos con cola (n= 204) café, 98.5% presentan puntos, solo tres son uniformes (estadios 30-31).
El desarrollo del huevo se inicia con una estructura esférica, dándose divisiones celulares desde el estadio 1 hasta el 9, en el 10 se inicia la gastrulación y termina en el 12. En los estadios 1-12 mide 1.74; del 13-20 es ovalado con ancho 1.33 y largo 3.06, y se desarrolla el embrión.
Eclosionan en estadio 21, la cornea es transparente; se distingue la boca, aunque todavía no se observan estructuras bucales como dentículos o pico y la aleta de la cola comienza a hacerse transparente. Siempre la aleta ventral es más pequeña que la dorsal. En el estadio 25 la abertura opercular se cierra del lado izquierdo y se forma el espiráculo, aparecen el pico y los dentículos en fórmula 2/2. En los estadios del 26-30 tienen una formula denticular 2/3, excepto dos con 1/2 (estadios 29-30), uno con 1/1 (estadio 34) y uno con 2/2 (estadio 36); aparecen y se desarrollan los miembros traseros. En el 31 comienza a diferenciarse el pie, como forma de paleta, éste se desarrolla y diferencia hasta culminar con un pie totalmente formado y con los 5 dedos casi totalmente diferenciados en el estadio 36 en el que la cola alcanza el máximo. El tamaño de los ojos y la distancia inter-orbital aumentan con el desarrollo, los ojos se desplazan hacia atrás. En la narina casi no hay crecimiento, desplazándose menos hacia atrás que los ojos. El ancho del cuerpo aumenta con el desarrollo. Del 42-43 cambian las estructuras bucales a una boca con mandíbulas típicas del adulto, ya no se da la presencia de pico y dentículos, y salen los miembros delanteros; la abertura de la boca crece desde la narina hacia el ojo; se da una reducción de la cola, quedando en el 43 apenas una pequeña parte de la misma.
Discusión
Incilius aucoinae se reproduce en ríos durante la época seca. Los huevos son uestos en una hilera cilíndrica adherida al sustrato, como habita en muchas especies de la familia Bufonidae (Duellman & Trueb 1986). A pesar de que utiliza cuerpos de agua lótica, el caudal durante la época seca es mínimo, esto asegura que los huevos y larvas no van a verse arrastrados aguas abajo, a pesar de que los huevos están sujetos al fondo. Ese es un ambiente que no es aprovechado por muchas especies, quizás por la razón anterior además de las características que debe tener la larva para ese ambiente. En Costa Rica otras especies relacionadas que usan ese hábitat son R. haematiticus, C. marinus, I. luetkenii e I. valliceps, mientras que el resto usan ambientes lénticos, lagos, cuerpos de agua temporales, sobre todo poco profundos o charcos (Altig & Johnston 1989, Köhler et al. 2000, Savage 2002). La especie estudiada posee un amplexo axilar, lo común en las especies de sapos de Costa Rica, excepto I. fastidiosus e I. holdridgei que utilizan un amplexo inguinal (Novak & Robinson 1975, Graybeal & de Queiroz 1992, Savage 2002). Chaunus marinus es el único sapo que comparte hábitat con I. aucoinae en el río Cañaza, de hecho se observaron reproduciéndose en los mismos momentos durante la época seca. La otra especie que podría estar presente es R. haematiticus que se conoce para la zona (Savage 2002). Las otras especies observadas en la época en que se reproduce esta son de otras familias, los hílidos Smilisca sordida y S. sila, y ocasionalmente cuando llueve algunos centrolénidos.
La nidada en I. aucoinae es de muchos huevos (8 940 en promedio) cuando se compara con otros Bufo (sensu lato). En I. holdridgei las nidadas tienen en promedio 74.6 huevos (Novak & Robinson 1975) y en I. fastidiosus es de 80-90 (Lips & Krempels 1995) dos de las especies en que se han reportado las nidadas más pequeñas. Las más grandes se reportan en C. marinus ovipositando de 2 500-12 500 huevos (Zug 1983). Con cantidades intermedias se tiene a I. coccifer con 2 000-4 000 (McDiarmid & Foster 1981) e I. luetkeni con 1 000-5 600 (Köhler et al. 2000). En este trabajo no se encuentra relación entre el tamaño de la hembra y del macho, ni en la cantidad de huevos puestos de seguro producto de la pequeña muestra encontrada, ya que esos aspectos deben influenciar el tamaño de la nidada (Stebbins & Cohen1995, Pough et al. 1998).
Las dos especies reportadas con pocos huevos también los tienen grandes, I. holdridgei con 2.76 mm de diámetro (Novak & Robinson 1975) e I. fastidiosus con 4.30 (Lips & Krempels 1995), adicionalmente I. periglenes con 3 mm (Jacobson & Vandenberg 1991) tres especies que usan charcos pequeños y que por lo menos en dos de ellas se ha reportado que al eclosionar la larva trae reservas alimenticias y no requieren alimentarse para finalizar el desarrollo larval (Novak & Robinson 1975, Jacobson & Vandenberg 1991, Savage 2002). La especie en estudio tiene huevos de tamaño intermedio, 1.75 mm de diámetro, comparables con los de las otras especies aunque hayan variaciones de tamaño, 1.8 en promedio para I. coniferus (Livezey 1986), en C. marinus con 1.7-2.0 mm (Zug 1983), 1.5 en I. luetkenii (Köhler et al. 2000), 1.37 en I. coccifer (McDiarmid & Foster 1981) y en I . valliceps el promedio es de 1.2 mm (Mendelson et al. 1999).
Las estructuras bucales y los hábitos de este renacuajo corresponden a lo que Savage (2002) clasifica como la forma generalizada, y ecomorfológicamente son larvas de ambientes lóticos (tipo II) con poco movimiento (tipo A), con un disco oral dirigido centralmente y de tamaño grande para sujetarse y raspar algas en el sustrato (ecomorfo 10). Es de forma ovoide y comprimido dorso-ventralmente (Fig. 1A), las especies R.haematiticus (McDiarmid & Altig 1989) e I. periglenes (Savage 1966) tienen renacuajos ovoides pero comprimidos lateralmente.
De los renacuajos de sapos en Costa Rica, I. aucoinae es el único de color café claro con puntos café oscuro, tanto en el dorso como en el vientre (Fig. 1, aunque hay excepciones de individuos negros), el de I. fastidiosus (Lips & Krempels 1995) es de color café chocolate, su vientre es gris. El de R. haematiticus (Scott 1983, McDiarmid & Altig 1989) e I. periglenes (Savage 1966, Jacobson & Vandenberg 1991) también poseen el dorso de color café, pero oscuro y uniforme, además el vientre en estas dos especies es claro y sin puntos. El renacuajo de I. holdridgei (Novak & Robinson 1975) se parece al de I. aucoinae ya que el dorso está muy pigmentado de café oscuro, pero el vientre es claro. Las otras especies tienen el dorso de color negro, en el caso de C. marinus (Savage 2002) e I. valliceps (Mendelson et al. 1999) el vientre es claro, en el último también el espiráculo es claro, en I. coniferus (Livezey 1986) e I. luetkenni (Köhler et al. 2000) el vientre es gris y en I. coccifer (McDiarmid & Foster 1981) aunque el vientre es claro se diferencia de los otros por tener manchas claras pequeñas en el dorso. Los ojos se encuentran en posición dorsal al igual que en I. fastidiosus, I. holdridgei, R. haematiticus e I. periglenes (Savage 2002).
En las estructuras bucales I. aucoinae es similar a I. fastidiosus (Lips & Krempels 1995) e I. holdridgei (Novak & Robinson 1975) porque en todas el espacio entre el borde de la boca y la primera fila de dentículos (A2, Fig. 2) como lo define Savage (2002) es moderado, mientras que en el resto de los renacuajos de esta familia en Costa Rica ese espacio es más amplio. La posición de la boca en I. aucoinae es antero-ventral (Fig. 1), al igual que en R. haematiticus (McDiarmid & Altig 1989) y al contrario de I. periglenes (Savage 1966) donde es ventral, en el resto de las especies es anteroventral dirigida ventralmente (Savage 2002). En la mayoría de las especies el disco oral es pequeño, menos del 67% del ancho del cuerpo, I. aucoinae (50%) no es la excepción (Fig. 2), mientras que en I. fastidiosus e I. coniferus es mediano (Savage 2002). En I. aucoinae el disco oral es emarginado, el único renacuajo con el disco completo es el de I. holdridgei (Novak & Robinson 1975). En todos los renacuajos de los sapos en Costa Rica, se da la presencia de pico en las estructuras bucales y una fórmula denticular 2/3 (Savage 2002). En I. aucoinae las papilas están presentes solamente en los bordes laterales de la boca (Fig. 2) y en una fila, mientras que C. marinus e I. periglenes tienen dos filas (Savage 2002).
Como otros renacuajos el de I. aucoinae tiene una cola corta (55% del largo total), que equivale a menos del 60% (Fig. 1), igual que en C. marinus, I. periglenes, I. coccifer e I. valliceps y a diferencia de lo que se da con R. haematiticus quien posee una cola larga, de más del 67% del largo total (Savage 2002). Las aletas de I. aucoinae son pequeñas (18% del alto total de la cola, menos del 20%, Fig. 1A), igual que en R. haematiticus y a diferencia de lo que sucede en I. fastidiosus, C. marinus, I. periglenes, I. coccifer e I. valliceps en los cuales esas aletas son moderadas (Savage 2002). En el caso de I. aucoinae las mismas son claras translúcidas, similar a I. fastidiosus(Lips & Krempels 1995) que también las tiene translúcidas pero en este caso son café olivo, mientras que las de R. haematiticus (McDiarmid & Altig 1989), C. marinus (Savage 2002) e I. periglenes (Jacobson & Vandenberg 1991) son claras, en I. coccifer hay pigmento oscuro disperso (McDiarmid & Foster 1981), en I. coniferus está moteado de negro (Livezey 1986), en I. luetkenii más bien son puntos oscuros dispersos (Köhler et al. 2000) y en I. valliceps están fuertemente moteadas de pigmento oscuro (Mendelson et al. 1999).
En resumen se puede diferenciar porque es el único renacuajo de las especies de Costa Rica que posee el cuerpo (dorso y vientre) y la cola de color café claro y punteado de café oscuro, con las aletas pequeñas café claro translúcidas, la aleta dorsal con puntos dispersos y la ventral sin ningún tipo de pigmento oscuro. También es el único ovoide con una tendencia a ser aplastado dorso-ventralmente (Fig. 1, Cuadro 1). Con la boca antero-ventral, característica que solo comparte con R. haematiticus y del cual se diferencia fácilmente ya que éste último tiene el dorso y cola oscuro uniforme y el vientre claro, además la cola es larga. Con el fin de facilitar la identificación de esta larva se elaboró una clave, que está basada en la presentada por Savage (2002) y las descripciones de la larvas de cada especie, pero con las modificaciones pertinentes que permiten incluir a esta, solo queda por incluir el renacuajo de I. melanochlorus para poder identificar todos los renacuajos de los Bufo (sensu lato) de Costa Rica.

Agradecimientos
A José Manuel Mora y Gerardo Umaña por sus sugerencias certeras en esta investigación y las revisiones que realizaron sobre el manuscrito. Danny Zamora realizó los dibujos de los renacuajos. Gerardo Chaves por su colaboración y la inclusión de los especímenes en los catálogos del Museo de zoología de la Universidad de Costa Rica. A un revisor anónimo por su exhaustiva y enriquecedora revisión del manuscrito. Esto es una contribución del Museo de zoología de la Universidad de Costa Rica.
Resumen
Se describe la larva y los estadios del desarrollo del huevo y larva de Incilius aucoinae utilizando especímenes del río Cañaza, Golfito, Costa Rica, recolectados en enero de 1997 y enero-febrero de 1998. La muestra fue de 696 individuos, 317 huevos en estadios 1-12, 176 huevos con embriones en estadios 15-16, y 204 renacuajos en estadios 21-43. El promedio del número de huevos por nidada fue de 8 940 (n = 4), los cuales fueron colocados en una hilera, sujetos al sustrato del río. Los huevos en estadios 1-12 tienen un promedio de diámetro de 1.75 (s = 0.38) mm y los huevos con embriones en estadios 15-16 miden 1.33 (0.34) de ancho y 3.06 (1.46) mm de largo. La descripción del renacuajo basada en el espécimen UCR 19982, es como sigue: el dorso, el vientre y la cola son de color café y punteado de café oscuro; la cola mide 9.43 mm y el cuerpo 6.18, para un tamaño total de 15.62; las aletas son pequeñas café claro translúcidas, la dorsal con puntos dispersos y la ventral sin ningún tipo de pigmento oscuro. También es el único renacuajo ovoide con una tendencia a ser aplastado dorso-ventralmente, y con la boca antero-ventral. Dentro de la variación observada, algunos individuos son de color negro (3.4 %) y pocos son uniformes (0.5- 1.5 %).
Palabras clave: Incilius aucoinae, renacuajo, amplexo, estado larval, Bufonidae, Golfito, Costa Rica.
Recibido 18-X-2007. Corregido 10-X-2008. Aceptado 16-XI-2008.
Referencias
Altig, R. 1970. A key to the tadpoles of the continental United States and Canada. Herpetologica 26: 180-207. [ Links ]
Altig, R & G.F. Johnston. 1989. Guilds of anuran larvae: Relationships among developmental modes, morphologies and habitats. Herpetol. Monog. 3: 81-109. [ Links ]
Duellman, W.E. & L. Trueb. 1986. Biology of amphibians. McGraw Hill Book Company, EEUU. [ Links ]
Gosner, K.L. 1960. A simplified table for staging anuran embryos and larvae with notes on identification. Herpetologica 16: 183-190. [ Links ]
Graybeal, A. & K de Queiroiz. 1992. Inguinal amplexus in Bufo fastidiosus, whit comments on the systematics of bufonid frogs. J. Herpetol. 26: 84-87. [ Links ]
Jacobson, S.K. & J.J. Vandenberg. 1991. Reproductive ecology of the endangered Golden toad (Bufo periglenes). J. Herpetol. 25: 321-27. [ Links ]
Köhler, G., E. Leer & J.R. McCraine. 2000. The tadpole of the Central American toad Bufo luetkenii Boulenger. J. Herpetol. 34: 303-306. [ Links ]
Korky, J. & R.G. Webb. 1973. The larva of the Mexican toad Bufo cavifrons Wiegmann. J. Herpetol. 7: 47-49. [ Links ]
Limbaugh, B.A. & E.P. Volpe. 1957. Early development of the Gulf Coast toad, Bufo valliceps Wiegmann. Amer. Mus. Novit. 1842: 1-32. [ Links ]
Lips, K.R. & D.M. Krempels. 1995. Eggs and tadpole of Bufo fastidiosus Cope, with comments on reproductive behavior. Copeia 3: 741-746. [ Links ]
Lips, K.R. & J.M. Savage. 1996. Key to the known tadpoles (Amphibia: Anura) of Costa Rica. Stud. Neotrop. Fauna Env. 31: 17-26. [ Links ]
Livezey, R.L. 1986. The eggs and tadpoles of Bufo coniferus Cope in Costa Rica. Rev. Biol. Trop. 34: 221-224. [ Links ]
McDiarmid, R.W. & R. Altig. 1989. Description of a bufonid and two hylid tadpoles from western Ecuador. Alytes 8: 51- 60. [ Links ]
McDiarmid, R.W. & S. Foster. 1981. Breeding habits of the toad Bufo coccifer in Costa Rica, with a description of the tadpole. Southwest Nat. 26: 353-363. [ Links ]
Mendelson III, J.R., P.C. Ustach & A.N. Montes de Oca. 1999. Description of the tadpole of Bufo tutelarius, natural history notes on the Bufo valliceps group, and a key to the tadpoles of the group. J. Herpetol. 33: 324-328. [ Links ]
Novak, R.M. & D.C. Robinson. 1975. Observations on the reproduction and ecology of the tropical montane toad, Bufo holdridgei Taylor in Costa Rica. Rev. Biol.Trop. 23: 213-237. [ Links ]
O´Neill, E.M. & J.R. Mendelson III. 2004. Taxonomy of Costa Rican toads referred to Bufo melanochlorus Cope, with the description of a new species. J. Herpetol. 38: 487-494. [ Links ]
Pough, F.H., R.M. Andrews, J.E. Cadle, M.L. Crump, A.H. Savitzky & K.D. Wells. 1998. Herpetology. Prentice Hall, Nueva Jersey, [ Links ] EEUU.
Savage, J. 1966. An extraordinary new toad (Bufo) from Costa Rica. Rev. Biol. Trop. 14: 153-167. [ Links ]
Savage, J.M. 2002. The amphibians and reptiles of Costa Rica: A Herpetofauna between two continents, between Two Seas. University of Chicago, Chicago, EEUU. [ Links ]
Scott, N.J. 1983. Bufo haematiticus (sapo, toad), p. 385. In D.H. Janzen (ed.). Costa Rican natural history. University of Chicago, Chicago, EEUU. [ Links ]
Shannon, F.A. & J.E. Werler. 1955. Notes on amphibians of the Los Tuxtlas Range of Veracruz, México. Trans. Kansas Acad. Sci. 58: 360-386. [ Links ]
Stebbins, R. & N. Cohen, 1995. A natural history of amphibians. Princeton University. Princeton, Nueva Jersey, EEUU. [ Links ]
Zug, G.R. 1983. Bufo marinus (sapo grande, sapo, giant toad, marine toad), p. 386-87. In D.H. Janzen (ed.). Costa Rican Natural History. University of Chicago, Chicago, EEUU. [ Links ]