Introducción
Los manglares cubren un 0.1 % de la superficie continental de la Tierra ( 81 485 km2) (Atwood et al., 2017), comprenden árboles y arbustos de al menos 70 especies (Krauss y Osland, 2019) que se ubican en las costas intermareales a lo largo de zonas tropicales y subtropicales del planeta (Godoy y Larceda, 2015; Woodroffe et al., 2016). Es tos halófitos tienen adaptaciones morfológi cas, fisiológicas y reproductivas que les per miten el crecimiento en condiciones salinas y anóxicas (Giri et al., 2011). Los bosques de manglar proporcionan cerca de 50 000 USD en servicios ecosistémicos por hectárea (Menéndez et al., 2020); pueden contener hasta 1023 Mg C·ha-1 (71-98 % se encuentra en el suelo), lo cual los coloca muy por encima del carbono total encontrado en los principales dominios forestales del mundo (200-400 Mg C·ha-1) (Donato et al., 2011); se les conside ra fitorremediadores de metales pesados, es pecies como Rhizophora sp. son capaces de bsorber hasta 95 % más metales que otras
plantas (Sundaramanickam et al., 2021); disminuyen las inundaciones hasta en un 70 % (Romañach et al., 2018); reducen el impacto de las olas en un 66 % en los primeros 100 metros del área de manglar (Menéndez et al., 2020); contribuyen al ahorro de 453 millones USD en daños evitados como la pobreza y 1000 millones USD por año en desastres naturales (Menéndez et al., 2018). Finalmente, entre los organismos que viven asociados a los manglares, los moluscos constituyen un componente importante de la dieta en humanos, en algunos casos, representan, incluso, la única fuente de ingresos por su alto valor comercial (Dias et al., 2007). Según Yahya et. (2020), estos bivalvos también contribuyen como fuentes minerales, de glucógeno y fármacos como antivirales.
A pesar de la trascendencia de los manglares, de 1996 al 2010, se estimó que prácticamente todos los del mundo habían sufrido algún tipo de deterioro antropogénico (Thomas et al., 2017); acorde con Polidoro et al. (2010), se han perdido cerca del 25-35 % de los manglares del planeta en un periodo de 50 años y, actualmente, se calcula que la tasa de disminución anual de estos bosques es del 0.16 % (Moschetto et al., 2021). En Costa Rica, los manglares comenzaron a ser impactados desde 1940 por el crecimiento poblacional y actividades agrícolas o acuícolas (López-Angarita et al., 2016). Según la Organización de las Naciones Unidas para la Alimentación y la Agricultura (FAO, 2007), la cobertura de manglar disminuyó de 63 400 hectáreas en 1980 a 41 000 hectáreas en el 2005, y Hernández-Blanco et al. (2018) señalan una pérdida anual del 1.3 % entre 1980 y el 2013. El 99 % de los manglares de Costa Rica se ubica en el Pacífico, entre los cuales se pueden mencionar el Estero Puntarenas y sus manglares asociados que se encuentran bajo el manejo del Área de Conservación del Pacífico Central. Estos han tenido una pérdida, desde 1945 y hasta el 2018, de 865.7 ha y aún se encuentran amenazados por el crecimiento poblacional, la sedimentación y actividades agrícolas (Sistema Nacional de Áreas de Conservación (SINAC), 2018a). De acuerdo con el SINAC (2019), solo para los manglares del golfo de Nicoya se han identificado 27 presiones que afectan de manera negativa estos ecosistemas.
Entre los poblados que se relacionan con los manglares de Puntarenas, se encuentra Chacarita, el cual, desde inicios de 1970, ha sufrido cambios de uso de suelo (allí se localizan pueblos como el 20 de Noviembre y Fray Casiano), además, se le deben añadir otras presiones como el establecimiento de cañeras, tala de árboles y extracción de recursos como pianguas (Anadara tuberculosa) (Jiménez, 1999). En este sentido, Acuña et al. (1998) informaron otras problemáticas como el vertido de efluentes por parte de los habitantes colindantes al manglar. Según el SINAC (2018a), con la aprobación del Plan de Manejo del Estero de Puntarenas, manglares como los de Chacarita se encuentran bajo una categoría de mínima intervención, con la meta de implementar acciones a futuro que colaboren en la disminución del impacto sobre todo proveniente del agro.
En el contexto de esta investigación, se busca evaluar las condiciones del manglar de Chacarita en la zona costera del Pacífico Central de Costa Rica, a través de la estructura y composición forestal, así como cuantificar las poblaciones de moluscos de interés comercial asociados, con el fin de proponer actividades de aprovechamiento sustentables con el manglar, como turismo comunitario con fines educativos.
Metodología
Área de estudio
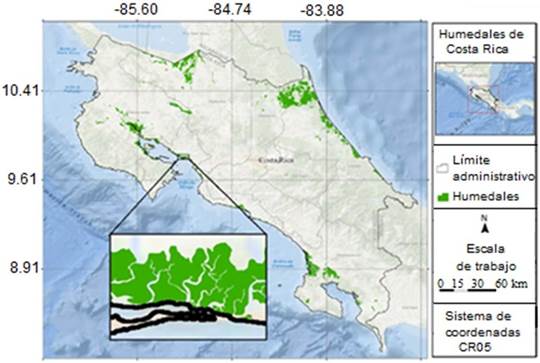
El manglar de Chacarita, ubicado en la ciudad de Puntarenas, Pacífico Central de Costa Rica, se localiza a 9°58’48” latitud y -84°46’12” longitud. Este sitio presenta una superficie total de 210 hectáreas (figura 1). El inventario de manglares y la extracción de moluscos bivalvos se realizaron en las zonas cercanas a los canales, donde hay mayor influencia antropogénica que representa un equivalente a 140 hectáreas susceptibles de muestreo.
Esta zona se caracteriza por poseer suelos hidromórficos comunes de manglar, conformada por Rhizophora mangle, Rizophora racemosa, Laguncularia racemosa, Avicennia germinans, Avicennia bicolor, Pelliciera rhizophorae y Conocarpus erectus (SINAC, 2018a). El principal río corresponde al Naranjo, el cual desemboca directamente en el manglar. En esta área, los rangos de altitud intermareal se encuentran entre 0 y 3 m s. n. m., las temperaturas medias anuales pueden oscilar entre 22º y 33 ºC (es posible que presenten variaciones), la precipitación promedio anual es de 1817 mm y están limitados tierra adentro por fincas dedicadas a la agricultura, ganadería, producción de sal y camarones (SINAC-Instituto Costarricense de Pesca y Acuicultura (INCOPESCA), 2019). La ciudad de Puntarenas, donde está ubicada el área de estudio, posee una formación geológica reciente (Denyer et al., 2004) según el Atlas del Instituto Tecnológico de Costa Rica (Ortíz y Soto, 2014), se sitúa en el Cuaternario, correspondiente a la última subdivisión del tiempo geológico, y cubre aproximadamente 2.6 millones de años.
Muestreo de la estructura y composición del manglar
Se utilizó la guía rápida del SINAC (2016), la cual constó de tres transectos per pendiculares al espejo de agua, cada uno conformado por tres cuadrantes de 25 m2 y a una distancia de 10 m de cada cuadrante. Se usó solo un cuadrante por transecto al azar y se analizó un total de 36 cuadrantes durante el año de estudio. Las visitas al manglar se realizaron una vez al mes durante un año (2020-2021), con el fin de establecer un inventario de manglares y estimar el carbono almacenado. En cada punto de muestreo, se tomó del agua superficial la temperatura (°C), con un multiparámetro de marca comercial YSI, y la salinidad, (ppm) con un refractómetro.
En cuanto a la base florística de especies núcleo, solo se consideró la biomasa viva. Los árboles fueron identificados según Pizarro et al. (2004). Se midió la altura (m) con un hipsómetro Nikon. Se obtuvo el diámetro de la altura de pecho (DAP en cm) de cada individuo mayor o igual a 5 cm de diámetro. Se calculó el índice de valor de importancia (IVI) por especie de árbol, el cual se logró sumando la frecuencia relativa parcelas que contienen cada especie entre el total de parcelas), la abundancia relativa cantidad por especie entre el total de todas las especies) y la dominancia relativa (suma del área basal de cada árbol por especie entre el total del área basal de todas las especies) Parray et al., 2021).
No es un servicio ecosistémico como tal, pero, como esta investigación tiene fines reflexivos hacia la protección del manglar, se estimó la cantidad de carbono almacenado, a través del cálculo de la biomasa aérea, en raíces y en raíces fúlcreas.
Se empleó la fórmula de Chavé et al. (2005) para el cálculo del carbono de la biomasa aérea
(CBA, Ec. 1): CBA = 0.0509·ρ·DAP·A Ec. 1
dónde ρ corresponde a la densidad gravitacional de la madera, DAP es el diámetro de la altura de pecho y A es la altura. Las densidades de la madera se obtuvieron de Zanne et al. (2009) y, para Pelliciera rizhophorae, de Southwell y Bultman (1971).
Se utilizó la fórmula de Komiyama et al. (2005) para el cálculo de la biomasa en raíces (CBR) (Ec. 2):
CBR = 0.199·ρ·0.899·DAP2.22 Ec. 2
En el caso de los mangles Rhizophora mangle que poseen amplias raíces aéreas, se usó la siguiente fórmula (Ec. 3), que permite calcular la biomasa almacenada en las raíces fúlcreas (CBF) (Smith y Whelan, 2006):
log10 (CBF) = 0.160·log10·DAP-1.041 Ec. 3
Una vez que se llevaron a cabo las estimaciones de biomasa, se obtuvo la transformación a carbono (Mg C), para la que se utilizó el factor de conversión de 0.464 g C por cada gramo de biomasa (Kauffman et al., 2011). La cantidad de carbono se multiplicó por el factor 3.67, para determinar el equivalente a CO2 (Mg C).
Moluscos bivalvos de interés comercial para consumo humano
La captura se centró en las siguientes especies: Leukoma spp., Mytella guyanensis, Anadara tuberculosa y Anadara similis. Se utilizaron los mismos transectos mensuales (durante un año, 2020-2021) establecidos para la base florística, solo que, para este caso, se muestrearon los tres cuadrantes de los tres transectos (se usaron en total 108 unidades de muestreo). En este proceso de extracción, fue necesario contar con la colaboración de dos personas de la comunidad de Chacarita con experiencia en la temática, quienes estuvieron presentes durante todos los muestreos.
A los moluscos extraídos se les determinó si se encontraban en la talla de primera madurez; para el caso de Leukoma spp. y Mytella guyanensis, se tomó en cuenta la recomendación de Wehrtman (2017) y para el de Anadara sp., se siguió la Ley de tallas mínimas de la República de Costa Rica, 13371-A (1982). A los especímenes se les midió la longitud (L) con un calibrador de precisión de 0.1 mm y se obtuvo la masa total húmeda (g), la masa de todas las secciones blandas (g) y la de masa visceral con gónada (g, estómago y hepatopáncreas), mediante una balanza digital con precisión 0.01g. Se especificó el sexo (macho: ♂; hembra: ♀), el índice gonadosomático (IG; masa gonadal/masa visceral · 100; Marshall, 1960), el índice de rendimiento de carne (IR; masa visceral/masa total · 100; Cruz y Palacios, 1983) y la madurez sexual, de acuerdo con Cruz (1984), para todos los organismos. Se calculó la relación masa total (g) y longitud (cm) para cada especie. Finalmente, se obtuvo el IVI que fue estimado como la suman de la frecuencia relativa, la abundancia relativa y la dominancia relativa.
Evaluación económica de servicios ecosistémicos
Se tomó el valor económico del carbono almacenado por hectárea en el área de estudio, utilizando el costo marginal de reducción del carbono (MAC), el cual, según Hernández-Blanco et al. (2021), está definido como el costo económico de eliminar una unidad adicional de emisiones de carbono, para lo que se utilizó el valor asignado por Fisher et al. (2007) de 125 USD por tonelada de carbono.
En el caso de los moluscos bivalvos de interés comercial, la cantidad obtenida de individuos se extrapoló al área de estudio analizada, de acuerdo con su frecuencia de aparición; no se tomó en cuenta Mytella guyanensis, pues la muestra no se consideró representativa y se le asignó un valor económico directo, según el precio de mercado estipulado en las bases de datos del Departamento de Estadística del INCOPESCA, los cuales correspondieron a 15.85 USD el kilogramo de Anadara sp. y 1.2 USD el de Leukoma spp., ambos montos sin concha. A este mismo departamento, y para apoyar el punto anterior, se le solicitó también la base de datos que se informa para los acopios en Chacarita, referida a peces que realizan sus primeros estadios en el manglar: “agria cola”, “clase”, “primera pequeña”, “primera grande”, “pargo”, “pargo mancha” y moluscos bivalvos, específicamente, para Anadara sp., Leukoma spp. y Mytella guyanensis (1.8 USD el kilogramo sin concha). Las variables de la base de datos que se analizaron fueron: especies que se extraen, kilos reportados y precio económico (USD), en el periodo 2008-2017 (datos disponibles al momento de la escritura de este artículo).
Finalmente, como en el área en estudio el turismo no es una actividad que se implementa en la actualidad, se realizó una valoración indirecta, hipotetizando un escenario en el cual se utilizaron los datos de visitación (2011-2019, únicos disponibles) de un parque temático marino especializado en educación ambiental, que se encuentra localizado en la ciudad de Puntarenas, Costa Rica (Parque Marino del Pacífico, PMP), cercano al área explorada; se tomaron como “posibles clientes” dispuestos a pagar (USD) por tours educativos a lo largo del manglar, si se les brinda una adecuada publicidad del sitio. Se efectuó una encuesta a 100 visitantes mayores de 18 años del PMP, en la que se les hicieron tres preguntas, con el fin de estimar el precio aproximado de esos viajes a través del manglar y un porcentaje posible de personas interesadas en adquirirlos; las interrogantes fueron: 1) ¿Conoce el manglar de Chacarita?, 2) ¿Está dispuesto (a) a visitarlo en un tour? y 3) ¿Cuánto está dispuesto a pagar por un tour que incluya tres horas de viaje, un refrigerio y charla ambiental?
Análisis de datos
La altura y el diámetro de los árboles de manglar, así como la longitud, la masa total y la masa de tejidos suaves de los moluscos fueron evaluados mediante prueba de Kruskal-Wallis y la prueba post hoc de mínima diferencia significativa (Least Significant Difference - LSD, P < 0.05), para determinar las diferencias significativas entre las especies (árboles de manglar o moluscos). Fueron probados todos los supuestos estadísticos para el análisis de varianza, como la normalidad y homogeneidad de los residuos. Se realizaron modelos de regresión lineal para la relación entre la altura (A) y el diámetro de los árboles de manglar (DAP) por especie (A = 𝛽0 + 𝛽1 · DAP; 𝛽0 y 𝛽1 son coeficiente del modelo). Asimismo, se realizó regresiones polinomiales de segundo grado para la relación entre la longitud (L), la masa total (MT) y la masa tejidos suaves (MTS) de las especies de moluscos (MT o MTS = 𝛽0 - 𝛽1 · L + 𝛽2 · L2; 𝛽0, 𝛽1 y 𝛽2 son coeficiente del modelo). Todos los análisis estadísticos se hicieron con el lenguaje de programación R, versión 3.6.1 (RCoreTeam, 2020), con un nivel de significación de α = 0.05.
Resultados
Estructura y composición del manglar
La temperatura se mantuvo constante en 27.5 ± 0.3 oC (media ± SD). En los meses de estación seca, la salinidad fue de 21.59 ± 3.54 ppm y en los meses de estación lluviosa correspondió a 6.13 ± 2.78 ppm. Se hallaron cinco especies de mangles; Pelliciera rhizophorae fue la de mayor índice de valor de importancia, seguido por Rhizophora racemosa. Por otro lado, la especie de menor importancia resultó ser R. mangle (Tabla 1).
En cuanto a la altura y DAP, respectivamente: L. recemosa presentó 5.03 ± 1.73 m (media ± SD, 2.52-6.88 m) y 13.99 ± 9 cm; P. rhizophorae, 4.71 ± 1.98 m (1.68-9.88 m) y 15.27 ± 7.32 cm; R. racemosa, 4.54 ± 1.61 m (2.34-9.74 m) y 20.63 ± 8.92 cm; R. mangle, 4.19 ± 1.44 m (2.55-7.27 m) y 15.45 ± 11.43 cm; y A. germinans, 3.30 ± 1.63 m (1.80-5.50 m) y 22.04 ± 20.50 cm. El 99 % de los individuos se encontró en las clases diamétricas entre 5 y 50 cm (16.84 ± 9.73 cm) y específicamente el 90 % se halló en el intervalo 5-31.25 cm. Solamente, A. germinans se muestrearon árboles de hasta 50.93 cm de diámetros.
La sumatoria de las reservas de carbono encontradas solamente en los cuadrantes muestreados correspondió a 4.29 Mg C de R. racemosa, 4.96 Mg C de P. rhizophorae, 1.51 Mg C de A. germinans, 1.02 Mg C de R. mangle y 0.64 Mg C de L. racemosa; donde se obtuvo un promedio, por cuadrante, de 0.2 ± 0.19 Mg C. Al realizar la extrapolación a toda el área de estudio, se alcanzó un total de 16 484.03 Mg C, lo cual es equivalente a 78.49 Mg C·ha-1 (33.27 Mg C ha-1 en raíces y 45.21 Mg C·ha-1 sobre el suelo; figura 2). La equivalencia total a CO2 fue de 288.05 Mg C·ha-1.
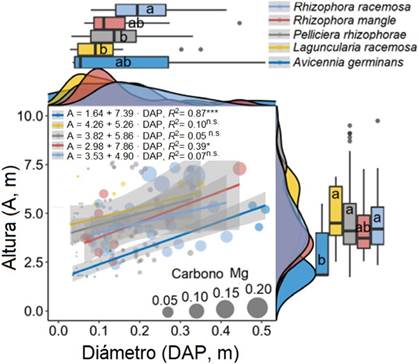
Nota: Fuente propia de la investigación.
Figura 2 Relación entre el diámetro de altura de pecho (DAP) y altura del árbol (A) de las cinco especies de mangles en el área de estudio. El tamaño de los círculos indica el contenido de carbono por árbol. Las letras iguales señalan no diferencias estadísticamente significativas entre las especies de manglar para el diámetro o la altura de los árboles (LSD, P > 0.05).
Tabla 1 Índice de valor de importancia (IVI, %) de los árboles de manglar en Chacarita,
| Especie | Dominancia (%) | Abundancia (%) | Frecuencia (%) | IVI (%) |
|---|---|---|---|---|
| Pelliciera rhizophorae | 41.4 | 53.6 | 36.1 | 43.7 |
| Rhizophora racemosa | 30.1 | 20.5 | 34.7 | 28.4 |
| Avicennia germinans | 15.3 | 8.4 | 6.9 | 10.2 |
| Laguncularia racemosa | 6.3 | 10.8 | 11.1 | 9.4 |
| Rhizophora mangle | 6.9 | 6.6 | 11.1 | 8.2 |
| Total | 100 | 100 | 100 | 100 |
Nota: Fuente propia de la investigación.
Poblaciones de molusco de interés comercial
Se obtuvo un total de 357 organismos (figura 3), de los cuales el 18 % correspondió a Anadara similis, el 37.5 % a Anadara tuberculosa (ambas conocidas como pianguas), 41.46 % a Leukoma spp. y 3.08 % a Mytella guyanensis. La distribución de los organismos no fue homogénea en el área de estudio.
Poblacionalmente, la especie de bivalvo con mayor índice de valor de importancia correspondió a Anadara tuberculosa, seguida por Leukoma spp. (Tabla 2).
Con respecto al índice gonadosomático (media ± SD), solamente se analizaron las tres especies de mayor índice de valor de importancia. Leukoma spp. presentó un índice de 22.70 ± 15.00 %, A. similis de 18.88 ± 7.58 % y A. tuberculosa de 18.05 ± 12.69 %. En cuanto a la proporción de sexos, la de Leukoma spp. fue 1♂: 2.6♀ (56♀ %, 21 % indefinidos, 23♂ % y el 34 % con un estadio de madurez de 3 a 4); la de A. tuberculosa, 1♂: 1.2♀ (46 % ♀, 15 % indefinidos, 39 ♂ % y el 21 % con un estadio de madurez de 3 a 4); y la de A. similis, 1♂: 7♀ (77 % ♀, 13 % indefinidos, 11♂ % y el 50 % con un estadio de madurez de 3 a 4). A. similis mostró una longitud de 4.01 ± 1.13 cm, el 80 % de los organismos se encontró en tallas menores a 4.7 cm; A. tuberculosa, 4.50 ± 1.16 cm, el 60 % fueron valores menores a 4.7 cm; y Leukoma spp., 3.41 ± 0.82 cm, el 97 % se encontró sobre los 1.2 cm (talla de primera madurez). Finalmente, se obtuvo para A. similis una masa total de 17.29 ± 13.86 g (con concha) y de partes blandas (sin concha) de 5.29 ± 2.69 g (26.92 ± 17.00 % IR - índice de rendimiento de carne); A. tuberculosa, 29.00 ± 20.34 g y 5.76 ± 3.30 g (21.74 ±
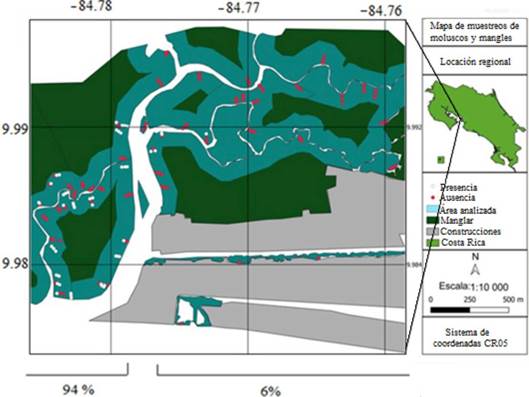
Nota: Fuente propia de la investigación
Figura 3 Ausencia (puntos rojos) y presencia (puntos blancos) de moluscos bivalvos de interés comercial para consumo humano en el área de estudio. Los porcentajes reflejan la cantidad de organismos muestreados en ambos lados del río Naranjo.
Tabla 2 Índice de valor de importancia (IVI, %) de moluscos en el manglar de Chacarita, Puntarenas, Costa Rica
| Especie | Dominancia (%) | Abundancia (%) | Frecuencia (%) | IVI (%) |
| Anadara tuberculosa | 57.3 | 37.5 | 45.3 | 46.7 |
| Leukoma spp. | 26.1 | 41.5 | 29.2 | 32.3 |
| Anadara similis | 16.2 | 17.9 | 19.8 | 18.0 |
| Mytella guyanensis | 0.4 | 3.1 | 5.7 | 3.0 |
| Total | 100 | 100 | 100 | 100 |
Nota: Fuente propia de la investigación.
9.05 % IR); y Leukoma spp., 12.46 ± 7.07 g y 2.71 ± 1.62 g (27.77 ± 15.14 % IR), respectivamente (figura 4).
Valoraciones de los servicios visitan áreas cercanas al lugar de estudio. Ecosistémicos
Se obtuvo un total de 346 organismos (solamente referido Anadara sp. y Leukoma spp.) que extrapolados al área de estudio correspondieron a 44 178 organismos de Anadara sp. (241.48 kg de carne) y 31 567 de Leukoma spp. (81.38 kg de carne), equivalentes a 27.3 USD·ha-1 para Anadara sp. y a 0.7 USD·ha-1 para Leukoma spp. Por otra parte, las reservas de carbono representaron 9812.63 USD·ha-1. Con respecto a los datos referidos al acopio de Chacarita, el lugar ha recibido, del 2008 al 2017, por concepto de peces, un total de 537 940.49 USD (219 674.99 kg) y de bivalvos 133 788.55 USD (18 629.34 kg); si bien es cierto no son recursos capturados en el manglar de Chacarita, sí representan ingresos económicos para la comunidad de manera indirecta. En cuanto al turismo, al menos 1331 personas por año dispuestas a pagar por educación ambiental visitan áreas cercanas al lugar de estudio. De acuerdo con la encuesta realizada a visitantes, el 50 % de las personas conoce dónde está localizado el manglar de Chacarita, el 92 % está dispuesto a visitar el manglar y el 76.8 % está anuente a pagar entre 25 y 32 USD (promedio 28.5 USD) por un tour, lo que podría representar hasta 34 000 USD al año para la comunidad.
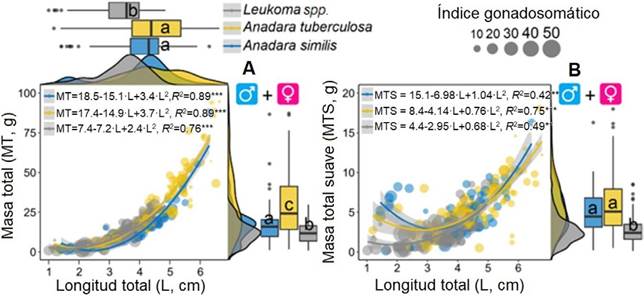
Nota: Fuente propia de la investigación
Figura 4 Relación entre la longitud, la masa total (A) y la masa de tejidos suaves (B) para las tres especies de moluscos bivalvos de mayor IVI en el área de estudio. El tamaño de los círculos indica el índice gonadosomático por individuo. Las letras iguales indican no diferencias estadísticamente significativas entre las especies de molusco para la longitud total, la masa total o la masa de tejidos suaves (LSD, P > 0.05).
Discusión
En este estudio se identificaron cinco especies de manglar, de las cuales P. rhizophorae y R. racemosa presentaron los mayores IVI, lo cual coincide con Jiménez (1994), al indicar que son las de mayor importancia en la costa Pacífica de América Central. Esto podría generar entre ellas una competencia por espacio (Acuña et al., 2018), incentivada por gradientes de salinidad (Mainardi, 1995), donde P. rhizophorae se beneficia más de las bajas salinidades (Garzón-Bautista et al., 2018). Lo anterior fue corroborado por Rincón et al. (2020), al afirmar que la salinidad es uno de los aspectos más determinantes en la distribución, el establecimiento y el crecimiento de las especies de manglar.
Además, a P. rhizophorae y R. racemosa, al mostrar las mayores abundancias y frecuencias, se les puede atribuir una distribución más horizontal. Las otras especies con menor IVI se pueden definir como conglomerados más localizados, tal como ha sido descrito por otros autores (Barrantes y Cerdas, 2014), posiblemente influenciados por la distribución de sus propágulos (Delgado et al., 2001) o por otros factores como gradientes ambientales, procesos físicos o patrones morfológicos (Samper y Silva, 2014).
Las clases diamétricas obtenidas en esta investigación coinciden con lo informado por Pineda (2021) para el Humedal Estero Puntarenas y sus Manglares Asociados. Cabe recalcar que, al encontrarse el 90 % de organismos entre las clases diamétricas de 5 a 31.25 cm, esto es indicativo de un proceso de regeneración del manglar, posiblemente incentivado por los asentamientos humanos o la actividad agrícola que ha generado reforestación a través del tiempo.
Con respecto al nivel del carbono, esta indagación encontró bajas reservas de tal elemento, en comparación con otros trabajos como el de Cifuentes et al. (2014), quienes informaron valores de carbono en mangles de Puntarenas entre 92 y 99 Mg C·ha-1 y en raíces entre 47.93 y 53.34 Mg C·ha-1; sin embargo, estos autores utilizaron otras fórmulas alométricas para el cálculo del carbono superficial, como la de Imbert y Rollet (1989), la de Smith y Whelan (2006) y la de Fromard et al. (1998). Por lo tanto, para realizar una comparación más real, usamos las mismas fórmulas que Cifuentes et al. (2014), con los datos recolectados para este estudio y se obtuvo un carbono total de 114.41 Mg C·ha-1 (81.14 Mg C·ha-1 en el nivel superficial), lo que representó un 45 % más de nuestro dato inicial reportado.
Por otro lado, en esta investigación los valores de carbono son mayores a los publicados por Agraz-Hernández et al. (2020) en México, los cuales utilizaron las mismas fórmulas alométricas, obtuvieron valores de carbono de 42.97 Mg C·ha-1 y estos bajos valores los relacionaron con la alta sedimentación del manglar, la presión por cambio de uso de suelo y los asociaron a un bosque secundario. En general, el carbono almacenado sobre el suelo, informado en este trabajo, es inferior al promedio mundial para manglares (78 ± 64.5 Mg C·ha-1), posiblemente enlazado a que es un bosque en regeneración y el 70 % de las variaciones en carbono están ligadas a la edad de los mangles (Estrada y Soares, 2017). Sin tomar en cuenta la fórmula alométrica que se emplee, el carbono arriba del suelo representa solamente 13-22 % de todo el carbono del sistema (Kauffman et al., 2011); por ello, el carbono en nuestra área de estudio es menor a las investigaciones citadas.
Con respecto a los moluscos, la diferencia en la cantidad de organismos muestreados en ambos lados del río Naranjo podría estar relacionada con la sedimentación acarreada por el mismo afluente; por su topografía, aquellos tienden a acumularse en sectores específicos, endureciendo los terrenos, lo que dificulta la reproducción de los individuos o la fijación de estos a los sustratos (Silva-Benavides y Bonilla, 2015). Además, lo dicho se puede asociar a las bajas salinidades, debido a que, según Vega et al. (2021), A. tuberculosa sobrevive mejor en ambientes con salinidades mayores a 12 ppm y para esta indagación se informan salinidades cercanas a 6 ppm en época lluviosa. Otro aspecto que influye en la cantidad de organismos es la presión antropogénica sobre los recursos (Diringer et al., 2019; Panta-Vélez et al., 2020) y la cercanía con la frontera agrícola. Cabe resaltar que la presión podría ser incluso mayor a la reportada, pues las recolectas de individuos se efectuaron en periodo pandémico por SARS-CoV-2.
Leukoma spp. presentó mayor abundancia de organismos comparada con las otras especies, en respuesta a que las almejas, a pesar de ser de los bivalvos más extraídos en Costa Rica (Rojas-Jiménez et al. 2022), no poseen el mismo valor cultural ni comercial que Anadara sp.; esto fue reflejado en los precios económicos estipulados para almeja y piangua por kilogramo (detallados en la metodología de la investigación) por parte del INCOPESCA. Además, Ordinola et al. (2020) se han referido a que Leukoma asperrima compite con las pianguas y tiende a incrementar su abundancia cuando dicho parámetro disminuye.
En general, las abundancias de organismos que se extrajeron en un año (357 organismos) fueron pocas, lo que sugiere generar un ordenamiento urgente de este recurso, debido a que de él dependen muchas familias costarricenses lideradas especialmente por mujeres (SINAC-INCOPESCA, 2019). Este panorama de poblaciones diezmadas de bivalvos ya había sido informado en Costa Rica por Fournier y Fonseca (2007): indicaron una disminución de 46.5 toneladas de los moluscos entre 1997 y 2005, en los manglares del Pacífico. Además, en un nivel ecológico, Yahya et al. (2020) mencionan que entre los principales roles que realizan dichos organismos se encuentra el reciclaje de nutrientes, facilitan el movimiento de las corrientes de agua a través de las raíces de los manglares y reducen la turbidez del agua. Así mismo, muchos moluscos son dependientes de los mangles, las mayores diversidades dentro de estos se han encontrado cerca de Rhizophora sp. (Printrakoon et al., 2008); los neumatóforos de los mangles facilitan la retención de sedimentos, lo que permite aumentar la disposición de alimentos para estos organismos (Skilleter y Warren, 2000) y les brinda protección ante depredadores (Yahya et al., 2020).
Así mismo, si se hace referencia solo a A. tuberculosa, se obtuvo una densidad poblacional de 0.022 organismos por m2, lo que está muy por debajo de valores como los informados por Silva-Benavides y Bonilla (2015), de 0.14 organismos por m2 en playa Blanca, 2.77 organismos por m2 en Golfito, Costa Rica, o 0.13 organismos por m2 en El Salvador, según Flores et al. (2011). De acuerdo con el SINAC (2018b), A. tuberculosa, cuando las densidades se encuentran entre 0 y 0.9, se puede catalogar como un recurso que está próximo a agotarse. En el caso de A. similis, esa densidad correspondió a 0.008 por m2 y en el de Leukoma spp. a 0.02 por m2.
El índice gonadosomático (IG) de Anadara sp. fue bajo en comparación con otros estudios, como el realizado por Tuñón (2013). Este investigador obtuvo valores cercanos a 30 % en Panamá, posiblemente asociados a la presión antropogénica similar a nuestro trabajo, que no les permita alcanzar mayores índices gonadales. Con respecto al índice de rendimiento de carne (IR), los valores obtenidos están entre los reportados por Silva-Benavides y Bonilla (2015) (12.725.9 %) en el Golfo Dulce, Costa Rica, pero son inferiores al valor máximo de pianguas publicado por Jordan y Gómez (2006) en Panamá (33.88 %).
A pesar de que los promedios de las longitudes de los organismos de Anadara sp. reportadas en este trabajo fueron mayores a otros hallazgos en otras zonas de Puntarenas, como es el caso de lo explorado por el Proyecto Golfos (2015) para la zona de Manzanillo (4.28 ± 0.6 cm para A. tuberculosa y 3.65 ± 0.34 cm para A. similis), el 70 % de las pianguas muestreadas (de ambas especies) se encontró por debajo de la talla mínima de extracción establecida por la Ley de la República de Costa Rica 13371-A (1982). Ello coincide con estudios como el de Vega et al. (2021), que obtuvieron en A. tuberculosa las tallas también menores a las aceptadas legalmente en Panamá. Manjarrés-Villamil et al. (2013) observaron una disminución de las poblaciones de A. similis en Colombia. No obstante, de Leukoma spp. el 97 % estaba en los rangos de primera madurez (Wehrtman, 2017). La relación masa total (g) y longitud (cm) para Anadara sp. coincide con Silva-Benavides y Bonilla (2001), lo que indica que las especies están constantemente en reproducción. Sin embargo, no logran alcanzar mayores tallas por la presión antropogénica que sufren (Diringer et al., 2019). El comportamiento de la relación masa de tejidos suaves y longitud muestra mayores variaciones para el género Anadara sp., evidenciando momentos en los que hay disminución de masa por concepto de carne, pero no por concepto de concha, la cual sigue en crecimiento y luego, a partir de 4 centímetros, el aumento de carne se hace muy prominente, quizá relacionado con la reproducción. Estos datos son similares a lo observado en el análisis de Lucero et al. 2011 para A. tuberculosa en Colombia.
La gran cantidad de hembras presentes en A. similis puede vincularse a procesos de reversión sexual de machos a hembras, lo que podría provocar desequilibrios en la proporción sexual (Panta-Vélez et al., 2020). La relación de sexo de A. tuberculosa estuvo más cercana a 1:1, lo cual es semejante a lo informado por otros investigadores en Costa Rica (Cruz, 1984; Silva-Benavides y Bonilla, 2015), Ecuador (Flores y Lincadeo, 2010) y Panamá (Jordan y Gómez, 2006). Sin embargo, Lucero et al. (2021) y Manjarrés-Villamil et al. (2013) afirman que el hermafroditismo puede estar presente en A. similis y A. tuberculosa, beneficiando la producción de hembras. En cuanto a Leukoma, Hiebert (2015) reportó hermafroditismo en Leukoma staminea, las hembras eran mayoría.
En la presente investigación, las valoraciones económicas de los recursos naturales tienen el fin de crear conciencia sobre los beneficios de estos al ser humano, así como lo mencionan Costanza et al. (2014) y Benson et al. (2017), en el caso específico de los manglares, son los que poseen el mayor valor económico por hectárea de todo el carbono azul del planeta. Esas valoraciones económicas requieren análisis profundos del estado de los recursos naturales, lo que posibilita enriquecer la toma de decisiones, sin dejar de lado a los usuarios inmediatos (comunidad), ellos deben ser parte fundamental de las políticas de conservación (Queiroz et al., 2017). La valoración económica total calculada en este estudio, mediante el muestreo, tomando en cuenta las reservas de carbono y los moluscos bivalvos muestreados, fue cercana a 1377 millones (USD). Por otro lado, Hernández et al. (2021) informaron de 86 millones (USD), aproximadamente, por año, en concepto de 11 servicios ecosistémicos, lo cual representa un valor mediano para el golfo de Nicoya, Costa Rica. La aproximación del valor económico del servicio ecosistémico turismo es cercana a lo reportado por Uddin et al. (2013), 40 000 USD al año en manglares de Bangladesh, pero muy inferior a ganancias económicas por el mismo concepto en otros manglares de Sri Lanka (93 000-119 000 USD al año) o de 700 000 USD en el Humedal Térraba-Sierpe en Costa Rica, por Sánchez et al. (2013).
Conclusiones
El presente estudio mostró una problemática asociada a la abundancia de las poblaciones analizadas de moluscos bivalvos de interés comercial para consumo humano. El 70 % de los individuos hallados del género Anadara estuvieron por debajo de la talla mínima establecida por la legislación costarricense, lo cual es un indicativo de presiones externas, posiblemente asociadas a las extracciones sin medida; sin embargo, se recalca que los organismos están en constante reproducción. Además, se observa, de acuerdo con los resultados, un bosque de mangle en regeneración, con cinco especies y un alto interés de la comunidad por visitar esta zona e incentivar un turismo que actualmente no está desarrollado.
Según los datos obtenidos, existen áreas que benefician la crianza de los moluscos, por lo tanto, se recomienda, con apoyo gubernamental, incentivar el cultivo del molusco Anadara sp., con fines de conservación y como generador de fuente de trabajo. Así mismo, se sugiere mayor intervención del Gobierno costarricense en la sensibilización, el empoderamiento y las capacitaciones de la comunidad hacia los recursos naturales que tienen aledaños, con el propósito de que ella sea la principal protectora de estos y que a la vez pueda mejorar su calidad de vida con actividades sostenibles. La generación de este tipo de información permite establecer planes de educación ambiental contextualizados y basados en competencias atinentes a la realidad de cada localidad.
Agradecimiento
Se agradece a la comunidad de Fray Casiano de Chacarita, a la Universidad Nacional por el apoyo económico, al Instituto Costarricense de Pesca y Acuicultura, al Sistema Nacional de Áreas de Conservación, al Parque Marino del Pacífico y a los biólogos Emmanuel Esquivel Murillo y Benedicto Valdés Rodríguez.
Declaración de la contribución de los autores
Todos los autores afirmamos que se leyó y aprobó la versión final de este artículo.
El porcentaje total de contribución para la conceptualización, preparación y corrección de este artículo fue el siguiente: M. C. O. 40 %, J. P. M. 30 %, A. H. U. 15 % y C. M. S. 15 %.
Declaración de disponibilidad de los datos
El intercambio de datos no es aplicable, debido a que en este estudio no se crearon ni analizaron nuevos datos. La información que respalda los resultados de este estudio será puesta a disposición por el autor correspondiente M. C. O., previa solicitud razonable