Introducción
En la década de los ochenta, Costa Rica inició la exportación de piña. Debido a la gran demanda de este producto, la producción avanzó rápidamente (Obando, 2017). Según un estudio realizado por el Laboratorio PRIAS del Centro Nacional de Alta Tecnología en el año 2018, un total de 65 670 hectáreas de tierras costarricenses están destinadas al cultivo de piña, lo cual equivale a una cobertura del 1,29 % del territorio nacional (Vargas et al., 2020). Diferentes estudios realizados en sitios asociados con la producción de piña en Costa Rica han evidenciado la contaminación de cuerpos de agua superficial con residuos de plaguicidas utilizados en dicha actividad (Echeverría-Sáenz et al., 2012; Fournier et al., 2019). En el caso de algunas sustancias, las concentraciones superan los límites relacionados con la protección de fauna acuática y se ha estimado que representanun riesgo para esos ecosistemas. En el presente se observa un escenario cuya búsqueda de la eliminación de plagas en los cultivos ha provoca o el uso de sustancias como fungicidas, herbicidas, insecticidas, nematicidas y otros agroquímicos, lo cual ha desencadenado el desplazamiento de esas sustancias hacia los cuerpos de agua por escorrentía, debido a las precipitaciones. Los tóxicos que están incluidos en los plaguicidas inducen a un desbalance a nivel biológico y químico de los ecosistemas (Castro et al., 2015). Por consiguiente, muchas especies que no perjudican el cultivo de la piña sufren los efectos de los plaguicidas aplicados, muchos de estos altamente persistentes, que se mantienen en los ecosistemas por varias décadas (Tribunal Latinoamericano del Agua, 2013). Según Ramírez (2017), las principales sustancias responsables de causar ecotoxicidad de invertebrados acuáticos, aplicadas en mayor cantidad anualmente en cultivos de piña en el Caribe y zona norte de Costa Rica, regiones donde se realiza la mayor actividad piñera del país, son ametrina, bromacil, diuron, glifosato, benfuracarb, carbaril, diazinon y etoprofos ver anexo A). Argüello et al. (2015) explican que el diuron es utilizado como control pre y postemergente temprano selectivo de malezas en zonas de cultivo. De acuerdo con Caseley (1996), esta sustancia se adhiere a los coloides presentes en el suelo, donde soporta la lixiviación; por lo tanto, es usada en cultivos con raíces extensas y profundas, tal como las de la piña. Mientras que Córdoba (2015) indica que el etoprofos es un insecticida organofosforado altamente tóxico, aplicado de manera manual a plantaciones de piña. Este se ha detectado en fuentes de agua y diversas edificaciones situadas en el Caribe, e inclusive en techos de escuelas. Por lo tanto, se evidencia la importancia de la evaluación toxicológica con bioindicadores para estimar el riesgo que representan estos contaminantes y poder actuar frente a la problemática ambiental. Los efectos que los plaguicidas ocasionan en las aguas superficiales y en los organismos que habitan esos ecosistemas pueden variar si las sustanci s se presentan de manera individual o en una mezcla (Escobar-Chávez et al., 2019). Por lo tanto, dado que en las muestras de agua analizadas cercanas a plantaciones regularmente aparecen mezclas de plaguicidas, con herbicidas e insecticidas dentro de los más comunes, es de gran relevancia realizar análisis que incluyan la mezcla entre estos dos tipos de sustancias, ya que esto permitiría evaluar si hay interacciones de tipo antagónico, aditivas o sinérgicas entre ellas. Las hidras son organismos bioindicadores de niveles de toxicidad del agua. Los bioensayos determinan efectos letales y subletales de los organismos ante la presencia de contaminantes. Estos son apreciables en las hidras por medio de cambios en el estado de sus tentáculos y/o mortalidad de los organismos (Barrera et al., 2019). La Hydra attenuata es un organismo de uso estándar a nivel internacional en estudios ecotoxicológicos para medir el efecto letal y subletal en la evaluación de calidad del agua; mientras que la Hydra vi idis es una especie presente naturalmente en ecosistemas de Costa Rica y que, como indican Hamada et al. (2020), también se utiliza en ensayos de toxicidad y posee una relación mutualista con microalgas. En cuanto a los organismos utilizados en los ensayos, es importante mencionar que la H. attenuata fue adquirida para cultivarse en el ECOTOX desde el año 1998; mientras que la H. viridis es nativa, fue aislada de un cuerpo de agua de Santo Domingo de Heredia y se cultiva en el laboratorio desde el año 2000. En las bases de datos internacionales sobre plaguicidas existen vacíos de información referente a los efectos ecotoxicológicos que muchas de estas sustancias tienen sobre las hidras. Considerando el escenario de contaminación que ocurre en ecosistemas acuáticos afectados por contaminación agrícola y, en particular, por el cultivo de piña, el objetivo de este trabajo fue determinar la toxicidad de dos plaguicidas utilizados en ese cultivo, individualmente y en mezcla, sobre dos especies de hidras. Por est razón, se desea conocer la sensibilidad de la H. attenuata a dos plaguicidas individuales, de mucho uso en piña y alta residualidad en aguas, así como a la mezcla de estos. Complementariamente, existe la necesidad de conocer más sobre la sensibilidad a plaguicidas de la H. viridis, para compararla con el organismo modelo que es la H. attenuata.
Metodología
El enfoque de la investigaciónes mixto, debido a que posee atributos tanto cuantitativos como cualitativos. Este trabajo condujo hacia el análisis de laboratorio con la utilización de la estadística y, a la misma vez, con descripciones morfológicas de las hidras.
Fase 1:Selección de plaguicidas
Para la selección de los dos plaguicidas se tomaron en consideración las ocho sustancias principalmente responsables de causar ecotoxicidad en invertebrados acuáticos, aplicadas en mayor cantidad anualmente en cultivos de piña en el país. Se utilizó la matriz adjunta en los anexos B y C, que puntuó distintos aspectos ambientales importantes para seleccionar un herbicida y un insecticida.
Fase 2: Ensayos de toxicidad
Las pruebas se basaron en el protocolo ''Bioensayo agudo con Hydra attenuata”, establecido por la Organización para la Cooperación y el Desarrollo Económicos (OCDE) (Trottier et al., 1997). A cada especie de hidra se le realizaron tres tratamientos: uno con el herbicida diuron, otro con el insecticida etoprofos y el tercero con una mezcla de estos dos. Las soluciones madre de los plaguicidas se prepararon en el Laboratorio de Análisis de Residuos de Plaguicidas (LAREP) según el protocolo ''Control de calidad analítico y procedimientos de validación de métodos para el análisis de residuos de plaguicidas en alimentos y piensos''(Laboratorios de Referencia de la Unión Europea, 2019). Las soluciones madre para las pruebas fueron preparadas a partir de soluciones patrón, disueltas
en acetona (ver tabla 1).
Para cada tratamiento se realizaron tres repeticiones y en cada repetición se utilizaron cinco diluciones de la sustancia de prueba (ver tablas 2 y 3), un control negativo, un control positivo y un blanco de acetona, con tres réplicas cada uno. Como control negativo y agua de dilución se utilizó medio de hidras (ver anexo D). Como control positivo, para la H. attenuata se usaron 0,00006
Tabla1.Calidad de soluciones patrón de plaguicidas utilizados para realizar las diluciones empleadas en los ensayos detoxicidad con hidras
| Plaguicida | Fómula Quimica | Marca | Lote | Pureza(%) |
|---|---|---|---|---|
| Diuron | C9H10CI2N2O | Sigma-Aldrich | BCBZ536 | 99,10±0,05 |
| Etoprofos | C8H19O2PS2 | Sigma-Aldrich | SZBD182XV | 93,40±0,05 |
Nota: Fuente propia de la investigación.
Tabla2. Concentracionesutilizadas en los ensayos de toxicidad de la Hydraattenuata con los plaguicidas diuron, etoprofos y la mezcla (diuron-etoprofos)
| Ensayo | Concentración | Diuron (mg/L) | Etoprofos (mg/L) | Mezcla(mg/L) | ||
|---|---|---|---|---|---|---|
| Diuron | Etoprofos | |||||
| 1 | Control(-) | N/A | N/A | N/A | ||
| 100%medio de hidra | ||||||
| Control solvente 32,00% acetona | 1150,00 | 1060,00 | 1150,00 | 1060,00 | ||
| Control(+) | 0,00006 | 0,00006 | 0,00006 | |||
| Cr+6 | ||||||
| 6,25% | 3,13 | 9,09 | 0,53 | 3,22 | ||
| 12,50% | 6,25 | 18,18 | 1,05 | 6,44 | ||
| 25,00% | 12,50 | 36,37 | 2,11 | 12,88 | ||
| 50,00% | 25,00 | 72,73 | 4,21 | 25,75 | ||
| 100,00% | 50,00 | 145,46 | 8,42 | 51,51 | ||
| 2 | Control(-) | N/A | N/A | N/A | ||
| 100%medio de hidra | ||||||
| Control solvente32,00% acetona | 1150,00 | 1060,00 | 1150,00 | 1060,00 | ||
| Control(+) | 0,00006 | 0,00006 | 0,00006 | |||
| Cr+6 | ||||||
| 6,25% | 3,13 | 9,11 | 0,53 | 3,22 | ||
| 12,50% | 6,25 | 18,23 | 1,05 | 6,44 | ||
| 25,00% | 12,50 | 36,46 | 2,11 | 12,88 | ||
| 50,00% | 25,00 | 72,92 | 4,21 | 25,75 | ||
| 100,00% | 50,00 | 145,84 | 8,42 | 51,51 | ||
| 3 | Control(-) | N/A | N/A | N/A | ||
| 100% medio de hidra | ||||||
| Control solvente 32,00%acetona | 1150,00 | 1060,00 | 1150,00 | 1060,00 | ||
| Control(+) | 0,00006 | 0,00006 | 0,00006 | |||
| Cr+6 | ||||||
| 6,25% | 3,09 | 9,11 | 0,53 | 3,22 | ||
| 12,50% | 6,18 | 18,22 | 1,05 | 6,44 | ||
| 25,00% | 12,36 | 36,44 | 2,11 | 12,88 | ||
| 50,00% | 24,73 | 72,88 | 4,21 | 25,75 | ||
| 100,00% | 49,46 | 145,75 | 8,42 | 51,51 |
Nota:N/A=Noaplica. Nota: Fuente propia de la i
Tabla 3. Concentracionesutilizadas en los ensayos de toxicidad de la Hydra viridis con los plaguicidas diuron, etoprofos y lamezcla (diuron-etoprofos)
| Ensayo | Concentración | Diuron(mg/L) | Etoprofos(mg/L) | Mezcla(mg/L) | ||
|---|---|---|---|---|---|---|
| Diuron | Etoprofos | |||||
| 1 | Control(-) | N/A | N/A | N/A | ||
| 100% medio de hidra | ||||||
| Control solvente | 1150,00 | 1060,00 | 1150,00 | 1060,00 | ||
| 32,00% acetona | ||||||
| Control(+) | 0,0013 | 0,0013 | 0,0013 | |||
| Cr+6 | ||||||
| 6,25% | 6,25 | 9,09 | 1,15 | 3,22 | ||
| 12,50% | 12,50 | 18,18 | 2,31 | 6,44 | ||
| 25,00% | 25,00 | 36,37 | 4,62 | 12,88 | ||
| 50,00% | 50,00 | 72,73 | 9,24 | 25,75 | ||
| 100,00% | 100,00 | 145,46 | 18,47 | 51,51 | ||
| 2 | Control(-) | N/A | N/A | N/A | ||
| 100% medio de hidra | ||||||
| Control solvente 32,00% acetona | 1150,00 | 1060,00 | 1150,00 | 1060,00 | ||
| Control (+) | 0,0013 | 0,0013 | 0,0013 | |||
| Cr+6 | ||||||
| 6,25% | 6,25 | 9,11 | 1,15 | 3,22 | ||
| 12,50% | 12,50 | 18,23 | 2,31 | 6,44 | ||
| 25,00% | 25,00 | 36,46 | 4,62 | 12,88 | ||
| 50,00% | 50,00 | 72,92 | 9,24 | 25,75 | ||
| 100,00% | 100,00 | 145,84 | 18,47 | 51,51 | ||
| 3 | Control (-) | N/A | N/A | N/A | ||
| 100% medio de hidra | ||||||
| Control solvente 32,00% acetona | 1150,00 | 1060,00 | 1150,00 | 1060,00 | ||
| Control(+) | 0,0013 | 0,0013 | 0,0013 | |||
| Cr+6 | ||||||
| 6,25% | 6,25 | 9,11 | 1,15 | 3,22 | ||
| 12,50% | 12,50 | 18,22 | 2,31 | 6,44 | ||
| 25,00% | 25,01 | 36,44 | 4,62 | 12,88 | ||
| 50,00% | 50,02 | 72,88 | 9,24 | 25,75 | ||
| 100,00% | 100,04 | 145,75 | 18,47 | 51,51 |
Nota: N/A= No aplica.
Nota: Fuente propia de la investigación.
mg/L Cr+6 y para la H. viridis 0,0013 mg/L Cr+6, los cuales se prepararon a partir de la sustancia patrón dicromato de potasio del lote 72403A, con grado de pureza de 99,93 ± 0,05 y fórmula química de K2Cr2O7. El blanco de acetona varió en cada ensayo de acuerdo con la concentración de acetona que contenía cada solución madre del plaguicida. La acetona utilizada es de la marca Riedel-de Haën, del lote EE978-US, con grado de pureza de 99,00 % ± 0,05 y fórmula química de C3H6O. En cuanto a la preparación de las mezclas, primeramente, con cada uno de los plaguicidas se determinó el promedio de la concentración que provocó la muerte del 50 % de los organismos expuestos (LC50) a las 48 h del ensayo. Luego, se calculó la mitad de ese promedio. Posteriormente, se mezcló la concentración anterior de diuron con la de etoprofos y se usó como la concentración más alta. Las diluciones se prepararon según el protocolo ''Bioensayo agudo con Hydra attenuata''establecido por la OCDE.
Los ejemplares se tomaron de la batería de organismos de ensayo del Laboratorio de Estudios Ecotoxicológicos del Instituto Regional de Estudios en Sustancias Tóxicas (IRET) de la Universidad Nacional. Durante el cultivo, las hidras permanecieron bajo las siguientes condiciones: en agua de cultivo de dureza media, a temperatura ambiental del laboratorio de 20 ± 2 ºC, con fotoperíodo 16/8 (luz/oscuridad) y alimentadas cuatro veces por semana con Artemia salina viva.
Se utilizaron hidras en estado normal, sin hidrantos ni yemas. Estas no se alimentaron durante las 24 horas previas al inicio del ensayo, ni durante el mismo. El día del ensayo se apartaron del cultivo, se enjuagaron y se colocaron en un recipiente con medio limpio. Luego, se colocaron 4 mL de cada una de las cinco diluciones de cada sustancia ensayada y de los controles en placas Petri de 35 mm de diámetro, y se pasaron a cada placa 15 hidras para prelavado, donde permanecieron por un tiempo de dos minutos.
Seguidamente, utilizando una placa multicelda de doce pozos, se colocaron en cada pozo (por triplicado) 4 mL de cada una de las cinco diluciones de cada tratamiento y de los controles. En cada pozo se introdujeron tres hidras prelavadas en la concentración respectiva, iniciando por el control negativo, seguida del blanco, las diluciones de prueba (de la más baja a la más alta) y el control positivo. Posteriormente, se cubrió cada multicelda con papelparafilm® y se colocó su tapasutapa(ver figura 1).
Las muestras se mantuvieron a una temperaturade 20±2ºC, con un foto período16/8(luz/oscuridad). Pasadas 24h y 48h se registró el estado morfológico de las hidras expuestas según la figura 2.Se consideró efecto letal a los estados










Figura 2. Estados morfológicos de la Hydraattenuatae Hydraviridis
Nota: Fuente propia de la investigación.
Tulipán y cuerpo desintegrado; mientras que se tomó como efecto subletala los estados de tentáculos abastonados y acortados, ya que tendrían la capacidad de regenerarse si volvieran acondiciones ideales. Se consideró válida la prueba cuando al menos el 90% de los organismos en el control negativo sobrevivieron y presentaron morfologíanormal. Además, se corroboró que el control positivo afectara aproximadamente a un 50% de los organismos expuestos.
Para evaluarla toxicidad aguda de los plaguicidas sobre las hidras se examinaron los cambios en la longitud y forma de su cuerpo.La concentración de efecto medio(EC50) y la concentración letal media (LC50) se estimaron por medio de una regresión de la respuesta observada sobre la concentración de exposición, utilizando el modelo Probit. Los cálculos fueron hechos en R (RCoreTeam) con el paquete cotox(Hlina et al., 2021).
Las interacciones de toxicidad se analizaron según De Lorenzo y Serrano (2007), calculando primeramente la suma de actividad biológica (S) para el valor de EC50 y LC50; y los límites inferiores (LCL) y límites superiores (UCL) de ambos valores. La fórmula corresponde a: S=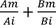 , donde Ames el valor del compuesto A en mezcla, Ai es el valor del compuesto A individualmente, Bm es el valor del compuesto Benmezcla y Bi es el valor del compuesto B individualmente.Luego, se utilizaron los valores de S para calcular los índices aditivos: SiS<1, el índice aditivo=- 1;ysiS>1,el índice aditivo=S(-1)+1.Por último, se clasificaron las interacciones según tres posibilidades: antagónica, si el índice aditivo es menor a cero; aditiva,si es igual a cero;o sinérgica,si es mayor a cero.
, donde Ames el valor del compuesto A en mezcla, Ai es el valor del compuesto A individualmente, Bm es el valor del compuesto Benmezcla y Bi es el valor del compuesto B individualmente.Luego, se utilizaron los valores de S para calcular los índices aditivos: SiS<1, el índice aditivo=- 1;ysiS>1,el índice aditivo=S(-1)+1.Por último, se clasificaron las interacciones según tres posibilidades: antagónica, si el índice aditivo es menor a cero; aditiva,si es igual a cero;o sinérgica,si es mayor a cero.
Resultados
En todos los ensayos la totalidad de los organismos del control negativo a las 48 horas estaban en estado normal. Además, los controles positivos se mantuvieron dentro de los rangos aceptables para la validación del ensayo. Asimismo, en todos los casos las tres réplicas de cada ensayo arrojaron resultados muy similares, lo cual sustenta la reproductibilidad de los resultados. Los hallazgos de los bioensayos se muestran de forma resumida en las tablas 4 y 5; sin embargo, los resultados completos se encuentran en los anexos E y F. Referente al efecto causado por los plaguicidas, la H. attenuata resultó ser la especie más sensible tanto para diuron como para etoprofos, la cual mostró efecto subletal desde la concentración más baja de ambas sustancias. En contraste, la H. viridis mostró mayor tolerancia ante la exposición a los plaguicidas de forma individual, pero fue la más sensible ante la mezcla, ya que se observó letalidad en la concentración mayor de la mezcla.
Los parámetros fisico químicos de los controles y concentraciones de plaguicidas, en las tres réplicas de cada sustancia, arrojaron valores muy similares, lo cual muestra que las hidras estuvieron bajo condiciones semejantes durantelos ensayos(ver tablas 6 y 7).
Tabla 4 Resultados obtenidos a las 48 horas en los ensayos de toxicidad de la Hydraattenuata con los plaguicidas diuron, etoprofos y la mezcla (diuron-etoprofos)
| Diuron | Etoprofos | Mezcla(diuron-etoprofos) | ||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Concentración (mg/L) | Concentración (mg/L) | Concentración (mg/L) | ||||||||||||||
| x̄ | s | No efecto | Efecto subletal | Efecto letal | x̄ | s | No efecto | Efecto subletal | Efecto letal | x̄ | s | No efecto | Efecto subletal | Efecto letal | ||
| Control (-) (100,00% medio de hidra) | N/A | x | Control (-) (100,00% medio de hidra) | N/A | x | Control(-) (100,00%mediodehidra) | N/A | x | ||||||||
| Control solvente(32,00%acetona)1150,00mg/L | 0 | x | x | Control solvente (0,80%acetona)1060,00mg/L | 0 | x | x | Control solvente D:1150,00mg/L E:1060,00mg/L | D:0,00 | E:0,00 | x | x | ||||
| Control(+)0,00006mg/LCr+6 | 0 | x | x | Control(+)0,00006mg/LCr+6 | 0 | x | x | Control(+) 0,00006mg/LCr+6 | 0 | x | x | |||||
| 3,11mg/L | 0,02 | x | x | 9,11mg/L | 0,01 | x | x | D:0,53mg/LE:3,22mg/L | D:0,00 | E:0,00 | x | x | ||||
| 6,23mg/L | 0,04 | x | x | x | 18,21mg/L | 0,02 | x | x | D:1,05mg/LE:6,44mg/L | D:0,00 | E:0,00 | x | x | |||
| 12,45mg/L | 0,08 | x | x | 36,42mg/L | 0,05 | x | x | D:2,11mg/LE:12,88mg/L | D:0,00 | E:0,00 | x | x | ||||
| 24,91mg/L | 0,16 | x | x | 72,84mg/L | 0,1 | x | D:4,21mg/LE:25,75mg/L | D:0,00 | E:0,00 | x | x | |||||
| 49,82mg/L | 0,31 | x | 145,68mg/L | 0,2 | x | D:8,42mg/LE:51,51mg/L | D:0,00 | E:0,00 | x |
Notas: x̄=promedio,s=desviación estándar,D=diuron,E=etoprofos,N/A=Noaplica.
Fuente propia de la investigación.
Tabla 5 Resultados obtenidos a las 48 horas en los ensayos de toxicidad de la Hydra viridis con los plaguicidas diuron,etoprofos y la mezcla(diuron-etoprofos)
| Diuron | Etotrofos | Mezcla (diuron-etoprofos) | ||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Concentración (mg/L) | Concentración (mg/L) | Concentración (mg/L) | ||||||||||||||
| x̄ | s | No efecto | No subletal | Efecto letal | x̄ | s | No efecto | Efecto subletal | Efecto letal | x̄ | s | No efecto | Efecto subletal | Efecto letal | ||
| Control (-) (100,00%medio de hidra) | N/A | x | Control (-)(100,00%medio de hidra) | N/A | x | Control(-)(100,00%mediodehidra) | N/A | x | ||||||||
| Control solvente (32,00%acetona)1150,00mg/L | 0,00 | x | Control solvente (0,80%acetona)1060,00mg/L | 0,00 | x | x | Control Solvente D:1150,00mg/L E:1060,00mg/L | D:0,00 | E:0,00 | x | ||||||
| Control (+)0,00013mg/LCr+6 | 0,00 | x | x | Control(+) 0,00006mg/LCr+6 | 0,00 | x | x | Control (+)0,00006mg/LCr+6 | 0,00 | x | x | |||||
| 6,25mg/L | 0,00 | x | 9,11mg/L | 0,01 | x | D:0,53mg/LE:3,22mg/L | D:0,00 | E:0,00 | x | |||||||
| 12,50mg/L | 0,00 | x | x | 18,21mg/L | 0,02 | x | D:1,05mg/LE:6,44mg/L | D:0,00 | E:0,00 | x | x | |||||
| 25,00mg/L | 0,01 | x | 36,42mg/L | 0,05 | x | x | D:2,11mg/LE:12,88mg/L | D:0,00 | E:0,00 | x | x | |||||
| 50,01mg/L | 0,01 | x | x | 72,84mg/L | 0,10 | x | x | D:4,21mg/LE:25,75mg/L | D:0,00 | E:0,00 | x | |||||
| 100,01mg/L | 0,02 | x | 145,68mg/L | 0,20 | x | D:8,42mg/LE:51,51mg/L | D:0,00 | E:0,00 | x | x |
Notas:x̄=promedio,s=desviación estándar, D=diuron, E=etoprofos, N/A=Noaplica.
Fuente propia de la investigación.
Tabla 6.Parámetros fisicoquímicos de los controles y concentraciones de plaguicidas utilizados en los ensayos con Hydra attenuata
| Plaguicida | Concentración | pH | Conductividad (µS/cm) | Temperatura (°C) | Oxigeno disuelto (mg/L) | |||||
|---|---|---|---|---|---|---|---|---|---|---|
| x̄ | s | x̄ | s | x̄ | S | x̄ | s | |||
| Diuron | Control (-) 100,00 % medio hidra | 7,21 | 0,82 | 285,00 | 36,86 | 23,90 | 0,46 | 7,44 | 0,21 | |
| Control solvente 1150,00 mg/L (32,00 % acetona) | 7,10 | 0,77 | 243,33 | 6,51 | 24,27 | 0,12 | 7,47 | 0,10 | ||
| Control (+) 0,00006 mg/L Cr +6 | 7,01 | 0,66 | 249,67 | 8,50 | 23,87 | 0,25 | 7,31 | 0,11 | ||
| 3,11 mg/L | 6,91 | 0,55 | 258,00 | 5,29 | 24,03 | 0,06 | 7,45 | 0,12 | ||
| 12,45 mg/L | 6,84 | 0,50 | 246,33 | 14,15 | 24,07 | 0,49 | 7,29 | 0,08 | ||
| 49,82 mg/L | 6,76 | 0,47 | 246,00 | 2,65 | 24,00 | 0,46 | 7,20 | 0,01 | ||
| Etoprofos | Control (-) 100,00 % medio hidra | 8,06 | 0,21 | 292,67 | 9,29 | 23,90 | 0,46 | 7,77 | 0,10 | |
| Control solvente 1060,00 mg/L (0,80 % acetona) | 7,84 | 0,21 | 212,20 | 15,27 | 24,27 | 0,12 | 7,62 | 0,08 | ||
| Control (+) 0,00006 mg/L Cr +6 | 7,63 | 0,25 | 243,67 | 23,97 | 23,87 | 0,25 | 7,56 | 0,05 | ||
| 9,11 mg/L | 7,38 | 0,11 | 259,00 | 1,00 | 24,03 | 0,06 | 7,66 | 0,08 | ||
| 36,42 mg/L | 7,13 | 0,13 | 237,67 | 1,53 | 24,07 | 0,49 | 7,53 | 0,12 | ||
| 145,68 mg/L | 7,10 | 0,19 | 215,67 | 5,51 | 24,00 | 0,46 | 7,48 | 0,11 | ||
| Mezcla (diuron - etoprofos) | Control (-) 100,00 % medio hidra | 7,61 | 1,16 | 278,33 | 8,02 | 24,03 | 0,81 | 7,46 | 0,12 | |
| Control solvente D: 1150,00 mg/LE: 1060,00 mg/L | 7,58 | 0,95 | 240,67 | 2,08 | 23,97 | 0,95 | 7,27 | 0,23 | ||
| Control (+) 0,00006 mg/L Cr +6 | 7,27 | 0,65 | 254,00 | 1,00 | 23,80 | 1,08 | 7,20 | 0,28 | ||
| D: 0,53 mg/L E: 3,22 mg/L | 7,06 | 0,51 | 258,00 | 1,00 | 23,93 | 0,86 | 7,32 | 0,18 | ||
| D:2,11 mg/L E:12,88 mg/L | 6,79 | 0,44 | 250,00 | 1,00 | 24,13 | 1,24 | 7,02 | 0,58 | ||
| D: 8,42 mg/L E: 51,51 mg/L | 6,64 | 0,29 | 238,67 | 3,51 | 24,17 | 1,29 | 6,94 | 0,55 | ||
Notas: x̄ = promedio, s = desviación estándar, D = diuron, E = etoprofos. Fuente propia de la investigación.
Tabla 7 Parámetros fisicoquímicos de los controles y concentraciones de plaguicidas utilizados en los ensayos con Hydra viridis
| Plaguicida | Concentración | pH | Conductividad (µS/cm) | Temperatura (°C) | Oxígeno disuelto (mg/L) | ||||
|---|---|---|---|---|---|---|---|---|---|
| x̄ | s | x̄ | s | x̄ | s | x̄ | s | ||
| Diuron | Control (-) | 6,91 | 0,60 | 214,00 | 8,54 | 24,03 | 0,25 | 7,08 | 0,46 |
| 100,00 % medio hidra | |||||||||
| Control solvente | 6,81 | 0,68 | 202,33 | 18,61 | 24,23 | 0,15 | 7,26 | 0,27 | |
| 1150,00 mg/L (32,00 % | |||||||||
| acetona) | |||||||||
| Control (+) 0,0013 mg/L Cr+6 | 6,81 | 0,61 | 201,87 | 13,68 | 24,27 | 0,38 | 7,04 | 0,39 | |
| 6,25 mg/L | 6,75 | 0,64 | 224,67 | 16,17 | 24,30 | 0,35 | 7,00 | 0,39 | |
| 25,00 mg/L | 6,73 | 0,63 | 213,67 | 17,79 | 24,30 | 0,50 | 7,00 | 0,29 | |
| 100,01 mg/L | 6,71 | 0,62 | 203,70 | 18,51 | 23,67 | 0,32 | 6,93 | 0,27 | |
| Etoprofos | Control (-) | 6,97 | 0,13 | 217,67 | 4,51 | 21,87 | 0,32 | 7,56 | 0,09 |
| 100,00 % medio hidra | |||||||||
| Control solvente 1060,00 mg/L (0,80 % acetona) | 6,75 | 0,08 | 175,80 | 16,73 | 21,87 | 0,40 | 7,55 | 0,14 | |
| Control (+) 0,0013 mg/L Cr+6 | 6,63 | 0,09 | 190,27 | 5,88 | 21,90 | 0,17 | 7,43 | 0,07 | |
| 9,11 mg/L | 6,50 | 0,15 | 215,00 | 6,56 | 21,97 | 0,35 | 7,51 | 0,05 | |
| 36,42 mg/L | 6,40 | 0,07 | 197,07 | 4,31 | 22,10 | 0,10 | 7,41 | 0,06 | |
| 145,68 mg/L | 6,36 | 0,08 | 179,40 | 9,78 | 21,97 | 0,15 | 7,33 | 0,06 | |
| Mezcla | Control (-) | 6,98 | 0,62 | 232,33 | 11,02 | 23,97 | 1,29 | 7,27 | 0,25 |
| (diuron - etoprofos) | 100,00 % medio hidra | ||||||||
| Control solvente D: 1150,00 mg/L E: 1060,00 mg/L | 6,74 | 0,64 | 212,67 | 6,51 | 23,67 | 1,19 | 7,16 | 0,18 | |
| Control (+) 0,0013 mg/L C+6 | 6,75 | 0,57 | 204,67 | 4,51 | 23,90 | 1,25 | 7,08 | 0,14 | |
| D: 1,15 mg/L | 6,67 | 0,48 | 231,33 | 7,02 | 23,90 | 1,01 | 7,27 | 0,12 | |
| E: 3,22 mg/L | |||||||||
| D: 4,62 mg/L | 6,37 | 0,15 | 219,67 | 8,96 | 23,33 | 1,18 | 7,21 | 0,17 | |
| E:12,88 mg/L | |||||||||
| D: 18,47 mg/L E: 51,51 mg/L | 6,62 | 0,41 | 217,67 | 14,01 | 24,00 | 0,92 | 6,99 | 0,21 |
Notas: x̄ = promedio, s = desviación estándar, D = diuron, E = etoprofos.
Fuente propia de la investigación.
Las primeras manifestaciones de afectación a las hidras en los tratamientos con diuron y etoprofos a las 48 horas se evidenciaron con los estados abastonado y acortado, lo cual indica un efecto subletal de estas sustancias. La H. attenuata mostró estos cambios morfológicos en el 33,33 % de los organismos expuestos a diuron a partir de la concentración más baja (3,11 mg/L) (gráfica 1). En la siguiente concentración (6,23 mg/L), la afectación fue del 74,07 % de individuos, y para las concentraciones superiores (12,45; 24,91 y 49,82 mg/L) la afectación alcanzó 100,00 % de la población. Por su parte, la H. viridis presentó sus primeras afectaciones ante el diu-ron a la concentración 12,50 mg/L con una respuesta del 40,74 % de los individuos; y, al igual que la H. attenuata, en las siguien-tes concentraciones (25,00; 50,01 y 100,01 mg/L) la afectación fue del 100,00 % de individuos expuestos.
Para la sustancia etoprofos la H. atte-nuata mostró cambios morfológicos a par-tir de la concentración 9,11 mg/L, afectando el 14,81 % de los individuos expuestos.

Nota: Fuente propia de la investigación.
Gráfica 1 Efecto subletal en la Hydra attenuata e Hydra viridis ante la exposición a diuron durante 48 horas
En las concentraciones siguientes correspondientes a 18,21; 36,42; 72,84 y 145,68 mg/L de esta sustancia, la afectación fue de 25,93; 81,48; 100,00 y 100,00 % de individuos respectivamente. Por su parte, la H. viridis presentó sus primeras afectaciones ante el etoprofos a la concentración de 36,42 mg/L, con una respuesta de 22,22 % de los individuos expuestos, mientras que en las concentraciones de 72,84 y 145,68 mg/L, la afectación fue de 74,07 y 100,00 % respectivamente (gráfica 2). Para la H. attenuata, en la concentración más alta de diuron (49,82 mg/L) y de etoprofos (145,68 mg/L) se registraron 24 y 22 individuos desintegrados respectivamente (efecto letal más importante), mientras que para la H. viridis en la concentración más alta de diuron (100,01 mg/L) y de etoprofos (145,68 mg/L) se registraron 20 y 3. En el tratamiento com mezcla de diuron-etoprofos no se obtuvieron individuos desintegrados de ninguna de las dos especies de ensayo (ver anexos E y F). Estos resultados muestran que conforme aumentó la concentración de los plaguicidas diuron y etoprofos, incrementó la afectación de individuos expuestos, y que ambas especies de hidras resultaron ser más sensibles al herbicida diuron que al insecticida etoprofos.
En cuanto los parámetros de toxicidad evaluados, en el ensayo con diuron, la EC50 de la H. viridis fue ,22 veces mayor respecto a la otra especie de hidra, y la LC50 fue 2,19 veces. Asimismo, en el ensayo con

Nota: Fuente propia de la investigación
Gráfica 2 Efecto subletal en la Hydra attenuata e Hydra viridis ante la exposición a etoprofos durante 48 horas
etoprofos la EC50 de la H. viridis fue 2,24 ve-ces mayor respecto a la H. attenuata, mien-tras que la LC50 de las dos especies mostró el mismo resultado. Lo anterior muestra una menor tolerancia de la H. attenuata ante la exposición a los plaguicidas (ver Tabla 8).
En el bioensayo de la interacción entre diuron y etoprofos según EC50, para la H. attenuata el resultado del índice aditivo fue de 0,19; 1,72 y 4,13 para UCL, EC50 y LCL respectivamente; por lo tanto, al ser valores mayores a cero, indica una toxicidad sinér-gica (ver anexo G). En el caso de la interacción según LC50, en el ensayo con la mezcla de ambos plaguicidas no hubo mortalidad; por consiguiente, no fue posible determinar el LC50 de la mezcla ni su interacción.
Respecto a la interacción de los plaguicidas con la H. viridis, según EC50 el re-sultado del índice aditivo fue de 0,93; 0,96 y 0,99 para UCL, EC50 y LCL respectivamen-te. Al ser valores mayores a cero, correspon-de a una toxicidad sinérgica. Asimismo, en la interacción según LC50 el índice aditivo fue de 0,36; 0,37 y 0,38; lo cual expresa una toxicidad sinérgica (ver anexo H).
Discusión
Al ser la hidra un organismo diplo-blástico, sus células se ubican de manera muy próxima al entorno; por consiguiente, responde rápidamente a los cambios que ocurren en el medio, de tal forma que los tóxicos presentes contribuyen a alte-raciones en su morfología y capacidad de regeneración de fracciones de su cuerpo (Murugadas et al., 2016). En los ensayos realizados tanto la H. attenuata como la H. viridis fueron más sensibles al herbici-da diuron que al insecticida etoprofos. Se-gún Demetrio (2012), las concentraciones necesarias de herbicida para afectar la vía metabólica de las plantas generan toxicidad también para los cnidarios. Además, Barrera et al. (2019) mencionan que las hidras presentan alta sensibilidad a los herbicidas ya que, en un estudio que empleó el herbi-cida glifosato y los insecticidas clorpirifos y cipermetrina, la H. attenuata mostró ma-yor sensibilidad al glifosato.
El diuron actúa de manera sistémica en las plantas, ya que es absorbido en ma-yor medida por las raíces, inhabilitando el transporte de electrones dentro del fotosis-tema II (IRET-UNA, 2020). A pesar de que no se registran en la literatura datos sobre la exposición de hidras al diuron, Dal (2020) menciona que al exponer la H. viridis a 400 μg/L de atrazina (cuyo modo de acción es similar al del diuron) por 35 días, se detectó una disminución de células del alga Chlore-lla presentes en las células de la hidra. Lo anterior resulta realmente negativo para esta especie de hidra, debido a que la relación de simbiosis con el alga le favorece la obten-ción de carbohidratos para su supervivencia.
Tabla 8 Parámetros de toxicidad de la Hydra attenuata e Hydra viridis en los bioensayos con diuron y etoprofos
| Hydra attenuata | Hydra viridis | |||||||
| Plaguicida | EC 50 | (mg/L) | LC 50 | (mg/L) | EC 50 | (mg/L) | LC 50 | (mg/L) |
| x̄ | s | x̄ | s | x̄ | s | x̄ | s | |
| Diuron | 4,24 | 0,68 | 16,84 | 1,20 | 13,64 | 2,48 | 36,94 | 0,01 |
| Etoprofos | 23,74 | 1,37 | 103,01 | 0,14 | 53,12 | 2,72 | 103,01 | 0,14 |
Notas: x̄ = promedio, s = desviación estándar.
Fuente propia de la investigación
Howe et al. (2017) también mencionan que al exponer a diuron al cnidario Exaiptasia pallida (anémona de mar que vive en simbiosis con el alga Symbiodinium spp.) por un periodo de doce días, a concentraciones de 10 μg/L y 200 μg/L, presentó un fuerte blanqueamiento; una EC50 de 100 μg/L y 132 μg/L; y la inhibición del 50 % de la reproducción asexual. Asimismo, Mansano et al. (2018) citan hallazgos de otros cnidarios sensibles al diuron, tales como Acropora tumida y Aiptasia sp. No se registra en la literatura información que explique la mayor sensibilidad que presentó H. attenuata al diuron en comparación con H. viridis. Sin embargo, a pesar de que el alga Chlorella sp. (que permanece en simbiosis con la H. viridis) se ve afectada por herbicidas, se considera que la acción antioxidante que le brinda a la hidra desde el inicio de su desarrollo hace que muestre menor afectación ante el diuron respecto a la otra especie de hidra; pero es conveniente realizar más investigaciones que permitan verificar lo mencionado. Referente al control solvente, la H. attenuata mostró sensibilidad a la acetona, y es posible que los efectos observados se relacionen con esa exposición junto al efecto del plaguicida.
Las especies de hidras estudiadas en este artículo, tanto la H. attenuata como la H. viridis, mostraron menor sensibilidad ante el insecticida etoprofos. Según Demetrio (2012), los insecticidas organofosforados actúan afectando el sistema nervioso por inhibición de la enzima acetilcolinesterasa.
Klimovich y Bosch (2018) mencionan que el sistema nervioso de la hidra es muy sencillo y carece de células migratorias mesodérmicas especializadas. Asimismo, Demetrio (2012) indica que solo un 3 % del total de sus células corresponden a neuronas; por lo tanto, sufren un menor efecto ante este tipo de sustancias. ''La baja sensibilidad de Hydra attenuata respecto a estos insecticidas podría deberse a que son organismos más sencillos con un sistema neuronal difuso y no centralizado, con la mayoría de las neuronas sin una polaridad definida''(p. 61).
Por su parte, el modo de acción del etoprofos es de contacto y actúa como inhibidor de la enzima colinesterasa (IRET-UNA, 2020). Los estudios de toxicidad con etoprofos son realmente escasos y en la literatura no se registran resultados sobre la exposición de los cnidarios a este plaguicida; sin embargo, se indica un análisis con un insecticida organofosforado que posee su mismo modo de acción: el clorpirifos. Olguín (2021) menciona que al exponer al cnidario Aurelia coerulea a 0,04 μg/L de clorpirifos por un periodo de nueve semanas, la tasa de reproducción por medio de brotación no se vio afectada; además, no hubo cambios en los perfiles de metabolitos. En otras palabras, este organismo resultó ser resistente al plaguicida.
La H. viridis fue la hidra que se vio menos afectada al estar expuesta a diuron y etoprofos. Hamada et al. (2018) y Ye (2017) observaron que la simbiosis de la H. viridis con el alga Chlorella sp. le proporciona una menor sensibilidad ante varios contaminantes.
El alga se alberga en las células epiteliales de la región gástrica de la hidra; como beneficio el alga obtiene nitrógeno derivado del metabolismo de la hidra, mientras esta última obtiene carbohidratos del alga. Se reporta adición de la actividad antioxidante en cnidarios que se relacionan simbióticamente con el alga, esto por medio de la presencia del gen encargado de codificar la enzima glutatión S-transferasa. Además, Guinou (2010) menciona que en épocas de extrema debilidad, las algas proveen a la hidra de alimento endógeno, lo cual representa una ventaja competitiva.
La interacción entre diuron y etoprofos, tanto para la H. attenuata como la H. viridis, resultó en una toxicidad sinérgica. Una mezcla es aditiva si la toxicidad corresponde a la suma de los efectos de cada sustancia, mientras que el sinergismo ocurre cuando la toxicidad es más elevada que la aditiva, y el antagonismo sucede cuando es inferior a la aditiva. El etoprofos es una sustancia neurotóxica que actúa al inhibir la actividad colinesterasa. A pesar de que los cnidarios no presentan un sistema nervioso complejo, sí se ha relacionado la actividad colinesterasa en estos organismos con la transmisión nerviosa (Flores et al., 2020), sugiriendo que la toxicidad de los organofosforados puede seguir ese mismo mecanismo.
En el caso del diuron, tampoco es claro el mecanismo de toxicidad para los cnidarios, pero en otros invertebrados se han observado señales de estrés oxidativo, daño mitocondrial y neurotoxicidad relacionadoscon la exposición a la sustancia y sus metabolitos (Lima et al., 2022). Una combinación de esos mecanismos descritos podría explicar el aumento de la toxicidad de la mezcla con respecto a las partes, si bien es necesaria más investigación para el caso específico de las hidras. Además, los efectos de las mezclas son producto de alteraciones de la actividad biológica que una sustancia provoca a la otra, ya se trate de cambios en la eliminación, en las tasas de absorción o en el metabolismo (Aronzon, 2013). Los efectos de los contaminantes pueden variar entre organismos y niveles de organización biológica (Andrade, 2021). Adicionalmente, realizar estudios con las sustancias por separado subestima el efecto que ocasionan los tóxicos en panoramas reales, cuyos ecosistemas acuáticos pueden estar contaminados por diversas sustancias, las cuales afectan de manera distinta a los organismos presentes. En este trabajo se evidenció que la mezcla de diuron y etoprofos es sinérgica, de forma que ocasionó a nivel subletal una afectación mayor en las hidras estudiadas en comparación con el efecto de las sustancias de manera individual. Por lo consiguiente, se rescata la gran utilidad de estos cnidarios como bioindicadores en el monitoreo de la calidad de agua y, de igual modo, la importancia de realizar más estudios con hidras, utilizando diferentes mezclas de sustancias para comprender la afectación de los tóxicos en los seres vivos. Este trabajo es un aporte para la comunidad científica porque ha generado información que se desconocía sobre la sensibilidad de las hidras (como organismo de ensayo) a plaguicidas. La H. attenuata resultó ser la especie más sensible ante los plaguicidas de forma individual, mientras que la H. viridis fue la más sensible ante la mezcla. Este dato es sumamente relevante, ya que en la ejecución de bioensayos de laboratorio permitiría otorgarle diferentes usos a cada especie de hidra, según la composición de la muestra de agua a estudiar. Por ejemplo, la H. attenuata podría ser una excelente herramienta para evaluar efectos de plaguicidas ante sustancias individuales; mientras que la H. viridis sería mucho más útil en la evaluación de muestras de agua que contengan mezclas de plaguicidas. Por esta razón, los resultados obtenidos son un primer indicio para la realización de más investigaciones con otras sustancias individuales y mezclas, que permitan verificar si efectivamente es conveniente darle el uso sugerido a cada especie de hidra. Los valores de los parámetros de toxicidad (EC50 y LC50) obtenidos indican la afectación a los niveles subletal y letal, respectivamente, en hidras, por permanecer expuestas a diuron y etoprofos. Estos datos ayudan a solventar el faltante de estudios realizados con hidras como organismos bioindicadores; además, proporcionan información que le permitirá al Laboratorio de Estudios Ecotoxicológicos (ECOTOX) optimizar su base de datos de bioindicadores y la realización de futuros ensayos que contribuyan al estudio de la sensibilidad de hidras ante otros contaminantes.
Conclusiones
La H. attenuata y la H. viridis resultaron ser más sensibles al herbicida diuron, debido al modo de acción de los herbicidas, que representan mayor toxicidad para estos organismos. Mientras que la sensibilidad de ambas especies al insecticida etoprofos fue menor, debido a que los insecticidas organofosforados están diseñados para afectar el sistema nervioso de los organismos y, al tener las hidras un sistema nervioso relativamente simple, sufren un menor efecto ante este tipo de sustancias. Se debe profundizar con más investigaciones para determinar si la simbiosis de la H. viridis con el alga Chlorella sp. la hace más resistente ante diversas sustancias individuales del medio, debido a que el alga le adiciona acción antioxidante y carbohidratos como alimento, ventaja que no posee la H. attenuata.
La interacción entre diuron y etoprofos, tanto para la H. attenuata como para la H. viridis, resultó en una toxicidad sinérgica, de modo que la mezcla ocasiona a nivel subletal una afectación mayor en las hidras en comparación con el efecto de las sustancias de manera individual.
La H. attenuata resultó ser la especie más sensible tanto para diuron como para etoprofos, mientras que la H. viridis fue la más sensible ante la mezcla de los dos plaguicidas. La H. attenuata, al verse más afectada por dos de las tres sustancias, es la hidra que mostró mayor sensibilidad, por lo que se recomienda mantenerla dentro de los organismos de la batería de pruebas de ECOTOX para la ejecución de bioensayos de toxicidad. Sin embargo, se recomienda realizar más investigaciones para verificar si es conveniente otorgarle diferentes usos a cada especie de hidra, de manera que la H. attenuata se utilice en ensayos toxicológicos con sustancias individuales y la H. viridis con mezclas de sustancias.
Financiamiento
Universidad Nacional, Costa Rica.
Declaración de la contribución de los autores
Todos los autores afirmamos que se leyó y aprobó la versión final de este artículo. El porcentaje total de contribución para la conceptualización, preparación y corrección de este artículo fue el siguiente: C.J.P.: 45 %, M.U.S.: 20 %, K.J.Q.: 15 %, F.M.T.: 15 % y S.V.V.: 5 %.
Declaración de disponibilidad de los datos
Los datos que apoyan los resultados de este estudio están disponibles como ''archivos suplementarios”en el sitio web de Uniciencia
Anexo en PDF















