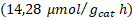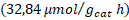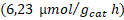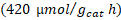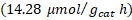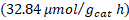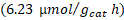INTRODUCCIÓN
La utilización de combustibles fósiles como principal fuente energética ha ocasionado un incremento constante de la concentración de gases de efecto invernadero a nivel atmosférico, a tal punto que se cree que se ha sobrepasado el punto de no retorno (Dutta & Radner, 2009; Masson-Delmotte et al., 2019). Las concentraciones atmosféricas de dióxido de carbono, metano y óxido nitroso han aumentado desde 1750, debido a la actividad humana.
Al finalizar el año 2019, por ejemplo, las concentraciones de estos gases eran de 411 ppm, 1874,7 ppm y 0,332 ppm, respectivamente, valores que excedían los niveles preindustriales en aproximadamente en un 47 %, 160 % y 23 %, respectivamente (Hmiel et al., 2020; Sapart et al., 2012; Xu et al., 2016).
Ante esta problemática, la idea de poder desarrollar procesos con los cuales se pueda reciclar el CO2 y transformarlo nuevamente en un combustible útil ha cobrado gran relevancia. Uno de los procesos que mayor investigación ha generado es la reducción fotocatalítica del CO2. En este proceso, el CO2 se transforma en compuestos con un potencial energético mayor, como por ejemplo monóxido de carbono, metano, metanol, ácido fórmico, formaldehído, entre otras sustancias (Bahadori et al., 2018). Esta reacción es un proceso no espontáneo, por lo que se necesita de una fuente energética que desplace la reacción hacia los productos. Esta energía se brinda, usualmente, mediante radiación dentro de un rango de longitudes de onda determinado (preferiblemente visible), la cual es canalizada por un fotocatalizador con una banda prohibida apropiada (Lingampalli et al., 2017; Mao et al., 2013; Nogueira et al., 2019; Sun et al., 2018).
Durante los últimos años, se han realizado diversos esfuerzos direccionados a mejorar la eficiencia del fenómeno en estudio, específicamente en medio acuoso, como en la presente investigación (Aurian-Blajeni et al., 1980; Do et al., 2016; Kumar et al., 2012; Maidan & Willner, 1986; Mele et al., 2015). La baja solubilidad del dióxido de carbono en el agua es una limitante del proceso, no obstante, se sabe que el esquema seleccionado repercute en la selectividad de la reacción y los productos obtenidos; mientras en fase gaseosa la producción de metano es mayoritaria, en medio acuoso se pueden producir gran variedad de sustancias, tales como metano, formaldehído, y ácido fórmico, por lo que la elección del esquema dependerá, en gran medida, de las sustancias deseadas (Kočí et al., 2008; Olivo et al., 2017).
Aparte de la fase en la que lleva a cabo la reacción, un elemento fundamental es la selección del fotocatalizador, entre algunos ejemplos ampliamente utilizados destacan: el ZnO (Liu et al., 2016; Mahmodi et al., 2013; Zhao et al., 2019), el CdS (Fujiwara et al., 1997; Johne & Kisch, 1997), el ZrO2 (Kohno et al., 1997; Tanaka et al., 2000), el MgO (Kohno et al., 2001; Teramura et al., 2004), el NiO/InTaO4 (Pan & Chen, 2007; Z.-Y. Wang et al., 2010), entre otros.
Entre la gran variedad de fotocatalizadores, el dióxido de titanio (TiO2) se conforma como una de las opciones más factibles, debido a su bajo precio y baja peligrosidad; además presenta una alta estabilidad (Lingampalli et al., 2017). Las características anteriores convierten al TiO2 en el semiconductor más ampliamente estudiado para la fotorreducción de dióxido de carbono (Al Jitan et al., 2020; Chen & Jin, 2019; Kočí et al., 2008; Razzaq & In, 2019; W.-N. Wang et al., 2014). Sin embargo, el hecho de que la radiación necesaria para excitar los electrones de su capa de valencia debe ser del ámbito ultravioleta, disminuye su potencial para ser utilizado en aplicaciones con luz solar. Para mitigar esta desventaja del TiO2 se han utilizado diferentes estrategias, entre ellas la sensibilización con especies cromóforas que absorben radiación visible e inyectan electrones a las partículas de TiO2 con lo que favorecen los procesos de reducción catalizados por el TiO2.
Entre algunos de los tintes más utilizados, destacan compuestos orgánicos como la rodamina B, la tionina, y la eritrosina (Carp et al., 2004); no obstante, también resulta usual la utilización de complejos metálicos (Ola & Maroto-Valer, 2015). Entre algunos complejos utilizados en la sensibilización del dióxido de titanio destacan el tinte N3 complejo metálico del rutenio (Nguyen et al., 2008), el tinte [Ru(bipy)3]2+ (bipy = 2,2´-bipiridina) (Ozcan et al., 2007), complejos metálicos de renio (Ha et al., 2014), entre otros.
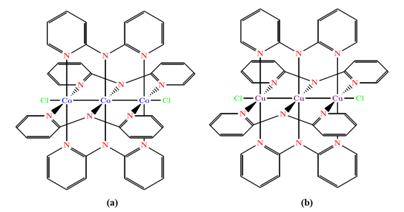
Particularmente, la sensibilización de TiO2 con diferentes moléculas orgánicas bifuncionales y trímeros de compuestos de transición ha sido utilizada para la síntesis de fotocatalizadores, evaluados en diversas aplicaciones como celdas solares y producción de hidrógeno a partir de la separación de agua (Camacho, 2012; Rivera, 2012). Por su parte, Montero ( 2014) estudió la funcionalización del dióxido de titanio con diversas alternativas, entre ellas, trímeros de Cu, Co, Ni y un dímero Ru para lo que utilizó glicina o ácido p-aminobenzoico (PABA) como moléculas de anclaje. En su evaluación de producción de hidrógeno, el trímero de cobre (Cu3(dpa)4Cl2) (dpa = 2,2´-dipiridilamina) fue el que presentó mejores resultados, seguido por el trímero de cobalto (Co3(dpa)4Cl2); además se determinó que utilizar PABA como molécula de anclaje producía los mejores resultados. Debido a la importante actividad catalítica demostrada en los anteriores estudios, se decidió investigar la aplicación de estos dos fotocatalizadores en la fotorreducción de dióxido de carbono.
En el presente artículo se reporta la evaluación de fotocatalizadores de dióxido de titanio sensibilizados con trímeros de cobalto [Co3(dpa)4Cl2] (dpa = 2,2´-dipiridilamina) y cobre [Cu3(dpa)4Cl2] en la fotorreducción de dióxido de carbono en fase acuosa. Así mismo, se definieron condiciones adecuadas para llevar a cabo las reacciones de funcionalización del TiO2 en un reactor de microondas, donde primero funcionaliza la superficie del TiO2 con ácido p-aminobenzoico (PABA) que actúa como molécula de enlace, y luego se ancla el trímero metálico. La estructura de los cromóforos utilizados se puede observar en Figura 1.
METODOLOGÍA
Determinación de condiciones de reacción para la síntesis de los fotocatalizadores
La síntesis de los fotocatalizadores se realizó con un reactor de microondas (Discover, CEM), mediante dos reacciones secuenciales: primero se lleva a cabo una reacción de funcionalización de la superficie del TiO2 con PABA, el cual actúa como molécula de enlace entre el TiO2 y el trímero metálico; luego se hace reaccionar el TiO2 funcionalizado con el trímero respectivo para que se dé el anclaje de este mismo a la estructura (ver Figura 2). Para cada una de estas dos reacciones, se realizó un diseño experimental con el propósito de determinar las condiciones de reacción que producían los mayores rendimientos.
Reacción de funcionalización del TiO2 con PABA
En esta primera etapa se funcionalizó el dióxido de titanio (Aeroxide TiO2 P-25) con el ácido p-aminobenzoico (Sigma-Aldrich) utilizando el método propuesto por Rivera (2012), se pesaron 0,3 g de dióxido de titanio, posteriormente, esta masa se agregó en el tubo utilizado para la síntesis, y se adicionó una disolución de ácido p-aminobenzoico en acetona (5 mL, 10 % m/m), después se agitó vigorosamente. En una última instancia se posicionó el tubo de reacción en el reactor de microondas y se ajustaron las condiciones según el esquema experimental propuesto. El diseño experimental seleccionado para esta etapa fue un Taguchi L9 con 3 réplicas. Se varió la temperatura, potencia y tiempo en 3 niveles, los cuales se pueden observar en la Tabla 1.
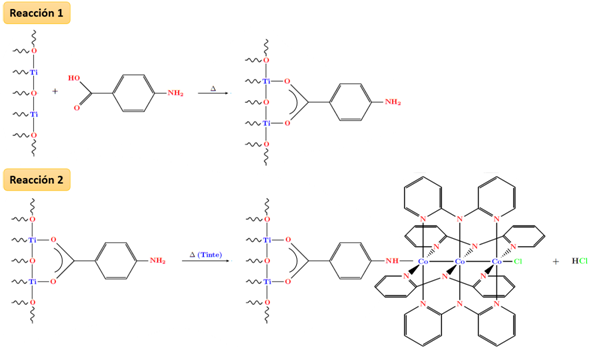
Figura 2 Reacciones involucradas en la síntesis de los fotocatalizadores utilizados: (1) El ácido p-aminobenzoico se ancla al semiconductor, (2) Proceso de sensibilización con el cromóforo seleccionado. Nota: Fuente propia de la investigación.
Tabla 1 Niveles seleccionados para cada variable en la reacción de funcionalización de dióxido de titanio con PABA
| Nivel | Potencia (W) | Tiempo (min) | Temperatura (°C) |
|---|---|---|---|
| Alto | 250 | 10 | 90 |
| Medio | 150 | 7 | 80 |
| Bajo | 100 | 5 | 70 |
Nota: Fuente propia de la investigación.
Reacción de anclaje de los trímeros de Cu y Co
Después de seleccionar las mejores condiciones para la funcionalización con PABA, se estudiaron las condiciones de reacción para el anclaje de los trímeros metálicos. Para el caso del catalizador con trímero de cobre se siguió la metodología propuesta en Berry et al. (2003), y para el de trímero de cobalto el procedimiento establecido por Cotton et al. (1997). En el tubo de reacción del reactor de microondas se agregaron 5 mL de una disolución del trímero respectivo en tetrahidrofurano (0,5 g en 90 mL) y 0,3 g del dióxido de titanio funcionalizado obtenido en la primera etapa.
Posteriormente se procedió a variar las condiciones acordes al diseño estadístico seleccionado (factorial 23 para el caso de Co y factorial 22 para el caso de Cu). Los niveles escogidos para cada variable se pueden observar en el Tabla 2. En el caso del trímero de Co se estudiaron las tres variables, mientras que para el de Cu no se estudió la potencia.
Tabla 2 Niveles seleccionados para cada variable en la reacción de anclaje del trímero metálico al dióxido de titanio funcionalizado con PABA
| Nivel | Potencia (W) | Tiempo (min) | Temperatura (°C) |
|---|---|---|---|
| Alto | 250 | 12 | 90 |
| Bajo | 150 | 5 | 80 |
Nota: Fuente propia de la investigación.
Después del proceso de síntesis con microondas, se procedió a realizar lavados de cada muestra con tetracloruro de carbono y un subsecuente secado a temperatura ambiente.
Caracterización de los fotocatalizadores sintetizados
En la primera etapa de síntesis se realizó una cuantificación del ácido p-aminobezoico funcionalizado en el TiO2, para esto se sometió cada muestra a un ambiente alcalino (NaOH, 0,1 M) durante 10 min. Después de un proceso de separación, la fase líquida fue analizada, se cuantificó la cantidad de PABA presente mediante espectrofotometría a 265 nm, con la ayuda de una curva de calibración previamente estandarizada. Se utilizó un espectrofotómetro ultravioleta-visible marca Termo Scientific modelo Evolution 600.
Además de la cuantificación del PABA anclado a la matriz de dióxido de titanio, se realizó un análisis espectrométrico IR (espectrómetro FT-IR marca Perkin Elmer y el espectrómetro IR marca Thermo Scientific modelo Nicolet 6700) antes y después del proceso de funcionalización.
Por otro lado, luego del anclaje de los cromóforos seleccionados, se determinó el porcentaje Cu o Co presente en los fotocatalizadores, mediante espectroscopía de absorción atómica (para el caso de Cu) y mediante espectrometría de emisión óptica con plasma acoplado inductivamente (para el caso de Co). Se utilizó un espectrómetro marca Perkin-Elmer y modelo Plasma 400 Sequential ICP-OES Spectrometer en el caso de ICP, mientras que para absorción atómica se utilizó un Perkin-Elmer, modelo AAnalyst 300.
Por último, se realizó un estudio morfológico de los sólidos obtenidos mediante un microscopio electrónico de barrido marca Hitachi modelo S- 3700N; además, se realizó una semicuantificación de Co mediante fluorescencia de rayos X por energía dispersiva (EDX).
Cuantificación de los productos de reacción
En el proceso de evaluación de los fotocatalizadores sintetizados se decidió cuantificar el formaldehído, ácido fórmico y metanol en la fase líquida, e hidrógeno, metano y monóxido de carbono en la fase gaseosa. Para la determinación de formaldehído se utilizaron, como base, las normas NIOSH 3500 y ASTM E1333 - 96(2002). Primeramente, se realizó una curva de calibración, para esto se valoró, con ácido clorhídrico, una disolución de formalina previamente tratada con sulfito de sodio, con timolftaleína como indicador (Jordan, 1980).
Para cuantificar el ácido fórmico, se realizó un pretratamiento a la muestra líquida, el cual consistió en reducir todo el ácido fórmico a formaldehído mediante la adición de magnesio y ácido clorhídrico; seguidamente se utilizó el método antes mencionado para cuantificar la cantidad de aldehído presente en la muestra. En lo que respecta al metanol, su determinación fue realizada mediante cromatografía de gases, utilizando un cromatógrafo marca SHIMADZU, modelo GC-2014 y una columna RTX-5 (60 m, 0.32 mm DI, 1.00 µm), se utilizó un detector FID, el volumen inyectado fue de 2 microlitros, la temperatura del horno se mantuvo en 45 °C, mientras que la temperatura del inyector en 200 °C, con un split de 40:1 y un flujo de gas nitrógeno de 2 mL/min. La determinación de las sustancias en la fase gaseosa se realizó mediante cromatografía de gases para lo cual se utilizó un cromatógrafo marca Hewlett Packard, modelo 6890, se usó una columna Supelco Carboxen-1010 Plot (30 m, 0,53 mm). La cuantificación de hidrógeno y monóxido de carbono se realizó con un sensor de conductividad térmica (TCD); mientras que para el metano con el de ionización de llama (FID); la temperatura del horno se mantuvo en 100 °C (4 min) hasta 230 °C a 15 °C/min; la temperatura de inyección fue de 200 °C; mientras que la del detector se estableció en 230 °C; por último, se utilizó como gas de arrastre nitrógeno con un flujo de 2 mL/min.
Evaluación de los fotocatalizadores en la reducción de dióxido de carbono
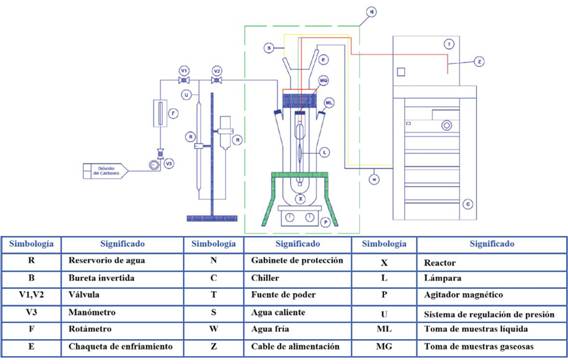
En esta etapa se realizaron diversas pruebas preliminares para garantizar que las sustancias de interés no fueron producto de la descomposición de alguna sustancia participante en el proceso de reacción; posteriormente, se evaluó el rendimiento de los fotocatalizadores sintetizados en la reducción de dióxido de carbono. En una primera instancia se pesaron 0,8 g de catalizador sintetizado, masa que se agregó en un beaker de 200 mL, además se adicionaron 150 mL de agua destilada; seguidamente el sistema fue sometido a un proceso de sonidificación con ultrasonido por 10 min, esto con el objeto de dispersar de mejor manera la muestra. La mezcla resultante se agregó al fotorreactor (Ace Glass 7861) de 1000 mL, junto con 620 mL de agua destilada y 30 mL de alcohol isopropílico como agente de sacrificio; el volumen final de reacción se mantuvo en 800 mL. El alcohol isopropílico actúa en este sistema como un agente reductor y donador de hidrógeno, función necesaria para inhibir la reducción del agua y, con ello, la producción de hidrógeno: de no estar presente, la reacción inhibida sería la fotorreducción del dióxido de carbono. Se utilizó una lámpara de mercurio de mediana presión de 450 W de potencia y un chiller marca Buchi (modelo F-305) para mantener la temperatura del sistema en 25 °C. Se burbujeó dióxido de carbono en el sistema por 30 min, para finalmente encender la lámpara e iniciar la toma de muestras. Las reacciones fueron monitoreadas por un periodo de 6 h a presión atmosférica. El esquema del montaje experimental utilizado se puede observar en la Figura 3.
ANÁLISIS Y RESULTADOS
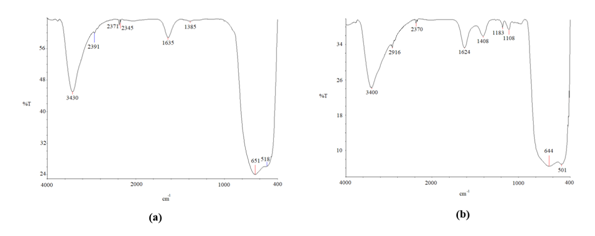
Durante la etapa de funcionalización del TiO2 con el ácido p-aminobenzoico, se presentó el anclaje de esta molécula en la superficie del dióxido de titanio, mediada por calentamiento con microondas. Los ácidos carboxílicos se enlazan fuertemente con el titanio en su forma bidentada, además el grupo amino libre puede ser utilizado para injertar polímeros o biomoléculas a la superficie del dióxido de titanio (Thomas et al., 2014). En esta investigación se realizó un proceso similar, en el cual se notó un cambio de color de blanco a amarillo después de la funcionalización. La unión dióxido de titanio-PABA se pudo evidenciar en el espectro IR obtenido para el TiO2 antes y después del proceso de funcionalización con microondas. Al contrastar ambos espectros (ver figura 4), se pueden distinguir algunas aportaciones del ácido p-aminobenzoico, en términos estructurales, al producto final. En el espectro del catalizador funcionalizado se pudo notar un pico ancho ubicado a los 3400 cm-1, el cual se puede asociar al grupo hidroxilo característico de un ácido carboxílico; también se notan dos picos a los 1624 cm-1 y 1408 cm-1, los cuales se asocian al grupo aromático presente en el ácido carboxílico.
En lo que respecta al diseño robusto establecido (Taguchi L9) en esta sección de la experimentación, no se presentó una diferencia significativa entre los diversos tratamientos en la variable de respuesta seleccionada, específicamente el porcentaje de ácido p-aminobenzoico anclado a la superficie del dióxido de titanio (p fue menor que el α definido en todos los casos, situación que se puede observar en la Tabla 3), no se percibió efecto alguno de las diferentes variables seleccionadas. Lo anterior en términos experimentales establece que ni el cambio de condiciones ni sus respectivas combinaciones resultaron suficientes para variar la composición final del ácido p-aminobenzoico impregnado en la superficie del catalizador, la cual en promedio fue 0,82 %. Lo anterior significa que se pueden trabajar todas las variables en los niveles bajos propuestos (5 min, 70 °C y 100 W), y dio como resultado un producto similar al producido al fijarlas en sus niveles altos, lo cual representa un buen hallazgo en términos de ahorro energético y de tiempo de trabajo. Se comprobaron los supuestos del análisis de varianza.
Tabla 3 Resultados del análisis de varianza realizado para el diseño robusto Taguchi L9 implementado
| Fuente de variabilidad | Suma de cuadrados | Grados de libertad | Cuadrado medio | Valor-p |
|---|---|---|---|---|
| Tiempo | 0,0028 | 2 | 0,0014 | 0,7848 |
| Temperatura | 0,0014 | 2 | 0,0007 | 0,8845 |
| Potencia | 0,0048 | 2 | 0,0024 | 0,6696 |
| Error | 0,1161 | 20 | 0,0058 | - |
| Total | 0,1251 | 26 | - | - |
Nota: Fuente propia de la investigación.
En la segunda etapa de reacción, relativa a la sensibilización, se notó un cambio de color de amarillo a verde al agregar el trímero de cobre y a azul en el caso del trímero de cobalto (ver Figura 5). Después de realizar los análisis estadísticos de tipo factorial por separado para cada modificación (23 en el caso del cobalto y 22 en el caso del cobre), se determinó, con un 95 % de confianza, que las condiciones seleccionadas no alteraron la cantidad de cobre o cobalto ancladas al catalizador después del proceso de calentamiento con microondas (ver Tablas 4 y 5).

Figura 5 Coloración de los fotocatalizadores: a) comparación entre el dióxido de titanio funcionalizado con PABA y el fotocatalizador sensibilizado con el trímero de cobalto b) fotocatalizador sensibilizado con el trímero de cobre. Nota: Fuente propia de la investigación.
Ante los resultados de los análisis de varianza, se recomienda la utilización de los niveles bajos en ambos casos, 150 W, 5 min y 80 °C para la sensibilización con cobalto, mientras que 5 min y 80 °C en el caso del trímero de cobre. Para cada diseño se comprobaron los supuestos del ANOVA.
Tabla 4 Resultados del análisis de varianza realizado para el diseño factorial 23 implementado en el caso de la sensibilización con el trímero de cobalto
| Fuente de variabilidad | Suma de cuadrados | Grados de libertad | Cuadrado medio | Valor-p |
|---|---|---|---|---|
| Temperatura | 0,0068 | 1 | 0,007 | 0,732 |
| Tiempo | 0,0390 | 1 | 0,039 | 0,420 |
| Potencia | 0,0638 | 1 | 0,064 | 0,309 |
| Temperatura-tiempo | 0,0885 | 1 | 0,089 | 0,237 |
| Temperatura-potencia | 0,1106 | 1 | 0,111 | 0,191 |
| Tiempo-potencia | 0,0518 | 1 | 0,052 | 0,356 |
| Temperatura-tiempo-potencia | 0,1208 | 1 | 0,121 | 0,173 |
| Error | 0,4325 | 8 | 0,054 | - |
| Total | 0,9136 | 15 | - | - |
Nota: Fuente propia de la investigación.
Tabla 5 Resultados del análisis de varianza realizado para el diseño factorial 22 implementado en el caso de la sensibilización con el trímero de cobre
| Fuente de variabilidad | Suma de cuadrados | Grados de libertad | Cuadrado medio | Valor-p |
|---|---|---|---|---|
| Tiempo | 0,7200 | 1 | 0,7200 | 0,381 |
| Potencia | 0,4050 | 1 | 0,4050 | 0,501 |
| Tiempo-potencia | 1,4450 | 1 | 1,4450 | 0,235 |
| Error | 2,9700 | 4 | 0,7425 | - |
| Total | 5,5400 | 7 | - | - |
Nota: Fuente propia de la investigación.
Los análisis elementales realizados dieron como porcentaje promedio de cobre 15,45 % para la sensibilización con el trímero de cobre, mientras que para el de cobalto fue de 1,07 %; esto concuerda con los resultados obtenidos por Rivera (2012). Aunado a lo anterior, se realizó una determinación semicuantitativa por SEM-EDX, cuyo resultado se puede observar en la Figura 6. Este análisis arrojó un porcentaje de cobalto en la superficie de 0,77 %, valor cercano al obtenido en los análisis previos mediante ICP. En la Figura 6, también se puede observar la micrografía del fotocatalizador de dióxido de titanio funcionalizado con el trímero de cobalto, esta se utilizó para realizar el análisis elemental.

Figura 6 Micrografía del fotocatalizador sensibilizado con el trímero de cobalto y análisis elemental realizado. Nota: Fuente propia de la investigación.
Después de la síntesis de los fotocatalizadores y las pruebas del sistema de reacción se procedió a estudiar su efectividad en la reducción de dióxido de carbono en medio acuoso, y se encontraron los siguientes comportamientos después de aproximadamente 6 h de reacción.
Durante el proceso se monitoreó la cantidad de dióxido de carbono en la fase gaseosa. Se presentó una disminución de la concentración de esta sustancia en el medio con el pasar del tiempo, específicamente de 16,6 % en el caso del catalizador de cobre y de un 13,7 % con el de cobalto.
En el caso del catalizador sensibilizado con el trímero de cobre (ver gráfica 1-b) es importante notar una alta selectividad hacia la producción de hidrógeno. Esta situación se debe a que el rompimiento de agua es un proceso que se favorece en medio acuoso. La energía libre de Gibbs, asociada a la reducción del agua en hidrógeno, es de 237 kJ/mol; mientras que el proceso de fotorreducción de dióxido de carbono es cercano a los 600 kJ/mol, dependiendo de la reacción que se presente. Este argumento se fortalece, si se analizan los potenciales de reducción de las dos reacciones principales que se presentaron: la reducción del agua a hidrógeno posee un potencial de reducción de 0,00 V; mientras que para el paso de dióxido de carbono a metano este tiene un valor de -0,24 V. Se sabe que la banda de conducción del dióxido de titanio sin modificar a un pH de 7 presenta un valor de -0,50 V. Sin tomar en cuenta las modificaciones realizadas, se puede notar que la primera reacción resulta favorable, ya que la banda de conducción es mucho más negativa. Si no se toma en cuenta la producción de hidrógeno, se puede evidenciar una pequeña producción de metano (ver gráfica 2-b); además no se presentó producción de monóxido de carbono durante este proceso.
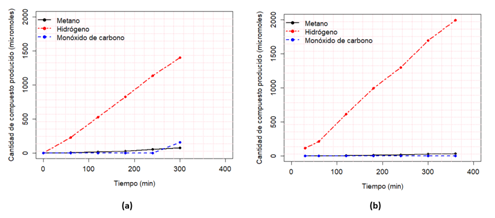
Gráfica 1 Micromoles producidos de cada uno de los productos mesurados durante el transcurso de la reacción; utilizando el fotocatalizador sensibilizado con el trímero de cobalto (a) y en (b) el trímero de cobre. Nota: Fuente propia de la investigación.
En lo que respecta al catalizador sensibilizado con el trímero de cobalto, se presentó un comportamiento similar, ya que se observó, mayoritariamente, el rompimiento de agua para producir hidrógeno (ver gráfica 1-a), con la salvedad de que sí hubo producción de monóxido de carbono. Como se puede notar en la gráfica 2-a, la concentración de metano creció con el pasar del tiempo, mientras que el monóxido de carbono empezó a producirse después de los 240 min, y sobrepasó la cantidad de metano. También es importante enmarcar la producción de este segundo compuesto, pues con el otro catalizador sensibilizado no se presentó (ver gráfica 2-b), por lo tanto, se puede inferir un mejor desempeño del catalizador modificado con el cromóforo de cobalto en la fotorreducción de dióxido de carbono, ya que se presenta una mayor producción de compuestos típicos de este procedimiento y una mayor diversidad de estos, cuando se agrega el monóxido de carbono.
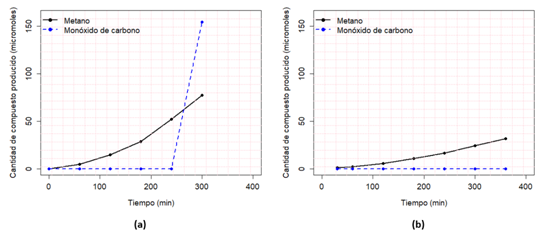
Gráfica 2 Micromoles producidos de metano y monóxido de carbono durante el transcurso de la reacción; utilizando el fotocatalizador sensibilizado con el trímero de cobalto (a) y en (b) el trímero de cobre
Según diversos estudios realizados en fotorreducción de dióxido de carbono (Izumi, 2015), el metano producido puede rondar entre  para el dióxido de titanio P-25 hasta
para el dióxido de titanio P-25 hasta para dióxido de titanio modificado con oro, donde se deben tomar en cuenta sus divergencias metodológicas (como el tipo de lámpara utilizada); sin embargo, se pueden establecer los
para dióxido de titanio modificado con oro, donde se deben tomar en cuenta sus divergencias metodológicas (como el tipo de lámpara utilizada); sin embargo, se pueden establecer los  como un promedio, si se consideran todas las investigaciones incluidas en este estudio. Es importante destacar que, si bien es cierto estos datos no resultan comparables, debido a divergencias en el procedimiento seguido para la obtención de los resultados, sirve como referencia para analizar el desempeño de los fotocatalizadores sensibilizados, el cual se puede tomar como bajo, ya que su rendimiento es cercano a los
como un promedio, si se consideran todas las investigaciones incluidas en este estudio. Es importante destacar que, si bien es cierto estos datos no resultan comparables, debido a divergencias en el procedimiento seguido para la obtención de los resultados, sirve como referencia para analizar el desempeño de los fotocatalizadores sensibilizados, el cual se puede tomar como bajo, ya que su rendimiento es cercano a los 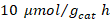 en promedio.
en promedio.
En el caso del monóxido de carbono, se presenta una situación diferente, pues el estudio realizado por Izumi (2015) presenta valores más bajos que los obtenidos en este trabajo.
Tomando en cuenta todo lo expuesto hasta el momento, se puede establecer que el catalizador con mejor rendimiento en la fotorreducción de dióxido de carbono fue el sensibilizado con el trímero de cobalto, ya que presentó más producción de monóxido de carbono y metano, productos típicos del fenómeno en cuestión; mientras que el modificado con el trímero de cobre resultó mejor en producción de hidrógeno. En la Tabla 6 se resume la producción de los diferentes productos por cada fotocatalizador.
Tabla 6 Producción de hidrógeno, metano y monóxido de carbono, según el fotocatalizador utilizado
| Fotocatalizador | Producción (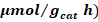
|
||
|---|---|---|---|
| H2 | CH4 | CO | |
| Trímero de Cu- TiO2 | 419,92 | 06,22 | 00,00 |
| Trímero de Co- TiO2 | 213,21 | 14,28 | 32,00 |
Nota: Fuente propia de la investigación.
Es importante destacar que para ninguno de los catalizadores se detectó producción de formaldehído, ácido fórmico ni metanol, en la fase líquida. En la mayoría de los estudios consultados, tampoco se presentó producción de compuestos en la fase líquida.
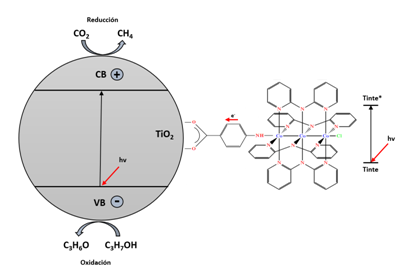
Después de analizada la experimentación, se puede realizar una aproximación al mecanismo de reacción, tal como se puede ver en la Figura 7. En primera instancia, la luz ultravioleta y visible proveniente de la lámpara de mediana presión excita el tinte promoviendo la generación de electrones; estos se movilizan aprovechado la deslocalización de electrones tanto en el cromóforo como en la molécula de anclaje, para ser inyectados en el semiconductor. Por otro lado, en la partícula de TiO2, si se obtiene la energía necesaria, se presenta un movimiento de electrones desde la banda de valencia hasta la banda de conducción. Los huecos producidos en la banda de valencia promueven procesos de oxidación, como, por ejemplo, el paso del isopropanol a acetona, o la transformación del agua en oxígeno; mientras que en la banda de valencia se dan reacciones de reducción como la conversión de dióxido de carbono en metano y monóxido de carbono, o bien, en la producción de hidrógeno. Después de todo este proceso, el tinte se regenera mediante la inyección de electrones a través de otras moléculas en el medio.
CONCLUSIONES
Se lograron sintetizar, satisfactoriamente, fotocatalizadores de TiO2 sensibilizados con trímeros de cobalto y cobre utilizando ácido p-aminobenzoico como molécula de enlace; estos fueron evaluados en su efectividad para reducir CO2 en fase acuosa.
No se presentó una diferencia significativa en el porcentaje de ácido p-aminobenzoico anclado al dióxido de titanio durante la primera etapa de síntesis al variar la temperatura, tiempo y potencia durante el proceso de calentamiento por microondas, por lo que esta reacción se puede trabajar en los niveles más bajos estudiados (70 ºC, 100 W y 5 min).
Tampoco se presentó una diferencia significativa en el porcentaje de trímeros de metal anclados en la segunda etapa de síntesis, por lo que también se puede trabajar en los niveles más bajos estudiados (80 ºC, 150 W y 5 min). En todas las evaluaciones de los fotocatalizadores se presentó una predominancia del proceso de rompimiento de agua sobre la fotorreducción de dióxido de carbono. El fotocatalizador sensibilizado con el trímero de cobalto presentó el mejor desempeño en la fotorreducción de dióxido de carbono con una producción de metano de 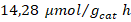 y de monóxido de carbono de
y de monóxido de carbono de 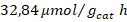 . En ninguno de los experimentos realizados se cuantificó producción de ácido fórmico, formaldehído ni metanol en la fase líquida. Por último, resulta relevante exponer que se notó una importante selectividad de los fotocatalizadores hacia la producción de hidrógeno, más que hacia la fotorreducción de dióxido de carbono; este hecho se convierte en uno de los principales retos de mejora para el desempeño de los catalizadores evaluados en el presente proyecto.
. En ninguno de los experimentos realizados se cuantificó producción de ácido fórmico, formaldehído ni metanol en la fase líquida. Por último, resulta relevante exponer que se notó una importante selectividad de los fotocatalizadores hacia la producción de hidrógeno, más que hacia la fotorreducción de dióxido de carbono; este hecho se convierte en uno de los principales retos de mejora para el desempeño de los catalizadores evaluados en el presente proyecto.
DECLARACIÓN DE LA CONTRIBUCIÓN DE LOS AUTORES Y AUTORAS
El porcentaje total de contribución para la conceptualización, preparación y corrección de este artículo fue el siguiente: C.R.S. 50 %, J.I.V. 8 %, L.W.P. 17 % y J.E.D.H. 25 %.
DECLARACIÓN DE DISPONIBILIDAD DE LOS DATOS
Los datos que respaldan los resultados de este estudio serán puestos a disposición por el autor correspondiente (C.R.S), previa solicitud razonable.