INTRODUCCIÓN
En la actualidad, la búsqueda de materiales restauradores que provean la garantía de un sellado efectivo entre el sustrato dental y el material de restauración, tomando en consideración sus propiedades biológicas y físicoquímicas en presencia de un medio húmedo, ha llevado a la expansión del uso de los materiales biocerámicos hacia el ámbito odontológico.
En el transcurso de las últimas cinco décadas, se ha documentado un avance favorable orientado hacia el desarrollo de materiales cerámicos con fines médicos (1). Sin embargo, no fue hasta los últimos veinte años que dichos avances fueron enfocados hacia el campo odontológico (2), gracias a las propiedades evidenciadas en diversos estudios (2,3,4,11,14).
Dentro del uso de dichos materiales biocerámicos, la utilización de materiales llamados “bioactivos”, es decir, aquellos capaces de inducir una respuesta biológica específica en el huésped (4), representa un avance remarcable en el campo de la Odontología. Una de las características principales de los materiales bioactivos es su habilidad para formar apatita (5). Dicho mineral favorece un sellado entre sustrato dentinario y el material de restauración, y su presencia ayuda a evitar una comunicación entre el tejido periodontal y el interior del órgano dental (6, 7), llevando así a una recuperación eficiente de estas estructuras.
El objetivo de este estudio es realizar una comparación de la cantidad de la patita generada por dos materiales biocerámicos: El material biocerámico clásico con propiedades mejoradas (8), MTA Repair HP® (Angelus Soluções Odontológicas, Londrina, PR, Brasil), lanzado en 2016 y Biodentine™ (Septodont, Saint-Maur-desFosses, Francia), un biocerámico lanzado al mercado en 2011 (11), y que ha ganado popularidad debido a las propiedades favorables que han sido documentadas sobre él, sin poseer las desventajas de otros materiales convencionales (9,10).
MATERIALES Y MÉTODOS
PREPARACIÓN DE LAS MUESTRAS
Se recolectaron órganos dentarios unirradiculares de reciente extracción los cuales se lavaron, desinfectaron y mantuvieron en hidratación con cloruro de sodio al 0.9%. Se seleccionaron de acuerdo con los criterios de inclusión y la porción coronal les fue removida. El segmento radicular se incluyó en acrílico autopolimerizable dentro de contenedores cilíndricos de cristal de 0.7 cm de diámetro. Los cilindros obtenidos con la porción radicular incluida fueron seccionados en tres segmentos con una pieza de mano de baja velocidad (NSK GS200) y un disco de diamante de dos luces DIS18 (Temok, Dental Instrumentation) conservando únicamente el tercio medio, correspondiente al tercio medio radicular. La sección resultante se calibró para obtener discos de dentina de 2.0 mm de grosor, los cuales se midieron con la ayuda de un calibrador vernier digital modelo HER-411 (Steren, México), obteniendo en total 8 discos. En cada disco de dentina, el espacio del conducto radicular existente fue ensanchado utilizando una fresa XGates Drill® (Dentsply, Tulsa Dental, Johnson City, TN, USA) para obtener un diámetro estandarizado de 1.10 mm. Las muestras fueron inmersas en MDCleanser® (ácido etilendiaminotetraacético, Meta-Biomed Co, Republic of Korea) al 17% durante 3 minutos seguido hipoclorito de sodio al 5.25% durante el mismo periodo de tiempo. En ambos periodos el irrigante se activó por medio de ultrasonido piezo eléctrico (Varios 560 NSK). Posteriormente los discos de dentina se lavaron con agua bidestilada durante 1 minuto y se dividieron aleatoriamente en 4 grupos. Grupo 1: Biodentine™ (Septodont, Saint-Maur-des-Fosses, France), grupo 2: MTA Repair HP® (Angelus Soluções Odontológicas, Londrina, PR, Brazil), grupo 3: Control positivo MTA Angelus® (Angelus Soluções Odontológicas, Londrina, PR, Brazil), grupo 4: Control negativo IRM® (Dentsply, Tulsa Dental, Johnson City, TN, USA). Todos los materiales se preparon de acuerdo a las indicaciones del fabricante, se obturo la porcion del conducto radicular en cada una de las muestras de los diferentes grupos. Posteriormente, las muestras se almacenaron individualmente en 15 ml de solución PBS pH 7 (solución salina amortiguada por fosfato, J. T. Baker, México) dentro de contenedores plásticos estériles desechables (SYM Laboratorios, México) durante 10 días en una incubadora bacteriológica de tipo seco (Blue Island, Illinois, USA) a 37º centígrados. La solución PBS fue renovada 5 días después de la primera inmersión. Una vez finalizado este periodo, los discos fueron colocados en la incubadora a 37ºC por 24 horas para su deshidratación. Pasadas las 24 horas, las muestras se colocaron en cajas Petri estériles desechables 100x15mm (SYM Laboratorios, México) para su transporte con gel de sílice para evitar la rehidratación.
ANÁLISIS POR MEDIO DE MICROSCOPIO ELECTRÓNICO DE BARRIDO
La caracterización morfológica del precipitado de apatita se realizó mediante un Microscopio Electrónico de Barrido de Emisión de Campo JEOL (Modelo JSM00F). En cada muestra se analizaron 4 zonas a tres magnificaciones: 500x, 1,500x y 8,000x utilizando un voltaje acelerado de
2.00 kV.
ANÁLISIS POR MEDIO DE ESPECTROSCOPÍA RAMAN
La caracterización microestructural se realizó por medio de Espectroscopía Raman con un instrumento Thermo Scientific TM DXRTM Raman microscope (Thermo Electron Scientific Instruments LLC, Madison, WI USA) conectado a un microscopio con 10 aumentos. Para cada muestra se obtuvieron 4 espectros en condiciones de dispersión inversa de 5.5 cm-1, utilizando una línea laser de 532 nm con una potencia de 10 mW.
ANÁLISIS POR MEDIO DE ESPECTROMETRÍA DE DISPERSIÓN DE ENERGÍA DE RAYOS X
La caracterización de la composición química se realizó mediante un Microscopio Electrónico de Barrido conectado a un detector de Energía Dispersiva de Rayos X (Inspect™ Scanning Electron Microscope, Japan). En cada muestra se analizaron 4 zonas utilizando un voltaje acelerado de 30 kV.
RESULTADOS
MICROSCOPIO ELECTRÓNICO DE BARRIDO DE EMISIÓN DE CAMPO
Cada muestra se analizó morfológicamente por medio de Microscopio Electrónico de Barrido a tres magnificaciones. En las muestras del grupo 1 Biodentine™ y grupo 2: MTA Repair HP®, y control positivo, la morfología del precipitado de apatita fue más evidente a 8,000 magnificaciones. A una magnificación de 500x, la superficie de Biodentine™ mostró aposición de precipitado distribuido de forma irregular, además, la interfaz dentina-material restaurador era poco notable, debido a que el precipitado se extendía más allá de la superficie del material restaurador. A 8,000x, la zona central mostró esferulitas adyacentes al material restaurador Biodentine™, mientras que las zonas periféricas 1 y 2 mostraron precipitado con una morfología que se asemeja a un conjunto de pétalos con la cresta siempre en dirección opuesta a la base. A una magnificación de 500x, la superficie de MTA Repair HP® mostró aposición de precipitado, aunque en menor cantidad que el generado sobre la superficie de Biodentine™, además, la interfaz dentina-material restaurador se observaba bien delimitada. A 8,000x, las zonas periféricas 1 y 2 mostraron aposición de precipitado en forma de pétalos, al igual que el observado sobre el precipitado de Biodentine™. A una magnificación de 500x, la superficie de MTA Angelus® mostró aposición de precipitado, al igual que el observado en las dos muestras anteriores, en proporciones parecidas a las obtenidas sobre la superficie de MTA Repair HP®. A 8,000x, la zona central y las zonas periféricas 1 y 2 mostraron aposición de precipitado en forma de pétalos.
En el grupo control negativo: IRM® tanto la zona central, como las zonas periféricas 1, 2 y 3 exhibieron cristales del material de restauración provisional IRM® sin aposición de precipitado.
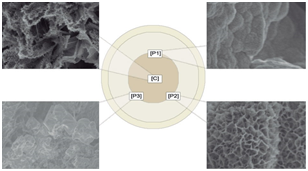
Figura 1 Representación de un disco de dentina y los cuatro puntos de medición. [C] zona central del material restaurador, [P1] zona periférica 1, [P2] zona periférica 2 y [P3] zona periférica 3. (De) Dentina, (Ce) Cemento y (MR) Material restaurador. (A) Zona central Biodentine™ (B) Zona periférica 1 MTA Angelus®. (C) Zona periférica 2 MTA Repair HP®. (D) Zona periférica 3 IRM®.
ESPECTROMETRÍA DE DISPERSIÓN DE ENERGÍA DE RAYOS X
El precipitado producido sobre la superficie de Biodentine™ demostró tener un mayor porcentaje de fósforo y calcio que el producido sobre MTA Repair HP® y MTA Angelus®. El precipitado formado sobre MTA Repair HP® demostró tener menor composición porcentual de fósforo con respecto a Biodentine™. El análisis de un disco de dentina sin material de obturación demostró resultados semejantes en los porcentajes de fósforo y calcio a los obtenidos sobre la superficie de MTA Repair HP® y MTA Angelus® (Tabla 1).
Tabla 1 Tabla comparativa que muestra los porcentajes de los elementos hallados en las cuatro zonas analizadas de las cuatro muestras.
| Biodentine™ | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| C | O | Na | Mg | Si | P | Cl | K | Ca | Fe | Ca/P ratio | ||||||
| Centro | 2.17 | 41.63 | 1.48 | 0.17 | 0.12 | 17.30 | 0.04 | 0.25 | 36.76 | 0.07 | 2.12 | |||||
| Zona 1 | 2.07 | 44.29 | 1.53 | 0.03 | 0.07 | 17.26 | 0.05 | 0.30 | 34.33 | 0.07 | 1.98 | |||||
| Zona 2 | 2.71 | 44.89 | 1.86 | 0.08 | 0.00 | 17.52 | 0.04 | 0.32 | 32.52 | 0.07 | 1.85 | |||||
| Zona 3 | 2.81 | 40.71 | 1.32 | 0.05 | 0.21 | 17.43 | 0.05 | 0.19 | 37.15 | 0.09 | 2.13 | |||||
| MTA Repair HP® | ||||||||||||||||
| C | O | Na | Mg | Si | P | Cl | K | Ca | Fe | Ca/P ratio | ||||||
| Centro | 3.01 | 56.44 | 3.99 | 0.95 | - | 11.77 | 0.03 | 1.21 | 22.46 | 0.14 | 1.90 | |||||
| Zona 1 | 4.19 | 45.91 | 2.37 | 0.19 | 2.16 | 15.75 | 0.05 | 0.54 | 28.83 | - | 1.83 | |||||
| Zona 2 | 3.99 | 45.31 | 2.62 | 0.17 | 1.91 | 15.55 | 0.04 | 0.51 | 29.12 | 0.79 | 1.87 | |||||
| Zona 3 | 6.79 | 43.13 | 2.15 | 0.24 | 2.17 | 14.97 | 0.02 | - | 30.43 | 0.10 | 2.03 | |||||
| MTA Angelus® | ||||||||||||||||
| C | O | Na | Mg | Si | P | Cl | K | Ca | Fe | Ca/P ratio | ||||||
| Centro | 2.68 | 44.37 | 1.64 | - | 2.98 | 14.50 | - | 0.26 | 33.56 | - | 2.31 | |||||
| Zona 1 | 8.09 | 44.01 | - | - | 2.51 | 14.38 | 0.10 | 0.23 | 30.59 | 0.09 | 2.12 | |||||
| IRM® | ||||||||||||||||
| C | O | Na | Mg | Si | P | Cl | K | Ca | Fe | Zn | Ca/P ratio | |||||
| Centro | 23.53 | 34.16 | 7.78 | 0.25 | 0.03 | 8.52 | 0.03 | 1.63 | 1.46 | 0.07 | - | 0.17 | ||||
| Zona 1 | 15.62 | 40.79 | 2.39 | 0.32 | 0.05 | 11.86 | 0.05 | 0.68 | 13.63 | 0.07 | 14.53 | 1.14 | ||||
ESPECTROSCOPÍA RAMAN
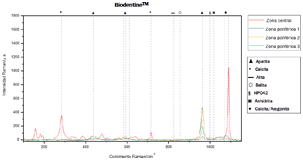
El espectro obtenido de la zona central del precipitado formado sobre la superficie de Biodentine™, cuyo láser apuntó a un área con aposición mínima de precipitado, muestra picos distintos a los generados en los espectros de las zonas periféricas 1, 2 y 3, en las cuales el láser apuntó directamente al precipitado. En estas últimas tres zonas, la intensidad generada por el pico de apatita es mayor al producido en la zona central (Figura 2).
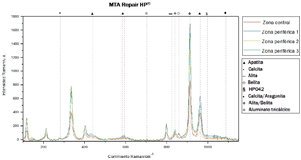
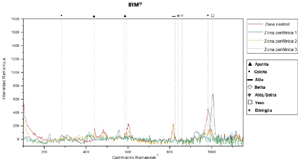
En los espectros obtenidos de la superficie de MTA Repair HP® y MTA Angelus® se puede observar que los picos coinciden en las cuatro zonas analizadas y el pico más pronunciado corresponde a alita/belita (Figura 3 y Figura 4).
Los espectros obtenidos de la superficie de IRM®, muestran una gran variabilidad de picos en todas las zonas analizadas, siendo el pico más pronunciado el correspondiente a yeso (Figura 5).
DISCUSIÓN
Este estudio ha demostrado que, ante la inmersión en una solución tamponada por fosfato, Biodentine™, MTA Repair HP® y MTA White®, presentaron cambios morfológicos y químicos sobre su superficie. Estos hallazgos son similares a los reportados por Bozeman et al. (2006), Tay et al. (2007), Reyes Carmona et al. (2009), Gandolfi et al. (2010), Kim et al. (2016) y Ranjkesh et al. (2016) quienes analizaron la respuesta de diferentes materiales de silicato de calcio después de ser sumergidos en una solución a base de fosfato.
En esta investigación se observó, como primer hallazgo, que al quinto día de inmersión en solución PBS, se había formado una capa de precipitado de color blanco macroscópicamente visible y distribuido de forma irregular sobre la superficie del Biodentine™. Estos hallazgos son semejantes a los reportados por Reyes Carmona et al. (5) y Gandolfi et al. (13), quienes observaron que al paso de cinco días de inmersión en solución PBS, los cementos a base de silicato de calcio utilizados en sus estudios habían formado un precipitado blanco visible a simple vista.
En este estudio, la morfología del precipitado se analizó después de 10 días de inmersión en solución PBS mediante MEB a una magnificación de 1,500x, en la cual se observaron grupos de protuberancias de forma redondeada con un diámetro de 2 a 5 micrones sobre la superficie de MTA Repair HP®, morfología que ya había sido antes reportada por Reyes Carmona et al. 5 y Ranjkesh et al. (16).
Dos tipos de morfologías fueron visibles a una magnificación de 8,000x, la primera de ellas fue en forma de esferulitas, con un diámetro de 0.4 a 1 micrón, observadas sobre la superficie de Biodentine™, mientras que el otro tipo de morfología se presentó en forma de pétalos, y se observó sobre el precipitado de Biodentine™ y MTA Repair HP®. Ambos tipos de morfología se reportaron con anterioridad por Ranjkesh et al. (16), y Reyes-Carmona et al., (5), quienes asociaron la configuración en forma de pétalos con precipitado de apatita, mientras que Gandolfi 24 et al. (13), reportaron la formación de esferulitas de apatita, las cuales poseían un diámetro de 0.5 a 2 micrones.
Los análisis realizados por medio de MEB-EDS indicaron que MTA Repair HP® y Biodentine™, contienen calcio y fósforo en cantidades importantes, con una relación Ca/P que varía en cada zona analizada, sin embargo, Biodentine™ mostró un mayor porcentaje de calcio y fósforo que MTA Repair HP®. Estos hallazgos coinciden con las imágenes obtenidas a través de MEB, ya que Biodentine™ muestra una mayor cantidad de aposición de precipitado.
Reyes Carmona et al. (5), reportaron un precipitado en forma de protuberancias redondeadas, el cual estaba compuesto principalmente de calcio y fósforo con una relación Ca/P de 1.40-1.42, mientras que en el precipitado en forma de pétalos la relación Ca/P era 1.41 a 1.55, además, Tay et al. (12), analizaron la relación Ca/P del precipitado formado sobre cemento Portland blanco después de diez días de inmersión en solución PBS, obteniendo una relación Ca/P de 1.40 a 1.50. Los resultados obtenidos para las muestras analizadas en este estudio son similares, ya que se encuentran dentro del rango obtenido por el reportado en la literatura (5) (12). Después de 10 días de inmersión en solución PBS, Biodentine™ demostró una relación Ca/P de 1.85 a 2.13 en las cuatro zonas, mientras que MTA Repair HP® demostró una relación Ca/P de 1.83 a 2.03 en las mismas zonas.
Gandolfi et al., reportaron que la relación Ca/P obtenida de la capa de precipitado aumentó con el tiempo de incubación, puesto que la relación Ca/P era de 1.32 durante el primer día de inmersión y aumentó a 1.98 después del séptimo día, lo que de acuerdo con ellos indicó la maduración de una fase de fosfato de calcio amorfo hacia apatita carbonatada, donde el carbonato reemplaza los iones fosfato (13).
Los espectros Raman obtenidos del precipitado formado sobre la superficie de Biodentine™ y MTA Repair HP® mostraron la presencia de picos que, de acuerdo con la literatura, corresponden a apatita, calcita, aragonita, alita y belita (13, 15, 17, 18).
En los espectros Raman obtenidos de las zonas periféricas de Biodentine™, el pico con mayor intensidad corresponde a apatita ~960/965 cm-1 debido a que el láser incidió sobre una capa prominente de precipitado, mientras que el obtenido de la zona central, cuyo láser incidió directamente sobre una zona de precipitado de menor espesor, muestra picos pronunciados de calcita ~281cm-1 y calcita/aragonita ~1087cm- 1, los cuales son componentes de Biodentine™.
En los espectros obtenidos de MTA Repair HP® los picos con mayor intensidad se encuentran en el corrimiento Raman ~860cm- 1, que corresponde a alita/belita, los cuales son los materiales núcleo que componen al MTA Repair HP®, silicato tricálcico y silicato dicálcico respectivamente. Picos de apatita en el corrimiento Raman ~965cm-1, 590cm-1 y 435cm-1 también fueron detectados en las cuatro zonas, aunque con una intensidad menor que la producida por alita/belita.
A pesar de que ambos materiales, Biodentine™ y MTA Repair HP®, mostraron picos de apatita, ninguno de ellos mostró picos ubicados en el corrimiento Raman ~1077cm-1, el cual ha sido reportado como un indicador de apatita carbonatada (16).
Reyes-Carmona et al. (5), reportaron la formación de apatita carbonatada después de 35 días de inmersión en solución PBS, mientras que Kim et al. (6) y Ranjkesh et al. (16), lo reportaron después de 28 días de inmersión. En los estudios antes mencionados, los autores reportaron la formación inicial de fosfato de calcio amorfo que posteriormente maduró hacia apatita carbonatada (19). Por lo tanto, la ausencia de picos que indiquen la presencia de este mineral en Biodentine™ y MTA Repair HP® puede indicar que el precipitado aún se encontraba en una fase de fosfato de calcio amorfo.
CONCLUSIÓN
En este estudio se comprobó que todos los materiales a base de silicato de calcio analizados demostraron ser bioactivos, debido a que sobre su superficie se formó un precipitado que, de acuerdo con los análisis realizados, demostró poseer fosfato de calcio amorfo, que actúa como precursor durante la formación de apatita carbonatada. Esta propiedad tiene una gran relevancia en el área biomédica y puede aportar múltiples beneficios en el campo odontológico, por lo tanto, es necesario analizar la capacidad de bioactividad de los biocerámicos de más reciente lanzamiento, además de las otras propiedades fisicoquímicas y biológicas de las cuales estos materiales son poseedores, mediante la ayuda de las herramientas tecnológicas y científicas que han contribuido significativamente en el campo de la investigación en odontología, aumentando la previsibilidad y el pronóstico con una mayor tasa de éxito en la rehabilitación oral.