Introducción
Aunque cerca de un 78% de la atmósfera está constituida por nitrógeno, este elemento no es fácilmente accesible a las plantas por estar en su forma gaseosa como dinitrógeno (N2). Sin embargo, existen microorganismos que tienen la capacidad de convertir el dinitrógeno en amonio, una sal que puede ser asimilada por prácticamente todos los organismos. El nitrógeno es un nutriente esencial, ya que es el componente principal de las proteínas y ácidos nucleicos. Algunos grupos de plantas como las leguminosas resuelven gran parte de sus requerimientos de nitrógeno a través del establecimiento de relaciones simbióticas con ciertas bacterias, llamadas rizobios, que pueden proveer hasta un 65% del nitrógeno disponible y que por consiguiente tienen gran importancia agrícola y ecológica (1)-(3).
La relación simbiótica establecida entre los rizobios y sus hospederos leguminosos es el resultado de una compleja señalización entre el huésped y el simbionte, resultando en la formación de nódulos, donde se encuentran las formas bacterianas de fijación de nitrógeno llamadas bacterioides. La infección de leguminosas por rizobios involucra la quimiotaxis de la bacteria con ácidos orgánicos, aminoácidos, azúcares y flavonoides excretados por las raíces hospederas (3, 4, 5, 6). El proceso biológico resultante, comúnmente conocido como fijación biológica de nitrógeno, es particularmente importante ya que tiene el potencial de reducir los costos de producción y aumentar la agricultura sostenible en suelos tropicales (7).
Aunque la fijación biológica de nitrógeno es un sello distintivo de la familia Fabaceae, los nódulos rizobianos también se encuentran en el género Parasponia (Cannabaceae) y dentro de otras ocho familias de angiospermas hay especies que forman nódulos con bacterias del género Frankia (Rosaceae, Betulaceae, Casuarinaceae, Myricaceae, Rhamnaceae, Elaeagnaceae, Datiscaceae, Coriariaceae). Todas estas familias que forman nódulos radiculares para fijar nitrógeno pertenecen a un mismo clado, Eurosidas I (Orden Rosales + Cucurbitales + Fagales), dentro del cual también hay muchas especies que no forman estas simbiosis (5), (8), (9). En el caso de Fabaceae, estudios comparativos con otras familias revelan que las leguminosas tienes sistemas radicales con mayor nitrógeno, menor largo específico de raíz y mayor diámetro que lo reportado en promedio para plantas con semillas (10), lo que sugiere una especialización particular de este grupo. Sin embargo, no está claro de donde proviene esta predisposición a formar nódulos, por qué no siempre se expresa, ni por qué existen diferencias morfológicas tan extensivas en los nódulos, pero muchas de estas respuestas pueden estar relacionadas con la historia evolutiva de estas plantas en conjunto con su historia biogeográfica y genética (9, 11, 12, 13, 14).
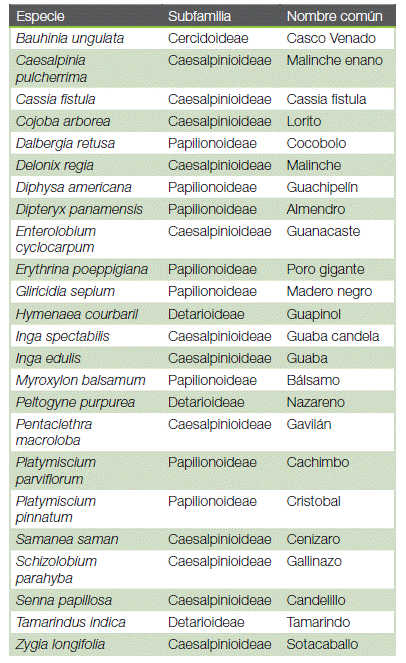
En Costa Rica, a pesar de que se han realizado varios estudios sobre la nodulación, muchas especies nativas, sobre todo forestales, no se han caracterizado o han sido estudiadas solo de manera superficial. En este estudio se evaluó la presencia de nódulos en 24 especies forestales leguminosas, agrupadas en cuatro subfamilias de Fabaceae, con la finalidad de establecer conexiones entre la capacidad de fijar nitrógeno, la filogenia y la morfología de las raíces. El establecimiento de estas relaciones provee información valiosa sobre los procesos de nodulación para determinar la influencia de los factores evolutivos, características funcionales o procesos químicos sobre la simbiosis. Siendo las leguminosas una familia con tanta importancia económica y ecológica, esta investigación proporcionará conocimientos fundamentales para la conservación y utilización de aquellas especies que se adaptan a vivir en condiciones ambientales adversas.
Materiales y métodos
En este estudio se evaluó la presencia de nódulos en 95 individuos de 24 especies de árboles leguminosos agrupadas en cuatro de las cinco subfamilias de Fabaceae, según la nueva clasificación APGII. Se utilizaron plantas de vivero entre los 30-70 cm de altura, la mayoría entre 0 y 2 años de edad, provenientes de un vivero forestal en San Carlos, el vivero de la Escuela de Ciencias Ambientales de la Universidad Nacional y otras creciendo como regeneración natural en jardines de la Sede Rodrigo Facio de la Universidad de Costa Rica. Se generó un árbol filogenético de las especies analizadas a partir de las secuencias del marcador TrnL y el espaciador intergénico TrnL-TrnF. Para la realización de la filogenia se bajaron las secuencias disponibles en Genbank del NCBI (https://www.ncbi.nlm.nih.gov/nuccore), luego se alinearon con el programa Mafft (https://mafft.cbrc.jp/alignment/server/), se editaron con el programa BioEdit (15). El árbol filogenético de máxima verosimilitud se generó con un modelo GTR+G+I implementado en el programa FastTree (16). Posteriormente el árbol fue visualizado con el programa MEGAX (17). Para cada individuo, además de la presencia o ausencia de nódulos, se tomaron en cuenta características morfológicas como la coloración y el grosor de sus raíces.
Resultados y discusión
Se detectó la presencia de nódulos en 14 de las 24 especies (58.3%), sin embargo, hubo grandes diferencias entre las subfamilias. En Detarioideae y Cercidoideae, consideradas como las más basales, no se detectaron nódulos. En la subfamilia Caesalpinioideae se encontraron nódulos en el 58.3% de las especies analizadas, todas en el clado que antes se clasificaba como Mimosaceae, En la subfamilia Papilionoideae, considerada como la más derivada, se observó la presencia de nódulos en el 87.5% de las especies evaluadas. En la Figura 1 se presenta un árbol filogenético de las especies estudiadas basado en el marcador molecular TrnL y el espaciador intergénico TrnL-TrnF, donde se marca la presencia o ausencia de nódulos, así como la coloración de la raíz. En general se distingue que las especies más derivadas de Fabaceae parecieran favorecer el establecimiento de relaciones simbióticas con bacterias rhizobiaceaes y, por tanto, la formación de nódulos que les permiten fijar nitrógeno atmosférico.
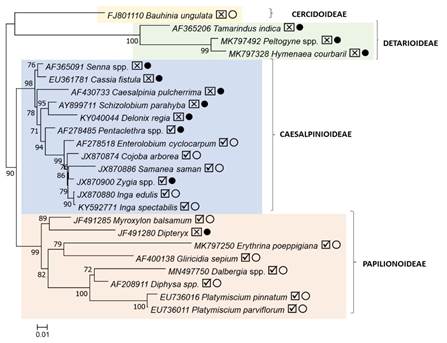
Figura 1 Relaciones filogenéticas de 24 especies de árboles pertenecientes a familia Fabaceae, agrupadas en cuatro subfamilias. El árbol filogenético de máxima verosimilitud se calculó a partir de las secuencias del marcador TrnL y el espaciador intergénico TrnL-TrnF, usando un modelo GTR+G+I implementado en el programa FastTree. Para cada especie se indica el número de acceso de las secuencias disponibles en el GenBank. Además, se indica si la especie presentó nódulos y si la coloración de las raíces fue clara u oscura.
Figure 1. Phylogenetic relationships of 24 tree species belonging to the Fabaceae family, grouped into four subfamilies. The maximum likelihood phylogenetic tree was calculated from the sequences of the TrnL marker and the TrnL-TrnF intergenic spacer, using a GTR+G+I model implemented in the FastTree program. For each species, the accession number of the sequences available in GenBank is indicated. In addition, it is indicated if the species presented nodules and if the coloration of the roots was light or dark.
En las subfamilias de leguminosas pareciera existir un patrón que asocia la capacidad de formar nódulos según el orden en que estas subfamilias evolucionaron (18). A partir de datos moleculares y fósiles de leguminosas, el origen de las leguminosas ha sido datado hace aproximadamente 59 millones de años, en un área semiárida al norte de la vía marítima de Tetis, con sus subfamilias reconocibles poco después (19), (20). Como nuestros resultados sugieren, la nodulación está ausente en los primeros linajes divergentes de la familia y por lo tanto la formación de nódulos evolucionó en las leguminosas en algún momento cercano después del origen de la familia (21). Esto concuerda con varias líneas de evidencia que sugieren que hace alrededor de 55 millones de años hubo un pico importante en el dióxido de carbono atmosférico, la temperatura y la humedad (22), (23). Como el proceso de fijación biológica de nitrógeno utiliza una cantidad significativa del carbono total fijado por la planta huésped, el exceso de dióxido de carbono junto con un déficit de nitrógeno pudo haber sido una fuerza impulsora para el origen de la nodulación.
Además de las condiciones climáticas, hay otros componentes y requisitos que debieron ser necesarios para el origen de la nodulación. Uno de estos tuvo que haber sido la capacidad de los dos organismos que participan en la simbiosis para reconocerse entre sí (24). En general, se acepta que esto se desarrolló a partir de la antigua simbiosis entre hongos y plantas terrestres para formar micorrizas arbusculares (25), (26). Actualmente se hipotetiza que cuando las leguminosas se encontraban en evolución reciente, los rizobios explotaron esta vía de señalización micorrícica, imitando las señales fúngicas simbióticas (27). También se ha sugerido que esta capacidad de señalización, y correspondientemente la nodulación en Fabaceae, ha surgido en eventos separados y se ha perdido en algunos linajes (9), (28). Esta podría ser la razón del porqué diferentes mecanismos de infección se observan dentro de las subfamilias de leguminosas y del porqué diferentes linajes de plantas se asocian con diferentes linajes de bacterias (9), (28). Por eso, las filogenias moleculares y los diferentes procesos de infección observados han revolucionado nuestra comprensión de las relaciones en las leguminosas y han llevado a una reorganización de los géneros y tribus tradicionales, aunque todavía exista una resolución incompleta en los clados más basales.
Estos análisis, por ejemplo, han confirmado que la nodulación ocurre en menor proporción en la subfamilia Caesalpinioideae, que ahora incluye lo que antes se consideraba la subfamilia Mimosoideae y en mayor proporción en la subfamilia monofilética Papilionoideae, aunque no sea universal en ninguno de los clados (20), (21). En Caesalpinioideae se han encontrado raíces invadidas por rizobios, con hilos de infección transcelular, pero sin la formación de nódulos (29). Esto apoya el razonamiento que, inicialmente, la formación de hilos de infección transcelular era una respuesta de defensa a un organismo invasor, ahora considerado simbionte, que evolucionó para desarrollar la infección del pelo radicular en los nódulos (30). Por otro lado, en Papilionoideae, donde algunos de los linajes divergentes más tempranos parecen ser incapaces de nodular, se liga el origen de la nodulación después de un evento de poliploidía desde el cual se reclutan los genes necesarios. Se ha sugerido que los principales donantes de genes duplicados fueron los genes asociados a las simbiosis de micorrizas arbusculares, los genes de formación del tubo polínico y los genes de hemoglobina (30, 31, 32). La falta de resolución en la filogenia y la ausencia de datos de nodulación para varios géneros hace imposible determinar si dentro de esta subfamilia ha habido más de un origen de nodulación (33). Mas aún, no se han establecido cuales son los mecanismos inhibitorios ligados a la ausencia de nodulación entre clados cercanamente emparentados, sean estos la ausencia de genes específicos ligados con las bacterias u otras adaptaciones a nivel radical que inhiben la nodulación.
En los resultados de esta investigación se observó que la mayoría de las raíces con nódulos presentaron una coloración clara, y las especies sin nódulos una coloración más oscura. La formación de nódulos requiere una secuencia de eventos altamente regulados y coordinados, iniciados por la generación de señales de flavonoides secretados por las raíces de la planta huésped. Se ha demostrado que los isoflavonoides y flavonoides presentes en los exudados de las raíces de una variedad de leguminosas inducen la transcripción de un conjunto importante de los genes nod de Rhizobium, responsables del proceso de nodulación (34).
Ejemplos de flavonoides que se liberan naturalmente de las plantas leguminosas para inducir la expresión de estos genes nod son la luteolina, algunas flavanonas (como el eriodictiol, la naringenina y la hesperetina), algunas flavonas (como la apigenina), algunos chalcones y algunos isoflavonoides (como la daidzeína y la genisteína) (35), (36). Las variaciones en los patrones de hidroxilación de estos flavonoides comunes en las raíces producen estructuras que dan colores claros, normalmente blancos o amarillentos, en estos tejidos subterráneos (5). Por ende, la coloración de las raíces y la química secundaria de las plantas podría ser un factor determinante en la capacidad de nodulación de una especie. Adicionalmente, la variación considerable entre los perfiles de flavonoides secretados en diferentes especies de leguminosas podría ser el factor que le permite a las bacterias distinguir a sus huéspedes y podría explicar la variación en la morfología de los nódulos y rutas de infección al afectar la expresión de proteínas y la actividad catalítica de una amplia variedad de enzimas (37).
Una coloración más oscura podría ser un indicador de la producción de sustancias tipo fenoles que son utilizadas por las plantas como un mecanismo de protección contra patógenos. Esto implicaría una posible contraposición entre el invertir en defensa a costa de simbiosis, o en el caso de las que realizan simbiosis, utilizar otros mecanismos alternativos para defenderse (38). Sin embargo, también hubo excepciones a lo anotado anteriormente. Por ejemplo, Bauhinia ungulata (Cercidoideae) no presentó nódulos a pesar de tener raíces claras (39) y esto podría deberse a su alta capacidad de formar simbiosis micorrízicas (40). Por otro lado, Pentaclethra macroloba y Zygia longifolia (Caesalpinioideae) sí presentaron nódulos a pesar de tener raíces con tonalidades oscuras. Estas especies podrían tener algún mecanismo de señalización e infección particular o algunas formas distintas de leghemoglobina por la cual tengan una coloración oscura en sus raíces a pesar de ser capaces de formar nódulos (41), (42). En este sentido, es necesario profundizar sobre el cómo los rasgos anatómicos, e incluso arquitecturales, de las raíces podrían tener relación con el establecimiento de relaciones simbióticas con bacterias fijadoras de nitrógeno.
La capacidad de algunas especies de fijar nitrógeno también podría llegar a ser un factor determinante para explicar la distribución de las especies y subfamilias y su preponderancia en distintos hábitats. La evidencia indica que las leguminosas se han movido desde tiempos muy cercanos a su origen a través de grandes distancias de agua, posiblemente saltando entre islas o por eventos climáticos extremos (43), (44). De esta forma, un posible evento único de pérdida de la nodulación en algunas especies podría resultar en especies no nodulantes estrechamente relacionadas que se encuentran en distintos continentes (23). También es crucial considerar que esta expansión en el territorio de las leguminosas no se da de forma aleatoria (45), (46). En años recientes se ha estudiado que el movimiento de las leguminosas fijadoras de nitrógeno se da hacia zonas más áridas por su capacidad de maximizar los recursos disponibles, como el agua (47), (48). Sin embargo, es probable que zonas anteriormente glaciadas tengan mayores cantidades de nitrógeno en el suelo y que la aptitud evolutiva se haya centrado en leguminosas no fijadoras de nitrógeno que gastan menos energía (49). Al respecto, es necesario realizar más investigación sobre este tema para explicar la composición de leguminosas noduladoras y no noduladoras en los trópicos y en zonas templadas y revelar la razón de la dominancia de ciertas subfamilias en distintos hábitats.
Una coloración blanca en los nódulos caracteriza a las estructuras cuando estas son jóvenes y aún no fijan nitrógeno. A medida que los nódulos aumentan de tamaño se vuelven color rosa a causa de la leghemoglobina, que controla el flujo de oxígeno a las bacterias (50). Durante el proceso de senescencia en los nódulos, que puede ocurrir por diferentes factores climáticos o fenológicos, los tejidos cambian de este color rosa a una coloración verde o negruzca debido a la degradación de la leghemoglobina y de los bacterioides (51). Se ha determinado que la actividad de los nódulos está estrechamente relacionada con el tamaño de las estructuras, siendo más productivas y conteniendo una mayor concentración de leghemoglobina cuando poseen un tamaño mediano. Por ende, si bien la coloración de las raíces podría ser una indicación de la capacidad de nodular de una fabácea, el tamaño de sus nódulos podría proveer un modelo simple y rápido para evaluar la actividad y fijación de nitrógeno de sus nódulos radiculares (52).
Se ha propuesto que algunas otras características morfológicas de las raíces tienen un efecto sobre la nodulación y viceversa. Al aumentar la densidad las raíces laterales de una planta, por ejemplo, se genera una fuerte competencia entre estas que disminuye la absorción de nitrógeno por unidad de longitud de la raíz (53). Por otro lado, el número y la distribución espacial de los nódulos afectan el crecimiento y la arquitectura del sistema radicular ya que tanto la disponibilidad como la distribución del nitrógeno influyen en el crecimiento lateral de las raíces (54). Por esto, la ubicación de los nódulos a lo largo del sistema radicular no se da de forma aleatoria. A nivel de una sola raíz, la región pequeña encima de la punta de la raíz donde los pelos radiculares han empezado a diferenciarse es más susceptible a la infección y es donde posteriormente se forman la mayoría de los nódulos. En esta ubicación, las paredes de los pelos radiculares permiten la deformación y así los rizobios penetran dentro del hilo de infección hasta la corteza de la raíz (55).
Sin embargo, observando el panorama del sistema radicular completo, no todas las raíces tienen nódulos y, muy a menudo, estos se encuentran en lo alto del sistema radicular. En sistemas de producción agrícola, esto se ha asociado con la aplicación de los inoculantes en la superficie del sustrato y la poca capacidad de migrar en el suelo de los rizobios (55). Otra posible explicación implica un mecanismo de regulación sistémico, donde los primeros nódulos que se forman envían una señal a la plántula y su interpretación lleva a la producción de una señal inhibitoria que desciende a la raíz, lo que evitaría que se desarrollen nuevos nódulos en las raíces más jóvenes que ahora se encuentran más profundas en el sustrato (56). Finalmente, otro nivel de control que afecta la distribución de los nódulos ocurre a nivel de genotipo, como se ha observado en la soja que diferentes variedades presentan diferentes perfiles de nodulación (54).
Hasta cierto punto parece que la morfología de la raíz y la filogenia de una especie son características indicativas de la capacidad de nodular de una leguminosa. Sin embargo, no todas las especies estudiadas responden al mismo patrón. Un caso notable dentro de las Papilionoideae evaluadas fue Dipteryx panamensis, la única dentro de este grupo que no presentó nódulos. Las raíces de esta especie se caracterizan por ser oscuras, gruesas, tener altos contenidos de nitrógeno, y elevadas tasas de crecimiento en las condiciones del bosque tropical húmedo (57), (58). Habría que determinar si esta especie es capaz de establecer algún otro tipo de relaciones endosimbióticas por ejemplo con bacterias no rhizobiaceaes (que no forman nódulos) o con micorrizas, que le permite tener ventajas adaptativas semejantes a la capacidad de formar nódulos y fijar nitrógeno. Los contenidos de nitrógeno deberían ser evaluados en demás especies de leguminosas que no formen nódulos, pues de manera similar podrían tener otros mecanismos para realizar la fijación del nitrógeno.
Conclusiones
En síntesis, este trabajo permitió demostrar que un alto porcentaje de las especies de árboles leguminosos tienen capacidad de formar nódulos y establecer relaciones simbióticas con bacterias fijadoras de nitrógeno, sin embargo, las variaciones observadas pueden estar relacionadas con la posición filogenética de la subfamilia de Fabaceae, rasgos morfológicos y anatómicos de las raíces, o con el establecimiento de relaciones simbióticas con otros grupos de bacterias y hongos. En futuros estudios sería importante evaluar con más detalle estas propuestas considerando un mayor número de especies, realizando caracterizaciones anatómicas y morfológicas de las raíces, caracterizando aislamientos de rizobios, e incluyendo el estudio de las poblaciones de endófitos de las raíces (bacterias y hongos) utilizando técnicas independientes de cultivo.