1. Introducción
El tejido musculoesquelético es muy sensible a las fuerzas mecánicas. Estas pueden influir en la señalización celular (Salvi y DeMali, 2018) e impulsar respuestas celulares (Dunn y Olmedo, 2016) que, a su vez, controlan y regulan respuestas y comportamientos en la fisiología humana (Wang, 2017). Un tipo de fuerzas mecánicas son las que se experimentan durante el ejercicio.
El ejercicio se suele clasificar en ejercicio de resistencia y ejercicio aeróbico (Wilson et al., 2012). El primero está diseñado para mejorar la fuerza y la potencia muscular (Stricker et al., 2020) mientras que el ejercicio aeróbico tiene como objetivo mejorar el rendimiento de resistencia general (Rothschild y Bishop, 2020). Ambos promueven adaptaciones en los tejidos musculoesqueléticos al alterar las vías de señalización encargadas de la síntesis de proteínas (Coffey y Hawley, 2007). Una sola sesión de ejercicio aeróbico es insuficiente para producir cambios significativos en el tejido musculoesquelético. Sin embargo, una sesión de ejercicio promueve alteraciones transitorias en la homeostasis celular que, cuando se repiten a lo largo del tiempo, dan lugar a la adaptación específica inducida por el ejercicio asociada con el entrenamiento a largo plazo (Coffey et al., 2009; Hughes, Ellefsen et al., 2018).
Los estudios han demostrado los efectos del ejercicio en la morfología del sistema musculoesquelético, sin embargo, hasta la fecha no existe ninguna revisión sistemática que resuma los efectos del ejercicio en la morfología de los tejidos del sistema musculoesquelético. Esto puede ayudar a orientar la toma de decisiones clínicas cuando se buscan cambios en los tejidos musculoesqueléticos. El objetivo principal de esta revisión sistemática es resumir los conocimientos actuales sobre las adaptaciones morfológicas del sistema musculoesquelético en respuesta al ejercicio crónico y, como objetivo secundario, identificar los tipos de ejercicio utilizados para provocar dichas adaptaciones morfológicas.
2. Metodología
Esta revisión se realizó de acuerdo con la guía Preferred Reporting Items for Systematic Reviews and Meta-Analyses (PRISMA) (Page et al., 2021). El estudio cuenta se registró en ROSPERO con el numero identificador CRD42020188000. Los estudios se consideraron elegibles para su inclusión si eran originales, con fecha de publicación entre 2000 y 2020, realizados en sujetos humanos, con inglés como idioma de publicación, tenían una clara intervención de ejercicio y, como resultado, presentaban una adaptación morfológica en el tejido estudiado. La búsqueda se realizó entre julio de 2021 y septiembre de 2021. Las bases de datos utilizadas fueron Pubmed, PEDro, ClinicalKey, Proquest y ResearchGate. Se excluyeron los estudios que detallaban cambios agudos. La estrategia de búsqueda se realizó mediante palabras clave y operadores booleanos: ((Cartílago O Disco Intervertebral O Hueso O Ligamento O Tendón O Músculo) Y Ejercicio). Todos los autores contribuyeron a la búsqueda inicial y al cribado. FL y AM realizaron el análisis completo por registro. En caso de desacuerdo, se recurrió a un tercer autor (LP o JCv) para dirimir una decisión. En los estudios observacionales se utilizó la herramienta AXIS para evaluar el riesgo de sesgo (Downes et al., 2016). En el caso de los estudios experimentales, se utilizó la escala PEDro para evaluar el riesgo de sesgo (Maher et al., 2003). No se excluyeron registros en función de la evaluación. Los ítems extraídos fueron los siguientes: autor, año de publicación, diseño del estudio, tejido estudiado, población, intervención, comparación y resultado.
3. Resultados
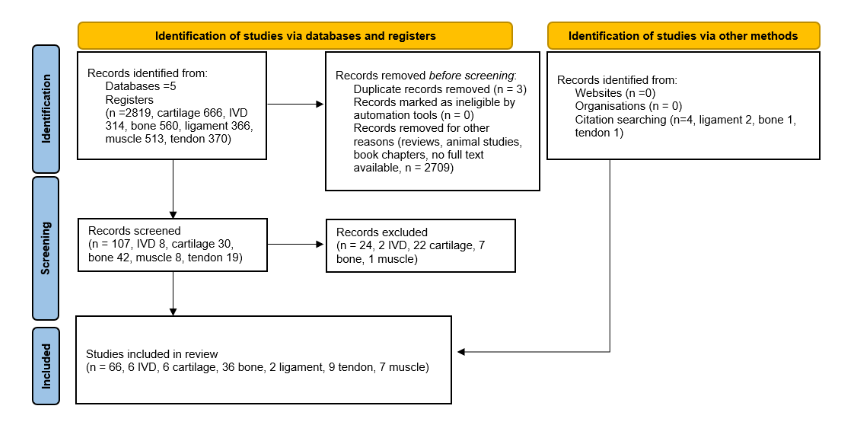
En total, se identificaron 2819 registros (314 para disco intervertebral (DIv), 666 para cartílago, 561 para hueso, 366 para ligamento 513 para músculo y 370 para tendón). Tras el análisis de texto completo, se incluyeron 66 registros en el análisis final (6 para DIv, 6 para cartílago, 36 para hueso, 2 para ligamento, 9 para tendón y 7 para músculo). El diagrama de flujo PRISMA se presenta en la Figura 1 (León et al., 2023).
Características por tejido
En el apéndice se presenta una lista completa con las características de cada estudio (autor, diseño, población, intervención, comparación y resultados).
Diseño del estudio
En el caso del DIv, cuatro estudios fueron observacionales y dos experimentales; en el del cartílago, los seis estudios fueron experimentales; en el del hueso, veinticinco estudios fueron experimentales y once observacionales; en el del ligamento, ambos estudios fueron observacionales; en el del tendón, cuatro fueron experimentales y cinco observacionales; y en el del músculo, los siete estudios fueron experimentales.
Población estudiada
Para el DIv, la población estudiada fueron personas que practican deporte (4) e individuos con dolor (lumbalgia crónica inespecífica (1) y dolor radicular en las piernas por hernia discal lumbar (1)); para el cartílago, eran principiantes de maratón asintomáticos (1), mujeres de 45-55 años (1) y participantes con osteoartritis (OA) (4); para hueso, eran participantes sanos (8), niños (7), mujeres posmenopáusicas (5), mujeres premenopáusicas (3), participantes con lesión medular (LM) (2), hombres con cáncer de próstata (1), supervivientes de cáncer de mama con menopausia relacionada con el tratamiento (1), personas que viven en la comunidad con ictus (1), participantes caucásicos de edad avanzada (2), jugadores de tenis adultos (1) y niños (1), hombres con osteopenia u osteoporosis (1), mujeres levantadoras de pesas (1) y reclutas del ejército estadounidense (1) y británico (1); para los ligamentos, las personas estudiadas fueron jugadoras de fútbol (1) y hombres levantadores de pesas (1); para los tendones, fueron reclutas de infantería básica (1), mujeres adultas mayores (1), participantes no entrenados en fuerza (1), hombres adultos (1) voluntarios activos recreativamente (1) y sujetos sanos (4); para el músculo, eran mujeres premenopáusicas con fibromialgia (FM) (1), hombres jóvenes (1), hombres sedentarios (1), hombres jóvenes activos (1) y sujetos sanos (3).
Características de la intervención
Para el DIv estudios observacionales (sin intervención) (4), ejercicios de core (1) y ejercicios de resistencia y aeróbicos (1); para el cartílago, hubo un programa de ejercicios en casa (1) un programa de carrera y un maratón (1), ejercicios aeróbicos y aeróbicos de step (1), ejercicios de resistencia acuática (1) y una comparación entre tres tipos de ejercicios (2); para los huesos hubo ejercicio aeróbico (1), ejercicios de fitness acuático (1), clases de actividad física del plan de estudios ordinario (3), entrenamiento militar básico (2), tenis (1), remo eléctrico funcional (REF) (1), ejercicios de caída con una sola pierna (1), ejercicios unilaterales de alto impacto (1), ejercicio general más suplementación (1), ejercicio y terapia hormonal (1), entrenamiento con ejercicios multicomponente (1), ejercicios de impacto y resistencia (1), combinación de ejercicios de resistencia, impacto y equilibrio (1), ejercicios progresivos de resistencia e impacto de alta intensidad (1), dos regímenes de ejercicios (1), entrenamiento progresivo de resistencia de alta intensidad (1), ejercicios progresivos de resistencia de intensidad moderada más ejercicios de impacto (2), ejercicios de impacto y pliométricos (1), estudios observacionales (7) y, el resto, una combinación de ejercicio general (7); para ligamento, ambos estudios fueron observacionales, por lo que no se utilizó ninguna intervención; para tendón hubo entrenamiento básico de infantería (1), ejercicios de flexión plantar (1), flexión plantar isométrica (2) flexión plantar unilateral isométrica explosiva (1) y estudios observacionales (4); para el músculo hubo ejercicios de resistencia corporal total (1), ejercicios de resistencia unilateral (1), ejercicios de prensa de piernas (2), sentadillas bilaterales con volante de inercia (1), ejercicios extensores de rodilla (1) y ejercicio excéntrico de rodilla (1).
Comparación
Para el DIv, la comparación fue con controles sin deporte (2), diferentes niveles de actividad (2), ejercicios centrales (1) y terapia manual y control motor (1); para el cartílago hubo un grupo de control simple (1) suplementación (sulfato de glucosamina) (1), atención habitual (1), sin entrenamiento (1) y tres tipos de ejercicio (2); para los huesos hubo entrenamiento de aqua fitness con control (1), actividad física semanal realizada en diferentes frecuencias (3), entre jugadores de tenis de brazos (1), tenis en diferentes poblaciones (1), pliometría en diferentes frecuencias (1), ejercicios de drop landing (1), levantadoras de pesas y controles emparejados por edad (1), carga ósea a lo largo de la vida (1), ejercicio más suplementación (1), entre gimnastas y no gimnastas (1) entre tipos de entrenamiento de alta intensidad (1), entre ejercicios de resistencia, equilibrio o salto (1), REF más ácido zoledrónico (1), entre ejercicio y terapia hormonal sustitutiva (THS) (1), comparación entre actividades motoras finas y gruesas más suplementación (calcio) (1), ejercicio aeróbico, de resistencia y equilibrio comparado con ejercicio de las extremidades superiores como control (1), deportes con diferentes patrones de impacto (1), aducción y abducción de la cadera de pie, sentadilla y peso muerto y un grupo de control (1), ejercicio de resistencia, fútbol y un grupo de control (1), entrenamiento de resistencia y flexibilidad progresivo y de intensidad moderada como control (2), resistencia de la parte inferior del cuerpo más ejercicio de salto o resistencia de la parte superior más ejercicio de salto y un grupo de control (1), solo entrenamiento con ejercicio y un grupo de control (1), sin comparación (6) y un grupo de control solo (4); para el ligamento no hubo comparación (1) y controles emparejados por edad (1); para el tendón hubo ningún ejercicio como control (2), dos regímenes de ejercicio con control sin ejercicio (1), cuatro tipos de deportes de salto (1), atletas de pista de salto de élite de nivel internacional y controles sanos activos recreativamente (1), dos tipos de deportes y sujetos sedentarios (1), dos tipos de régimen de ejercicio y ningún entrenamiento específico como control (1), corredores masculinos, corredoras femeninas y mujeres no corredoras (1) y ninguna comparación (1); en el caso del músculo, entre hombres y mujeres (1), participantes jóvenes y mayores (1), contracciones concéntricas y excéntricas (2), carga pesada y baja (1), diferentes velocidades y ningún ejercicio como controles (1) y mujeres sanas como controles (1).
Resultados
Los resultados más notificados para el DIv fueron un mayor DIv en 5 estudios y valores de T2 más altos en 3 estudios; para el cartílago, un aumento del grosor (2) y una disminución del grosor (2); para el hueso hubo aumentos de la densidad mineral ósea (DMO) (20), aumentos del contenido mineral óseo (CMO) (10) y aumentos del área cortical (6); en el ligamento, aumento del área de la sección transversal (AST) (1) y aumento del volumen (1); en el tendón, aumento del AST (6) y aumento de la rigidez (5); en el músculo, aumento de la masa (4) y aumento del AST (2).
Riesgo de sesgo de los estudios observacionales por tejido
Las características del riesgo de sesgo de los estudios observacionales se presentan en Tabla 1. Para el DIv se cumplieron todos los criterios; solo en un estudio se calculó el tamaño de la muestra (Bowden et al., 2018). En el caso de los huesos, se cumplieron todos los criterios; solo dos estudios no respondieron y en ambos se describieron las medidas adoptadas para abordar el problema de los que no respondieron, la tasa de respuesta y la información sobre los que no respondieron (Hughes, Gaffney-Stomberg et al., 2018; O'Leary et al., 2019). Para el ligamento se cumplieron todos los criterios; solo uno no discutió las limitaciones del estudio y no obtuvo la aprobación ética ni el consentimiento informado (Grzelak et al., 2012). Para el tendón se cumplieron todos los criterios; en tres se adoptaron medidas para tratar a los que no respondieron, se describió la tasa de respuesta y se facilitó información sobre los que no respondieron (Karamanidis y Epro, 2020; Milgrom et al., 2014; Westh et al., 2007) y una tenía un tamaño de muestra justificado y sin significación estadística clara (Milgrom et al., 2014). Todos los estudios incluidos relativos a músculo y cartílago correspondían a diseños experimentales; por lo tanto, no se realizó ninguna evaluación de los estudios observacionales.
Tabla 1 Evaluación del riesgo de sesgo para estudios observacionales mediante la herramienta AXIS. N/A, no aplicable ya que no hubo no respondedores
| Autores | Obj. | Dis. | n | Pob. | MAd. | NR | α | Mét. | Datos | RIC | DCJ | Lim. | FCI | Ética | ||||||
| Disco intervertebral | ||||||||||||||||||||
| Belavy et al. (2017) | SÍ | SÍ | NO | SÍ | SÍ | SÍ | N/A | SÍ | SÍ | SÍ | SÍ | SÍ | N/A | SÍ | SÍ | SÍ | SÍ | NO | SÍ | |
| Belavy et al. (2019) | SÍ | SÍ | NO | SÍ | SÍ | SÍ | N/A | SÍ | SÍ | SÍ | SÍ | SÍ | N/A | SÍ | SÍ | SÍ | SÍ | NO | SÍ | |
| Owen et al. (2021) | SÍ | SÍ | NO | SÍ | SÍ | SÍ | N/A | SÍ | SÍ | SÍ | SÍ | SÍ | N/A | SÍ | SÍ | SÍ | SÍ | NO | SÍ | |
| Bowden et al. (2018) | SÍ | SÍ | SÍ | SÍ | SÍ | SÍ | N/A | SÍ | SÍ | SÍ | SÍ | SÍ | N/A | SÍ | SÍ | SÍ | SÍ | NO | SÍ | |
| Hueso | ||||||||||||||||||||
| Bailey et al. (2010) | SÍ | SÍ | NO | SÍ | SÍ | SÍ | N/A | SÍ | SÍ | SÍ | SÍ | N/A | N/A | SÍ | SÍ | SÍ | SÍ | NO | SÍ | |
| Dowthwaite et al. (2007) | SÍ | SÍ | NO | SÍ | SÍ | SÍ | N/A | SÍ | SÍ | SÍ | SÍ | N/A | N/A | SÍ | SÍ | SÍ | SÍ | NO | SÍ | |
| Draghici et al. (2019) | SÍ | SÍ | NO | SÍ | SÍ | SÍ | N/A | SÍ | SÍ | SÍ | SÍ | N/A | N/A | SÍ | SÍ | SÍ | SÍ | NO | SÍ | |
| Ducher et al. (2011) | SÍ | SÍ | NO | SÍ | SÍ | SÍ | N/A | SÍ | SÍ | SÍ | SÍ | N/A | N/A | SÍ | SÍ | SÍ | NO | NO | SÍ | |
| Ducher et al. (2009) | SÍ | SÍ | NO | SÍ | SÍ | SÍ | N/A | SÍ | SÍ | SÍ | SÍ | N/A | N/A | SÍ | SÍ | SÍ | SÍ | NO | SÍ | |
| Ducher et al. (2004) | SÍ | SÍ | NO | SÍ | SÍ | SÍ | N/A | SÍ | SÍ | SÍ | SÍ | N/A | N/A | SÍ | SÍ | SÍ | SÍ | NO | SÍ | |
| Heinonen et al. (2002) | SÍ | SÍ | NO | SÍ | SÍ | SÍ | N/A | SÍ | SÍ | SÍ | SÍ | N/A | N/A | SÍ | SÍ | SÍ | SÍ | NO | SÍ | |
| Hughes, Gaffney-Stomberg et al. (2018) | SÍ | SÍ | NO | SÍ | SÍ | SÍ | SÍ | SÍ | SÍ | SÍ | SÍ | SÍ | SÍ | SÍ | SÍ | SÍ | SÍ | NO | SÍ | |
| Nilsson et al. (2013) | SÍ | SÍ | NO | SÍ | SÍ | SÍ | N/A | SÍ | SÍ | SÍ | SÍ | N/A | N/A | SÍ | SÍ | SÍ | SÍ | NO | SÍ | |
| O'Leary et al. (2019) | SÍ | SÍ | NO | SÍ | SÍ | SÍ | SÍ | SÍ | SÍ | SÍ | SÍ | SÍ | SÍ | SÍ | SÍ | SÍ | SÍ | NO | SÍ | |
| Rantalainen et al. (2011) | SÍ | SÍ | NO | SÍ | SÍ | SÍ | N/A | SÍ | SÍ | SÍ | SÍ | N/A | N/A | SÍ | SÍ | SÍ | SÍ | NO | SÍ | |
| Ligamento | ||||||||||||||||||||
| Grzelak et al. (2012) | SÍ | SÍ | NO | SÍ | SÍ | SÍ | N/A | SÍ | SÍ | SÍ | SÍ | N/A | N/A | SÍ | SÍ | SÍ | NO | NO | NO | |
| Myrick et al. (2019) | SÍ | SÍ | NO | SÍ | SÍ | SÍ | N/A | SÍ | SÍ | SÍ | SÍ | N/A | N/A | SÍ | SÍ | SÍ | SÍ | NO | SÍ | |
| Tendón | ||||||||||||||||||||
| Epro et al. (2019) | SÍ | SÍ | NO | SÍ | SÍ | SÍ | N/A | SÍ | SÍ | SÍ | SÍ | N/A | N/A | SÍ | SÍ | SÍ | NO | NO | SÍ | |
| Karamanidis y Epro (2020) | SÍ | SÍ | NO | SÍ | SÍ | SÍ | SÍ | SÍ | SÍ | SÍ | SÍ | SÍ | SÍ | SÍ | SÍ | SÍ | NO | NO | SÍ | |
| Milgrom et al. (2014) | SÍ | SÍ | SÍ | SÍ | SÍ | SÍ | SÍ | SÍ | NO | SÍ | SÍ | SÍ | SÍ | SÍ | SÍ | SÍ | NO | NO | SÍ | |
| Westh et al. (2007) | SÍ | SÍ | NO | SÍ | SÍ | SÍ | SÍ | SÍ | SÍ | SÍ | SÍ | SÍ | SÍ | SÍ | SÍ | SÍ | NO | NO | SÍ | |
| Zhang et al. (2015) | SÍ | SÍ | NO | SÍ | SÍ | SÍ | N/A | SÍ | SÍ | SÍ | SÍ | N/A | N/A | SÍ | SÍ | SÍ | NO | NO | SÍ | |
Nota. Obj.: objetivos claros; Dis.: diseños de estudio correctos; n: tamaño de la muestra; Pob,: población definida; MAd: muestra adecuada para representar a la población destinataria; Sel.: proceso de selección adecuado; NR: medidas adoptadas para hacer frente a los que no responden; FR: factores de riesgo y variables de resultado medidos de forma adecuada a los objetivos; α: significación estadística clara; Mét.: métodos descritos; Datos: datos básicos descritos; %R:porcentaje de respuesta descrito; INR: información sobre sobre los nos respondedores descrita; RIC: resultados internamente coherentes; RAD: resultados internamente coherentes; DCJ: discusión y conclusiones justificadas; Lim.: limitaciones discutidas; FCI: financiación o conflicto de intereses que puedan afectar a los resultados; Ética: aprobación ética o consentimiento informado obtenido.
Fuente: elaboración propia.
Riesgo de sesgo de los estudios experimentales por tejido
Las características del riesgo de sesgo de los estudios experimentales se presentan en la Tabla 2. Para el DIv, un estudio obtuvo una puntuación de 6/10 (Khanzadeh et al., 2020) y otro obtuvo uno de 7/10 (Owen et al., 2020).
Para el cartílago, un estudio obtuvo una puntuación de 9/10 (Armagan et al., 2015), otro obtuvo un puntaje de 8/10 (Munukka et al., 2016), tres tuvieron un puntaje de 6/10 (Benli Küçük, 2017; Cotofana et al., 2010; Koli et al., 2015) y uno tuvo un puntaje de 3/10 (Hinterwimmer et al., 2014).
Para hueso, un estudio tuvo un puntaje de 4/10 (Hasselstrøm et al., 2008), diez tuvieron un puntaje de 5/10 (Detter et al., 2013; Gabr et al., 2016; Greene et al., 2009; Marques et al., 2011, 2013; Milliken et al., 2003; Specker y Binkley, 2003; vainionpää et al., 2007; valdimarsson et al., 2006; Wochna et al., 2019), siete tuvieron un puntaje de 6/10 (Bailey et al., 2010; Du et al., 2021; Kukuljan et al., 2011; Lambert et al., 2020; Pang et al., 2006; Watson et al., 2015; Winters-Stone y Snow, 2006) y siete tuvieron un puntaje de 7/10 (Bolton et al., 2012; Harding et al., 2020; Karinkanta et al., 2007; Lang et al., 2014; Morse et al., 2019; Winters-Stone et al., 2013, 2014).
Para tendón, tres tuvieron un puntaje de 5/10 (Arampatzis et al., 2007; Epro et al., 2017; Werkhausen et al., 2018) y uno tuvo un puntaje de 6/10 (Bohm et al., 2014).
Para músculo, cuatro tuvieron un puntaje de 5/10 (Bickel et al., 2011; Fernandez-Gonzalo et al., 2014; Franchi et al., 2014; Holm et al., 2008) y tres tuvieron un puntaje de 6/10 (Franchi et al., 2015; Häkkinen et al., 2002; Marzilger et al., 2020).
Los parámetros que no cumplieron la mayoría de los estudios fueron la ocultación de la asignación, el cegamiento de los sujetos, el cegamiento de los terapeutas y el cegamiento de los evaluadores. Los estudios incluidos para el tejido ligamento correspondían a un diseño observacional; por lo tanto, no se realizó una evaluación de los estudios experimentales.
Tabla 2 Evaluación del riesgo de sesgo de los estudios experimentales mediante la herramienta PEDro
| Autores | Crit | Ale | Asig | Base | Suj | Ter | Eval | 85% | IntTrat | Grupo | Clave | PEDro | |
| Disco intervertebral | |||||||||||||
| Khanzadeh et al. (2020) | NO | SÍ | NO | SÍ | NO | NO | NO | SÍ | SÍ | SÍ | SÍ | 6/10 | |
| Owen et al. (2020) | SÍ | SÍ | NO | SÍ | NO | NO | SÍ | SÍ | SÍ | SÍ | SÍ | 7/10 | |
| Cartílago | |||||||||||||
| Armagan et al. (2015) | SÍ | SÍ | SÍ | SÍ | SÍ | NO | SÍ | SÍ | SÍ | SÍ | SÍ | 9/10 | |
| Cotofana et al. (2010) | SÍ | SÍ | NO | SÍ | NO | NO | NO | SÍ | SÍ | SÍ | SÍ | 6/10 | |
| Hinterwimmer et al. (2014) | SÍ | SÍ | NO | SÍ | NO | NO | NO | SÍ | SÍ | SÍ | SÍ | 6/10 | |
| Koli et al. (2015) | SÍ | SÍ | NO | SÍ | NO | NO | NO | SÍ | SÍ | SÍ | SÍ | 6/10 | |
| Küçük et al. (2017) | SÍ | SÍ | SÍ | SÍ | NO | NO | SÍ | SÍ | SÍ | SÍ | SÍ | 8/10 | |
| Munukka et al. (2016) | SÍ | NO | NO | NO | NO | NO | NO | SÍ | SÍ | NO | SÍ | 3/10 | |
| Hueso | |||||||||||||
| Alghadir et al. (2016) | SÍ | NO | NO | SÍ | NO | NO | NO | SÍ | SÍ | SÍ | SÍ | 5/10 | |
| Bailey y Brooke-Wavell (2010) | SÍ | SÍ | NO | SÍ | NO | NO | NO | SÍ | SÍ | SÍ | SÍ | 6/10 | |
| Bolton et al. (2012) | SÍ | SÍ | SÍ | SÍ | NO | NO | NO | SÍ | SÍ | SÍ | SÍ | 7/10 | |
| Detter et al. (2013) | SÍ | NO | NO | SÍ | NO | NO | NO | SÍ | SÍ | SÍ | SÍ | 5/10 | |
| Du et al. (2021) | SÍ | SÍ | NO | SÍ | NO | NO | NO | SÍ | SÍ | SÍ | SÍ | 6/10 | |
| Greene et al. (2009) | SÍ | NO | NO | SÍ | NO | NO | NO | SÍ | SÍ | SÍ | SÍ | 5/10 | |
| Harding et al. (2020) | SÍ | SÍ | SÍ | SÍ | NO | NO | NO | SÍ | SÍ | SÍ | SÍ | 7/10 | |
| Hasselstrøm et al. (2008) | SÍ | NO | NO | SÍ | NO | NO | NO | NO | SÍ | SÍ | SÍ | 4/10 | |
| Karinkanta et al. (2007) | SÍ | SÍ | NO | SÍ | NO | NO | SÍ | SÍ | SÍ | SÍ | SÍ | 7/10 | |
| Kukuljan et al. (2011) | SÍ | SÍ | NO | SÍ | NO | NO | NO | SÍ | SÍ | SÍ | SÍ | 6/10 | |
| Autores | Crit | Ale | Asig | Base | Suj | Ter | Eval | 85% | IntTrat | Grupo | Clave | PEDro | |
| Lambert et al. (2020) | SÍ | SÍ | NO | SÍ | NO | NO | NO | SÍ | SÍ | SÍ | SÍ | 6/10 | |
| Lang et al. (2014) | SÍ | SÍ | NO | SÍ | SÍ | NO | NO | SÍ | SÍ | SÍ | SÍ | 7/10 | |
| Marques et al. (2011) | SÍ | NO | NO | SÍ | NO | NO | NO | SÍ | SÍ | SÍ | SÍ | 5/10 | |
| Marques et al. (2013) | SÍ | SÍ | NO | SÍ | NO | NO | NO | NO | SÍ | SÍ | SÍ | 5/10 | |
| Milliken et al. (2003) | SÍ | NO | NO | SÍ | NO | NO | NO | SÍ | SÍ | SÍ | SÍ | 5/10 | |
| Morse et al. (2019) | SÍ | SÍ | NO | SÍ | NO | NO | NO | SÍ | SÍ | SÍ | SÍ | 7/10 | |
| Pang et al. (2006) | SÍ | SÍ | NO | SÍ | NO | NO | NO | SÍ | SÍ | SÍ | SÍ | 6/10 | |
| Specker y Binckley (2003) | SÍ | SÍ | NO | SÍ | NO | NO | NO | NO | SÍ | SÍ | SÍ | 5/10 | |
| vainionpää et al. (2007) | SÍ | SÍ | NO | SÍ | NO | NO | NO | NO | SÍ | SÍ | SÍ | 5/10 | |
| valdimarsson et al. (2006) | SÍ | NO | NO | SÍ | NO | NO | NO | SÍ | SÍ | SÍ | SÍ | 5/10 | |
| Watson et al. (2015) | SÍ | SÍ | NO | SÍ | NO | NO | NO | SÍ | SÍ | SÍ | SÍ | 6/10 | |
| Winters-Stone et al. (2014) | SÍ | SÍ | NO | SÍ | SÍ | NO | NO | SÍ | SÍ | SÍ | SÍ | 7/10 | |
| Winters-Stone et al. (2013) | SÍ | SÍ | SÍ | SÍ | NO | NO | NO | SÍ | SÍ | SÍ | SÍ | 7/10 | |
| Winters-Stone y Snow | SÍ | SÍ | NO | SÍ | NO | NO | NO | SÍ | SÍ | SÍ | SÍ | 6/10 | |
| (2006) | SÍ | NO | NO | SÍ | NO | NO | NO | SÍ | SÍ | SÍ | SÍ | 5/10 | |
| Tendón | |||||||||||||
| Arampatzis et al. (2007) | SÍ | NO | NO | SÍ | NO | NO | NO | SÍ | SÍ | SÍ | SÍ | 5/10 | |
| Bohm et al. (2014) | NO | SÍ | NO | SÍ | NO | NO | NO | SÍ | SÍ | SÍ | SÍ | 6/10 | |
| Epro et al.(2017) | SÍ | NO | NO | SÍ | NO | NO | NO | SÍ | SÍ | SÍ | SÍ | 5/10 | |
| Werkhausen et al. (2018) | SÍ | NO | NO | SÍ | NO | NO | NO | SÍ | SÍ | SÍ | SÍ | 5/10 | |
| Músculo | |||||||||||||
| Bickel et al. (2011) | SÍ | NO | NO | SÍ | NO | NO | NO | SÍ | SÍ | SÍ | SÍ | 5/10 | |
| Autores | Crit | Ale | Asig | Base | Suj | Ter | Eval | 85% | IntTrat | Grupo | Clave | PEDro | |
| Fernandez-Gonzalo et al. (2014) | SÍ | NO | NO | SÍ | NO | NO | NO | SÍ | SÍ | SÍ | SÍ | 5/10 | |
| Franchi et al. (2014) | SÍ | SÍ | NO | SÍ | NO | NO | NO | SÍ | SÍ | SÍ | SÍ | 6/10 | |
| Franchi et al. (2015) | SÍ | NO | NO | SÍ | NO | NO | NO | SÍ | SÍ | SÍ | SÍ | 5/10 | |
| Häkkinen et al. (2002) | SÍ | SÍ | NO | SÍ | NO | NO | NO | SÍ | SÍ | SÍ | SÍ | 6/10 | |
| Holm et al. (2008) | SÍ | NO | NO | SÍ | NO | NO | NO | SÍ | SÍ | SÍ | SÍ | 5/10 | |
| Marzilger et al. (2020) | NO | SÍ | NO | SÍ | NO | NO | NO | SÍ | SÍ | SÍ | SÍ | 6/10 | |
Nota. Crit: Criterios de elegibilidad; Ale: Asignación aleatoria; Asig: Ocultación de asignación; Base: Similitud de base; Suj: Cegamiento de sujetos; Ter: Cegamiento del terapeuta; Eval: Cegamiento del evaluador; 85%: Medidas de más del 85% de los sujetos en el resultado clave; IntTrat: Resultados del tratamiento, control o “intención de tratar”; Grupo: Comparación entre grupos; Clave: Medición puntual o de la variabilidad de los resultados clave; PEDro: Puntuación PEDro total.
Fuente: elaboración propia.
4. Discusión
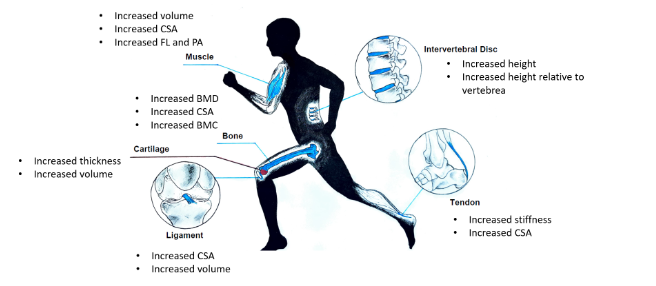
El objetivo de esta revisión sistemática fue resumir los conocimientos actuales sobre las adaptaciones morfológicas de los tejidos del sistema osteomuscular en respuesta al ejercicio crónico y, como objetivo secundario, identificar los tipos de ejercicio más adecuados para provocar adaptaciones morfológicas. Un resumen visual de los resultados se presenta en Figura 2.
Fuente: elaboración propia.
Figura 2 Efectos del ejercicio crónico en los tejidos musculoesqueléticos
Cuatro estudios mostraron cambios en los parámetros del DIv, incluyendo un aumento de la altura, una mayor altura del DIv en relación con el cuerpo vertebral y una mejor hidratación del DIv. Estas adaptaciones se produjeron, principalmente, como respuesta al ejercicio aeróbico. El DIv se divide en dos subestructuras: el núcleo pulposo (NP), que ofrece resistencia a las fuerzas de compresión, y el anillo fibroso (AF), que ofrece resistencia a las fuerzas de tensión. Se sabe que las fuerzas de compresión y tensión desencadenan respuestas anabólicas, como la reorganización del citoesqueleto y la expresión de genes. (Fearing et al., 2018; Iatridis et al., 2006). Acorde a esto, en los estudios que mostraron diferencias en los parámetros del DIv, la población realizaba actividades que implicaban momentos de compresión dinámica en la columna vertebral como saltar, caminar o correr; podría ser el caso de que el ejercicio aeróbico, debido a su elemento de compresión dinámica, sea el más adecuado para provocar una respuesta en el DIv. Dos estudios no hallaron cambios en la altura del DIv tras la intervención. Khanzadeh et al. (2020) no encontraron cambios tras la intervención consistente en ejercicios de suspensión. Aunque el AF es sensible a las fuerzas de tensión, parece que, debido al mayor contenido de agua en el NP, las respuestas al ejercicio son más perceptibles en el NP y no en el AF. Teniendo esto en cuenta, la intervención utilizada podría no ser apropiada para provocar una respuesta en el DIv. Owen et al. (2020) hallaron diferencias en la altura del DIv y los tiempos T2, pero estas no alcanzaron Significación estadística. Los autores plantean la hipótesis de que esto puede deberse a la escasa adherencia al ejercicio y a la duración de la intervención.
Cuatro estudios mostraron cambios en el grosor y el volumen del cartílago y una mejor orientación del colágeno. Estos cambios se observaron como resultado del ejercicio aeróbico y de resistencia. Aunque no se comprenden del todo, se sabe que los mecanismos por los cuales el cartílago se adapta a las fuerzas mecánicas es una interacción entre la matriz pericelular (MPC) y el condrocito. La MPC proporciona una conexión entre la matriz extracelular (MEC) y el condrocito y alberga factores de crecimiento y moléculas reguladoras que se unen a los receptores del condrocito en respuesta a la carga mecánica, como el factor de crecimiento de fibroblastos 2 (FGF2). Mientras tanto, el condrocito es el verdadero órgano mecanorresponsivo, que alberga mecanorreceptores sensibles a las moléculas liberadas por la MPC, como canales iónicos, cilios primarios e integrinas. Esta interacción entre la MPC y el condrocito provoca una reorganización del citoesqueleto, la activación de las proteínas quinasas activadas por mitógenos (MAPK), la secreción de glicoproteínas de la familia Watts y la expresión de microARN (miARN) (Gilbert y Blain, 2018; vincent y Wann, 2019; Zhao et al., 2020). Un estudio no encontró cambios en la morfología del cartílago tras la intervención, Cotofana et al. (2010) no observaron cambios en la morfología del cartílago de la rodilla tras tres meses de intervención. Los autores abordaron la duración de la intervención como una limitante en su estudio, que podría ser la razón de la falta de cambios observados; sugieren que tres meses es un plazo demasiado corto para que el cartílago se adapte. En línea con esto, los estudios incluidos en esta revisión sistemática que observaron cambios en el cartílago tenían tiempos de intervención de cuatro, seis y doce meses. Un estudio observó una disminución del grosor y el volumen del cartílago tras el periodo de intervención. Hinterwimmer et al. (2014) realizaron un periodo de intervención de seis meses de entrenamiento supervisado de maratón y una carrera de maratón tras el periodo de intervención y observaron una disminución del grosor y el volumen del cartílago. Los tiempos de examen de la IRM pueden explicar los resultados observados. La medida de seguimiento se realizó un día después del maratón, lo que podría representar una respuesta aguda al ejercicio. Como respuesta aguda al ejercicio, el grosor del cartílago disminuye de forma dependiente de la dosis y se desconoce el tiempo necesario para que vuelva a los niveles basales (Bini y Bini, 2020; Crowder et al., 2021; Esculier et al., 2019; Harkey et al., 2018; Kersting et al., 2005), por lo que es posible que los resultados observados se debieran a la carrera de maratón. Aun teniendo esto en cuenta, los autores interpretaron los resultados como una disminución no significativa del grosor y el volumen del cartílago, lo que indica que el ejercicio en forma de entrenamiento y carrera de maratón no es perjudicial para la salud del cartílago.
Treinta y seis estudios informaron de cambios en parámetros óseos como el aumento de la DMO, el AST, el número trabecular, el aumento del área cortical y el CMO, siendo la cadera y la columna vertebral las localizaciones más señaladas. Estas adaptaciones se observaron en diferentes poblaciones y grupos de edad, como personas sanas, niños, mujeres premenopáusicas, personas con ictus, hombres con cáncer de próstata e incluso personas con lesiones medulares, y como resultado de ejercicios de resistencia, aeróbicos y pliométricos. Se sabe que el tejido óseo es sensible a las cargas mecánicas y que desencadena diferentes respuestas, como el aumento de la densidad mineral ósea y de la resistencia mediante la estimulación de las células madre mesenquimales, los osteoprogenitores, los osteoblastos y los osteocitos terminalmente diferenciados (Yuan et al., 2016). La estimulación mecánica del hueso comienza con la actividad muscular que provoca una ligera flexión del hueso. Esta flexión inicia el flujo de fluido dentro de la red lacuno-canicular del interior de los huesos que, a su vez, estimula el osteocito, desencadenando la remodelación ósea (Gusmão y Belangero, 2015; Rosa et al., 2015). Tres estudios no informaron de ninguna interacción entre el ejercicio y los parámetros óseos. Wochna et al. (2019) utilizó una intervención de seis meses de clases de aqua fitness en mujeres posmenopáusicas, y no se observaron cambios en la densidad mineral ósea en todo el cuerpo, la cadera izquierda o la columna vertebral ni cambios en los marcadores de recambio óseo. Los autores señalaron, como limitación de su estudio, el pequeño tamaño de la muestra, lo que podría explicar los resultados obtenidos. Karinkanta et al. (2007) aplicaron un programa de ejercicios de doce meses consistente en entrenamiento de resistencia, entrenamiento de equilibrio y saltos, una combinación de ambos y grupo de control, respectivamente. Aunque no se observaron cambios en la DMO, se produjo un aumento de la fuerza del cuello femoral, tanto en el grupo de resistencia como en el combinado y una disminución del 2% menos del índice de fuerza ósea en el grupo combinado en comparación con el grupo de control en el eje tibial. Los autores plantearon la hipótesis de que esto podría deberse a una redistribución del mineral óseo dentro del cuello femoral y la tibia en respuesta al ejercicio y no a un aumento del mineral óseo per se. Greene et al. (2009) utilizaron un protocolo de caídas de ocho meses en niñas prepúberes. El protocolo consistía en caídas unilaterales con alturas de 14 cm y 28 cm. No observaron cambios en la geometría ósea, las propiedades biomecánicas ni el índice de resistencia ósea. Los autores plantearon la hipótesis de que las razones por las que no se observaron cambios se debieron a la corta duración de la carga (momento de aterrizaje), la intensidad moderada (las alturas relativamente bajas utilizadas) y la falta de variabilidad en el movimiento. La intensidad moderada de los aterrizajes en caída podría explicar los resultados observados, ya que se ha observado en los artículos de esta revisión que la corta duración de la carga, como la que se experimenta durante el footing, y la falta de variabilidad en el movimiento, como ocurre en los ejercicios pliométricos, pueden provocar cambios en el hueso.
Dos estudios observaron un aumento del volumen y del AST en el ligamento cruzado anterior (LCA) y en el ligamento cruzado posterior (LCP), respectivamente. Se sabe que la exposición del ligamento a cargas mecánicas provoca un aumento de la rigidez del tejido (Frank, 2004), aunque se sabe poco sobre los detalles de este proceso. Una prueba de la adaptación mecánica es el proceso denominado “ligamentización”, que hace referencia a un cambio en las propiedades histológicas que experimenta un injerto de tendón cuando se utiliza para la reconstrucción del LCA en el que, con el tiempo, el injerto de tendón empieza a parecerse más a un LCA normal que a un tendón. Estos cambios en las propiedades histológicas se han observado tanto en estudios con animales como con seres humanos y podrían explicarse por las fuerzas mecánicas que experimenta el ligamento durante la marcha normal y las actividades deportivas (Claes et al., 2011; Pauzenberger et al., 2013). Los estudios incluidos en esta revisión tenían un diseño observacional y los tejidos estudiados fueron el LCA y el LCP. Podría ser que las fuerzas experimentadas en la rodilla, que se traducen en el LCA y el LCP, durante la sentadilla o la carrera sean las que desencadenen la adaptación del ligamento.
Nueve estudios de esta revisión informaron de cambios en el tendón como el aumento de la rigidez y la AST. Se observó que estas adaptaciones se producían en el tendón rotuliano y el tendón de Aquiles, en poblaciones sanas, en diferentes grupos de edad y como resultado del ejercicio aeróbico y de resistencia y de diferentes deportes como el voleibol, el baloncesto, la pista de saltos, la pista de campo, entre otros. La principal célula mecanosensible del tendón es el tenocito; este es sensible a las cargas mecánicas a través de una serie de mecanismos y vías de señalización como el cilio primario, el calcio intracelular entre otros (Lavagnino et al., 2015; Munukka et al., 2016), induciendo así cambios bioquímicos en los tendones que afectan al diámetro de las fibrillas de colágeno y al AST (Wang, 2006). Aún se debate si el aumento de la rigidez y el AST pueden ser beneficiosos o no. Por ejemplo, en atletas que se recuperan de una tendinopatía rotuliana, una disminución de la rigidez se asocia a una mejora de los resultados clínicos (Breda et al., 2022) mientras que otros autores han descubierto que una mayor rigidez rotuliana puede estar relacionada con una mejora mecánica en la transmisión de la fuerza durante la contracción muscular (Cristi-Sánchez et al., 2019) y almacenamiento y liberación de energía (Wiesinger et al., 2016), y protección contra lesiones por esfuerzo (Radovanović et al., 2022).
Siete estudios informaron de cambios en el músculo, como un aumento de la masa magra del muslo (MML), de las fibras de tipo I y II, AST y del volumen muscular. Estas adaptaciones se produjeron tanto en mujeres como en hombres, en poblaciones jóvenes y de edad avanzada y como resultado del ejercicio de resistencia. El ejercicio de resistencia suele promover la hipertrofia muscular, con un aumento del AST muscular (Moghetti et al., 2016). Mientras que los filamentos de miosina y actina en el interior del sarcómero son los responsables de la contracción muscular, existen una serie de posibles estructuras mecanosensoras en el sarcómero, como 1) el disco Z, que proporciona un punto focal para la transmisión de fuerza entre sarcómeros y actúa como anclaje principal durante la sarcomerogénesis 2) los costámeros, que actúan como adhesiones focales en el interior del músculo esquelético 3) la titina, una proteína que se encuentra paralela a la actina y la miosina y 4) la filamina-C y la Bag3, proteínas que residen en el interior del disco Z. También se ha propuesto que la deformación experimentada por los mionúcleos como consecuencia de la carga del citoesqueleto, junto con las proteínas anteriormente mencionadas, activa una cascada de señalización que desencadena la adaptación del músculo (Jani y Schöck, 2009; Wackerhage et al., 2019).
Tres estudios informaron de adaptaciones específicas en respuesta al tipo de contracción, en los que las contracciones concéntricas provocaron un aumento del ángulo de pennación (AP), mientras que las contracciones excéntricas indujeron un aumento de la longitud del fascículo (LF). Aunque aún no se comprenden las razones, y aunque ambos tipos de contracciones promueven un aumento de la masa muscular, parece existir una adaptación específica al tipo de contracción. Por ejemplo, como resultado de una contracción concéntrica se produce un aumento de sarcómeros en paralelo, aumentando así el vientre medio del músculo y aumentando la AP, mientras que, como resultado de contracciones excéntricas, se produce un aumento de sarcómeros en serie, aumentando la LF (Franchi et al., 2017).
Fortalezas y limitaciones
La principal fortaleza de esta revisión es que es la primera que resume los cambios morfológicos en el sistema osteomuscular en respuesta al ejercicio crónico.
Es necesario discutir las limitaciones. En primer lugar, debido a los términos de ejercicio que a menudo se utilizan indistintamente en la bibliografía, como “ejercicio de resistencia” o “ejercicio cardiometabólico” para referirse al ejercicio aeróbico, “entrenamiento con pesas” o “entrenamiento de fuerza” para referirse al ejercicio de resistencia y “actividad física” o “carga fisiológica” para referirse al ejercicio, es posible que algunos artículos no se hayan incluido en esta revisión. En segundo lugar, debido a la heterogeneidad de los estudios, como la población o el tejido estudiado y el tipo de intervención de ejercicio, no fue posible realizar un meta-análisis.
5. Conclusión
El ejercicio tiene la capacidad de desencadenar adaptaciones morfológicas en los tejidos del sistema osteomuscular. Estas adaptaciones son específicas de cada tejido y pueden ir desde un aumento de grosor, volumen y rigidez, y se producen principalmente debido al ejercicio aeróbico, de resistencia y pliométrico. Aunque está claro que los tejidos pueden adaptarse, aún persisten varias interrogantes. Se desconoce la dosis mínima necesaria para provocar dichas adaptaciones o qué tipo de ejercicio es el mejor para desencadenarlas. Aunque se ha demostrado que se producen adaptaciones en presencia de cambios patológicos, como la osteopenia y la osteoporosis, se desconoce hasta qué punto pueden adaptarse estos tejidos, o incluso si pueden producirse adaptaciones mientras el tejido está lesionado. Además, aún no se sabe si estas adaptaciones son perjudiciales, como el engrosamiento de un ligamento o un tendón, o si pueden ser beneficiosas, como la mejora de los resultados funcionales en el deporte o el bienestar general, o si estas adaptaciones son constantes a lo largo de la vida. Para avanzar en la práctica de la medicina del ejercicio, los estudios futuros deberían abordar estas cuestiones.











 text in
text in