Los constantes procesos de deforestación y cambios en el uso del suelo afectan negativamente a todos los grupos faunísticos, en especial a los más dependientes de la calidad de hábitat como es el caso de las aves, particularmente a las especies de bosque (Petit & Petit, 2003; Lampila, Monkkonen, & Desrochers, 2005; Cerezo, Robbins, & Dowell, 2009; Cepeda & Montero, 2011).
Pese a lo anterior, varios autores sugieren que la conservación de matrices heterogéneas de hábitat también favorecen importantes poblaciones de especies de aves que utilizan homogéneamente ambientes heterogéneos (Pereira & Barrantes, 2009; Ramírez-Albores, 2010), particularmente las zonas ecotonales entre áreas alteradas y las contiguas a bosques (Grundel & Pavlovic, 2007).
La composición de las comunidades de aves están supeditadas a una intrincada red de variables ecológicas internas y externas a las poblaciones, donde los ensamblajes taxonómicos pueden ser afectados por aspectos de alimentación (Pimm, Lawton, & Cohen, 1991), reproducción (Vitz & Rodewald, 2007), migración, extinciones locales por competencia, variaciones temporales o espaciales particularmente climáticas, por alteración en las estructuras de los ecosistemas como la diversidad y estructura de bosques o remanentes, y por aspectos metapoblacionales de cercanía de parches ecosistémicos, su tamaño o dispersión (Diamond, 1975; Ricklefs, 1975; Schoener, 1983; Gilpin & Hanski, 1991; Bock, Cruz, Grant, Aid, & Strong, 1992; Bersier & Meyer, 1995).
Esta dependencia de la calidad del hábitat, su gran movilidad, facilidad de ubicación, bajos costos de monitoreo y rápida adaptación a los cambios en su ambiente hacen de las aves uno de los grupos faunísticos favorables para el estudio de la calidad ambiental en una región (Reynaud & Thioulouse, 2000).
Los distritos de Bahía Ballena y Puerto Cortés, en la zona sur de Costa Rica están constituidos por una amplia matriz ecosistémica donde la mayoría del uso del suelo está dedicado a la agricultura o el pastoreo bovino, con una cobertura forestal boscosa muy reducida (Villegas-Arguedas, 2017).
El Centro Nacional de Alta Tecnología de Costa Rica determinó la existencia de 19 ecosistemas o categorías del uso del suelo en esta región, con cultivos de arroz, palma aceitera y banano como los principales usos antrópicos, además de ecosistemas naturales de vegetación asociada a los humedales de helecho Acrostichum aureum y la palma de yolillo Raphia taedigera (PRIAS, 2010).
Esta investigación tuvo como objetivo determinar la diversidad y abundancia de aves en la zona costera de los distritos Bahía Ballena y Puerto Cortés del cantón de Osa en la zona sur lo cual permitió la caracterización del grupo de las aves en estos distritos costeros.
MATERIALES Y MÉTODOS
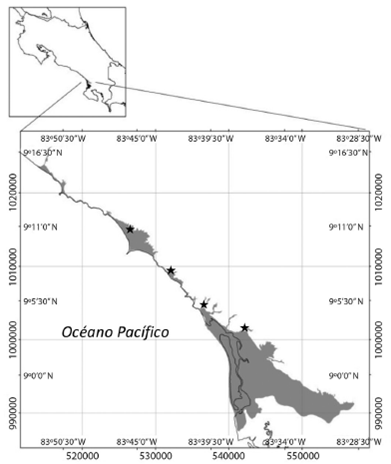
La investigación se desarrolló en la zona costera de los distritos Bahía Ballena y Puerto Cortés hasta el pie de monte, definido en la cota 20m.s.n.m, para un área de estudio total de 12 223,10Ha, entre los 9°16’00”-8°7’00”N & 83°28’00”-83°50’00”O (Fig. 1).
Se estableció en la medida de lo posible un punto de muestreo cada 10km aproximadamente para un total de cuatro estaciones de muestreo, en el río Morete (río Higuerón en la cartografía), quebrada Ballena, río Tortuga y río Coronado.
Cada dos meses entre junio 2017 y abril 2018 se realizó una visita a los sitios de muestreo, recorriéndolos mañana y tarde, en cada uno de los cuatro sitios se estableció un transecto de franja con ancho variable (30-50m) con el fin de detectar los individuos a ambos lados del trayecto (Bibby, Burguess, & Hill, 2000; Ralph, Geupel, Pyle, Martin, & De Sante, 1993; Chani, Bucher, Echeverría, Marigliano, & Brandán, 1998), cada muestreo tendrá variantes en la longitud del recorrido debido a los sitios con diferentes distancias u obstáculos. Los conteos se realizaron de 06:00 a 09:00h y de las 15:00 a las 18:00h.
La obtención de los datos para especies e individuos por especies se recopiló con búsqueda intensiva de las aves, registrando únicamente las observadas (Ralph et al., 1993; Bibby et al., 2000), no estableciendo ningún tiempo para este fin y registrando las aves que utilizaron el ambiente boscoso.
Con los registros se determinó la riqueza de especies, abundancia relativa, distribución para cada especie y la diversidad alfa según los siguientes criterios:
Riqueza: La riqueza de especies por localidad se determinó con el tabulador de especies de Henderson y Seaby (2006) mediante su software Diversity, mismo que arroja el número exacto de especies que han sido registradas en una base de datos.
Abundancia relativa: La abundancia relativa se obtuvo de la relación entre los individuos totales observados por especie, ya sea por sitio o meses muestreados, con la totalidad de muestreos realizados.
La abundancia relativa se calculó dividiendo la cantidad de individuos cuantificados entre los kilómetros recorridos (Bibby et al., 2000; Pereira & Barrantes, 2009). Para las comparaciones en la abundancia entre especies y sitios de muestreo se utilizó un análisis de varianza (ANOVA) no paramétrico Kruskall-Wallis con contrastes como prueba post-hoc (Zar, 2010).
Distribución: La similitud/disimilitud en la composición de especies se reflejó mediante el Índice de similitud/disimilitud de Bray-Curtis sobre compartición de especies (Magurran, 1988), el cual se utilizó para un análisis de conglomerados por sitios utilizando unión simple de la distancia euclidiana; para estos análisis se utilizó el software para análisis estadístico InfoStat 1.1 (Balzarini et al., 2017).
En este método, la distancia entre dos conglomerados está definida por la del par de objetos más distantes, la que se determinó, tomando el coeficiente de correlación cofenética mayor según Fowler, Cohen y Jarvis (1998) y Balzarini et al. (2017). Estos valores se utilizaron para estimar diferencias espaciales y la composición de especies de aves por sitios.
Diversidad: La diversidad de aves, conocida como diversidad alfa por ser exclusiva de un sitio particular de muestreo, se estableció mediante dos índices ecológicos de uso popular en este tipo de investigación cuantitativa: el de proporcionalidad Shannon-Wiener (H’=-∑pi ln pi) y el de dominancia mediante el recíproco Berguer-Parker (1/d: d=Nmax/N) según los criterios de Magurran (1988), Henderson y Seaby (2006) y Moreno (2001), aplicando el Random Test de Solow (1993) para determinar la existencia de diferencias estadísticamente significativas entre los sitios de muestreo.
Ética, conflicto de intereses y declaración de financiamiento: el autor declara haber cumplido con todos los requisitos éticos y legales pertinentes, tanto durante el estudio como en el manuscrito; que no hay conflictos de interés de ningún tipo, y que todas las fuentes financieras se detallan plena y claramente en la sección de agradecimientos. Asimismo, están de acuerdo con la versión editada final del documento. El respectivo documento legal firmado se encuentra en los archivos de la revista.
RESULTADOS
Se registró un total de 158 individuos de 35 especies de aves (32 especies residentes y tres especies migratorias) en 19 familias taxonómicas en la zona de estudio, a partir del recorrido de 47,2km. de muestreo entre los cuatro sitios Morete, Ballena, Tortuga y Coronado, donde la mayoría de los registros fueron de la tangara Ramphocelus passerinii (Bonaparte, 1831) (Passerini’s Tanager) con 30 avistamientos, seguida del perico zapoyol Brotogeris jugularis (Müller, 1776) (Orange-chinned Parakeet) con 19, luego la reinita guardaribera Myiothlypis fulvicauda (von Spix, 1825) (Buff-rumped Warbler) y el colibrí rabirufo Amazilia tzacatl (De la Llave, 1833) (Rufous-tailed Hummingbird) tuvo 12 avistamientos (Cuadro 1).
CUADRO 1: Especies e individuos registrados por sitio de muestreo
| Especies | Sitios de muestreo | Totales | |||
| Río Morete (Higuerón) | Quebrada Ballena | Río Tortuga | Río Coronado | ||
| Tinamiformes Tinamidae | - | - | - | - | - |
| Tinamus major | 1 | - | - | - | 1 |
| Apodiformes Trochilidae | - | - | - | - | - |
| Phaethornis guy | - | - | 1 | - | 1 |
| Phaethornis longirostris | - | 1 | 3 | - | 4 |
| Phaethornis striigularis | - | - | 1 | - | 1 |
| Amazilia tzacatl | 2 | 4 | 3 | 3 | 12 |
| Pelecaniformes | - | - | - | - | - |
| Ardeidae | - | - | - | - | - |
| Bubulcus ibis | 10 | - | - | - | 10 |
| Cathartiformes | - | - | - | - | - |
| Cathartidae | - | - | - | - | - |
| Coragyps atratus | 2 | - | - | - | 2 |
| Cathartes aura | 4 | 1 | - | - | 5 |
| Sarcoramphus papa | - | 1 | - | - | 1 |
| Accipitriformes | - | - | - | - | - |
| Accipitridae | - | - | - | - | - |
| Rupornis magnirostris | 1 | - | - | - | 1 |
| Buteogallus anthracinus | - | - | 1 | - | 1 |
| Coraciiformes | - | - | - | - | - |
| Alcedinidae | - | - | - | - | - |
| Chloroceryle americana | - | - | - | 1 | 1 |
| Piciformes | - | - | - | - | - |
| Ramphastidae | - | - | - | - | - |
| Ramphastos ambiguus | 1 | 1 | 1 | - | 3 |
| Picidae | - | - | - | - | - |
| Dryocopus lineatus | 1 | - | - | - | 1 |
| Falconiformes | - | - | - | - | - |
| Falconidae | - | - | - | - | - |
| Milvago chimachima | 1 | - | - | - | 1 |
| Psittaciformes | - | - | - | - | - |
| Psittacidae | - | - | - | - | - |
| Brotogeris jugularis | 15 | 1 | 3 | - | 19 |
| Psittacara finschi | - | - | 1 | - | 1 |
| Passeriformes | - | - | - | - | - |
| Thamnophilidae | - | - | - | - | - |
| Myrmeciza exsul | - | 1 | - | - | 1 |
| Furnariidae | - | - | - | - | - |
| Xiphorhynchus susurrans | - | 1 | - | - | 1 |
| Xiphorhynchus erythropygius | - | 1 | - | - | 1 |
| Tyrannidae | - | - | - | - | - |
| Elaenia flavogaster | - | - | - | 3 | 3 |
| Pitangus sulphuratus | 5 | - | 1 | - | 6 |
| Megarynchus pitangua | - | 1 | - | 1 | 2 |
| Fringillidae | - | - | - | - | - |
| Euphonia luteicapilla | - | - | - | 2 | 2 |
| Passerellidae | - | - | - | - | - |
| Arremon aurantiirostris | - | - | 1 | - | 1 |
| Arremonops conirostris | 2 | 2 | - | - | 4 |
| Icteridae | - | - | - | - | - |
| Psarocolius montezuma | 1 | - | - | - | 1 |
| Parulidae | - | - | - | - | - |
| Vermivora cyanoptera** | - | 1 | - | 3 | 4 |
| Protonotaria citrea** | 1 | - | - | - | 1 |
| Myiothlypis fulvicauda | 6 | 1 | 3 | 5 | 15 |
| Cardellina pusilla** | - | - | - | 5 | 5 |
| Thraupidae | - | - | - | - | - |
| Thraupis palmarum | - | - | - | 5 | 5 |
| Ramphocelus passerinii | 11 | 11 | 3 | 5 | 30 |
| Coereba flaveola | 1 | - | 3 | 6 | 10 |
| Thraupis episcopus | - | 1 | - | - | 1 |
| Totales | 65 | 29 | 25 | 39 | 158 |
** Migratoria
Riqueza: Se registró una diferencia estadísticamente significativa en la riqueza de especies entre los sitios de muestreo (Kruskall-Wallis H=7,88; g.l=3; p=0,0417), siendo el río Morete (Higuerón) el de más riqueza con 17 especies respecto a los otros lugares (p=0,04), mientras que el río Coronado registró la menor cantidad de especies (n=11; p=0,91) (Fig 2).
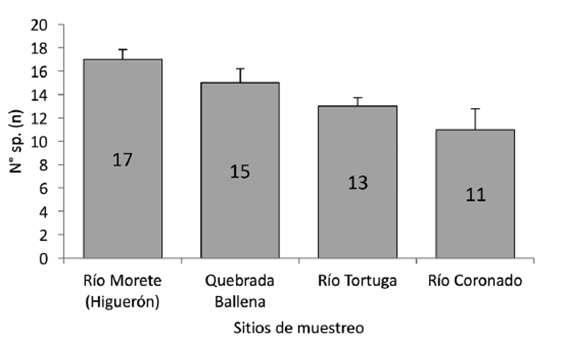
Fig. 2 Riqueza de aves por localidad con comparación de medias por contrastes post-hoc y su D.E. (Kruskall-Wallis H=7,88, g.l=3, p<0,05).
El registro de especies a lo largo del periodo de muestreo no presentó diferencias estadísticamente significativas (Kruskall-Wallis H=8,91; gl=5; 0,0978). Octubre fue el mes con mayor cantidad de registro de especies (Fig. 3).
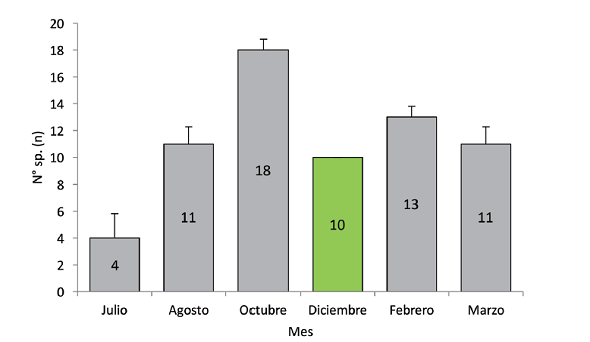
Fig. 3 Riqueza de aves por mes en comparación de medias por contrastes post-hoc y su D.E. (Kruskall-Wallis H=8,91; g.l=5; p<0,05).
Abundancia relativa: El sitio con mayor registro de aves fue el río Morete (Higuerón) en el distrito Bahía Ballena con 65 individuos (IAR=3,71) (Kruskall-Wallis H=9,55; g.l.=5; p=0,0212*), seguido del río Coronado en Puerto Cortés con 39 (IAR=3,33), registros cercanos al total de la abundancia relativa para el área de estudio de 3,35 (Cuadro 2).
CUADRO 2: Abundancias relativas por sitios de muestreo
| Sitios | N° especies | N° individuos | Esfuerzo (km recorridos) | IAR* |
| Río Morete (Higuerón) | 17 | 65 | 17,5 | 3,71 |
| Río Coronado | 11 | 39 | 11,7 | 3,33 |
| Quebrada Ballena | 15 | 29 | 10,5 | 2,76 |
| Río Tortuga | 13 | 25 | 7,5 | 3,33 |
| Totales | 35 | 158 | 47,2 | 3,35 |
*IAR= Índice de abundancia relativa
Distribución: el reemplazo de especies entre sitios puede considerarse alto, registrándose la compartición en sus ensamblajes taxonómicos entre el sitio en el río Morete (Higuerón) y la quebrada Ballena en un 40,43%, siendo estos dos sitios los más similares; mientras el río Morete (Higuerón) y el río Coronado son los de mayor reemplazo de especies con una similitud de apenas el 25% (Cuadro 3, Fig. 4).
CUADRO 3: Matriz de similitud Bray-Curtis entre sitios de muestreo
| Morete | Ballena | Tortuga | Coronado | |
| Morete | * | 40,43 | 31,11 | 25,00 |
| Ballena | * | * | 37,04 | 32,35 |
| Tortuga | * | * | * | 37,50 |
| Coronado | * | * | * | * |
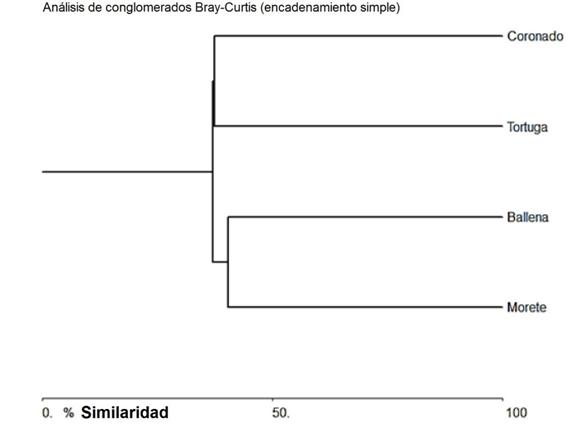
Fig. 4 Similitud de Bray-Curtis en la composición de especies entre los sitios de muestreo (unión simple de la distancia euclidiana con un índice de correlación cofenética de 0,98).
Diversidad: se registró una diversidad alfa entre sitios de muestreo similar, siendo el sitio en el río Tortuga en Puerto Cortés el que sugiere la mayor diversidad de especies de aves, mientras que el sitio en la quebrada Ballena registró la menor diversidad; de manera inversa la dominancia del recíproco Berger-Parker confirma que en el río Tortuga hay menor dominancia de especies (Cuadro 4).
CUADRO 4: Diversidad alfa de aves y dominancia del recíproco de Berger-Parker en los sitios de muestreo
| Sitios | H´ Shannon-Wiener* | Variance H´* | Berger-Parker |
| Río Tortuga | 2,43 | 0,02 | 0,12 |
| Río Morete (Higuerón) | 2,35 | 0,01 | 0,23 |
| Río Coronado | 2,27 | 0,01 | 0,15 |
| Quebrada Ballena | 2,22 | 0,05 | 0,38 |
*H´= Diversidad alfa
No obstante hay sitios con mayor o menor diversidad, esta no sugiere diferencias estadísticamente significativas entre sitios (Cuadro 5).
CUADRO 5: Probabilidad Random Test de Solow (1993) para la diversidad alfa entre sitios (p>0,05)
| Quebrada Ballena | Río Coronado | Río Morete (Higuerón) | Río Tortuga | |
| Quebrada Ballena | _ | 0,84 | 0,74 | 0,49 |
| Río Coronado | - | - | 0,74 | 0,56 |
| Río Morete (Higuerón) | - | - | _ | 0,86 |
| Río Tortuga | - | - | - | - |
DISCUSIÓN
Se ha documentado como los constantes procesos de deforestación y transformación de los hábitats originales afectan negativamente los distintos procesos ecológicos en las especies de aves, conllevando a una inevitable perdida de diversidad (Vitz & Rodewald, 2007; Ramírez-Albores, 2010).
No obstante, también otros autores han considerado que en algunos momentos en los ciclos de vida de algunas especies se requiere de una variada condición de los hábitats, desde bosques maduros, hasta ecotonos con áreas deforestadas, o donde se da crecimientos muy inmaduros de bosques secundarios (Vitz & Rodewald, 2007).
En Costa Rica se tienen registros que confirman que la mayoría de la diversidad de especies de aves utiliza de manera homogénea ambientes heterogéneos, aprovechando las distintas matrices ecosistémicas a disposición, considerándose pocas las especies que son especialistas de bosques y más las especies generalistas, tanto en zonas de vida húmedas y lluviosas como el caribe (Villegas & Villalobos 2014), o en la zona sur, en la Península de Osa (Pereira y Barrantes, 2009), como en zonas secas como Cañas en Guanacaste (Cárdenas, Harvey, Ibrahim, & Finegan, 2003).
Esta condición del uso de toda la matriz de ambientes alterados por la avifauna también ha sido bien documentada en el caso de las especies migratorias, la cuales evidentemente se han adaptado a estos cambios constantes en sus hábitats, tolerancia fundamental para su ciclo de vida migrante, aunque dependientes de algunas condiciones mínimas de hábitat natural o pequeños corredores como bordes de remanentes de bosques, o bosques de riveras (Cerezo, Robbins, & Dowell, 2009). Especies migratorias como C. pusilla, V. cyanoptera y P. citrea utilizaron también los remantes boscosos de los ríos Morete, Ballena y Coronado para sus actividades de forrajeo.
Este registro de aves en las zonas de protección de los ríos Morete, Ballena, Coronado y Tortuga coincide con Fletcher y Hutto (2006), autores que promueven como técnica de muestreo efectiva, barata y rápida el conteo de aves exclusivamente en ríos, considerando que estos hábitats son utilizados por la mayoría de las especies de aves, migrantes o no, reportando hasta un 90% de detección de la riqueza de una región.
Los resultados de la presente sugieren que en esta zona entre el río Morete (Higuerón) y el río Coronado, zona costera de Bahía Ballena y Puerto Cortés de Osa, no hay diferencias en la diversidad de aves a lo largo de dicha franja litoral, además que el recambio en los ensamblajes taxonómicos es dinámico.
La mayor riqueza registrada en el río Morete podría deberse más a la disponibilidad de campo visual que se tuvo para el conteo, lo que podría sesgar, ya que los sitios en la quebrada Ballena, el río Tortuga y el río Coronado tienen cauces más confinados, no son abiertos o amplios como el río Morete, lo cual puede influir en la detección de las aves.
En la zona sur de Costa Rica, se han registrado entre 205 (Pereira & Barrantes, 2009) y 222 especies de aves, de las cuales al menos 27 son especies migratorias (SINAC, 2017), durante la presente se registraron 35 especies de aves en esta región, de las cuales 3 son migratorias.
No se sugieren diferencias entre los sitios de muestreo, por lo que los eventuales esfuerzos de conservación que se propongan para estos remanentes boscosos, sea en sitios públicos como la zona marítimo-terrestre o en las propiedades privadas favorecerán a toda la región.
Estas zonas de protección de ríos y quebradas son utilizados por la mayoría de las especies en algún momento de sus ciclos de vida, para alguna de sus actividades reproductivas o alimentarias, por lo que su desaparición tendría consecuencias irreversibles para el mantenimiento de la diversidad de especies de aves local (Blake & Loiselle 1991; Loiselle & Blake 1992; Blake & Loiselle 2001; Latta, Brouwer, Olivieri, Girard-Woolley, & Richardson 2017).
En conclusión, se hace necesario enfocar la atención en estos remanentes boscosos riparios resquicios de la actividad forestal y del cambio de uso del suelo, debido a que son elementos fundamentales en la matriz ecológica requerida por este grupo faunístico. Se concluye que ambos distritos del cantón de Osa presentan similar diversidad y composición de esta avifauna, la cual tiene como buen reducto para su conservación las zonas de protección de ríos y quebradas, cuyo uso es dinámico y que representa hábitats importantes para la realización de sus distintas actividades ecológicas como la alimentación y reproducción.












 uBio
uBio