Introducción
El frijol (Phaseolus vulgaris L.) es una de las leguminosas más importantes para el consumo directo a nivel mundial y se encuentra dentro del grupo que posee más semillas comestibles en México. Además, es la leguminosa de mayor consumo humano y representa el 36 % de la ingesta diaria de proteínas (Morales-Rivera et al., 2015). Después del maíz, el cultivo de frijol es el más relevante en México, con una superficie sembrada promedio anual de 1,4 millones de hectáreas (Servicio de Información Agroalimentaria y Pesquera, 2023). Otros factores como su composición nutricional hacen que tenga un lugar preferencial, ya que es una fuente rica de proteínas y minerales como el zinc y el hierro (De Ron et al., 2015).
Uno de los principales problemas para la agricultura es la selección del método adecuado para la aplicación de fertilizantes, lo cual limita la disponibilidad de nutrientes en las plantas y promueve deficiencias, especialmente de micronutrientes; esto trae como consecuencia la baja productividad de los cultivos (Ugalde-Acosta et al., 2011). Una herramienta importante para solventar las deficiencias de micronutrientes en los cultivos es la fertilización foliar, la cual ha demostrado que puede mejorar el rendimiento y la calidad de los cultivos (Fernández et al., 2015).
La aplicación de zinc (Zn) de manera foliar ayuda a la planta a tener una mayor productividad y crecimiento, ya que juega un papel relevante dentro de las plantas al ser un elemento necesario para producir clorofila y síntesis de proteínas, además de ser clave en la producción de biomasa. El Zn también es importante como cofactor en las enzimas involucradas en el metabolismo oxidativo de las plantas (Palacio-Márquez et al., 2021). Sin embargo, las técnicas actuales de fertilización, tanto edáfica como foliar, son insostenibles debido al alto grado de contaminación y degradación que provocan en los ecosistemas, por lo que se deben buscar alternativas sustentables para mantener la productividad agrícola. En este contexto, una alternativa novedosa para el incremento de la productividad y el aprovechamiento de nutrientes es el uso de bioestimulantes como el quitosano, el cual tiene propiedades que promueven el crecimiento y la nutrición en los cultivos (Rivas-García et al., 2021). El quitosano ha demostrado su actividad sobre la regulación del crecimiento, la promoción de la germinación y el vigor de las plantas; además, influye en el incremento del rendimiento agrícola (Singh et al., 2021).
En la actualidad, el quitosano puede representar una alternativa favorable para aumentar los rendimientos y reducir la contaminación ambiental debido al uso excesivo de fertilizantes y plaguicidas (Rivas-García et al., 2021). La aplicación combinada de diversas fuentes de Zn más quitosano tiene resultados favorables en la acumulación de biomasa, la producción de frutos, la concentración de Zn en hoja y fruto, y la eficiencia de uso del agua en plantas de frijol ejotero cv. Strike, lo que permite una mejor adaptación y tolerancia al estrés hídrico (Hernández-Figueroa et al., 2022; Mirbolook et al., 2020).
Estos estudios posicionan al quitosano como uno de los compuestos más prometedores para utilizar en combinación con micronutrientes como el Zn, debido a su amplia gama de características que incluyen biocompatibilidad y relación costo-beneficio (Mirbolook et al., 2020; Palacio-Márquez et al., 2022). Sin embargo, aún existen dudas sobre este compuesto como producto comercial aceptado, debido a la gran cantidad de productos en el mercado de diversas características, que a su vez causan resultados variables por lo que es necesario un mayor número de estudios para determinar sus efectos positivos sobre las plantas (Palacio-Márquez et al., 2022). Con base en lo anterior, el presente trabajo de investigación tuvo como objetivo evaluar la eficiencia de la aplicación de nitrato de zinc más quitosano (NZN+Q) sobre la biomasa, el rendimiento, la actividad fotosintética y los pigmentos fotosintéticos en plantas de frijol ejotero.
Materiales y métodos
Manejo del cultivo
El experimento se llevó a cabo bajo una malla sombra de 9 m2, ubicada en las instalaciones del Centro de Investigación en Alimentación y Desarrollo (CIAD), en Delicias, Chihuahua, México (coordenadas 28º 10’ 21,6’’ latitud norte, 105º 27’ 16,5’’ longitud oeste), con una altitud promedio de 1280 m s. n. m., una temperatura media de 22,2 ± 7,8 ºC y una humedad relativa promedio de 22,38 %.
Se utilizaron semillas de frijol (Phaseolus vulgaris L.) cv. Strike (consumo en ejote o vaina fresca de frijol), obtenidas de la comercializadora Hydro Environment S. A. de C. V. localizada en Tlalnepantla, Estado de México, México. Las semillas se sembraron en charolas de poliestireno para su germinación. Diez días después de la siembra, cuando las plantas tenían una altura aproximada de 15 cm, se trasplantaron a macetas de plástico con un diámetro de 30,5 cm y un volumen de 13,4 L. Estas se llenaron con un sustrato compuesto por vermiculita y perlita agrícola en una proporción 2:1 (v/v).
Se colocaron dos plantas por maceta y se regaron con 500 mL de la siguiente solución nutritiva Hoagland modificada (Sánchez, 2006): 6 mM NH4NO3, 1,6 mM K2HPO4, 0,3 mM K2SO4, 4 mM CaCl2, 1,4 mM MgSO4, 5 µM Fe-EDDHA, 2 µM MnSO4, 0,25 µM CuSO4, 0,3 µM Na2MoO4 y 0,5 µM H3BO3, la cual se aplicó cada tres días durante los primeros 30 días después del trasplante y diariamente los siguientes 30 días.
Diseño experimental
Se empleó un diseño experimental completamente al azar con ocho tratamientos. Estos consistieron en la aplicación de nitrato de zinc de la marca GoZinc® obtenido de la casa comercial Gowan-México, a dosis de 0, 25, 50 y 100 ppm, de manera individual y en combinación con quitosano a dosis de 50 ppm (Cuadro 1). El quitosano utilizado fue de la marca comercial Quitofyt® de la casa comercial Tecno-Orgánica.
Cuadro 1 Descripción de los tratamientos aplicados vía foliar sobre plantas de frijol (Phaseolus vulgaris L.) cv. Strike, durante el periodo de septiembre-octubre de 2021, en Delicias, Chihuahua, México.
| Tratamiento | Dosis de nitrato de zinc (ppm) | Quitosano | Clave |
| Control | 0 | No | Control |
| Control | 0 | Sí | Control+Q |
| Nitrato de zinc | 25 | No | NZN25 |
| Nitrato de zinc | 50 | No | NZN50 |
| Nitrato de zinc | 100 | No | NZN100 |
| Nitrato de zinc | 25 | Sí | NZN25+Q |
| Nitrato de zinc | 50 | Sí | NZN50+Q |
| Nitrato de zinc | 100 | Sí | NZN100+Q |
Cada tratamiento contó con cuatro repeticiones; cada repetición consistió en una maceta con dos plantas. Los tratamientos se aplicaron vía foliar cada 10 días a partir de la aparición de las primeras hojas verdaderas a los 15 días después del trasplante, para un total de cuatro aplicaciones durante el experimento.
Muestreo vegetal
Sesenta días después del trasplante, se cosecharon las plantas y se efectuaron dos lavados. El primer lavado se realizó con agua destilada y el segundo con agua tridestilada. Posterior a los lavados, las plantas se dividieron en cuatro órganos: raíz, tallo, hoja y fruto.
Análisis vegetal
Biomasa. Se obtuvo el peso seco de hoja, tallo, raíz y fruto con la ayuda de una balanza analítica, para lo cual se introdujeron en una estufa de secado (Shel-Lab 1380FX, Cornelius, OR, EE. UU.), a una temperatura de 70 °C por 48 h. Los resultados se expresaron en gramos por planta con base en el peso seco.
Producción. Se determinó el peso del total de frutos por planta con base en la materia fresca con la ayuda de una balanza analítica y se expresó en gramos por planta.
Actividad nitrato reductasa “in vivo” (NR) (EC 1.6.6.1). Se determinó mediante el método propuesto por Sánchez (2006). Las láminas foliares se cortaron en secciones de 7 mm y se colocaron en 10 mL de búfer de incubación (búfer de fosfato K 100 mM, pH 7,5 y propanol al 1 % (v/v)). Las muestras se infiltraron a una presión de 0,8 bares. Se incubaron a 30 °C en la oscuridad durante 1 h y finalmente se colocaron en un baño de agua hirviendo para detener la actividad NR. Después, se tomó 1 ml de extracto enzimático y se le adicionaron 2 mL de sulfanilamida al 1 % (p/v) en HCl 1,5 M y 2 mL al 0,02 % (p/v) N- (diclorhidrato de 1-naftil) -etilendiamina en HCl 0,2 M. La concentración de nitrito resultante se determinó por espectrofotometría a 540 nm, frente a una curva patrón de NO2 - con un rango de 0,25 a 2 μg ml-1. Los resultados se expresaron en μM de NO2 - gpf h-1.
Actividad fotosintética. Se midió en hojas completamente desarrolladas sin ningún tipo de daño físico, tomadas de la parte media de la planta durante la etapa de llenado de fruto (50 días después del trasplante). Se utilizó un medidor portátil LI-COR 6400. Por tratamiento, se cuantificaron cuatro plantas; en cada planta se seleccionó una hoja sana de color homogéneo y libre de daños. Se utilizó una concentración de 400 μmol/ml de CO2 en la celda de referencia, en tanto que la celda de muestra se mantuvo en aproximadamente 380 μmol/ml de CO2. El déficit de presión de vapor del aire de la cámara de muestra fue menor a 1,5, y la temperatura de bloque que alojó a la hoja fue de 25 °C. La actividad fotosintética se expresó como μmol m-2 s-1 de CO2 (Kocal et al., 2008).
Índice de clorofila. Se midió usando un lector de clorofila Minolta SPAD 502 para el cual se tomaron cinco hojas completamente expandidas (sin daños físicos y en partes libres de nervaduras) por cada planta y cuatro plantas por tratamiento. Se realizaron tres muestreos a través del desarrollo del cultivo, en la etapa de crecimiento vegetativo (lectura 1), la etapa de floración (lectura 2) y la etapa de amarre de fruto (lectura 3). Los resultados obtenidos se expresaron en unidades SPAD (Shrestha et al., 2012).
Pigmentos fotosintéticos. Se analizaron siguiendo la metodología de Wellburn (1994), para lo cual se recolectaron taleolas foliares de 7 mm de diámetro, libres de nervaduras con un peso aproximado de 0,125 g y se colocaron en tubos de ensayo. Seguidamente, se adicionaron 10 mL de metanol a cada tubo de ensayo y se dejaron reposar durante 24 h en oscuridad. Pasado este tiempo, se tomó la lectura en un espectrofotómetro Genesis 10S UV-VIS a longitudes de onda de 666, 653 y 470 nm. Los resultados se expresaron en mg g-1 de peso fresco. Para el cálculo de clorofila a, se utilizó la ecuación 1; para clorofila b, se utilizó la ecuación 2, y para carotenos, la ecuación 3.
Chl a = (15,65(A666) - 7,34(A653)) (1)
Chl b = (27,05(A653) − 11,21(A666)) (2)
Carotenos = ((1000*A470) - 2,86(Chl a) − 129,2(Chl b)) / 221 (3)
Concentración de zinc. Se determinó mediante el método propuesto por Wolf (1982), en el cual se pesó un gramo de muestra seca y se agregaron 25 mL de mezcla triácida (88,9 % de HNO3, 8,9 % de HCl y 2,2 % de H2SO4), y se colocaron en un horno digestor a 300 °C. La muestra resultante se aforó a 50 mL con agua destilada (muestra principal). La lectura de Zn se realizó por medio de un espectrofotómetro de absorción atómica (Thermo Scientific™ iCE™ 3300 AAS).
Resultados
Biomasa
Se encontraron diferencias estadísticas significativas para la variable de acumulación de biomasa (p < 0,05). Los tratamientos de NZN a 50 ppm y los tratamientos de NZN+Q a dosis de 25 y 50 ppm destacaron con un incremento de 37,76 %, 42,39 % y 40,61 %, respectivamente, en relación con el control sin aplicación (Figura 1). Por su parte, la adición de quitosano de manera individual no presentó diferencias estadísticas respecto al tratamiento sin aplicación.

Figura 1 Efecto de la aplicación conjunta de nitrato de zinc y quitosano en la producción de biomasa (peso seco) de plantas de frijol (Phaseolus vulgaris L.) cv. Strike, durante el periodo de septiembre-octubre de 2021 en Delicias, Chihuahua, México. Letras diferentes indican diferencias significativas según la prueba LSD de Fisher.
Producción
Los resultados de rendimiento obtenidos en el presente estudio presentaron diferencias estadísticamente significativas (p < 0,05) con un incremento de 45,22 % cuando se aplicó NZN+Q a dosis de 25 mg kg-1 respecto al control sin aplicación, y un incremento de 47,7 % en relación con el tratamiento de NZN+Q a 100 mg kg-1 (Figura 2). La aplicación de quitosano no obtuvo diferencias estadísticamente significativas en comparación con la misma dosis sin aplicación de quitosano.

Figura 2 Efecto de la aplicación conjunta de nitrato de zinc y quitosano en el rendimiento (peso fresco) de plantas de frijol (Phaseolus vulgaris L.) cv. Strike, durante el periodo de septiembre-octubre de 2021, en Delicias, Chihuahua, México.
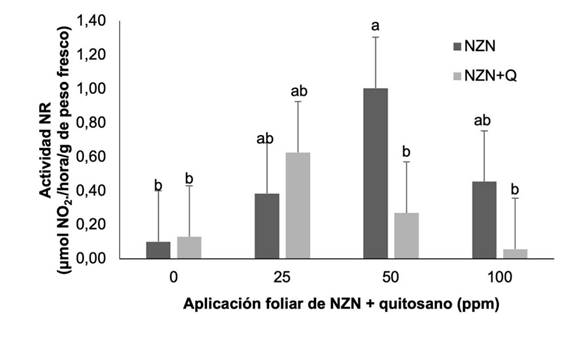
Actividad nitrato reductasa in vivo
Se encontraron diferencias significativas en la actividad de la enzima NR (p < 0,05). La aplicación de NZN a dosis de 50 mg kg-1 incrementó nueve veces su actividad respecto al control. Por su parte, la aplicación de Zn no presentó diferencias significativas para los tratamientos de 25 y 100 mg kg-1, pero se observó un aumento numérico para todos los tratamientos, mientras que la aplicación de quitosano no mostró diferencias estadísticas con el testigo sin aplicación (Figura 3).
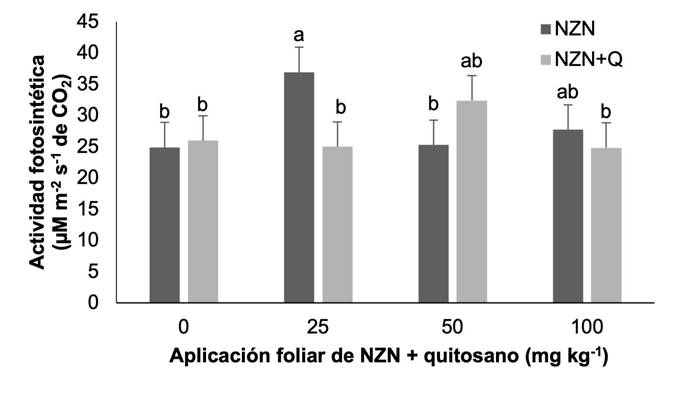
Actividad fotosintética
La actividad fotosintética presentó diferencias significativas para el tratamiento de NZN a dosis de 25 mg kg-1 (p < 0,05). La aplicación de este tratamiento incrementó 48.37 % con respecto al control sin aplicación, mientras que la aplicación de quitosano no presentó diferencias estadísticas con el testigo (Figura 4).
Índice de clorofila
Las mediciones SPAD presentaron diferencias significativas (p < 0,05). La aplicación de nitrato de Zn más quitosano obtuvo incrementos en relación con el control sin aplicación para todas las mediciones. Además, dentro de las tres mediciones, la tercera presentó un descenso en los índices de clorofila, en comparación con las lecturas previas para los tratamientos de NZN. Sin embargo, en los tratamientos en los que se aplicó quitosano el descenso fue menor o se presentaron incrementos (Cuadro 2).
Cuadro 2 Efecto de la aplicación conjunta de nitrato de zinc y quitosano en el índice de clorofila de plantas de frijol (Phaseolus vulgaris L.) cv. Strike, durante el periodo de septiembre-octubre de 2021, en Delicias, Chihuahua, México.
| Tratamientos | Desarrollo | Floración | Amarre del fruto |
| (unidades SPAD) | |||
| Control | 37,00 cd | 37,89 bc | 36,61 c |
| Control+Q | 34,64 d | 37,76 c | 36,98 bc |
| NZN25 | 40,44 ab | 39,75 abc | 37,72 bc |
| NZN+Q25 | 41,79 a | 42,02 a | 40,27 ab |
| NZN50 | 38,75 bc | 38,13 bc | 39,48 abc |
| NZN+Q50 | 40,22 ab | 40,34 ab | 41,34 a |
| NZN100 | 40,41 ab | 39,66 abc | 39,62 abc |
| NZN+Q100 | 41,15 ab | 41,31 a | 41,36 a |
Letras diferentes indican diferencias significativas según la prueba LSD de Fisher. / Different letters indicate significant differences according to LSD Fisher test.
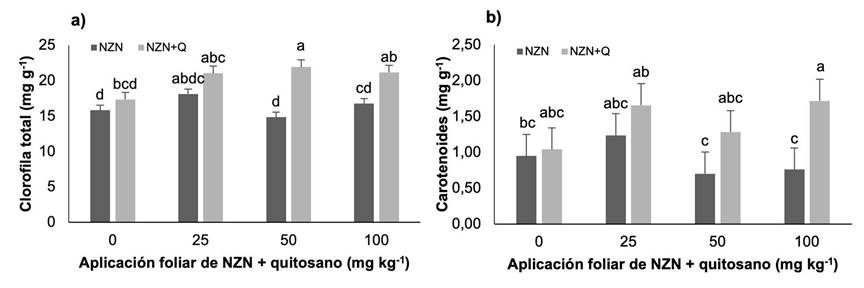
Pigmentos fotosintéticos
Se encontraron diferencias significativas para los parámetros de clorofila total y carotenoides (p < 0,05). La aplicación de NZN + quitosano incrementó en promedio 34,99 % el contenido de clorofila total en relación con el control sin aplicación, mientras que la aplicación de NZN solo incremento 4,7 %. En cuanto al contenido de carotenoides, también se hallaron diferencias estadísticas significativas (p < 0,05). La aplicación de NZN+Q mostró un aumento promedio de 63,16 % en comparación con el control sin aplicación, mientras que la aplicación de NZN presentó una disminución de 5,26 % (Figura 5).
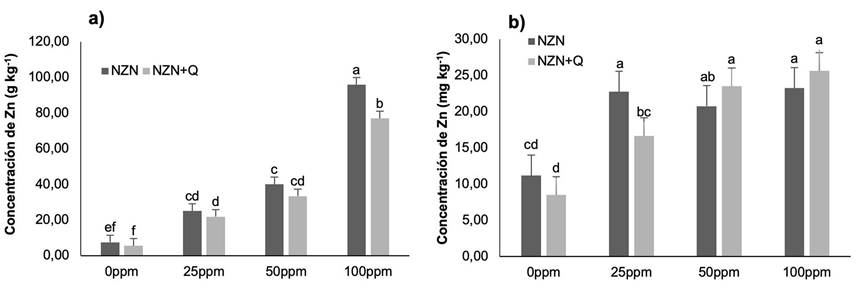
Concentración de zinc
Se encontraron diferencias significativas para la concentración de Zn tanto en hoja como en fruto (p < 0,05). Todos los tratamientos aplicados incrementaron la concentración de Zn en hoja y fruto, aumentando progresivamente conforme se subía la dosis de Zn (Figura 6). En el caso de la concentración en hoja, los tratamientos con NZN mostraron ligeros incrementos para las tres dosis en relación con su contraparte de NZN+Q; mientras que, para el fruto, los resultados de las dosis de 50 y 100 mg kg-1 de NZN+Q presentaron valores inversos, aumentando la concentración en comparación con la aplicación de NZN en solitario. Estos resultados indican que el quitosano, en combinación con altas dosis de Zn, podría incrementar la traslocación de micronutrientes hacia órganos sumideros como el fruto.
Discusión
La producción de biomasa es una de las variables más importantes para identificar el desarrollo óptimo de los cultivos (Sánchez Chávez et al., 2016). Resultados similares a los obtenidos en el presente estudio se encontraron al aplicar una fuente alterna de Zn en forma de sulfato en combinación con quitosano en plantas de frijol cv. Nebraska, y se observaron incrementos de entre 34 y 43 % en biomasa fresca (Ibrahim & Ramadan, 2015). Asimismo, al combinar Zn más quitosano en plantas de frijol a dosis de 10 µM en la solución nutritiva, se alcanzaron aumentos de hasta cuatro veces en biomasa seca (Mirbolook et al., 2020). El incremento en la producción de biomasa se puede atribuir a los efectos positivos del quitosano ante radicales libres de oxígeno, disminuyendo su contenido y evitando así el daño por oxidación, lo cual se ha relacionado con un mayor crecimiento vegetativo (Pichyangkura & Chadchawan, 2015). Previamente, se informó que la aplicación foliar de quitosano beneficia el crecimiento vegetativo, principalmente bajo condiciones de estrés en diversos cultivos como el frijol, el pimiento morrón, entre otros (Abu-Muriefah, 2013; Ghoname et al., 2010; Mondal et al., 2012).
En relación con la variable de rendimiento, estudios previos han señalado que un exceso de Zn puede causar estrés en las plantas, lo que afecta su desarrollo y rendimiento. Esto podría explicar por qué los tratamientos con las dosis altas obtuvieron los rendimientos más bajos (Sturikova et al., 2018). En cuanto a la producción de frijol ejotero en México, Salinas-Ramírez et al. (2012) han reportado un promedio de 78 g por planta para frijol ejotero, por lo que los tratamientos de NZN a 50 ppm y NZN+Q a dosis de 25 y 50 mg kg-1 superaron el promedio por planta en 9,3, 19,5 y 20,7 g, respectivamente. Estudios relacionados con la aplicación foliar de Zn son de gran impacto en la agricultura, ya que han obtenido resultados positivos en los cultivos, mejorando el desarrollo de la planta e incrementando el rendimiento (Sida-Arreola et al., 2015). Además, estudios previos han indicado efectos positivos de la aplicación foliar de quitosano, destacando que se puede mantener o mejorar la producción en plantas como el chile, el frijol y el tomate (Pichyangkura & Chadchawan, 2015).
La enzima nitrato reductasa (NR) es la encargada de transformar el nitrato de las plantas en nitrito, el cual posteriormente se asimila y convierte en metabolitos nitrogenados, por lo que su reacción puede ser inducida a la aplicación de nitrato (Maldonado, 2013). En cuanto a la variable NR, diversos estudios indican incrementos de 110 % al aplicar sulfato de Zn foliar en plantas de haba o aumentos de hasta 22 veces al aplicar 4 y 8 mg kg-1 de un nanofertilizante a base de Zn y Mo (Mohamed et al., 2016; Ramírez-Estrada et al., 2022). La aplicación foliar de Zn acrecienta la actividad NR, ya que este micronutriente actúa de manera indirecta sobre la asimilación de nitrógeno debido a que juega un papel fundamental en el desarrollo y la síntesis de proteínas en las plantas (Hemantaranjan & Trivedi, 2015).
Los resultados obtenidos para la variable de actividad fotosintética coinciden con un estudio en el que se aplicó Zn de manera foliar en concentraciones de 100 y 200 g ha-1 en plantas de frijol y se encontraron aumentos de 42 % en los parámetros relacionados con la fotosíntesis (Yeboah et al., 2021). En el presente trabajo de investigación, el tratamiento de NZN+Q a dosis de 25 mg kg-1 obtuvo el rendimiento más elevado; sin embargo, no alcanzó la mayor actividad fotosintética. Esto puede explicarse debido a que la actividad fotosintética en el frijol comienza a disminuir una vez que se acerca al periodo de cosecha y encuentra su punto máximo en la etapa de floración (Chávez-Simental & Álvarez-Reyna, 2012). La actividad fotosintética es un proceso de gran importancia para el desarrollo de los cultivos, ya que es la principal fuente de energía para las plantas. Las deficiencias de Zn pueden afectar este proceso y disminuir la productividad (Almeraya-del Valle & Sánchez-Quintanar, 2015).
En cuanto a los parámetros relacionados con los pigmentos fotosintéticos, los resultados obtenidos para el índice de clorofila se encuentran dentro del rango de 35 a 50 unidades SPAD reportado para plantas de frijol (Medina-Pérez et al., 2018). Resultados similares a los del presente estudio se encontraron al combinar quitosano más una fuente de Zn sin nitrato, observando aumentos de 2,5 veces el contenido de clorofila total y 2,3 veces el contenido de carotenoides en plantas de frijol (Mirbolook et al., 2020); mientras que, al aplicar diversas fuentes de Zn en plantas de frijol ejotero, se reportaron incrementos de 25,4 % en el contenido de clorofila (Bautista-Diaz et al., 2021).
Al aplicar diversas fuentes de Zn de manera edáfica en frijol, se obtuvieron aumentos en los niveles de clorofila de hasta 83 % en comparación con el control sin la aplicación de Zn (Ponce-García et al., 2019). Los resultados encontrados para la variable de carotenoides presentaron una tendencia similar a los obtenidos para clorofila total, lo que podría indicar que, al igual que la clorofila, los niveles de carotenoides están relacionados con un correcto funcionamiento del metabolismo celular, el cual se puede ver influenciado positivamente por la acción del quitosano (Hidangmayum et al., 2019; Ibrahim & Ramadan, 2015). Diversos estudios indican que la aplicación de quitosano de manera foliar aumenta el índice de clorofila, lo cual representa una alternativa interesante, en especial si la planta enfrenta situaciones de estrés (Abu-Muriefah, 2013; Behboudi et al., 2018; Mondal et al., 2012). Los niveles de clorofila están asociados a una mayor eficiencia para obtener los nutrientes y un correcto funcionamiento del metabolismo celular; diversos estudios relacionan el efecto del quitosano sobre estos parámetros (Hidangmayum et al., 2019; Ibrahim & Ramadan, 2015).
La concentración de Zn en los tratamientos aplicados se encuentra por encima del límite publicado, según el cual, para la mayoría de las plantas, una concentración de 20 mg kg-1 en hojas maduras es suficiente para alcanzar un correcto desarrollo fisiológico, presentando síntomas de deficiencia por debajo de los 15 mg kg-1 (Broadley et al., 2012). Otros autores consideran un mínimo de 25 ppm y un límite superior de 150 mg kg-1 como valores óptimos para el correcto desarrollo de las plantas en general (Mitra, 2015).
Los resultados obtenidos coinciden con un estudio previo, en el cual se aplicó la combinación de Zn más quitosano y se obtuvieron valores entre 100 y 200 mg kg-1 en la concentración de Zn para la parte aérea de plantas de frijol, con diferencias estadísticas en comparación con el testigo sin aplicación; además, al calcular el factor de traslocación del Zn en la planta, se encontraron incrementos en relación con el control sin aplicación (Mirbolook et al., 2020). Estudios previos mencionan el efecto del quitosano como quelatador de metales como el Zn, asociando los efectos benéficos que se le atribuyen al quitosano en el desarrollo de las plantas con un posible rol como acarreador de metales dentro de la planta. Este fenómeno se presenta debido a que la estructura de este compuesto facilita la unión de iones metálicos mediante intercambio iónico, la formación de complejos y un encapsulamiento intra e intermolecular (Deshpande et al., 2017; Liu et al., 2014; Vasconcelos, 2014).
Estos resultados posicionan al quitosano como una alternativa para aplicar en combinación con fertilizantes que contengan Zn, ya que los datos presentados indican que potencializa los efectos positivos del Zn, obteniendo mejores rendimientos y una mayor acumulación de biomasa. Esto se debe a sus efectos sobre la concentración de este nutriente, que está relacionado con aumentos en el contenido de clorofila, lo que genera una mayor actividad fotosintética y, en consecuencia, un mayor desarrollo en la planta. Finalmente, es importante señalar que se requieren más estudios en cuanto al uso del nitrato de Zn en combinación con quitosano en la horticultura para determinar con certeza su efecto en la fisiología y nutrición de las plantas, así como comprobar sus efectos positivos en otros cultivos.
Conclusiones
La aplicación de nitrato de zinc más quitosano obtuvo incrementos para las variables de producción de biomasa, rendimiento y contenido de zinc en fruto y favoreció la actividad fotosintética y los parámetros relacionados con los pigmentos fotosintéticos. Además, la aplicación foliar de nitrato de zinc más quitosano a 25 mg kg-1 ppm fue la dosis más eficiente en favorecer la acumulación de biomasa y el rendimiento en frijol ejotero, superando el promedio de 78 g por planta previamente reportado para la variedad Strike.