Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Agronomía Mesoamericana
On-line version ISSN 2215-3608Print version ISSN 1659-1321
Agron. Mesoam vol.23 n.2 San Pedro Dec. 2012
Aislamiento y evaluación In Vitro de la Antagonistas de Botrytis cinerea en mora
Isolation and in vitro evaluation of antagonists to Botrytis cinerea in blackberry
Isolation and in vitro evaluation of antagonists to Botrytis cinerea in blackberry
*Dirección para correspondencia
Resumen
El objetivo de este estudio fue determinar la capacidad antagónica de hongos a Botrytis cinerea en el cultivo de la mora en Costa Rica. Durante el primer semestre del 2009 se aislaron 35 hongos filamentosos habitantes del carpoplano de frutos de mora, de los cuales seis cepas de Trichoderma fueron seleccionadas para su evaluación in vitro contra B. cinerea por medio de la técnica de cultivos duales. En la evaluación se determinó la competencia por sustrato y el efecto antibiótico. Para evaluar la competencia por sustrato se utilizó la escala de Bell y en el caso del efecto antibiótico se calculó el porcentaje de inhibición del crecimiento. Todas las cepas evaluadas compitieron eficientemente por sustrato contra B. cinerea, destacaron los aislamientos Lu13 y Lu15, que alcanzaron el grado I en la escala usada, donde el antagonista sobrepasó y creció sobre el patógeno cubriendo el 100% del medio de cultivo. Los restantes aislamientos de Trichoderma alcanzaron el grado II de antagonismo. En cuanto al efecto antibiótico, todos los aislamientos inhibieron el crecimiento micelial de B. cinerea, cuatro de ellos alcanzaron un valor mayor al 80% al ser evaluados en condiciones in vitro.
Palabras clave: moho gris, pruebas de antagonismo, Trichoderma, antibiosis.
Abstract
The aim of this study was to determine the antagonistic capacity of fungi to B. cinerea in blackberry crops in Costa Rica. During the first semester of 2009, 35 isolates of native filamentous fungi from the carpoplane of blackberry fruits were obtained, six of which belonging to the genus Trichoderma sp. were selected to evaluate their antagonistic effect in vitro against B. cinerea through the dual-culture technique. In this evaluation, competition for the substrate and the antibiotic effect were determined. The first one was calculated using Bell’s scale, and for the assessment of antibiotic effect, percent inhibition of radial growth (PIRG) was calculated. All tested isolates effectively competed for substrate against B. cinerea, within Trichoderma strains Lu13 and Lu15 excelled, achieving grade I in the scale used, where the antagonist overgrew the pathogen covering 100% of the culture medium. The remaining isolates of Trichoderma, were classified in grade II of antagonism. As to the antibiotic effect, all isolates inhibited mycelia growth of B. cinerea, four of which showed an effectiveness higher than 80% in this in vitro screening technique.
Key words: gray mold, antagonistic test, Trichoderma,antibiosis.
Introducción
En Costa Rica, el cultivo de la mora (Rubus spp.) es realizado en pequeñas unidades productivas, como una opción de diversificación agrícola y fuente alterna de ingresos para los agricultores. Durante la última década, la mora ha gozado de gran aceptación por parte de los consumidores, tanto nacionales como extranjeros, principalmente por las propiedades medicinales y alimenticias que presenta y las diversas formas de consumirla. Como consecuencia esta actividad productiva ha ido en ascenso y en la actualidad reúne un número superior a 800 familias de productores, que de manera integrada participan en las labores de manejo agronómico del cultivo (MAG 2008).
Conforme esta actividad se ha incrementado, los problemas de índole fitosanitario se han hecho más evidentes y entre ellos destaca la enfermedad conocida como moho gris, la cual constituye una de las principales limitantes para la producción de esta fruta. El agente etiológico de la enfermedad es Botrytis cinerea P. Mich. ex Pers., el cual causa pudriciones en varios tipos de frutos menores, como el arándano (Vaccinium sp.), frambuesa (Rubus idaeus L.) y uva (Vitis vinífera L.), produciendo grandes pérdidas tanto en campo como en almacenamiento (Pitt y Hocking 2009).
El método tradicionalmente usado para el combate de B. cinerea ha sido el uso de fungicidas sintéticos. Sin embargo, este fitopatógeno ha desarrollado resistencia a dichos compuestos químicos debido a su uso repetitivo (Molina et al. 2006). Además del problema mencionado, actualmente los consumidores muestran una preferencia por productos agrícolas libres de compuestos químicos debido a los efectos secundarios de estos sobre la salud humana y el medio ambiente.
En este contexto, aparece como una opción viable la búsqueda de un método de combate biológico como parte de una estrategia dentro del concepto de manejo integrado de enfermedades, para reducir los problemas ocasionados por B. cinerea en el cultivo de la mora en pequeñas unidades productivas, donde su uso constituiría un valor agregado al producto final.
El objetivo de este estudio fue determinar la capacidad antagónica de hongos a Botrytis cinerea en el cultivo de la mora en Costa Rica.
Materiales y Métodos
Se muestrearon plantaciones de mora orgánica localizadas en cuatro zonas productoras de Costa Rica: La Trinidad, San Martín y Buena Vista pertenecientes a la provincia de San José y La Luchita localizada en la provincia de Cartago (Cuadro 1).
Obtención de frutos en el campo
Durante los meses de febrero a junio del año 2009, se realizaron cuatro visitas a cada sitio para recolectar frutos directamente de plantas de mora. La selección de plantas en las parcelas y de frutos de los estratos bajo, medio y alto en cada planta se hizo de manera aleatoria, los cuales se escogieron en tres estados fenológicos de desarrollo: maduros (con tono púrpura), verdes (de totalmente verdes a levemente rosa) y recién formados. Cada fruto se empacó de forma que no sufriera daños mecánicos y luego el material se transportó al Laboratorio de Fitopatología de la Universidad Nacional de Costa Rica donde se refrigeró a una temperatura de 6ºC hasta su análisis.
Aislamiento de potenciales hongos antagonistas
Los frutos recolectados se homogeneizaron para escoger un total de diez unidades por parcela, los cuales se colocaron en un matraz, erlenmeyer con 90 ml de agua destilada estéril, se sometieron a agitación por 30 minutos. Posteriormente se realizaron diluciones decimales hasta 10-6 en condiciones de esterilidad. De cada una de las diluciones se tomó una alícuota de 0,25 ml para depositarse por triplicado en placas Petri con el medio de cultivo papa-dextrosa-agar (PDA) + ácido láctico (25%). Cada alícuota se extendió sobre la superficie del medio usando aplicadores estériles con cabeza de algodón, de modo que quedara homogéneamente distribuida. Los cultivos fueron incubados en oscuridad a 26°C, hasta que se observaron colonias fungosas. Los hongos aislados fueron luego purificados en platos Petri y mantenidos en libre crecimiento a temperatura ambiente.
Evaluación de antagonistas en pruebas in vitro
La evaluación de la capacidad antagónica in vitro se efectuó por medio de la técnica de cultivos duales, la cual consiste en colocar en un extremo de la caja Petri un disco de 5 mm de diámetro, del medio de cultivo que contenía el antagonista y en el otro extremo de la caja un disco igual al anterior, pero en este caso con el agente fitopatógeno.
Debido a que antagonistas y patógeno presentan diferencias en sus tasas de crecimiento se utilizó micelio de B. cinerea con seis días de desarrollo y micelio de las cepas de los antagonistas con tres días de desarrollo. Los cultivos duales se utilizaron para evaluar dos mecanismos de antagonismo: A) competencia por sustrato y B) antibiosis.
Para evaluar la competencia por sustrato de los antagonistas se midieron tres variables: 1) ubicación en la escala de clases de Bell et al. (1982), 2) tiempo de contacto antagonista-patógeno y 3) crecimiento radial. La escala de Bell consta de cinco clases: en la uno, el antagonista ocupa completamente la superficie del medio de cultivo cubriendo totalmente al patógeno; en la dos, el antagonista llega a sobrepasar las dos terceras partes de la superficie del medio de cultivo; en la tres, el antagonista y el patógeno colonizan cada uno aproximadamente la mitad de la superficie del medio y ninguno parece dominar al otro; en la cuatro, el patógeno sobrepasa al crecimiento del antagonista colonizando tres cuartas partes de la caja Petri y en la clase cinco, el agente fitopatógeno llega a cubrir totalmente el plato Petri.
El tiempo de contacto, es el lapso de tiempo (número de días) en el cual las cepas de antagonista y fitopatógeno entran en contacto. El crecimiento radial de las cepas es el radio de la colonia expresado en centímetros (cm).
Para la comprobación del efecto antibiótico se evaluó el porcentaje de inhibición del crecimiento (PIC) a los siete días, el cual se calculó mediante la fórmula utilizada por Skidmore y Dickinson (1976), donde PIC= [(C1-C2)/C1] x100. C1 es el crecimiento radial del testigo (fitopatógeno sin antagonista) y C2 el crecimiento radial del fitopatógeno en los tratamientos en cultivo dual.
Diseño experimental y análisis estadístico
En esta investigación se utilizó un diseño completamente al azar con cuatro repeticiones por tratamiento (cada uno de los aislamientos de antagonistas) y un testigo absoluto del patógeno. La unidad experimental consistió en una caja Petri. Los resultados de PIC y crecimiento radial se analizaron mediante un análisis de varianza (ANDEVA) y comparación de medias de Tukey para determinar diferencias significativas entre tratamientos. Previo al ANDEVA, los datos fueron explorados visualmente mediante histogramas y test de normalidad de Kolmogorov-Smirnov. Debido a que los datos del PIC no presentaron una distribución normal, fueron sometidos a una transformación Log10 para su normalización previo al ANDEVA. Para lo anterior se utilizó el paquete estadístico PASW Statistics 18.
Resultados y Discusión
Agentes de combate biológico aislados
Se aislaron un total de 35 cepas de hongos habitantes del carpoplano pertenecientes a ocho géneros diferentes (Cuadro 2).
La población de hongos recuperados del carpoplano de mora fue muy diversa, predominando el género Cladosporium sp., el cual fue obtenido en todas las localidades. Esto coincide con Blakeman y Fokkema (1982) quienes mencionan que este género es un habitante común de las partes aéreas de las plantas y algunas especies de él son antagonistas de algunos patógenos de plantas (Baker y Cook 1982). En frecuencia le siguieron los hongos Penicillium spp. y Trichoderma spp., el resto de estos aislados fue escaso. La variabilidad encontrada en el número y tipo entre localidades puede responder a diversos factores, según lo sugiere Leveau (2006), quien sostiene que las comunidades de hongos sobre las superficies aéreas de las plantas son determinadas por la combinación de una serie de factores abióticos (atmosféricos), bióticos (otros organismos y sus interacciones), así como por la disponibilidad de nutrientes exudados por la planta. Otra condición que contribuyó a la heterogeneidad observada, fue la forma en la cual se obtuvo los frutos, dado que estos provenían de estratos de plantas de distintas variedades. Hubo diferencias en las comunidades microbianas de las partes aéreas, aún entre hojas de una misma planta, donde poblaciones de una especie pueden ser similares entre sí pero no idénticas (Yang et al. 2001).
Agentes de combate biológico utilizados en las pruebas de antagonismo
Previo a las pruebas definitivas de antagonismo, se realizó una serie de pruebas preliminares para descartar aquellos aislamientos que presentaron resultados poco promisorios para el combate de B. cinerea en condiciones in vitro. Como producto de esta selección se eligieron únicamente seis cepas de Trichoderma para ser evaluadas de manera definitiva contra B. cinerea. Estos aislamientos fueron Lu15 y Lu13 procedentes de La Luchita, SM 18, SM 12 y SM 13B obtenidas de San Martín y BV1 de Buena vista.
Evaluación de la competencia por sustrato
De conformidad a la escala de Bell et al. (1982), todos los aislamientos de Trichoderma se ubicaron en las categorías I y II, lo cual los coloca en la categoría de antagonistas de B. cinerea (Cuadro 3).
Las especies de Trichoderma regularmente presentan resultados satisfactorios en las pruebas de competencia por sustrato. Esto ha sido observado en experimentos realizados por Bell et al. (1982) quienes hallaron que un 65% de las cepas de este hongo se ubicaron en la clase I al evaluarse contra R. solani G-2 antagonista y un 85% se ubicó en la clase II al evaluarse contra el mismo hongo R. solani AG-3. Igualmente Arzate et al. (2006) ubicaron a Trichoderma sp. en la clase I al evaluar el grado de competencia contra Mycosphaerella fijiensis M. Morelet. También Martínez et al. (2008), obtuvieron más de un 90% de aislamientos de Trichoderma que clasificaron como clases I y II contra Rhizoctonia después de siete días.
La competencia por nutrientes y sustrato en la superficie de las plantas es un importante mecanismo de combate biológico contra los patógenos que dependen de alimentación externa, como es el caso de B. cinerea (Elad y Chet 1987, Roberts 1990). De acuerdo a Campbell (1989) Botrytis es altamente vulnerable a la competencia por nutrientes y sustrato, lo cual le confiere cierta desventaja frente a otros microorganismos habitantes del carpoplano. Lo anterior ha sido aprovechado por diferentes antagonistas, donde T. viride y T. polysporum combatieron efectivamente a B. cinerea en el cultivo de fresa (Tronsmo y Dennis 1977).
Tiempo de contacto
En todos los casos antagonista y patógeno hicieron contacto a los tres días. Resultados similares han sido obtenidos por otros autores, quienes han determinado que Trichoderma y diversos patógenos (M. fijiensis, R. solani, Sclerotium rolfsii Sacc.) entran en contacto entre uno y tres días después de establecida la prueba de cultivos duales (Hernández 2005, Arzate et al. 2006).
De acuerdo a Michel (2001), un tiempo de contacto corto es una característica deseable en un antagonista, ya que entre menor sea este, implicará una mayor agresividad.
Crecimiento radial
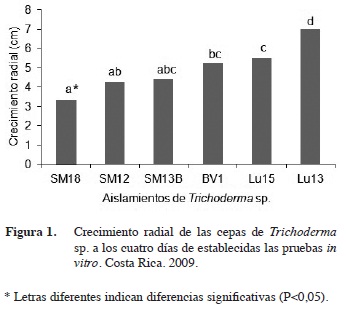
La cepa Lu13 presentó el mayor crecimiento radial (7 cm), a los cuatro días mostrando diferencias significativas respecto a las cepas restantes (P<0,05). Esta cepa cubrió por completo el plato Petri en el tiempo de incubación señalado. El resto mostró un menor crecimiento radial en el mismo lapso de tiempo (Figura 1).
Evaluación del efecto antibiótico
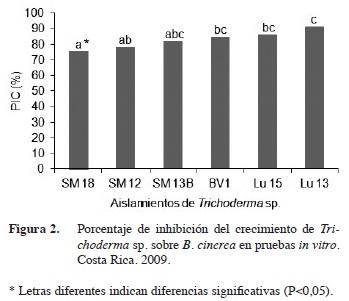
El aislamiento Lu13 presentó los valores más altos de inhibición del crecimiento con un PIC de 91,43%, valor que es significativamente diferente con respecto a los demás antagonistas (P < 0,05). Asimismo, las cepas Lu15, BV1 y SM13B, mostraron alta capacidad para inhibir el crecimiento de B. cinerea, presentando valores de PIC superiores al 80%. Sin embargo, no existieron diferencias significativas entre estos tres aislamientos (Figura 2).
La capacidad antibiótica desarrollada por el género Trichoderma se debe principalmente a la producción de los antibióticos peptaibol, trichozianinas A1 y B1. Mediante la producción de estas sustancias Trichoderma sp. logra inhibir la germinación de las esporas y la elongación de las hifas de B. cinerea (Schirmböck et al. 1994). Debido a lo anterior, resulta razonable pensar que la cepa Lu13 es efectiva debido a una alta producción de antibióticos, donde la inhibición es resultado de la concentración y capacidad de difusión de los compuestos inhibitorios secretados por ella (Swadling y Jeffries 1996). Trichoderma se caracteriza por presentar altos valores de PIC en cultivos duales con hongos fitopatógenos. Esto es respaldado por Ribamar y Oliveira (1988), quienes obtuvieron resultados de PIC de un 100% cuando Trichoderma compitió contra Cladosporium gloeosporioides G.F. Atk. Asimismo Michel et al. (2005) obtuvieron valores de inhibición de crecimiento de un 94% contra S. rolfsii en pruebas in vitro.
Con la metodología empleada se logró aislar y evaluar seis cepas de microorganismos antagonistas nativos de B. cinerea provenientes de plantaciones de mora, lo cual es necesario e importante debido a que uno de los principales problemas en la efectividad del combate biológico de hongos fitopatógenos y otras plagas, es la introducción de microorganismos no nativos en los ecosistemas, condición que puede volverse problemática cuando los agentes de combate biológico utilizados no se encuentran adaptados a las condiciones ambientales donde se van a aplicar. La variación en la efectividad de los diferentes antagonistas se debe a que la actividad antagónica de un microorganismo es muy cambiante. Se ha observado que cepas de Trichoderma sp. varían mucho en su efecto antagónico debido a la versatilidad de mecanismos que posee, los cuales se expresan dependiendo de las condiciones ambientales prevalentes (Campbell 1989).
Es relevante el efecto antagónico de la cepa Lu13, la cual resultó notablemente superior a las demás, esta se ubicó en la clase I de la escala de Bell, presentó los valores más altos de crecimiento radial, así como un porcentaje de inhibición de B. cinerea superior al 90%.
Los antagonistas aislados en la investigación poseen el potencial para ser agentes de combate biológico de B. cinerea.
Literatura citada
Arzate, J; Michel, A; Domínguez, V; Santos, O. 2006. Antagonismo de Trichoderma spp. sobre Mycosphaerella fijiensis Morelet, agente causal de la Sigatoka Negra del plátano (Musa sp.) in vitro e invernadero. Revista Mexicana de Fitopatología 24:98-104. [ Links ]
Baker, K; Cook, R. 1982. Biological control of plant pathogens. The American Phytopathological Society. St. Paul, Minnesota. USA. 433 p. [ Links ]
Bell, D; Well, H; Markham, C. 1982. “In vitro” antagonism of Trichoderma species against six fungal plant pathogens. Phytopathology 72:379-382. [ Links ]
Blakeman, JP; Fokkema, NJ. 1982. Potential for biological control of plant diseases on the phylloplane. Annual Review of Phytopathology 20:167-192. [ Links ]
Campbell, R. 1989. Biological control of microbial plant pathogens. Cambridge University Press. New York. USA. 218 p. [ Links ]
Elad, Y; Chet, I. 1987. Possible role of competition for nutrients in biocontrol of Pythium damping-off by bacteria. Phytopathology 77:190-195. [ Links ]
Hernández, N. 2005. Control biológico de Sclerotium rolfsii Sacc. en el cultivo de cacahuate (Arachis hypogaea L.) con Trichoderma spp. Tesis de Maestría. Universidad Autónoma de Guerrero. Unidad Académica de Ciencias Agropecuarias y Ambientales. Maestría en Ciencias en Producción Agrícola. Iguala, Guerrero, México. 107 p. [ Links ]
Leveau, JH. 2006. Microbial communities in the phyllosphere. In Riederer, M; Müller, C. eds. Biology of the pant cuticle. Blackwell Publishing Ltd. Chennai. India. p. 334-367. [ Links ]
MAG (Ministerio de Agricultura y Ganadería). 2008. Mora (Rubus spp.) cultivo y manejo poscosecha (en línea). Consultado 9 dic. 2008. Disponible en
http://www.mag.go.cr/bibioteca_virtual_ciencia/manual_mora_indice.html. [ Links ]
Martínez, B; Reyes, Y; Infante, D; González, E; Baños, H; Cruz, A. 2008. Selección de aislamientos de Trichoderma spp. candidatos a biofungicidas para el control de Rhizoctonia sp. en arroz. Revista Protección Vegetal 23(2):118-125. [ Links ]
Michel, A. 2001. Cepas nativas de Trichoderma spp., (Euascomicetes: Hypocreales), su antibiosis y micoparasitismo sobre Fusarium subglutinans y F. oxysporum (Hyphomycetes: Hyphales). Tesis de Doctorado en Ciencias. Universidad de Colima. Tecomán, Colima, México. 162 p. [ Links ]
Michel, A; Reyes, A; Otero, M; Rebolledo, O; Lezama, R. 2005. Potencial antagónico de Trichoderma spp., sobre Fusarium oxysporum Schlechtend.:Fr. f. sp. lycopersici (Sacc.) Snyder y Hansen y Sclerotium rolfsii (Sacc.) in vitro e invernadero. Revista Mexicana de Fitopatología 23:284-291. [ Links ]
Molina, G; Zaldúa, S; González, G; Sanfuentes, E. 2006. Selección de hongos antagonistas para el control biológico de Botrytis cinerea en viveros forestales en Chile. Bosque 27(2):126-134. [ Links ]
Pitt, J; Hocking, A. 2009. Fungi and food spoilage. Springer. New York. USA. 519 p. [ Links ]
Ribamar, S; Oliveira, N. 1988. In vitro antagonistic potential of Trichoderma spp. against Colletotrichum gloeosporioides agent of antracnose in the passion fruit (Passiflora). Boletín Micológico 13:103-110. [ Links ]
Roberts, R. 1990. Postharvest biological control of gray mold of apple by Cryptococcus laurentii. Phytopathology 80:526-530. [ Links ]
Schirmböck, M; Lorito, M; Wang, Y; Hayers, C; Arisan, I; Scala, F; Harman, G; Kubicek, C. 1994. Parallel formation and synergism of hydrolytic enzymes and peptaibol antibiotics, molecular mechanisms involved in the antagonistic activity of Trichoderma harzianum against phytopathogenic fungi. Applied and Environmental Microbiology 60:4364-4370. [ Links ]
Skidmore, AM; Dickinson, CH. 1976. Colony interactions and hyphal interference between Septoria nodorum and phylloplane fungi. Transactions of the British Mycological Society 66(1):57-64. [ Links ]
Solano, J; Villalobos, R. 2001. Aspectos fisiográficos aplicados a un bosquejo de regionalización geográfico climático de Costa Rica. Tópicos Meteorológicos y Oceanográficos 8(1):26-39. [ Links ]
Swadling, I; Jeffries, P. 1996. Isolation of microbial antagonists for biocontrol of grey mould disease of strawberries. Biocontrol Science and Technology (6):125-136. [ Links ]
Tronsmo, A; Dennis, C. 1977. The use of Trichoderma species to control strawberry fruit rots. Netherlands Journal of Plant Pathology 83(1):449-455. [ Links ]
Yang, CH; Crowley, DE; Borneman, J; Keen, NT. 2001. Microbial phyllosphere populations are more complex than previously recognized. Proceedings of the National Academy of Sciences of the USA (98): 3889-3894. [ Links ]
*Correspondencia a:
José Alonso Calvo-Araya. Escuela de Ciencias Agrarias, Universidad Nacional, Apartado 86-3000. Heredia, Costa Rica. josealonsocalvoaraya@gmail.com.
Germán Rivera-Coto. Escuela de Ciencias Agrarias, Universidad Nacional, Apartado 86-3000. Heredia, Costa Rica. grivera@una.ac.cr
Steffany Orozco-Cayasso. Escuela de Ciencias Agrarias, Universidad Nacional, Apartado 86-3000. Heredia, Costa Rica. sorozc@una.ac.cr
Rafael Orozco-Rodríguez. Escuela de Ciencias Agrarias, Universidad Nacional, Apartado 86-3000. Heredia, Costa Rica. rorozco@una.ac.cr
1. Este trabajo forma parte de la Tesis de Licenciatura del primer autor realizada en la Escuela de Ciencias Agrarias, Universidad Nacional de Costa Rica, Heredia, Costa Rica.
2. Escuela de Ciencias Agrarias, Universidad Nacional, Apartado 86-3000. Heredia, Costa Rica. josealonsocalvoaraya@gmail.com; grivera@una.ac.cr; sorozc@una.ac.cr; rorozco@una.ac.cr
Recibido: 17 de febrero, 2012. Aceptado: 9 octubre, 2012