Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Agronomía Mesoamericana
On-line version ISSN 2215-3608Print version ISSN 1659-1321
Agron. Mesoam vol.22 n.2 San Pedro Dec. 2011
Nota técnica
Manómetros de burbuja para realizar mediciones continuas de la presión de raíz en los cultivos tropicales
Marco V. Gutiérrez-Soto2*, Rubén Calderón-Cerdas2, José Miguel Araya-Alfaro2
*Dirección de correspondencia:
Resumen
Manómetros de burbuja para realizar mediciones continuas de la presión de raíz en los cultivos tropicales. El objetivo del presente trabajo es presentar un manómetro de burbuja simple y de bajo costo para la medición continua de la presión de raíz en diferentes ambientes, donde está involucrada en varios trastornos fisio-patológicos de las plantas. Se describen el concepto y los mecanismos de la presión de raíz, sus posibles funciones, y su asociación con diversos desórdenes de los cultivos, como el agrietamiento de tallos y frutos, la infiltración y la ruptura de las hojas, la gutación y el humedecimiento de las superficies vegetales, y el desarrollo de diversas enfermedades, antes y después de la cosecha. Se describe la construcción, la instalación y el funcionamiento de los manómetros de burbuja para medir la presión de raíz. Se discute la importancia de la medición y las posibilidades para el control de la presión de raíz en el manejo de la zona radical de los cultivos, mediante la intervención tanto de las propiedades físicas, químicas y biológicas del suelo y los sustratos, especialmente alrededor de la rizosfera, como del ambiente aéreo de las plantas cultivadas.
Palabras clave: Absorción y transporte de agua, enfermedades fisiológicas, gutación, sustrato, xilema.
Abstract
Bubble manometers for the continuous measurement of root pressure in tropical crops. The objective of this technical note is to introduce a low-cost bubble manometer to measure root pressure in different environments, where it is a major component of several physio-pathological disorders of crop plants. The concept and mechanisms of root pressure are explained, its putative functions, and its association with various physiological disorders such as fruit and stem cracking, leaf infiltration and burst, guttation and plant surface wetness, and the development of several preand post-harvest diseases. The construction, installation and functioning of bubble manometers to measure root pressure is described. The importance of controlling root pressure as part of the root-zone management strategy is discussed, which includes interventions the physical, chemical, and biological properties of soil and substrates, especially near and around the rhizosphere, and of the aerial environment of crop plants.
Keywords: Guttation, physiological disorders, substrate, water uptake and transport, xylem.
Introducción
Algunos trastornos fisio-patológicos experimentados por los cultivos están relacionados con la presión de raíz (Robeson et al. 1989, Peet 1992, Grunwald et al. 2003). Esta es la capacidad de las plantas para generar presiones positivas y provocar la exudación de savia del xilema a través de los hidátodos, usualmente bajo condiciones de reducida transpiración (Kramer y Boyer 1995). Además de su papel en la fisiología de las plantas, la presión de raíz y su manifestación más común, la gutación, están involucradas en algunos de los trastornos conocidos como “enfermedades fisiológicas”. Estos desórdenes incluyen:
1. el agrietamiento de algunos frutos (tomate, cítricos, pomos), tallos suculentos (caña de azúcar) y hojas (helecho hoja de cuero) (Peet 1992),
2. la “mojadura” no deseada de las superficies de las plantas (Aylor y Taylor 1982, Schuh 1991),
3. la infiltración del mesófilo de las hojas y la pérdida de los espacios aéreos (“manchas de agua”) (Feild et al. 2005),
4. la necrosis de secciones de las hojas, frecuentemente los bordes y las puntas, debida a la acumulación de sales en concentraciones tóxicas (Shapira et al. 2009)
5. la absorción y el traslado de xenobióticos provenientes del suelo hasta las hojas (Weidner et al. 2005).
Además, los hidátodos, sitios de la gutación, pueden servir como ruta de entrada para algunos patógenos (Robeson et al. 1989), y el humedecimiento de las superficies vegetales propicia la diseminación y la germinación de las esporas, y favorece el desarrollo de enfermedades bacterianas y fungosas, entre otras, antes y después de la cosecha (Aylor y Taylor 1982). La presión de raíz puede interaccionar con otros tipos de estrés como el exceso de luz y las altas temperaturas, agravando algunos problemas como la quemadura por el sol y el agrietamiento de los frutos (Peet 1992).
La presión de raíz ha sido observada en algas (Hwang y Morris 1991), helechos (Sperry 1983), plántulas y adultos de varias coníferas (Lopushinsky 1980, Ketchie y Lopushinsky 1981), y en una gran variedad de angiospermas acuáticas y terrestres, mono y dicotiledóneas, que incluye hierbas, palmas, lianas y otras trepadoras, bambús, arbustos, y árboles forestales y frutales. Muchas de estas especies (uva, caña de azúcar, bambú, maíz, arroz, tomate, girasol, etc.) son de interés económico (Scholander et al. 1955, Davis 1961, O’Leary 1965, Fisher et al. 1997, Ewers et al. 1997, López-Portillo et al. 2000, Saha et al. 2009).
En este trabajo se resume el mecanismo de la presión de raíz y la gutación, y se describen la construcción y el uso de manómetros de burbuja simples y de bajo costo, que permiten la medición de la presión de raíz por varios días. Estos pueden ser usados en diversas operaciones agrícolas en las cuales la presión de raíz y la gutación son frecuentes; además, servir en el diagnóstico y la prevención de diversos trastornos fisiológicos.
Presión de raíz: conceptos y mecanismos
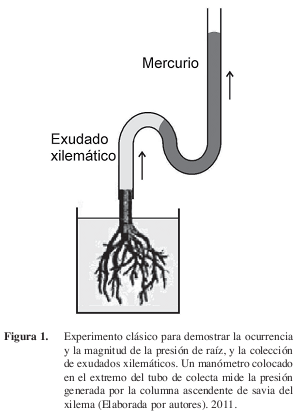
En ausencia de transpiración, la presión de raíz se desarrolla en los elementos traqueales del xilema como resultado de la actividad metabólica de las raíces (White 1938, Pickard 2003a,b). Es positiva e impulsa la savia hacia arriba en el xilema, y en plantas amputadas o decapitadas, se manifiesta en la forma de exudación (Figura 1). La presión de raíz es un proceso activo porque requiere de células vivas para su operación, y el oxígeno y los inhibidores metabólicos la afectan, sin alterar la permeabilidad de las membranas (Zholkevich 1991, Schwenke y Wagner 1992). Generalmente, la raíz genera hasta +200 KPa (2 atm) de presión, suficiente para elevar una columna de agua hasta poco más de 10 m de altura, por lo que se presume que es más importante en plantas de baja estatura. Los mayores valores de presión de raíz registrados en la literatura son de 400 a 600 KPa en maíz y tomate (White 1938, citas en Kramer y Boyer 1995). Plantas decapitadas de caña de azúcar, maíz y tomate pueden exudar 1 l/semana, 100 ml/día, y hasta 80 ml de savia/día, respectivamente (Kramer y Boyer 1995).
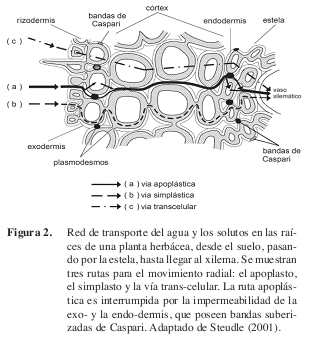
La estructura de la raíz y la generación de la presión están íntimamente integradas (Clarkson 1993, Steudle 2001, Pickard 2003a,b). Actualmente, se considera que la red de transporte en las raíces involucra al menos tres rutas diferentes para el movimiento radial del agua y los solutos:
1. el simplasto, que es la continuidad protoplasmática y citoplasmática interna mediada por los plasmodesmos,
2. el apoplasto, constituido por las paredes celulares, los espacios intercelulares, y el lumen de los elementos del xilema localizados alrededor de los protoplastos. Es la ruta con menor resistencia, pero está interrumpida en la exoy la endo-dermis por las bandas suberizadas de Caspari, y
3. la vía trans-celular, que depende de la actividad de los canales de agua y de las acuaporinas. Los componentes simplástico y trans-celular no pueden ser separados fácilmente en la actualidad (Steudle 2001, Pickard 2003a,b).
La predominancia de las diferentes vías varía con la edad y las condiciones fisiológicas y ambientales de la raíz. Dada esta complejidad estructural y funcional, el modelo clásico de la raíz como un sistema osmótico simple (Figura 2) resulta insuficiente para explicar las diversas manifestaciones de la presión de raíz hasta ahora observadas (Zholkevich 1991, Pickard 2003a,b).
Recientemente, Pickard (2003a,b) propuso un modelo biofísico que trata la raíz como un sistema trifásico, continuo pero heterogéneo (Figura 3). El modelo incluye al menos tres compartimentos bien mezclados (“homogéneos”) y dos interfaces heterogéneas. Los compartimentos son:
1. el suelo (un reservorio de agua y solutos de composición constante),
2. el xilema (confinado y de volumen definido), y
3. un compartimento simplástico y elástico (que separa los dos anteriores).
El simplasto, localizado entre el exterior de la raíz y el xilema, es un reservorio de solutos heterogéneo y compartimentado, que puede experimentar grandes fluctuaciones osmóticas que lo hacen más importante en el control del ritmo diurno y en el ajuste de la presión de raíz a condiciones ambientales cambiantes. Las dos interfaces heterogéneas son:
1. la interface suelo:simplasto, una aglomeración de la raíz contra el simplasto de la estela, asimétrica y altamente permeable, que absorbe activamente iones desde el suelo hacia el interior de las células, y así generar el flujo subsecuente del agua, impulsado por gradientes de energía libre y mediado por las acuaporinas, y
2. la interface simplasto:xilema, otra membrana asimétrica que absorbe activamente iones desde el xilema y los traslada a los protoplastos (el simplasto).
Esta resorción de solutos realizada por la interface simplasto:xilema a lo largo del xilema causa una progresiva reducción longitudinal de la osmolalidad de la savia. A través de esta interface ocurren dos flujos paralelos de agua, uno impulsado por diferencias en energía libre, y el otro por gradientes hidrostáticos que obedecen las leyes de la hidráulica macroscópica (solubilidad y difusión), y ocurriría a través de canales de Navier-Stokes (exclusión <3,5 nm), como los plasmodesmos y las punteaduras de las paredes de los vasos xilemáticos.
Este modelo permite explicar la alternancia entre la absorción y la exudación de la savia reflejada en los ritmos diurnos, la menor concentración de solutos en la savia exudada que en la solución del suelo (Klepper y Kaufmann 1966, Enns et al. 1998), las oscilaciones autónomas (Grossenbacher 1939), y las respuestas rápidas de la presión de raíz a los extremos osmóticos impuestos en el medio de cultivo (Pickard 2003a,b). También puede explicar la importancia de los antecedentes fisiológicos de las plantas (Leonard 1944) y la alta variabilidad de los patrones de exudación a veces observados entre individuos por lo demás comparables.
La presión de raíz muestra ritmos diurnos y estacionales que pueden ser mejor observados cuando las plantas son mantenidas bajo condiciones ambientales constantes. Estos ritmos diurnos son causados por variaciones circadianas de la respiración, las acuaporinas y la conductividad hidráulica, y la división celular, que finalmente se traducen en ritmos diarios en la absorción de minerales, la capacidad de transporte de agua, y el crecimiento (Clarckson et al. 2000). En ausencia de transpiración, la presión de raíz es una alternativa para el movimiento de savia en el xilema, y en plantas pequeñas y de ambientes sombríos, puede servir para reparar la cavitación (Ewers et al. 2001) y movilizar minerales hasta tejidos jóvenes que no han completado sus conexiones vasculares, como los meristemos del tallo y las puntas de las raíces. Los ritmos anuales son más importantes en las especies perennes, y en climas estacionales están relacionados con la rehidratación y la reparación de la cavitación durante la brotación (Hacke y Sauter 1996, Williams et al. 1997, Ewers et al. 2001, Strati et al. 2003).
La gutación, la exudación de fluidos a través de los hidátodos, es la manifestación natural más frecuente de la presión de raíz (Figura 4). Los hidátodos son poros localizados en los bordes de las hojas de muchas especies, descritos a veces como “estomas atrofiados”, a través de los cuales se liberan líquidos xilemáticos filtrados por el epitema (Sperry 1983). Este es un tejido parenquimatoso flojo, “de rapiña”, donde los solutos no recuperados a lo largo del xilema son secuestrados en el simplasto del mesófilo y en el floema de las hojas. Por lo tanto, el líquido de la gutación es relativamente pobre en minerales y de reducido potencial osmótico (Klepper y Kaufmann 1966), pero diversos compuestos orgánicos con funciones variadas han sido detectados en el exudado también (Ketchie y Lopushinski 1981, Grunwald et al. 2003).
Construcción e instalación de los manómetros de burbuja
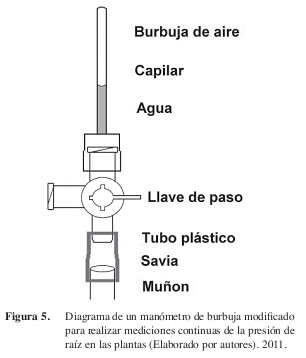
Este modelo permite realizar mediciones continuas de la presión de raíz sin necesidad de reemplazar el instrumento luego de cada medición (como en Ewers et al. 1997 y Fisher et al. 1997), lo que permite registrar fácilmente los cursos diurnos de la presión de raíz en diferentes condiciones, y reduce el gasto de materiales y el tiempo dedicados a la construcción y la instalación de los manómetros. Los manómetros de burbuja pueden ser acoplados al muñón de varios órganos (peciolos, pedicelos, tallos y ramas decapitadas) luego de su escisión (Figura 5).
Cada manómetro consta de una base de tubo de vinil unida firmemente al muñón, una llave de paso de tres vías, y un capilar de vidrio sellado en su extremo distal. Este capilar, que servirá como manómetro, es insertado en uno de los tapones de la llave de paso (Figura 5). El primer paso para la instalación de un manómetro es el corte limpio del eje vegetal sobre el cual se realizarán las mediciones de la presión. Por ejemplo, la lámina de las hojas y frutos completos pueden ser separados del peciolo y del pedicelo, respectivamente, y se pueden decapitar el tallo principal, uno secundario, o una rama de una planta. El corte se realiza preferiblemente con un bisturí en un ángulo recto. Los lados del muñón son recubiertos cuidadosamente con cinta de fontanería, sin ejercer presión y sin obstruir la superficie del corte.
El tubo de vinil empleado para construir la base del manómetro puede ser de cualquier diámetro, pero debe quedar firmemente ajustado al muñón y sin ninguna fuga. El tubo se inserta rápidamente alrededor del mismo dando un ligero giro. Luego se coloca una delgada película de adhesivo instantáneo (cianoacrilato) que cubra el tubo y la cinta de fontanería. Los tubos de diámetros anchos, apropiados para muñones más firmes y de mayor diámetro (como los tallos leñosos), pueden ser asegurados mediante gasas metálicas. Una vez instalado sobre el muñón, el interior del tubo de vinil se llena con agua antes de acoplar el manómetro. La instalación rápida del tubo de vinil y su humedecimiento contribuyen a mantener la superficie del corte hidratada y exudando. Se puede colocar una capa adicional de cinta sobre el pegamento para asegurar ambas partes, y se espera aproximadamente 5 minutos de secado antes de proceder a la colocación del manómetro. Diversos adaptadores pueden ser utilizados para conectar el tubo de vinil al manómetro. Todos los materiales pueden ser obtenidos fácilmente en ferreterías y tiendas de suministros médicos, u ordenados por catálogos. Es conveniente contar con una variedad de conectores y tubos de vinil de diferentes diámetros.
El capilar utilizado en la construcción de este manómetro de burbuja mide 10 cm de largo, y sus diámetros interno y externo son 0,8 y 1,1 mm, respectivamente (Kimble Products, EEUU). El extremo del capilar de vidrio es sellado herméticamente con la ayuda de una flama. El manómetro incluye una llave de paso multivías, colocada entre el tubo de vinil y el capilar de vidrio, que permite dirigir el flujo xilemático (Figura 5). En cada una de las dos direcciones restantes hay un tapón de rosca, uno de los cuales debe ser perforado para introducir el capilar de vidrio. Esta unión debe ser asegurada con silicón.
Con ayuda de una jeringa hipodérmica, se introduce agua dentro del capilar, asegurándose de eliminar todas las burbujas. El capilar de vidrio debe ser infiltrado hasta aproximadamente un tercio de su longitud, manteniendo una burbuja de aire en su interior. Inicialmente, la llave debe estar abierta de manera que el agua dentro del manómetro es retenida sólo por fuerzas capilares. Con el sistema hidratado y las burbujas eliminadas, se cierra la llave de paso permitiendo el flujo de savia hacia el interior del capilar de vidrio, y se espera al menos cinco minutos antes de realizar la primera lectura.
La presión de raíz (Praíz) se calcula utilizando una fórmula empírica, para lo cual se mide la longitud de la burbuja dentro del capilar de vidrio antes y después de la manifestación de la presión de raíz (Ewers et al. 1997, Fisher et al. 1997).
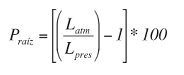
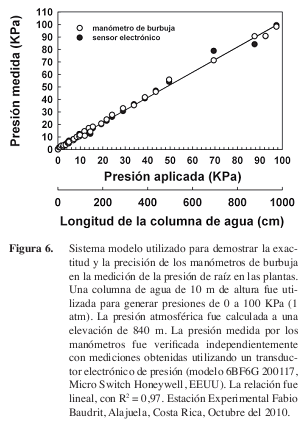
Donde Latm y Lpres son la longitud de la burbuja bajo presión atmosférica y la presurizada por la presión de raíz, respectivamente. La longitud de la burbuja sujeta sólo a la presión atmosférica dentro del capilar se mide con la llave de paso abierta. La presión ejercida dentro del manómetro por acción del flujo xilemático se compara con la presión atmosférica midiendo la longitud de la burbuja de aire presurizada, contenida dentro del capilar con la llave de paso cerrada. La exactitud de las mediciones de la presión de raíz obtenidas con el manómetro de burbuja fue verificada en un experimento modelo (Figura 6).
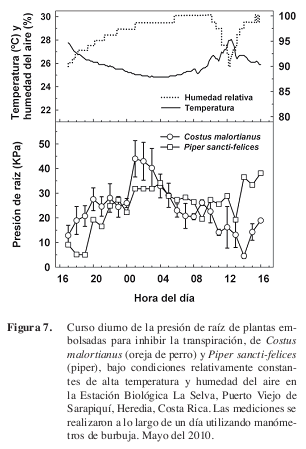
Este procedimiento puede ser repetido a lo largo del día (Figura 7). Típicamente, la presión de raíz desciende gradualmente debido a la cicatrización del corte, y en plantas decapitadas, debido a las alteraciones sufridas por las raíces desprovistas de fotoasimilados, entre otros efectos.
Discusión
A pesar de su importancia práctica y de la relativa facilidad con la que puede ser medida y registrada, la presión de raíz es poco conocida y no ha recibido la atención que merece como componente de algunos trastornos experimentados por los cultivos tropicales, y en algunos casos, de su solución. Los patrones de la presión de raíz de las plantas herbáceas examinadas por nosotros hasta ahora sugieren un alto grado de diversidad y de capacidad de aclimatación a diferentes condiciones fisiológicas y ambientales. Debido a que el transporte de agua en las raíces de especies perennes con crecimiento secundario está mucho menos bien caracterizado que el de las plantas herbáceas, la diversidad conocida en la presión de raíz seguramente se ampliará conforme más especies tropicales sean examinadas durante su ciclo fenológico anual.
Muchos modelos de manómetros y otros instrumentos para la medición de la presión de diferentes tejidos, órganos, y tipos de exudación en las plantas (resinas, látex, hule, savia) pueden ser construidos fácilmente e implementados con diversos propósitos y en diferentes ambientes (Milburn y Ranasinghe 1996). Esto contribuirá a ampliar nuestro conocimiento sobre la incidencia, las funciones, y las consecuencias de la presión de raíz y otros fenómenos semejantes, en la producción de cultivos y en ambientes naturales por igual.
Es posible reducir y hasta suprimir la presión de raíz de manera rápida y efectiva, así como estimularla en casos en los que se requiera la reparación de la cavitación o la recuperación hídrica y osmótica de las plantas luego de episodios de estrés. El registro continuo de la presión de raíz permitiría el diagnóstico temprano, el tratamiento preventivo, y la intervención oportuna y efectiva de la zona radical de las plantas. Esto puede lograrse a través del control hortícola de:
1. el ambiente aéreo (radiación, temperatura, humedad y demanda evaporativa de la atmósfera), que afecta también la actividad de las raíces a través de la regulación de la corriente de transpiración,
2. el régimen hídrico y mineral de los sustratos o de las soluciones nutritivas, utilizando lavados osmóticos rápidos y selectivos, y
3. la intervención de las propiedades físicas, químicas y biológicas del suelo, especialmente alrededor de la rizosfera.
Cualquier condición ambiental que favorezca la transpiración impedirá el desarrollo de la presión de raíz y la ocurrencia de la gutación (White 1938, Pickard 2003a,b). A un alto costo energético, es posible utilizar calentadores de aire y ventilación generada por abanicos eléctricos dentro de los ambientes protegidos, para crear las condiciones ambientales que secan los tejidos, estimulan la apertura estomática, remueven la capa límite, promueven la transpiración, y reducen la manifestación de la presión de raíz. Estos incluyen la luz azul y fotosintéticamente activa, temperatura, humedad y velocidad del aire moderadas, y baja [CO2]. Por el contrario, si se requiere estimular la presión de raíz para facilitar la hidratación de las plantas y su recuperación luego de episodios de estrés, es posible inducir el cierre estomático e inhibir la transpiración, aumentando la humedad a lo largo del sistema suelo-atmósfera-atmósfera, reduciendo la luz y la velocidad del viento, y aumentando [CO2].
Las modificaciones más efectivas y factibles del ambiente físico-químico de las raíces para controlar la presión de raíz, son el control del contenido y la retención del agua, y del potencial osmótico del sustrato, o de la solución nutritiva. Otras propiedades físicas de los sustratos, como la temperatura, la textura y la compactación, pueden ser relativamente fáciles de ajustar también. Posibles modificaciones químicas del ambiente de las raíces incluyen el control del pH (por sus efectos sobre el metabolismo de las raíces y la disponibilidad de los nutrientes), la calidad de la solución nutritiva del sustrato, y la administración apropiada y selectiva de sales minerales y otros solutos. Por ejemplo, sería posible controlar la ocurrencia e intensidad de la presión de raíz prescribiendo cambios súbitos en las condiciones químicas y osmóticas del sustrato, debido a los efectos particulares que algunos elementos como los cationes divalentes tienen sobre la presión de raíz (Pickard 2003b).
En algunos cultivos, la intensidad de la presión de raíz ha sido correlacionada con el vigor y la fenología de las plantas en el campo (Clearwater et al. 2007), y con los daños causados a las raíces por la preparación del suelo (Leonard 1944). Un ambiente biológico subterráneo bien acondicionado promueve la formación de raíces y rizosferas saludables (McCully 1999), equipadas con rizovainas bien desarrolladas, y de microflora y microfauna que facilitan la micorrización, la mineralización, el control biológico, y la fungistasis, todas necesarias para aumentar y mantener el volumen absorbente de las raíces, y la adquisición del agua y de nutrientes. Las raíces saludables son capaces de producir células borde (Hawes et al. 1998) más efectivas en la percepción del ambiente del sustrato, y de responder a la señalización química en la rizosfera.
Estas relaciones son de gran interés agrícola, porque la generación de presiones en las plantas, como la de raíz, puede ser un fenómeno más general de otros tejidos y otros órganos además de la raíz, como los peciolos, los troncos, y los frutos, y tener importantes implicaciones sobre el crecimiento, el rendimiento, y su calidad (Peet 1992, Emmons et al. 1996). Es posible que el número conocido de procesos fisiológicos y trastornos asociados con la presión de raíz se incremente en los cultivos tropicales en el futuro cercano, debido al auge de ambientes protegidos como invernaderos, túneles plásticos y casas de sombra, en cuyo interior se generan con frecuencia las condiciones micro-climáticas que propician la manifestación de la presión de raíz y la gutación (Schuh 1991), y en los que potencialmente existen también las mayores oportunidades para su control.
Agradecimientos
Agradecemos al Dr. Frank Ewers (Depto. de Botánica y Fitopatología, Michigan State Univ., EEUU) por su asesoría al inicio del proceso de construcción de los manómetros de burbuja, y de las mediciones de presión de raíz. La Vicerrectoría de Investigación de la Universidad de Costa Rica proveyó financiamiento parcial para este trabajo.
Literatura citada
Aylor, DE; Taylor, GS. 1982. Aerial dispersal and drying of Peronospora tabacina conidia in tobacco shade tents. Proc. Natl. Acad. Sci. USA. 79:697-700. [ Links ]
Clarkson, DT. 1993. Roots and the delivery of solutes to the xylem. Phil. Trans. R. Soc. Lond. B. 341:5-17. [ Links ]
Clarkson, DT; Carvajal, M; Henzler, T; Waterhouse, RN; Smyth, AJ; Cooke, DT; Steudle, E. 2000. Root hydraulic conductance: diurnal aquaporin expression and the effects of nutrient stress. Journal of Experimental Botany 51:61-70. [ Links ]
Clearwater, MJ; Blattmann, P; Luo, Z; Lowe, RG. 2007. Control of scion vigour by kiwifruit rootstocks is correlated with spring root pressure phenology. Journal of Experimental Botany 58(7):1741-1751. [ Links ]
Davis, TA. 1961. High root-pressures in palms. Nature 21:277-278. [ Links ]
Emmons, CLW; Scott, JW. 1996. Factors affecting cuticle cracking in tomato. Proc. Fla. State Hort. Soc. 109:178-182. [ Links ]
Enns, LC; McCully, ME; Canny, MJ. 1998. Solute concentrations in xylem sap along vessels of maize primary roots at high root pressure. Journal of Experimental Botany 49(326):1539-1544. [ Links ]
Ewers, FW; Cochard, H; Tyree, MT. 1997. A survey of root pressures in vines of a tropical lowland forest. Oecología 110(2):191-196. [ Links ]
Ewers, FW; Améglio, T; Cochard, H; Beaujard, F; Martignac, M; Vandame, M; Bodet, C; Cruiziat, P. 2001. Seasonal variation in xylem pressure of walnut trees: root and stem pressures. Tree Physiology 21:1123-1132. [ Links ]
Feild, TS; Sage, TL; Czerniak, C; Iles, WJ. 2005. Hydathodal leaf teeth of Chlorantus japonicus (Chlorantaceae) prevent guttation-induced flooding of the mesophyll. Plant, Cell and Environment 28:1179-1190. [ Links ]
Fisher, JB; Angeles, GA; Ewers, FW; Lopez-Portillo, J. 1997. Survey of root pressure in tropical vines and woody species. International Journal of Plant Sciences 158(1):44-50. [ Links ]
Grossenbacher, KA. 1939. Autonomic cycle of rate of exudation of plants. American Journal of Botany 26:107-109. [ Links ]
Grunwald, I; Rupprecht, I; Schuster, G; Kloppstech, K. 2003. Identification of guttation fluid proteins: the presence of pathogenesis-related proteins in non-infected barley plants. Physiologia Plantarum 119:192-202. [ Links ]
Hacke, U; Sauter, JJ. 1996. Xylem dysfunction during winter and recovery of hydraulic conductivity in diffuse-porous and ring-porous trees. Oecología 105:435-439. [ Links ]
Hawes, MC; Brigham, LA; Wen, F; Woo, HH; Zhu, Y. 1998. Function of root border cells in plant health: pioneers in the rhizosphere. Annual Review of Phytopathology 36:311-327. [ Links ]
Hwang, YH; Morris, JT. 1991. Evidence of hygrometric pressurization in the internal gas space of Spartina alternifolia. Plant Physiology 96:166-171. [ Links ]
Ketchie, DO; Lopushinsky, W. 1981. Composition of root pressure exudate from conifers. USDA, Forest Service. Research Note PNW-395. p. 1-6. [ Links ]
Klepper, B; Kaufmann, MR. 1966. Removal of salt from xylem sap by leaves and stems of guttating plants. Plant Physiology 41:1743-1747. [ Links ]
Kramer, PJ; Boyer, JS. 1995. Water relations of pants and soils. San Diego, EEUU. Academic Press. 495 p. [ Links ]
Leonard, OA. 1944. Use of root pressures in determining injury to roots by cultivation. Plant Physiology 19(1):157-163. [ Links ]
López-Portillo, J; Ewers, FW; Angeles, GM; Fisher, JB. 2000. Hydraulic architecture of Monstera acuminata: evolutionary consequences of the hemiepiphytic growth form. New Phytologist 145:289-299. [ Links ]
Lopushinsky, W. 1980. Occurrence of root pressure exudation in Pacific Northwest conifer seedlings. Forest Science 26(2):275-279. [ Links ]
McCully, M. 1999. Roots in soil: unearthing the complexities of roots and their rhizospheres. Annual Review of Plant Physiology and Plant Molecular Biology 50:695-718. [ Links ]
Milburn, JA; Ransinghe, MS. 1996. A comparison of methods for studying pressure and solute potentials in xylem and also in phloem laticifers of Hevea brasiliensis. Journal of Experimental Botany 47(294):135-143. [ Links ]
O´Leary, J. 1965. Root-pressure exudation in woody plants. Botanical Gazette 126(2):108-115. [ Links ]
Peet, MM. 1992. Fruit cracking in tomato. Hort Technology 2(2):216-223. [ Links ]
Pickard, WF. 2003a. The riddle of root pressure. I. Putting Maxwell’s demon to rest. Functional Plant Biology 30:121-134. [ Links ]
Pickard, WF. 2003b. The riddle of root pressure. II. Root exudation at extreme osmolalities. Functional Plant Biology 30:135-141. [ Links ]
Robeson, DJ; Bretschneider, KE; Gonella, MP. 1989. A hydathode inoculation technique for the simulation of natural black rot infection of cabbage by Xanthomonas campestris pv. campestris. Annals of Applied Biology 115:455-459. [ Links ]
Saha, S; Holbrook, NM; Montti, L; Goldstein, G; Cardinot, GK. 2009. Water relations of Chusquea ramosissima and Merostachys claussenii in Iguazu National Park, Argentina. Plant Physiology 149:1992-1999. [ Links ]
Shapira, O; Khadka, S; Israeli, Y; Shani, U; Schwartz, A. 2009. Functional anatomy controls ion distribution in banana leaves: significance of Na+ seclusion at the leaf margins. Plant, Cell & Environment 32(5):476-485. [ Links ]
Sperry, JS. 1983. Observations on the structure and function of hydathodes in Blechnum lehmannii. American Fern Journal 73(3):65-72. [ Links ]
Scholander, PF; Love, WE; Kanwisher, JW. 1955. The rise of sap in tall grapevines. Plant Physiology 30(2):93-104. [ Links ]
Schuh, W. 1991. Influence of temperature and leaf wetness period on conidial germination in vitro and infection of Cercospora kikuchii on soybean. Phytopathology 81:1315-1318. [ Links ]
Schwenke, H; Wagner, E. 1992. A new concept of root exudation. Plant, Cell and Environment 15:289-299. [ Links ]
Steudle, E. 2000. Water uptake by plant roots: an interaction of views. Plant and Soil 226:45-46. [ Links ]
Steudle, E. 2001. The cohesion-tension mechanism and the acquisition of water by plant roots. Annual Review of Plant Physiology and Plant Molecular Biology 52:847-875. [ Links ]
Strati, S; Patiño, S; Slidders, C; Cundall, E; Mencuccini, M. 2003. Development and recovery from winter embolism in silver birch: seasonal patterns and relationship with phenological cycle in oceanic Scotland. Tree Physiology 23:663-673. [ Links ]
Weidner, M; Martins, R; Muller, A; Simon, J; Schmitz, H. 2005. Uptake, transport and accumulation of nicotine by golden photo (Epiprenum aureum): the central role of root pressure. Journal of Plant Physiology 162:139-150. [ Links ]
White, PR. 1938. Root-pressure: an unappreciated force in sap movement. American Journal of Botany 25:223-227. [ Links ]
Williams, JE; Davis, SD; Portwood, K. 1997. Xylem embolism in seedlings and resprouts of Adenostoma fasciculatum after fire. Aust. J. Bot. 45:291-300. [ Links ]
Zholkevich, KAVN. 1991. Root pressure. In Waisel, Y; Eshel, A; Kafkafi, U. eds. Plant roots, the hidden half. Marcel-Dekker, New York. p. 589-603. [ Links ]
*Correspondencia a: Marco V. Gutiérrez-Soto, Rubén Calderón-Cerdas & José Miguel Araya-Alfaro: Estación Experimental Agrícola Fabio Baudrit Moreno, Universidad de Costa Rica. surdo26@racsa.co.cr (autor para correspondencia); ruben.calderon@hotmail.com; araya.josecr@gmail.com
1 Recibido: 15 de junio, 2010. Aceptado: 27 de octubre, 2011.
2 Estación Experimental Agrícola Fabio Baudrit Moreno, Universidad de Costa Rica. surdo26@racsa.co.cr (autor para correspondencia); ruben.calderon@hotmail.com; araya.josecr@gmail.com
Recibido: 15 de junio, 2010. Aceptado: 27 de octubre, 2011.