Introducción
Los terceros molares inferiores generalmente erupcionan en boca entre los 17 y 24 años de edad (González, Barceló, De la Tejera Chillón, Valles, & Lara, 2014), su extracción está indicada en situaciones que generen lesión periodontal a las piezas adyacentes erupcionadas, impactación, pericoronaritis (Sociedad Americana de Cirugía Oral y maxilofacial, 2005) procesos agudos odontológicos que afectan al área bucodental, traumatismos oseodentarios, lesiones en la mucosa oral u otro tipo de complicación patológica (Shubha , y otros, 2016).
La cirugía de terceros molares es un procedimiento complejo que debe planificarse junto a un examen de imagen como la radiografía panorámica buscando una visión más clara de la posición dentaria y prever las posibles complicaciones así como el tiempo quirúrgico realizado en la cirugía (Olate, Alister, Thomas, Alveal, & Unibazo, 2014)
Uno de los principios que se fundamenta en la cirugía es la forma en que el individuo responde al trauma provocado por el acto quirúrgico (Castillo, García-Sívoli, Arteaga, Dávina, & Molina, 2010), el dolor, el trismo por contracción muscular y la inflamación en el transcurso de 24 a 72 horas son complicaciones comunes reportadas y se cree que surgen de una respuesta inflamatoria, consecuencia directa e inmediata del procedimiento quirúrgico (Zafra & Nieto, 2019), las complicaciones intraoperatorias y posoperatorias referentes a la extracción de terceros molares pueden llegar a convertirse en una verdadera molestia para el paciente (Lee, y otros, 2015)
Resulta innovador en odontología el empleo de concentrados plaquetarios de segunda generación, como la fibrina rica en plaquetas, que contiene factores de crecimiento y propiedades de cicatrización (Meza, Lecca, Correa, & Ríos, 2014).
La búsqueda de terapias que disminuyan la convalecencia post quirúrgica, es el empleo de materiales bioactivos de origen autólogo como son las plaquetas ricas en fibrina que estimulan la proliferación y diferenciación celular para la reparación de los tejidos (Felzani, 2005) obteniendo mejoría en el dolor del paciente y acelerando el tiempo del proceso de cicatrización (Fierro-Serna, Martínez- Rider, Hidalgo-Hurtado, Toranzo- Fernández, & Pozos-Guillén, 2011)
La cicatrización de un alvéolo sucede por tres fases, inflamatoria, proliferativa y fase de remodelado para restaurar la integridad del tejido, en el momento de la lesión, se activan múltiples vías celulares y extracelulares, de una manera estrechamente regulada y coordinada (Rosales, Alvarado, & Ojeda, 2012).
Dentro del proceso de cicatrización de tejidos posterior a una extracción del órgano dentario, se puede utilizar plasma rico en plaquetas (PRP) para disminuir la pérdida de hueso puesto que las plaquetas juegan un papel fundamental al intervenir durante la hemostasia ya que estos contienen factores de crecimiento que ayudan a la cicatrización y al proceso de bioformación (Morales Navarro & Vila Morales, 2016). El alveolo se cierra y éste puede ser cubierto con una membrana de tipo reabsorbible o no reabsorbible y finalizar con una sutura (Paltas, Guzmán , Benenaula, Núñez, & Simbaña, 2017)
Las plaquetas son materiales biológicos autólogos, la unión de todos estos elementos favorece la acción del plasma formado por fragmentos anucleares de los megacariocitos que se encuentran en la sangre periférica cuyo principal papel es la hemostasia debido a que contiene una serie de proteínas, citocinas y factores bioactivos que regulan la cicatrización de heridas (Gil Cárdenas, Osorio Daguer, Fortich Mesa, & Harris Ricardo, 2017). PRF es obtenido de la sangre autógena, tomando una muestra por una punción venosa, que posteriormente tras la centrifugación de sangre propia del paciente anticoagulada se separan los distintos componentes, al ser una fuente de actividad mitógena en el plasma sanguíneo y portador de factores de crecimiento y proteínas en la biología ósea (Beca, Hernández, Morantes, & Bascones, 2007).
Una vez activado, el PRF puede ser inyectado en su forma líquida, o bien, pasados 10 minutos se formará un hidrogel, el cual puede aplicarse directamente en el tejido dañado, o puede utilizarse en conjunto con células (Castro-Piedra & Arias-Varela, 2019)
En la práctica odontológica existen tratamientos que causan pérdida del tejido óseo, reducción de soporte, incluso después de una extracción.
La utilización del PRF perfecciona el proceso quirúrgico, enfatizando la etapa de restauración fisiológica, permitiendo una reparación acelerada con mejores resultados en los tejidos conjuntivos damnificados (Sanchez, Azofra, Aizpurúa, Elorriaga, & Andía, 2003).
Objetivo:
En el propósito de esta revisión de literatura tiene como objetivo determinar el beneficio en el proceso de cicatrización post extracción de terceros molares mandibulares con plaquetas ricas en fibrina empleando literatura referida en la base de datos Pub Med, Google académico y Science direct dearticulos publicados entre el año 2016 a 2021.
Materiales y métodos
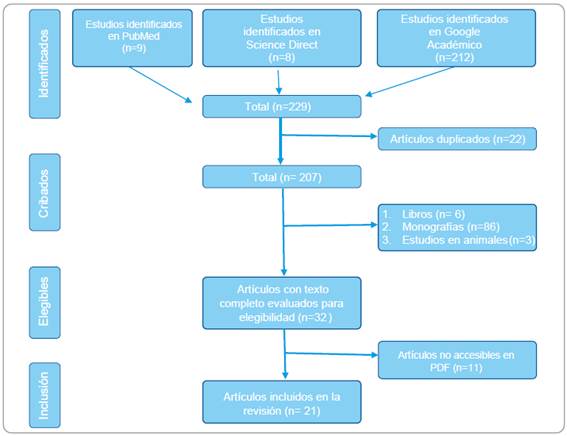
La investigación realizada tiene un alcance exploratorio, de carácter documental y descriptivo El diseño es no experimental de corte transversal, con enfoque cualitativo. Se estableció como muestra artículos publicados durante el periodo 2016-2021 recolectados en la base de datos de Pub Med, Google académico y Science Direct empleando como estrategia de búsqueda PICO, las palabras Mandibular Third Molars”, “Platelet-Rich Fibrin”, “Oral surgery, regeneration” encontrados y aprobados por el sistema Descriptores en ciencias de la Salud (DESC), utilizando términos boléanos AND y sus homónimos en español.
Se seleccionó los artículos tomando en cuenta la similitud entre el título, resumen y objetivo, considerados todos los estudios de revisiones sistemáticas, meta-análisis, estudios comparativos y revisiones de literatura que comprendan diferentes criterios acerca de la preservación del alveolo dentario posterior a cirugía de terceros molares con el uso de plaquetas ricas en fibrina.
La búsqueda arrojó 9 en Pub Med y 212 en Google Académicos, 8 en Science Direct, determinando los criterios de exclusión excluyendo libros, monografías y estudios experimentales, quedó 175 artículos que no cumplen con el objetivo a investigar, 22 estaban duplicados y 21 artículos se consideran incluidos en esta revisión de literatura. Los artículos fueron leídos en su total integridad, se analizó los artículos, objetivos, metodología y conclusión de cada uno de ellos lo cual fue expuesto a seguir y posteriormente analizados.
Resultados
Cicatrización alveolar
El proceso de cicatrización ocurre para reponer la estructura de los tejidos lesionados como respuesta del organismo frente a un agente lesivo, la cicatrización de los tejidos blandos y duros tiene lugar a nivel celular y estructural regulado por las proteínas (Dilmer, y otros, 2021).
La cicatrización de alveolos post exodoncia se considera de segunda intención cuando se llena el alveolo de sangre activándose las vías de coagulación y una gran cantidad de glóbulos rojos en un contenido fibroso que ocupa todo el espacio alveolar, durante las primeras 24 a 48 horas se produce una dilatación de vasos remanentes del tejido periodontal, los leucocitos se sitúan en el lugar de la herida para que a los siete días ya se encuentre una malla de tejido conectivo establecida (Ritto, Fischer, Figueredo, Medeiros, & Canellas, 2019).
Dentro del proceso de reabsorción fisiológica de las paredes del alvéolo, el hueso lamelar se reabsorbe y remplaza por hueso reticular hasta producir mayor pérdida vertical en la cresta vestibular, comprobándose que los mayores cambios dimensionales post extracción ocurren en el tercio coronal del alvéolo (Vargas, Serrano, & Estrada, 2018)
El seguimiento posquirúrgico de una avulsión dentaria compleja, terceros molares con raíces divergentes requieren una odontosección del diente, seccionar en varias estructuras, generando un posible trauma óseo, dolor significativo, edema, hematoma e incluso se asocia a un retraso en la cicatrización del sitio quirúrgico relacionado con la falta de sangrado o un coágulo de sangre inestable dentro de la avulsión (Del Corso, y otros, 2017), después de la extracción, el hueso alveolar sufre un proceso de atrofia, cambios dimensionales y modulación de tejidos blandos (Anwandter, y otros, 2016)
El tiempo de cicatrización natural de una persona sin enfermedades sistémicas puede variar entre 7 y 10 días con un cierre total de tejidos blandos, en cuanto a tejido óseo el tiempo estimado de regeneración va desde los 4 a 6 meses, su rehabilitación sucede a partir de los 6 meses y se considera un tejido apto (Lobaton, Mantilla, Felzani, Suarez, & Gonzalez, 2016), incluso con una reducción en el volumen del reborde alveolar que se cuantifica entre 5,0 a 7,0 mm en sentido vestíbulopalatino/ lingual después de 12 meses de cicatrización (Travezán, Aguirre, & Arbildo, 2021)
Plaquetas ricas en fibrina (PRF)
Las plaquetas son atraídas hacia el lugar de la lesión y su función es destacable en la hemostasia como en el proceso de reparación de una herida, así la formación de fibrina y la cascada de coagulación son estimuladas, los factores de crecimiento están presentes en cada una de las fases de cicatrización, promoviendo en la zona de lesión la inducción de la quimiotaxis, la angiogénesis y osteogénesis, proliferación y diferenciación de células progenitoras, la división celular y la síntesis de colágeno (López-Pagán & Pascual-Serna, 2020). La fibrina es una forma activada de la molécula fibrinógeno, transformándose en un pegamento biológico capaz de consolidar el primer grupo de plaquetas y crear una pared protectora durante la hemostasia siendo la primera matriz cicatricial en el sitio de la lesión, se activan a partir de las plaquetas atrapadas en la matriz de fibrina al estimular una respuesta mitogénica de las células del periostio para obtener la cicatrización (Feigin & Shope, 2019) PRF es una nueva generación de concentrados plaquetarios constituidos en su mayoría, por fibrina, plaquetas y citoquinas, se obtiene por centrifugación sin anticoagulantes y por tanto es estrictamente autólogo, (Masako, y otros, 2017) su combinación de monómeros de fibrina conducen a la formación de una estructura trimolecular que origina una red suave y permeable para una rápida colonización de las células cicatrizales, su preparación es 15 minutos antes de la operación, tomando muestras de sangre sin anticoagulante en tubos de plásticos recubiertos en vidrio de 10 ml, después del primer centrifugado a 3000 rpm durante 10 minutos (González, Suárez, Hernández, & Moreno José, 2018), descartamos el plasma pobre en plaquetas que se acumula en la parte superior de los tubos y recolectamos el PRF de aproximadamente 2 mm por debajo de su punto de contacto con los glóbulos rojos para incluir cualquier plaqueta restante (Ramirez, y otros, 2018).
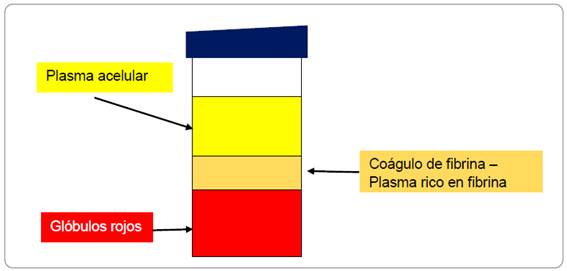
El coagulo de fibrina es obtenido en la mitad del tubo 10 ml, entre los glóbulos rojos del fondo y el plasma acelular de la parte superior, suficiente para llenar la cavidad de cada paciente, la activación de la muestra de sangre ocurre cuando entran en contacto con la superficie del tubo de ensayo y comienza después de algunos minutos el proceso de la cascada de coagulación, figura 1 (Escalante Otárola, Castro Núñez, Geraldo Vaz, & Kuga, 2016), su aplicación se recomienda cuando las paredes están intactas, si existe más paredes ausentes o dañadas debe combinarse PRF con sustitutos óseos, demostrando a su vez un excelente comportamiento como conector biológico entre las partículas óseas (Orión, Salgado, & Arriba, 2017)
Proliferación de prf en tejidos post extracción de terceros molares
Las plaquetas liberan factores de crecimiento que influyen en la cicatrización con su efecto biológico de viabilidad y proliferación de células osteoprogenitoras y preosteoblastos que habitan en los tejidos adyacentes, periostio y endostio, inmersos en el interior de la matriz de fibrina después de su activación, al ser secretados como consecuencia de un injerto, herida o colgajo se unen a la superficie externa de la membrana celular del tejido vía receptores transmembranales (Gürbüzer, y otros, 2018). En el tejido, el PRF se disuelve lentamente, formando una matriz de fibrina sólida que se remodela lentamente al estilo de un coágulo de sangre natural, plaquetas y citocinas se retienen de forma eficaz y se liberan gradualmente con el tiempo (Morales Navarro & Vila Morales, 2016) la utilización de fibrina autóloga en lesiones de evolución lenta e incierta condiciona un menor tiempo de recuperación y calidad del tejido reparado (Yuvika, y otros, 2016)
Los pacientes tratados con PRF presentan menor dolor después de la extracción de los terceros molares mandibulares evaluados y comparados en el primer día posoperatorio y a los 3 meses con un alto grado de satisfacción por su concentrado de citoquinas leucocitarias favoreciendo una automodulación de los procesos inflamatorios (Orozco, Gómez, Ninin, & Celis, 2016), también se puede usar para acelerar la curación natural en pacientes inmunodeprimidos y anticoagulados aquellos que toman medicamentos que interfieren con la cicatrización y aquellos con antecedentes de radioterapia (Yuvika, y otros, 2016).
La función de las membranas PRF es entonces estimular la cicatrización gingival durante el primer mes de seguimiento pero también proteger el injerto óseo del ambiente oral y preservar la cresta alveolar, como una barrera biológica (Blinstein & Bojarskas, 2018)); además mantener el volumen del reborde residual perdido y disminuye el dolor post quirúrgico, sangrado e inflamación de la mucosa alveolar (Alves Dos Santos, 2020).
Discusión
Las plaquetas ricas en fibrina mejoran el proceso de cicatrización / regeneración de heridas de tejidos blandos y defectos intraóseos por su concentrado plaquetario aumentando la formación de hueso nuevo en los alvéolos posteriores a la extracción (Deborah, Madhuri, Mohammad, Sanjay, & Vanshika, 2020), un efecto beneficioso por la liberación de factores de crecimiento y citocinas sumergidas en las plaquetas y la malla de fibrina (Canellas, Ritto, & Medeiros, 2017) misma que contiene leucocitos para resistir y combatir la infección, la presencia de leucocitos tiene un gran impacto en la biología de la cicatrización de heridas (Lago Méndez, y otros, 2007)
Estudios que evidencian factores de confusión sobre la cantidad de PRF coinciden que al utilizar un mayor volumen de sangre obtenemos mayor número de factores de crecimiento (Faez, Mohamed, Ehab, & Mohammed, 2017) a diferencia del PRP, las plaquetas ricas en fibrina resultan eficaces al formar una matriz de fibrina con arquitectura tridimensional compleja que no se disuelve rápidamente después de la aplicación (Yelamali & Saikrishna, 2015)sin especificar si la cantidad de volumen de sangre podría afectar el proceso de curación, pero la mayoría de los estudios incluidos informaron el uso del mismo protocolo de preparación con 5 a 10 ml de sangre venosa y no se pudo evaluar el efecto del volumen de PRF (Sanizo & Alarcón, 2016)
Existe incertidumbre en la literatura sobre las posibles ventajas de la PRF para la regeneración ósea, basados en nuestra revisión de literatura comprobamos la aplicación de PRF mejora el estado post quirúrgico y cicatrización del paciente sometido a exodoncia de terceros molares, sin embargo un estudio reportó que las plaquetas ricas en fibrina no modificaron la cicatrización del tejido duro, formación de hueso cortical después de la extracción, influyendo en la reducción de la inflamación y el edema por la limitación de estudios histológicos del sitio de la lesión (OD Osunde, RA Adebola, & UK Omeje, 2011)
Existe limitada información sobre la influencia de la PRF en la cicatrización de los tejidos blandos y la regeneración ósea, exigiendo mayor investigación en forma de ensayos clínicos aleatorios en un número de pacientes considerable (Ankit, y otros, 2020) para comparar sistemáticamente, de forma aleatoria y controlada los efectos de la PRF en una amplia gama de odontología (Bilginaylar & Uyanik, 2016), estos hallazgos también deben interpretarse con precaución hasta que se recopilen los datos clínicos requeridos centrados en la resistencia, rigidez o tenacidad, actualmente solo se utiliza un protocolo de centrifugación de PRF para uso clínico, resultaría innovador investigar sobre las modificaciones en velocidades y el efecto del tiempo de centrifugación en propiedades biomecánicas para diversas aplicaciones biomédicas (Miron, y otros, 2017)
El PRF y sus beneficios son aplicables a diversas áreas odontológicas, no únicamente extracción de terceros molares pudiendo utilizarse de forma efectiva en pacientes sometidos a cirugía ortognática, reducción de fracturas, reconstrucciones por defectos óseos, reparación de ligamento, regeneración de cartílago, entre otros mejorando la cicatrización y brindando al paciente en su fase post quirúrgica todas las utilidades de las plaquetas ricas en fibrina.