Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Costarricense de Cardiología
Print version ISSN 1409-4142
Rev. costarric. cardiol vol.2 n.3 San José Dec. 2000
TRABAJO ORIGINAL
Resumen
Introducción. Una complicación de la Diabetes Mellitus es la neuropatía autonómica diabética (NAD), la cual tradicionalmente se diagnostica con criterios clínicos. El análisis de la variabilidad de la frecuencia cardíaca (VFC), consiste en el estudio de las variaciones de tiempo entre latido y latido consecutivos del corazón, reflejo de la influencia y que tiene importancia pronóstica.
Objetivo. Determinar la utilidad del análisis de la VFC como método auxiliar para el diagnóstico y clasificación de los pacientes con NAD.
Material y métodos. Se eligieron individuos con diagnóstico clínico de diabetes mellitus tipo 2 con NAD y como grupo control, diabéticos sin NAD; también se incluyó un grupo control de individuos sanos. Para el registro, se empleó un equipo PowerLab utilizando una derivación electrocardiográfica durante 5 minutos. Se estimaron variables en dominio de tiempo y de frecuencia y se compararon entre los grupos.
Resultados. Se estudiaron 6 pacientes diabéticos con NAD, 3 sin NAD y 6 sujetos sanos. La diferencia más dramática se observó en el grupo de pacientes diabéticos con NAD. Al compararse valores promedio entre ambos grupos de diabéticos se observaron diferencias significativas tanto en variables de dominio de tiempo como de frecuencia: SDNN 26.799 vs 12.601, p=0.047, SDdNN 21.880 vs 9.953, p=0.031, RMSSD 21.841 vs 9.940, p=0.03), LF 125.937 vs 35.077, p=0.1 y HF 67.717 vs 14.472, p=0.02). No se encontró diferencias entre diabéticos sin NAD y controles sanos.
Conclusión. El análisis de la VFC es útil en la valoración cuantitativa de la NAD, lo cual tiene importancia pronóstica.
Palabras Clave
Variabilidad de la FC, diabetes.
Summary
Introduction. A recognized diabetes mellitus complication is autonomic neuropathy (DAN), that is usually diagnosed by clinical criteria. Heart rate variability analysis (HRV) consist in the study of time variations along consecutive heart beats, reflecting autonomic influence, with prognostic importance.
Objetive. To determine usefullness of HRV analysis as ancilliary method for diagnosis and follow-up of patients with DAN.
Materials y methods. We selected type 2 diabetic patients with clinical diagnosis of DAN and without DAN, as control group. Also we included healthy individuals. For data adquisition we used a PowerLab equipment with a single electrocardiographic lead, during 5 minutes. We calculate time domain and frequency domain variables and compared it between groups.
Results. We studied 6 diabetic patients witn DAN, 3 without DAN and 6 normal subjects. The most dramatic difference ocurred in diabetics with DAN. Comparing mean values between both groups of diabetics we observed statistical differences in time domain and in frequency domain variables: SDNN 26.799 vs 12.601, p=0.047, SDdNN 21.880 vs 9.953, p=0.031, RMSSD 21.841 vs 9.940, p=0.03), LF 125.937 vs 35.077, p=0.1 and HF 67.717 vs 14.472, p=0.02). We did not found differences between diabetes without DAN and normal controls.
Conclusion. HRV analysis is usefull in evaluating cuantitatively DAN, with prognosis information.
Key Words
Heart rate variability, diabetes.
Introducción
Uno de los aspectos de la modulación del sistema nervioso autónomo sobre el aparato cardiovascular es el balance entre el tono simpático y el parasimpático sobre la frecuencia cardíaca. En condiciones patológicas, tal modulación puede verse afectada, por ejemplo, en el infarto agudo de miocardio se produce un incremento del tono simpático de manera compensatoria ante la pérdida de la geometría normal del ventrículo izquierdo, generándose así un disbalance entre el tono simpático y parasimpático, hecho que se ha relacionado a mayor mortalidad en este grupo de enfermos(1).
Una complicación conocida de la Diabetes Mellitus es la neuropatía autonómica diabética (NAD), la cual inicialmente cursa con disminución de la velocidad de conducción nerviosa y resistencia a la conducción por daño isquémico; posteriormente, degeneración axonal que progresa a todas la fibras nerviosas hasta producir desmielinización(2). Como origen de esta disfunción se postulan alteraciones metabólicas (en la vía del poliol y metabolismo anormal del inositol, formación de productos terminales de la glicosilación avanzada, incremento en las especies oxígeno reactivas y alteraciones en el metabolismo de los ácidos grasos esenciales) o hipoxia secundaria a anomalías microvasculares que comprometen la irrigación del nervio(2).
Sus manifestaciones clínicas incluyen hipotensión ortostática, impotencia, disfunción gastrointestinal (p.ej. diarrea crónica), retención urinaria o alteraciones en la termorregulación como sudoración inmotivada o anhidrosis en las extremidades inferiores. Otras complicaciones relacionadas son la neuropatía sensomotora distal simétrica, la amiotrofia y la mononeuritis múltiple.
Tradicionalmente se han utilizado diversos síntomas y signos para el diagnóstico de la NAD tales como registrar la presión arterial en decúbito y de pie o la frecuencia cardíaca con inspiración profunda, maniobra de valsalva(3) y pre y post ejercicio físico(2). En los últimos años se viene utilizando el análisis de la variabilidad de la frecuencia cardíaca (VFC), como marcador de la función autonómica(4) y por ende del equilibrio simpático/parasimpático. Este consiste en el análisis de las variaciones en la duración del intervalo de tiempo que transcurre entre latido y latido consecutivos del corazón (los intervalos RR). Este método se ha aplicado desde hace varias décadas en obstetricia: ciertos patrones en las variaciones de la frecuencia cardíaca fetal durante las contracciones uterinas del trabajo de parto predicen sufrimiento fetal agudo. Recientemente, este método ha devenido como marcador pronóstico en los pacientes con cardiopatía isquémica(1,5), insuficiencia cardíaca(6), miocarditis Chagásica(7,) síncope(8) o en los que han sido sometidos a trasplante cardíaco(9). Otros métodos auxiliares que también se han utilizado en la evaluación del sistema nervioso autónomo incluyen variabilidad de la presión arterial(10), sensibilidad barorefleja(11), velocidad de onda de pulso(12,13), variabilidad del intervalo QT(14), respuesta simpática cutánea(15) o métodos por imágenes como la gamagrafía miocárdica de SPECT con I231-Meta-iodobenzilguanina –MIBG(16).
La presente investigación tuvo como objetivo determinar la utilidad del análisis de la VFC como método auxiliar para el diagnóstico y clasificación de los pacientes con NAD.
Materiales y métodos
Pacientes. Fueron elegidos para el estudio, individuos con diagnóstico clínico de diabetes mellitus tipo 2 con neuropatía autonómica diabética. Se utilizaron los siguientes criterios para el diagnóstico clínico de NAD:
1.-Presencia de taquicardia sinusal de reposo mayor de 100 latidos/minuto
2.-Pobre incremento de la frecuencia cardíaca con la posición de pie [cociente(17) frecuencia cardíaca en decubito/frecuencia cardíaca de pie < 1
3.-Caída de la presión arterial con la posición de pie > 10 mmHg
Se consideró por lo menos uno de estos tres criterios y por lo menos un síntoma típico para establecer el diagnóstico clínico de NAD.
Como grupo control se eligieron pacientes diabéticos con características similares en cuanto a edad, tipo de diabetes y comorbilidad, pero sin los criterios para NAD mencionados. No se consideró el tiempo de evolución de la diabetes como criterio de inclusión o exclusión ya que la aparición de NAD se correlaciona en forma directa con ella.
Fueron excluídos pacientes diabéticos que tuvieran antecedentes de enfermedades cardiovasculares como infarto de miocardio, isquemia miocárdica sintomática, hipertensión arterial descompensada o insuficiencia cardíaca en CF II-IV (de la New York Heart Association) o bien de ingesta de medicamentos o sustancias que pudieran afectar los resultados (p.ej. betabloqueantes).
También se incluyó un grupo control de individuos adultos conocidos sanos, asintomáticos, con un interrogatorio y examen físico que no evidenció hallazgos patológicos.
Diseño del estudio. Se utilizó como regla de oro los signos y síntomas de NAD para establecer la utilidad del análisis de la VFC en confirmar el diagnóstico clínico y secundariamente para clasificar y estratificar a los pacientes con NAD. Las variables analizadas en el grupo de diabéticos con NAD se compararon con el grupo de diabéticos sin NAD clínica. También se compararon los valores promedio de los diabéticos sin NAD clínica con los de los sujetos sanos del grupo control, para corroborar que los pacientes sin NAD clínica no fueran portadores de cualquier anomalía en este tipo de análisis.
Adquisición y análisis de los datos. Para la adquisición de datos se empleó un equipo digital de registro PowerLab ADInstruments utilizando una derivación electrocardiográfica estándar DI ó DII, durante 5 minutos en decúbito supino. La frecuencia de adquisición fue de 1 KHz y se filtró la señal en el rango 20-250 Hz. Antes de iniciar el registro, se constató que el sujeto estuviese de previo en reposo y en posición adecuada.
El análisis y presentación gráfica de los datos se realizó con la extensión "heart rate variability", determinándose variables tanto en Dominio de Tiempo como en Dominio de Frecuencia.
Las variables en dominio de tiempo se obtuvieron utilizando mediciones directas o cálculos aritméticos e incluyeron:
| Variables simples (en ms): | -RR máximo -RR mímimo -Rango (diferencia entre RR máximo y mínimo) -RR promedio -RR mediana -Frecuencia cardíaca promedio (latidos/min) |
| Métodos estadísticos (en ms): | -Desviación estándar de los RR (o llamados NN, deriva de "normal to normal"), el SDNN -Desviación estándar de las diferencias entre latidos consecutivos, el SDDeltaRR -Raíz cuadrada del promedio de así dife- rencias entre intervalos sucesivos elevadas al cuadrado, el RMSSD -Número de diferencias entre intervalos RR sucesivos mayores de 50 ms, el NN50 -Número de diferencias entre intervalos RR sucesivos mayores de 50 ms divididos por el número total de RR sucesivos, expresado en porcentaje |
Métodos Geométricos: Se empleó el Ploteo de Poincaré de los NN (ver presentación gráfica más adelante).
Para calcular los parámetros en dominio de frecuencia, es necesario desdoblar la señal sinusoidal (el tacograma de intervalos RR, ver más adelante) en los múltiples componentes de distinta frecuencia que lo componen, mediante métodos matemáticos; en este estudio se utilizó el de Transformación rápida de Fourier. Se establecieron los rangos convencionales(18,19) de alta y baja frecuencia y se calculó el poder de los mismos. Los parámetros utilizados fueron:
-Poder del rango baja frecuencia (rango 0.04 – 0.15 Hz), Lf, en ms(2)
-Poder del rango alta frecuencia (rango 0.15 – 0.4 Hz), HF, en ms(2)
-Relación LF/HF
Para establecer si las diferencias entre grupos eran estadísticamente significativas se utilizó el método t de student del programa Systat 6.0.1 for Windows, considerando una diferencia como significativa si el valor de p era < 0.05.
Presentación de los datos. La presentacion gráfica de los datos en ejes de coordenadas incluyó (figura 1):
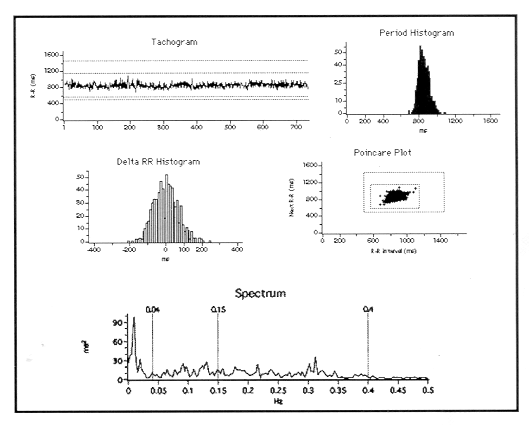
Figura 1. Tacograma, Histograma de los intervalos RR y de sus diferencias, ploteo de Poincaré y espectro de un individuo sano. Véase más detalles en el texto
El tacograma de los intervalos RR. Consiste en graficar en las ordenadas la duración de cada uno de los intervalos RR consecutivos (en las abcisas).
El histograma de los intervalos RR. Es un gráfico de barras que presenta el número de intervalos RR (ordenadas) y la duración RR (abcisas) en intervalos (barras) que difieren 10 ms entre sí en orden tanto creciente como decreciente.
El histograma de las diferencias RR (Delta RR) es un gráfico de barras que presenta el número diferencias entre RR y RR consecutivos (ordenadas) y la duración de tales diferencias (abcisas) en intervalos (barras) que difieren 10 ms entre sí en orden tanto creciente como decreciente.
El ploteo de Poincaré que muestra la duración de cada intervalo RR en ms (ordenadas) versus la duración del RR inmediatamente precedente (abcisas), el llamado "mapa de retorno". Se utilizó la clasificación modificada de Woo et al(20) para el análisis de los patrones obtenidos desde la distribución de los RR el delta RR.
El espectro representa las bandas de frecuencia (en Hz, abcisas) y su respectivo poder (ordenadas) en ms.
Se estudiaron 6 pacientes diabéticos con diagnóstico clínico de NAD. Como grupo control de incluyeron 3 pacientes diabéticos sin evidencia clínica de NAD y 6 sujetos sanos.
El tiempo de enfermedad en el grupo de diabéticos con NAD fue en promedio 18 años (R: 7 a 35) mientras que en grupo de diabéticos sin NAD, 30 días (de realizado el diagnóstico). En otras variables como edad. sexo, raza, comorbilidad, etc., ambos grupos son similares.
La diferencia más dramática en los diversos parámetros del análsis de la VFC se observó en el grupo de pacientes diabéticos con NAD versus los que no tenían NAD (compárese las figuras 1 y 2), halllazgo estadísticamente significativo.
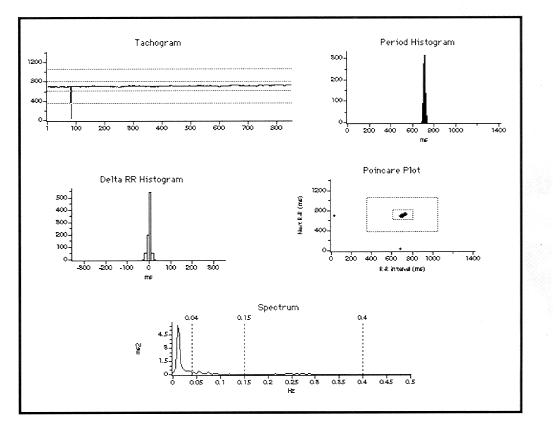
Los valores promedio obtenidos para las diferentes variables de VFC se muestran en la tabla I. Al compararse entre ambos grupos puede observarse una clara diferencia tanto en variables de dominio de tiempo como de frecuencia (tablas II y III). Destacan las variables estadísticas (SDNN 26.799 vs 12.601, p=0.047, SDdNN 21.880 vs 9.953, p=0.031, RMSSD 21.841 vs 9.940, p=0.03) y las de dominio de frecuencia (LF 125.937 vs 35.077, p=0.1 y HF 67.717 vs 14.472, p=0.02) respectivamente.
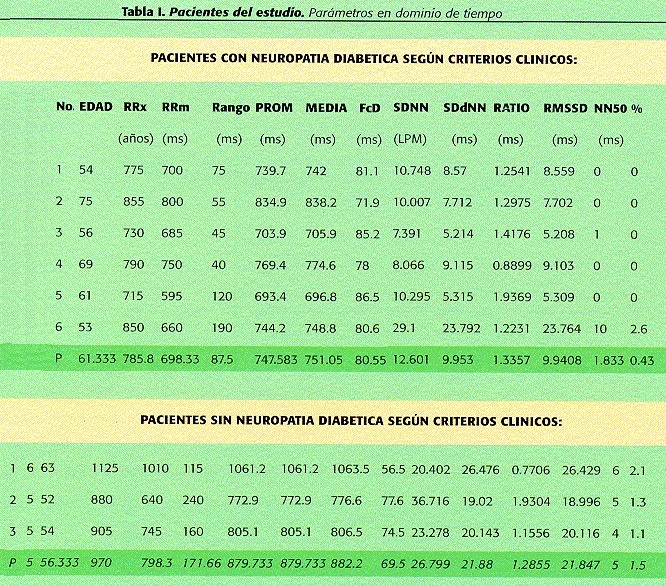
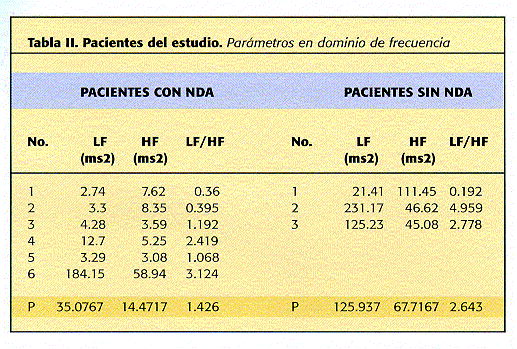
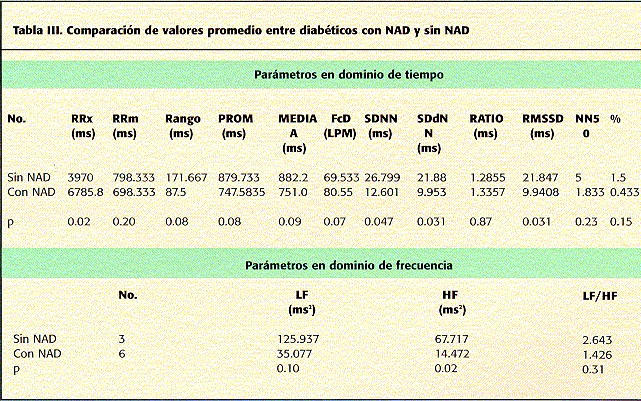
Es de notar que en el grupo de diabéticos con NAD, resalta el No. 6 (tabla I) quien presenta valores de las variables estadísticas más cercanos o incluso mayores al promedio de los valores del grupo sin NAD: SDNN 29.1 vs 26.799, SDdNN 23.792 vs 21.88, RMSSD 23.74 vs 21.847, NN50 10 vs 5 y %NN50 2.6 vs 1.5 lo que podría sugerir que el diagnóstico clínico no necesariamente refleja la presencia de disfunción autonómica objetiva, según esta metodología. Si este paciente se excluyera del análsis, los valores de p se incrementan aún más, en especial para LF (p=0.03).
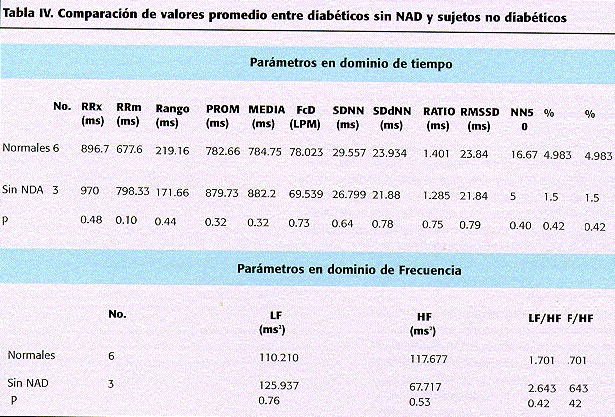
Finalmente, se comparó al grupo de pacientes diabéticos sin NAD con un grupo de individuos sanos (tabla IV) sin encontrarse diferencias, lo que nos indica que ninguno de estos pacientes podría ser portador de una anomalía según este tipo de análisis.
Discusión
El análisis de la VFC ha sido previamente descrito como un exámen útil para el diagnóstico de neuropatía diabética tanto con variables de dominio de tiempo como de frecuencia(21,22) en registros breves(23,24) como prolongados(25) e incluso, para la detección de la misma antes de la aparición de síntomas y signos típicos de la afección(26,27) para lo cual de utilizan maniobras que la desenmascaren tales como stress mental(28) ortostatismo(29,30,31,32,33), inspiración profunda(32), durante el sueño(31) o maniobra de Valsalva(32). Se ha demostrado además que dichos hallazgos son reproducibles en el tiempo(34).
En este estudio se utilizó como regla de oro a las manifestaciones clínicas de la NAD, pues se trataba de pacientes con un cuadro clínico típico y con diabetes de larga evolución. Nuestros resultados confirman que este análisis es de utilidad como exámen auxiliar para el diagnóstico, detección de casos oligosintomáticos y clasificación y cuantificación de la gravedad de la NAD puesto que encontramos una correlación directa entre los signos y síntomas y las anomalías en el análsis de la VFC.
Aunque en este estudio se utilizó una metodología convencional, existen otros métodos de análisis de la VFC que inluyen métodos geométricos como el ploteo de recurrencia(35), en dominio de frecuencia, el modelo autoregresivo(22,23,36) o los llamados métodos basados en fenómenos no lineares como tono-entropía(37), dimensión fractal(11), demodulación compleja(38) y encarrilamiento postural(38).
La importancia de detectar y clasificar la presencia y gravedad de la neuropatía autonómica radica principalmente en la posibilidad de modificar el pronóstico del paciente ya que la presencia de NAD se ha relacionado a mayor mortalidad(39), muerte súbita cardíaca(40), prolongación del QT y subsecuente aparición de arritmias letales(41) isquemia miocárdica silente(42) y otras complicaciones como micro-albuminuria(43). En Costa Rica el diagnóstico tradi-cionalmente se ha hecho sobre bases clínicas y ésta metodología aporta mayor sensibilidad, monitoreo de la evolución y probablemente, de la respuesta al tratamiento farmacológico.
Conclusión
El análisis de la VFC es un método diagnóstico útil en la valoración y estratificación de los pacientes diabéticos con NAD, cuya detección es de importancia pronóstica.
Referencias
1. Jimenez RA, Myerburg RJ. Sudden Cardiac Death: Magnitude of the problem, Substrate/Trigger Interaction, and Populations at Risk. En: Crawford MH, ed. Cardiology Clinics. Cardiac Arrhythmias and related Sindromes: Current Diagnosis and Management. Philadelphia WB Saunders; 1993; 11: 1-10 [ Links ]
2. Buolton, ASM. Diabetic Neuropathy. 1° Ed. UK : Marius Press ;1997. p. 63 - 145. [ Links ]
3. Bennet T, Farquhar IK; Hosking DJ, Hampton JR. Assessment of methods for estimating autonomic nervous control of the heart in patients with diabetes mellitus. Diabetes 1978; 27:1167-1174 [ Links ]
4. Le Heuzey JY. La Variabilité sinusales: intérêt en rythmologie. Arch Mal Coeur Vaiss1992; 85(IV): 37-43 [ Links ]
5. Kleiger RE, Miller JP, Bigger JT, Moss AJ and the Multicenter Post-Infarction Research Group: Decreased Heart Rate Variability and its Association with increased Mortality After Acute Myocardial Infarction. Am J Cardiol 1987; 59: 256 [ Links ]
6. Soejima K, Akaishi M, Suzuki Y, Meguro T, Yoshikawa T, Mitamura H, Handa S, Ogawa S. Age-corrected heart rate variability as an index of the severity of heart failure in patients with left ventricular dysfunction. Eur Heart J 1994; 15 (suppl): 326 [ Links ]
7.Gunzzetti S, Iosa D, Pescis M et al. Effects of Simpathetic Activation on Heart Rate Variability in Chagas' patients. J Autonom Nerv Syst 1990; 30: 79 [ Links ]
8. Bigger JT. Heart Rate Variabilility Analisys . J Amb Monit 1994;7: 84 [ Links ]
9. Dubner S, Bozovich G, Gutiérrez O, Perrone S, Favaloro R. Evaluación de la Variabilidad de la Frecuencia Cardíaca en Receptores de Trasplante Cardíaco Ortotópico. Su Comparación con Normales Diagnóstico. Buenos Aires, 1993; 11:743-748 [ Links ]
10. Herpin D, Raud-Rayier P, Rosenberg T, Fieuzal S, Marechand R, Dermange J. Average level and varibility of 24 hour blood pressure in the normotensive insuline-dependent diabetic patient. Ach Mal Coeur Vaiss 1991; 84: 1091-1095 [ Links ]
11. Ducher M, Cerutti C, Gustin MP, Abou-Amara S, Thivolet C, Laville M, Paultre CZ, Fauvel JP. Noninvasive exploration of cardiac autonomic neuropathy. Four reliable methods for diabetes? Diabetes care 1999; 22: 388-393 [ Links ]
12. Matsuto T, Inano K, Miida T, Okada M. Assessment of diabetic cardiovascular autonomic neuropathy by heart rate variability and pulse wave velocity. Rinsho Byori 1998; 46: 1037-1042 [ Links ]
13. Okada M, Matsuto T, Sugita O, Yamada T. Use of heart rate varibility and pulse wave velocity for diagnosing cardiovascular autonomic neuropathy. Rinsho Byori (Abstract)1992; 40: 655-9 [ Links ]
14. Ong JJ, Sarma JS, Venkataramn K, Levin SR, Singh BN. Circadian rithmicity of heart rate and QTc interval in diabetic autonomic neuropathy: implications for the machanism of sudden death. Am Heart J 1993; 125: 744-752 [ Links ]
15. Chassande B, Charpentier G, Budy I, Willer JC, Lille F. Sympathetic skin responses and variability of the RR interval: correlation with the severety stages of diabetic polyneuropathy. Rev Neurol (Paris)1996; 152: 623-9 [ Links ]
16. Murata K, Sumida Y, Murashima S, Matsumura K, Takeda H, Nakagawa T, Shima T. A novel methos for assessment of autonomic neuropathy in type 2 diabetic patients: a comparative evaluation of I123-MIBG myocardial scintigraphy and power spectral analysis of heart rate variability. Diabet Med 1996; 13: 266-272 [ Links ]
17. Tattersall, Robert. Diabetes : Clínica y Tratamiento. 1° Ed. Churchill, Livinstone. España. 1993. pp. 373 – 389 [ Links ]
18. Task force Task Force of the European Society of Cardiology and the North American Society of Pacing and Electrophysiology: Heart Rate Variability: Standard of Measurement, Physiological Interpretation and Clinical Use. Circulation 1996; 93:1043-1065) [ Links ]
19. Gutiérrez O. Variabilidad de la frecuencia cardíaca en individuos sanos costarricenses. Rev Costarr Cardiol 2000, 2:1-12 [ Links ]
20. Kamen PW, Tonkin AM. Application of the Poincaré plot to Heart Rate Variability: A New Measure of Functional Status in Heart Failure. Aust NZ J Med 1995; 25: 18-26 [ Links ]
21. Pagani M, Malfatto, G, Pierini S, Casati R, Masu AM, Poli M, Guzzetti S, Lombardi F, Cerutti S, Malliani A. Spectral analisys of heart rate variability in the assessment of autonomic diabetic neuropathy. J Auton Nerv Syst 1988; 23: 143-153 [ Links ]
22. Bellavere F, Balzani I, Da Msi G, et al. Power spectral analysis of heart rate variations improves assessment of diabetic cardiac autonomic neuropathy. Diabetes 1992; 41: 633 - 40. [ Links ]
23. Comi G, Sora MG, Bianchi A, Bontempi B, Gianoglio P, Cerutti S, Micossi P, Canal N. Spectral analysis of short-term heart rate variability in diabetic patients. J Auton Nerv Syst 1990; 30: Suppl S45-49 [ Links ]
24. Roithinger FX, Allinger S, Knoflach P, Punzengruber C, Pachinger O. Short-term frequency and time domain analysis of heart rate variability in type I diabetes subjects. Wien Klin Wochenschr 1996; 108:133-136 [ Links ]
25. Malpas SC, Maling TJ. Heart-rate variability and acardiac autonomic function in diabetes. Diabetes 1990; 39: 1177-1181 [ Links ]
26. Weston PJ, James MA, Panerai RB, McNally PG, Potter JF, Thurston H. Evidence of defective cardiovascular regulation in insulin-dependent diabetic patients without clinical autonomic disfunction. Diabetes Res Clin Pract 1998; 42:141-148 [ Links ]
27. Yamasaki Y, Ueda N, Kishimoto M, Tani A, Ishida Y, Kawamori R, Kamada T. Assessment of early stage autonomic nerve dysfunction in diabetic subjetcs-application of power spectral analysis of heart rate variability. Diabetes Res 1991; 17: 73-80 [ Links ]
28. Laederach-Hofmann k, Mussgay I; Winter A, Klinkenberg N, Ruddel H. Early dysfunction in patients with diabetes mellitus assessed by spectral analysis of heart rate and boold pressure variability. Clin Physiol 1999; 19: 97-106 [ Links ]
29. Weise F, Heydenreich F. A non-invasive approach to cardiac autonomic neuropathy in patients with diabetes mellitus. Clin Physiol 1990; 10:137-145 [ Links ]
30. Weise F, Heydenreich F. Age-related changes of heart rate power spectra in diabetic man during orthostasis. Diabetes Res Clin Pract 1991; 11: 23-32 [ Links ]
31. Ewing DJ, Neilson JM, Shapiro CM, Stewart JA; Reid W. Twenty four hour heart rate variability: effects of posture, sleep and time of day in healthy controls and comparision with bedside tests of autonomic function in diabetic patients. Br Heart J 1991; 65; 239-244 [ Links ]
32. Naliboff BD, Gilmore SL, Rosenthal MJ. Acute autonomic responses to postural change, valsalva maneuver and paced breathing in older type II diabetic man. J Am Geriatr Soc 1993; 41: 648-653 [ Links ]
33. Moriguchi A, Otsuka A, Kohara K, Mikami H, Ogihara T. Evaluation of orthostatic hypotension using power spectral analysis. Am J Hypertens 1993; 6: 198-203 [ Links ]
34. Burger AJ, Charlamb M, Weinrauch LA, D’Elia JA. Short- and long-term reproducibility of heart rate varibilityin patients with long-standing type I diabetes mellitus. Am J Cardiol 1997; 80: 1198-1202 [ Links ]
35. Mestivier D, Chan NP, Channudet X, Bauducean B, Larroque P. Realtionship between diabetic autonomis disfunction and heart rate variability assessed by recurrence plot. Am J Physiol 1997; 272:H1094-9 [ Links ]
36. Jeffe RS, Aoki TT, rohatsch PL, Disbrow EA, Fung DL. Predicting cardiac autonomic neuropathy in type I (insulin-dependent) diabetes mellitus. Clin Auton Res 1995; 5: 155-158 [ Links ]
37. Oida E, Kannagi T, Moritani T, Yamori Y. Diabetic alteration of cardiac vago-sympathetic modulation assessed with tone-entropy analysis. Acta Physiol Scand 1999; 165: 129-134 [ Links ]
38. Kamal A. Assessment of autonomic function using complex demodulation and posture entrainment techniques: an application to normal subjects and diabetic patients. Fornt Med Biol Eng 1996; 7: 1-10 [ Links ]
39. Tsuji H, Larson MG, Venditti FJ, Manders ES, Evans JC, Feldman CL, Levy D. Impact of reduced heart rate variability on risk for cardiac events. The Framingham Heart Study. Circulation 1996; 94: 2850-5 [ Links ]
40. Weston PJ, James MA; Panerai R, McNally PG, Potter JF, Thurston H, Swales JD. Abnormal baroreceptor-cardiac reflex sensitivity is not detected by conventional test of autonomic function in patients with insulin-dependent diabetes mellitus. Clin Sci 1996; 91: 59-64 [ Links ]
41. Veglio M, Borra M, Stevens LK, Fuller JH, Perin PC The EURODIAB IDDM Complication Study Group. The relation between QTc interval prolongation and diabetic complications. Diabetologia 1999; 42: 68-75 [ Links ]
42. Marchant B, Umachandran V, Stevenson R, Kopelman PG, Timmis AD. Silent myocardial ischemia: role of subclinical neuropathy in patients with and without diabetes. J Am Coll Cardiol 1993; 126: 108-114 [ Links ]
43. Rutter MK, McComb JM, Brady S, Marshall SM. Autonomic neuropathy in asymptomatic subjects with non- insulin-dependent diabetes mellitus and microalbuminuria. Clin Autonom Res 1998; 8: 251-257 [ Links ]
*Cátedra de Fsiología, Universidad de Iberoamérica,
**Servicio de Medicina Interna, Cátedra de Medicina, Hospital México, Universidad de Iberoamérica
Ap. Postal 847-1000 San José, Costa Rica
E-mail=unibecr@sol.racsa.co.cr














