Introducción
Aedes aegypti es el principal vector de los virus dengue (DENV), fiebre amarilla (YFV), chikungunya (CHIKV) y Zika (ZIKV) (1). Actualmente en Costa Rica circulan simultáneamente DENV, CHIKV y ZIKV, lo que representa un serio problema de salud pública (2). Dadas las masivas campañas de control basadas en el rociamiento de DDT que se efectuaron en la década de los años 50, Costa Rica fue declarada libre del mosquito en 1961 (3). Luego de varios reportes de reintroducciones en las décadas de siguientes, a inicios de la década de los años 90, el Ministerio de Salud reconoció la presencia Ae. aegypticon distribución a lo largo de todo el país (4). Así, en 1993, se presentaron los primeros casos de dengue, convirtiéndose en la principal enfermedad de transmisión vectorial en Costa Rica hasta la actualidad (4). Dada la inexistencia de tratamiento antiviral y la carencia de vacunas que eviten la propagación, el control vectorial es la única alternativa de control viable con la que cuentan los sistemas de salud para estas virosis. Aunque el control ambiental basado en la eliminación de criaderos tiene un mayor impacto sobre las poblaciones vectoriales en comparación con otros métodos, el control químico constituye una alternativa que se utiliza frecuentemente y es fundamental en situaciones de brote epidémico (1). Para el control del vector se han utilizado principalmente insecticidas de los siguientes tipos: organoclorados, los cuales actúan inhibiendo los canales de sodio y bloqueando la acción del ácido gamma-aminobutírico; organofosforados que funcionan como inhibidores de la acetilcolinesterasa; carbamatos, los cuales tienen el mismo mecanismo de acción que los organofosforados y finalmente los piretroides que actúan sobre la membrana plasmática de las neuronas provocando un retraso en el cierre de los canales de sodio voltaje dependientes (5). De los anteriores, los piretroides se consideran los insecticidas de elección debido al requerimiento de bajas dosis de aplicación, corta persistencia, escasa bioacumulación y poca toxicidad en mamíferos (5).
En Costa Rica, en la última década, se han empleado principalmente piretroides como la deltametrina y cipermetrina para el control de adultos, además del organofosforado temefós para el control larval (6). Estudios efectuados con cepas costarricenses de Ae. aegypti, han demostrado la ocurrencia de resistencia para algunos de estos insecticidas. Por ejemplo, Bisset y colaboradores demostraron resistencia a temefós y deltametrina en cepas de la y de la Región Pacífico Central (7). Asimismo, estudios más recientes, con cepas de la provincia de Limón, evidenciaron también resistencia a deltametrina y resistencia incipiente a cipermetrina (6,8).
El cantón de Orotina, en la Región Pacífico Central, constituye uno de los territorios que ha mostrado una gran incidencia de dengue, chikungunya y Zika (9,10,11). Por esta razón, el uso de insecticidas para el control del vector ha sido una práctica frecuente que podría haber condicionado la aparición resistencia en cepas locales de Ae. aegypti. De esta forma, el propósito del presente estudio es evaluar, en una cepa de Ae. aegyptide Orotina, la condición de resistencia a los insecticidas organofosforados malatión y temefós, y a los piretroides deltametrina, lambda cialotrina y cipermetrina, así como determinar los mecanismos de detoxificación enzimática correspondientes.
Métodos
Establecimiento de la colonia de Ae. aegypti
La cepa de Ae. aegyptise estableció a partir de larvas colectadas durante mayo de 2016 en el distrito central de Orotina. Estas se obtuvieron a partir de criaderos y fueron transportadas al Laboratorio de Investigación en Vectores (LIVE) para su identificación y separación. Las larvas correspondientes a Ae. aegyptise colocaron en bandejas plásticas con agua libre de cloro a las que se agregó periódicamente purina molida como alimento para dichas larvas. Las bandejas se colocaron en una cámara de mantenimiento de insectos (Darwin Chambers) a temperatura constante de 27,8 ± 0,8 °C, humedad relativa del 95% y fotoperiodo de 12 horas. En estas condiciones se logró el desarrollo y pupación de los mosquitos. Una vez que emergieron los mosquitos adultos (F0), estos se colocaron en la caja para mantenimiento de colonias de 30 x 30 x 30 cm. Adicionalmente se suministró sacarosa al 10%, una fuente de sangre, y un depósito con agua libre de cloro como sitio de ovipostura.
Se trabajaron dos colonias de Ae. aegypti. La cepa Orotina, cuyo proceso de establecimiento se describió anteriormente, fue la cepa de campo. Como cepa control de susceptibilidad se empleó la cepa Rockefeller procedente del Instituto Pedro Kourí ubicado en La Habana Cuba (6). Esta cepa de origen caribeño es susceptible a insecticidas y fue establecida durante los años 30 en Puerto Rico (7). Las formas inmaduras y los adultos se manejaron de la misma forma que la cepa Orotina.
Insecticidas y sinergistas
Para los bioensayos larvales se utilizaron los siguientes insecticidas:
Temefós: fosforotritionato de o, o, o, o´-tetrametil-o, o´-tio-di-p-fenileno (IUPAC), Chem Sevice. West Chester Pennsylvania, grado analítico, 98.1% de pureza; malatión: dietil mercaptosuccinato, éster con o, o- dimetil fosforoditioato (IUPAC), Cheminova, grado analítico, 99,4% de pureza; cipermetrina: (1RS)-cis, trans-3-(2,2-diclorovinil)-2,2-dimetilciclopropano carboxilato de (RS)-ciano-3-fenoxibencileno (IUPAC), Sigma Aldrich Laborchemikalien, grado técnico, 94,3% de pureza; deltametrina: (1R,3R)-3-(2,2-dibromovinil)-2,2-dimetilciclopropano carboxilato de (S)-ciano 3-fenoxibenzilo (IUPAC), Chem Sevice, West Chester Pennsylvania, grado analítico, 99,5% de pureza y lambda cialotrina: (RS)-α-cyano-3-fenoxibencil (1RS,3Rs)-3-(-cloro-3,3,3-trifluoroprop-1-enil)-2,2-dimetil ciclopropano carboxilato (IUPAC), Allister, grado técnico, 97,1% de pureza.
Para evidenciar los mecanismos de detoxificación en las condiciones de resistencia se emplearon los siguientes sinergistas:
Butóxido de piperonilo (BP): Chem Sevice, West Chester Pennsylvania, grado analítico, 98,2% de pureza; S,S,S tributilfosforotritionato (DEF): Chem Sevice, West Chester Pennsylvania, grado analítico, 97,5% de pureza y ácido etacrínico (AE): ácido 2-(2,3-dicloro-4-(2-metilideno-1oxibutil) fenoxi) acético, ABcam Biochemicals, grado analítico, 99,0% de pureza.
Bioensayos larvarios para la determinación de resistencia
Los bioensayos larvarios se efectuaron de acuerdo con la metodología establecida por la Organización Mundial de la Salud en 1981 (12). Brevemente, los estándares de insecticidas, contenidos en su empaque de fábrica se diluyeron en alcohol absoluto para tener soluciones concentradas de los mismos. A partir de las mismas se prepararon soluciones correspondientes a cinco concentraciones de prueba, utilizando agua libre de cloro como diluyente. Estas concentraciones provocaron entre un 2 y un 100 % de mortalidad en las larvas de Ae. aegyptique se evaluaron. Cada concentración de prueba se estableció diluyendo 1,0 ml del insecticida, en una concentración ajustada, en 249 mL de agua libre de cloro. Como control de viabilidad se sustituyó el insecticida por alcohol absoluto. Los ensayos fueron efectuados por quintuplicado.
Los experimentos se efectuaron en condiciones controladas (temperatura de 27,8 ± 0,8 °C, humedad relativa del 95% y fotoperiodo de 12 horas) (8). A las 24 horas se realizó la lectura en la cual se contabilizaron las larvas muertas o moribundas. Posteriormente se efectuó un análisis probit-log en que se calculó la concentración letal 50% (CL50) (6). El nivel de significancia que se utilizó como coeficiente de heterogeneidad fue de 0,05. Se empleó el programa SPSS v.11.5 para realizar dicho análisis (6).
Para cada insecticida se calculó un factor de resistencia 50% (FR50), que es una división de la CL50 de la cepa Orotina entre la CL50 de la cepa Rockefeller. De acuerdo con los criterios establecidos por Mazzari y Georghiou, cepas con factores de resistencia menores a 5 son consideradas no resistentes, con valores entre 5 y 10 muestran resistencia incipiente y con valores superiores a 10 se consideran con resistencia manifiesta (13).
Bioensayos para determinar mecanismos de detoxificación enzimática.
En casos de resistencia, larvas de la cepa de campo se sometieron al tratamiento previo de 4 horas con los sinergistas BP, el cual es inhibidor de enzimas monooxigenasas, DEF, que inhibe esterasas y AE que inhabilita el glutatión S-transferasa. Las concentraciones utilizadas fueron 0,008 mg/L para BP y 5 mg/L para DEF y AE (15). Posteriormente, se calculó la CL50 con cada uno de los sinergistas y el factor de sinergismo 50% (FS50), el cual relaciona la CL50 del insecticida calculada en el primer bioensayo larvario con la CL50 obtenida mediante la exposición previa de las larvas a cada sinergista, respectivamente (12).
Resultados
Los bioensayos larvarios determinaron que no existe resistencia a insecticidas organofosforados por parte de la cepa de Orotina. En cuanto a temefós, dicha cepa mostró una CL50 de 0,0669 mg/L, mientras que para la cepa Rockefeller fue de 0,0810 mg/L. De esta forma el FR50 calculado tuvo un valor de 0,82 (Cuadro 1). En el caso del malatión, la CL50 fue de 0,0105 mg/L para la cepa Orotina, mientras que para la Rockefeller fue de 0,0350 mg/L. El FR50 correspondiente fue 1,35 (Cuadro 1). En cuanto a los piretroides se observaron resultados variables. En el caso de deltametrina, su CL50 fue de 0,00418 mg/L, mientras que para la cepa Rockefeller fue de 0,00176 mg/L. El FR50 correspondiente fue 2,37 (Cuadro 1). Para lambda cialotrina, su CL50 fue de 0,02267 mg/L, en tanto que para la cepa Rockefeller fue de 0,01641 mg/L; de esta forma el FR50 fue 1,38 (Cuadro 1). Con respecto a la cipermetrina la cepa estudiada mostró una CL50 de 0,01103 mg/L y para la cepa Rockefeller su CL50 fue de 0,00207 mg/L; el FR50 correspondiente fue 5,32 (Cuadro 1).
Cuadro 1. CL50, FR50 y parámetros estadísticos, para los insecticidas evaluados en las cepas Rockefeller y Orotina.
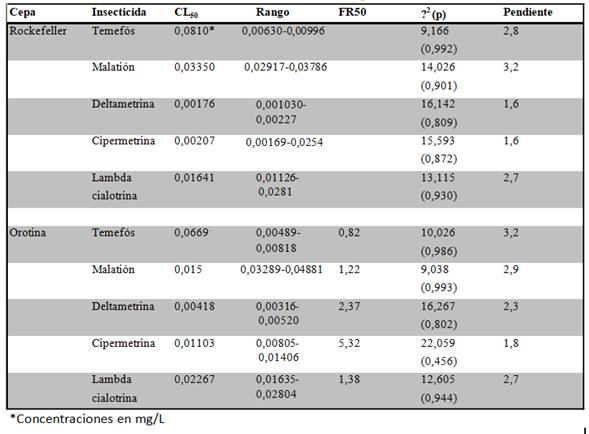
Lo anterior evidenció una resistencia incipiente a cipermetrina, por lo que se procedió a realizar la evaluación con los sinergistas para determinar los mecanismos de detoxificación enzimática relacionados con la resistencia que mostró la cepa Orotina. En el análisis de resistencia a cipermetrina mediante la utilización de sinergistas se observó que solo el BP logró revertir el estado de resistencia; el FS50 tuvo un valor de 10,92 (Cuadro 2).
Cuadro 2 CL50, FS50 y parámetros estadísticos, luego de la exposición previa a los sinergistas butóxido de piperonilo (BP), ácido etacrínico (AE) y S,S,S tributilfósforotritionato (DEF) en la cepa Orotina. Concentraciones expresadas en mg/L.
| Insecticida | Sinergista | CL50 | Rango | FS50 | X2 (p) | Pendiente |
| Cipermitrina | BP | 0,00101* | 0,00049- 0,00153 | 10,92 | 13.540 (0,699) | 2,0 |
| AE | 0,00308 | 0,00213- 0,00425 | 3,58 | 22,755 (0,416) | 1,6 | |
| DEF | 0,00338 | 0,00213- 0,00487 | 3,26 | 13,490 (0,919) | 1,6 | |
| *Concentraciones en mg/L | ||||||
Discusión
En el estudio efectuado se determinó que tanto para malatión como para temefós, los FR50 mostraron valores inferiores a 5. De acuerdo con los criterios de interpretación de resistencia propuestos por Mazzari y Georghiou (13), esta condición denota la ausencia de resistencia a estos insecticidas organofosforados. Actualmente los insecticidas piretroides son de elección para el control espacial de Ae. aegypti. Por esta razón, la exposición de las poblaciones de vectores a organofosforados se ve minimizada. La ausencia de resistencia a organofosoforados como malatión ha sido descrita en diversos países y regiones. Así se evidencia en los trabajos de Cáceres-Carrera en San José, Costa Rica (14). De igual forma, esta condición de susceptibilidad ha sido informada en países como Cuba, Venezuela, Jamaica, Nicaragua, Colombia y Panamá (14,15,16,17). En relación con temefós, que constituye el principal insecticida de acción larvicida contra el vector, se ha podido demostrar resistencia en países cercanos a Costa Rica como Cuba, Venezuela, El Salvador, Colombia, Panamá y Nicaragua (14,15,16,17). En el caso de Costa Rica, tanto la resistencia como la susceptibilidad a temefós han sido descritas en cepas locales de Ae. aegypti. En un estudio de Bisset y colaboradores se informó sobre situaciones de resistencia manifiesta a temefós en dos cepas, una procedente de la Región Huetar Caribe y otra de la Región Pacífico Central (7). En ese estudio se pudo observar que la resistencia mostrada al insecticida estuvo asociada a esterasas (7). Por su parte, Cáceres-Carrera pudo evidenciar resistencia a temefós en una cepa procedente de Barrio Escalante, en el Centro de San José (14). La condición de resistencia a temefós puede generarse por el uso repetido e indiscriminado de este insecticida. Asimismo, la aplicación de concentraciones subletales de los insecticidas, derivada de errores operativos, puede representar una presión selectiva que favorece la aparición de resistencia en las cepas locales (8). En estudios más recientes de Calderón-Arguedas y Troyo, no se encontró resistencia al temefós en cepas de Ae. aegyptide Guápiles, Guácimo, Siquirres y Limón, en la Región Huetar Caribe de Costa Rica, (6,8). Igualmente, estos investigadores evidenciaron susceptibilidad a temefós en cepas de Barranca, Quepos y Jacó en la Región Pacífico Central (datos no publicados). Estos hallazgos demuestran que la utilización de temefós sigue siendo eficiente para el control larval en las zonas estudiadas. Bisset y colaboradores determinaron que la formulación comercial de temefós que se usa en Costa Rica (BIOLARV G1), es efectiva sobre larvas de Ae. aegypticuando se aplica en una concentración inicial de 1 ppm (7). Aún con recambios diarios de agua, estos investigadores observaron un 100% de mortalidad en los días 11 y 12 post exposición (7). En ausencia de recambios, la capacidad larvicida del temefós se evidenció 22 a 24 días luego de la exposición (7). Esto indica que temefós podría seguir siendo una alternativa efectiva para el control larvario de Ae. aegyptien poblados de Costa Rica. No obstante, y como ha sido recomendado, es requerido evaluar cada cierto tiempo la efectividad biológica del insecticida en las dosis de trabajo para asegurar que no se haya desarrollado resistencia por parte del vector (18).
En relación con la evaluación de los insectidas piretroides, en el presente trabajo se observó susceptibilidad a deltametrina y lambda cialotrina, para los cuales los FR50 fueron de 1,35 y 1,37 respectivamente. La ausencia de resistencia a lambda cialotrina también ha sido observada en estudios efectuados con cepas de Panamá, Nicaragua, El Salvador y Cuba (14,15,16,17). Para Costa Rica, la lambda cialotrina solo ha sido evaluada por Cáceres-Carrera, quien no evidenció resistencia a dicho insecticida (14). Por otro lado, la resistencia a deltametrina ha sido reportada reiteradamente en cepas de Costa Rica. Bisset y colaboradores pudieron demostrar una FR50 de 59,25 en una cepa de la Región Pacífico Central. Al igual que con el temefós, la resistencia estuvo asociada con un incremento en la actividad de enzimas esterasas (7). En otro estudio, Calderón-Arguedas y Troyo demostraron la ocurrencia de resistencia a este insecticida en cepas de Siquirres y Cariari en la Región Huetar Caribe; en estos casos la resistencia estuvo asociada con el sistema citocromo P450 monooxigenasa (6,9). La evidencia de resistencia a deltametrina propició la sustitución, por parte del Ministerio de Salud, de este insecticida por cipermetrina, el cual es ampliamente usado en productos para el tratamiento espacial, formulaciones en aerosol de carácter doméstico y productos veterinarios.
Precisamente, la cipermetrina fue el único insecticida evaluado con la cepa de Ae. aegyptide Orotina para la cual se evidenció resistencia (FR50:5,32) En países como Cuba también se ha reportado resistencia a este insecticida, la cual se ha relacionado con su uso continuo (19). Cáceres-Carrera observó resistencia a cipermetrina en una cepa de San José, Costa Rica (14), en tanto que Calderón-Arguedas y Troyo evidenciaron resistencia incipiente a este insecticida en una cepa de Ae. aegyptiprocedente de Guácimo (6). También se evidenció resistencia en cepas de las localidades de Guápiles y Limón (8). Los estudios con sinergistas pudieron evidenciar que sólo el BP generó una reversión en el estado de resistencia lo que vincula, en parte, la resistencia con el sistema enzimático del citocromo P450 monooxigenasa. Estos resultados son esperables debido a que este sistema enzimático juega un papel fundamental en la detoxificación de piretroides por parte de mosquitos (20). Además, se ha visto que insectos resistentes tienen una transcripción incrementada de los genes CYP6B2 y CPYP9A4, vinculados a este sistema, los cuales codifican por enzimas que podrían estar relacionadas con la detoxificación del piretroide (21). Otro mecanismo que también podría estar involucrado con la resistencia a cipermetrina está dado por las mutaciones en los genes que codifican por las proteínas que conforman canales de sodio (resistencia por knockdown o kdr). Esas proteínas modificadas condicionan una baja sensibilidad al sitio de acción de los piretroides y organoclorados en el sistema nervioso de los artrópodos, perdiendo su efectividad biocida (20).
Como se deduce del presente trabajo, los estudios de resistencia deben efectuarse de forma periódica y sobre cepas puntuales. Posiblemente la capacidad de desplazamiento limitada que exhibe Ae. aegypti, aunada a las diferencias operativas en los tratamientos insecticidas, hacen que los perfiles de resistencia de las cepas sean diferentes de una localidad a otra. Por tal razón, los sistemas de salud deben incrementar esfuerzos para promover el control larval del vector basado en la eliminación de cridaderos y de esta forma reducir al mínimo la utilización de sustancias químicas que, aparte de ser contaminantes, promueven la generación de fenómenos de multiresistencia y resistencia cruzada a insecticidas.














