Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Acta Pediátrica Costarricense
Print version ISSN 1409-0090
Acta pediátr. costarric vol.15 n.1 San José Jan. 2001
Introducción
El refinamiento de las técnicas quirúrgicas y el mejoramiento en los dispositivos de derivación del LCR han aumentado la sobrevida y beneficiado la calidad de vida, de los infantes y niños con hidrocefalia. Actualmente la complicación más frecuente y discapacitante de estos procediminetos es la infección del LCR. Puede presentarse como ventriculitis, meningitis y compartimentalización del LCR (1-6). Otras complicaciones son el adelgazamiento cortical, el empiema subdural, y las convulsiones. La infección es la complicación que más se ha correlacionado con retraso mental y deterioro de la capacidad mental.
( 6 ).
La incidencia varía de acuerdo al tipo de derivación. En caso de derivación ventrículoperitoneal ( D-VP ) oscila entre 2 y 20 % dependiendo del centro hospitalario, en caso de derivación ventrículoatrial (D-VA) oscila entre 19 y 35 % (7-11). Muchos factores se han asociado con el aumento en el riesgo de infección. Los pacientes menores a 6 meses son los más propensos. Otros factores de riesgo son un tiempo operatorio de más de 60 minutos, procedimientos en los que participen más de 3 cirujanos, y pacientes con mielomeningocele que ameriten colocación de la derivación en los primeros 7 días de vida. En cuanto al tipo de procedimiento, los que más se asocian a infección son el reemplazo total, y la reinserción del sistema después de infección (7, 16-16).
Fisiopatología
Las bacterias responsables de la mayoría de las infecciones son en su mayoría comensales de piel y cuero cabelludo, de baja virulencia. Los gérmenes más frecuentemente implicados son los estafilocosos, principalmente los coagulasa.-negativa ya que producen "slime"(baba) o glycocalix, en el 70 % de los casos. En los folículos pilosos también se anidan los Streptococcos sp, los Corynebacterium sp, las propionobacterias, los enterococos, y en ocasiones los bacilos conformes Gram-negativos.
Estos gérmenes ganan acceso a la válvula y al LCR generalmente durante la cirugía, en menor proporción, la migración de los gérmenes a la válvula y al LCR ocurre a partir de la herida quirúrgica durante el período postoperatorio. Otra forma de
infección en los que tienen D-VP es por migración de la punta del catéter distal a una víscera hueca, generalmente colon, en estos casos, se produce una infección retrógrada por gérmenes propios del intestino grueso como los bacilos conformes Gramnegativos, los enterococos, los anaerobios y los hongos tipo Candida sp.
En pacientes con D-VA puede haber siembra retrógrada de la punta del catéter dista[ ubicada en aurícula derecha, durante episodios de bacteremia o septicemia (17-23 ).
Presentación clínica
La presentación clínica de las infecciones del LCR en pacientes con derivaciones del mismo, dependerá del tipo de derivación, del agente ofensor y de la edad del paciente. El tiempo de inicio de la sintomatología varía de acuerdo al tamaño del inóculo y del tipo del patógeno. Los bacilos conformes Gram-negativos son más virulentos y causan enfermedad abrumadora. Las infecciones causadas por S aureus a menudo se presentan con infección de la herida quirúrgica o formación de absceso cutáneo o subcutáneo Los estafilococos coagulasa negativa generalmente se presentan en una forma menos virulenta y más insidiosa e indolente (7, 24-29).
El tiempo de inicio de la infección después del procedimiento quirúrgico se ha asociado con el tipo de microorganismo involucrado. Los pacientes infectados por S aureus generalmente tienen un inicio temprano (primeros 15 días postquirúrgicos) ( 7, 16, 27), mientras que aquellos infectados por estafilococos coagulasa negativa tienen inicio tardío (más de 15 días)
En los pacientes con D-VA se distinguen tres formas de presentación de la infección :1. La sepsis aguda:, se presenta en los 2 a 7 días siguientes a la cirugía y se asocia a infección de la herida quirúrgica. Existe disfunción valvular, el paciente generalmente se encuentra febril, tóxico, con anemia, con leucocitosis y desviación a la izquierda. El hemocultivo es positivo en el 50 a 70% de los casos y el cultivo del LCR es positivo en el 30 % de los casos. El LCR generalmente presenta pleocitosis con predominio de segmentados, hipoglucorraquia y proteínas elevadas. 2. La sepsis subaguda:, generalmente se presenta de días a meses después de la cirugía. El paciente tiene un proceso clínico indolente, la fiebre no es alta o puede estar ausente. En el 30-40 % de los casos hay disfunción valvular. El hemocultivo es positivo en el 10 % de los casos y el cultivo del LCR en el 50 %. Las alteraciones del LCR no son llamativas. 3. La infección inaparente o subiclínica:, ocurre de meses a años después de la cirugía. El LCR es normal y el diagnóstico generalmente se hace en forma accidental al cultivar el sistema después de su retiro por disfunción, o porque ya no sea necesaria su permanencia (30-34).
En pacientes con D-VP la infección se divide en temprana si se presenta en los primeros 15 días postoperatorios y en tardía si ocurres después. Los síntomas y signos son generalmente vagos e insidiosos. Hay fiebre, disfunción valvular en el 80-100 % de los casos. Hay vómito, nausea e irritabilidad en el 20-30 %. Los signos meníngeos no son un hallazgo constante y se presentan en una quinta parte de los casos. Otra quinta parte de los pacientes va a presentar apnea y convulsiones y en el 5 % de los casos va a haber infección de la herida quirúrgica o infección del túnel, que consiste en eritema, inflamación y/ o supuración de la piel sobre el recorrido del catéter distal o proximal. Otra presentación clínica en el paciente con D-VP es la peritonitis. Esta puede ser dada por cocos Gram-positivos tipo estafilococos , por siembra al peritoneo y acción de sus toxinas sobre el mismo. Esta modalidad de infección puede ocurrir de semanas a meses después de la cirugía y las manifestaciones son enteramente abdominales, generalmente sin compromiso neurológico . En estos casos, la punta del catéter distal se puede visualizar libre en la cavidad peritoneal y generalmente no hay formación de pseudoquiste ni perforación de víscera hueca.
La peritonitis secundaria a perforación de víscera hueca se puede presentar de semanas a meses post-cirugía. El paciente luce febril, tóxico, con gran distensión y dolor abdominal. Hay signos meníngeos y el LCR muestra gran pleocitosis, elevación de las proteínas y glucosa baja. La mortalidad en estos casos es del 10 al 20 % y el daño permanente al SNC se va a presentar en el 30 % de los sobrevivientes. La infección generalmente es dada por bacilos conformes Gram-negativos entéricos y en el 12-21 % de los casos la flora es mixta. La infección del LCR por bacilos conformes Gram-negativos entéricos también puede tener como foco de partida el tracto urinario en pacientes con derivaciones ventrículo-ureterales o lumbo-ureterales ( 7, 16, 22, 27-29, 35-39) .
La meningitis de origen hematógeno en un paciente con derivación del líquido cefalorraquídeo tiene un curso similar a la de los pacientes sin derivación. Los gérmenes más frecuentemente implicados son los mismos por edad que los de los pacientes sin derivaciones. La gran mayoría de los pacientes va a responder a tratamiento conservador con antibióticos dirigidos, de acuerdo al agente etiológico, sin necesidad alguna de cirgufa. Generalmente no hay disfunción valvular y en la mayoría de los pacientes habrá signos menfngeos. En estos casos el LCR va lvular generalmente presenta las mismas características que el líquido lumbar, a diferencia de los pacientes con infección relacionada al sistema de derivación , en los que el LCR valvular o ventricular es anormal y el del espacio lumbar generalmente es normal ( 7-27 , 40-41).
Hallazgos del LCR
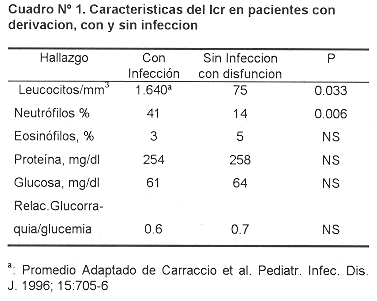
El parámetro más útil para diferenciar entre infección y disfunción valvular es el recuento de leucocitos que generalmente es superior a 100 / mm 3 en casos de infección; el porcentage de neutrófilos superior al 15 es el otro parámetro útil. Los recuentos más altos de leucocitos en el LCR se han observado en pacientes con infecciones por bacilos conformes Gram-negativos El promedio de formas segmentadas usualmente es de 63% (rango de 20-100%). La concentracioón promedio de proteina es de 136 mg/dl (rango, 40-375 mg/dl). Los pacientes con hidrocefalia hipertensiva pueden presentar en el LCR leucocitosis y elevación de las proteínas en ausencia de infección. No se ha visto que la concentración de proteina sea de utilidad. Se ha encontrado que la hipoglucorraquia se presenta tanto en infección como en disfunción , por lo que su valor no es de mayor utilidad para diferenciar entre infección y disfunción sin infección ( 7, 16, 24, 42-46 ). La eosinofilia tampoco ha sido de ayuda para diferenciar entre infección y disfunción. El porcentage de eosinófilos puede estar aumentado en ambos casas. Se ha observado que la eosinofilia puede ser secundaria al efecto de la gentamicina intraventricular y al efecto del óxido de etileno que se utiliza para esterilizar el material del "shunt" ( 47 ). Cuadro n° 1.
Bacteriología: La bacteriología del las infecciones del LCR en pacientes con derivaciones del mismo, refleja la flora normal de la piel y del cuero cabelludo del huésped. En una serie de 297 pacientes seguidos por 7 años, el 75 % de los episodios infecciosos fueron causados por estafilococos coagulasa negativa y S. aureus (7). Entre los estafilococos predominan los estafilococos coagulasa negativa y se ha visto que de los que producen infección el 70 % son productores de glicocalix. El 19-22 % de los episodios infecciosos son causados por infecciones por bacilos conformes Gram-negativos que se aislan en cultivo puro o mixto, sobre todo en casos de perforación de víscera hueca por la punta del catéter distal. Otros organismos misceláneas tales como enterococos, Bacillus sp, Estreptococos viridans y difteroides pueden coexistir con anaerobios y con bacilos conformes en el 14 % de los pacientes con DVP que presentan infección del LCR (17-23).
Diagnóstico
Ante la sospecha clínica de una infección del LCR en un paciente con derivación, se debe de llegar a un diagnóstico microbiológico específico por medio de la tinción de Gram y el cultivo del LCR obtenido del reservorio y de cualquier área con purulencia. Además, se debe tomar un hemocultivo, principalmente en pacientes con D-VA. La obtención del LCR debe ser realizada por un neurocirujano o por una persona familiarizada con el procedimiento. Una punción del reservorio o una muestra del LCR a través del drenaje ventricular externo es esencial para establecer el diagnóstico de infección. En el paciente febril, pero con pocas probabilidades de tener infección asociada a la derivación, se deben buscar otros focos, sobre todo el tracto urinario, y evitar así punciones innecesarias del reservorio y el contaminar la derivación en el paciente bacterémico.
Debe afeitarse el cuero cabelludo sobre el reservorio, lavar por tres minutos con clorhexidina y hacer la punción con una aguja N° 21, a la que idealmente se le debe adaptar un raquimanómetro para medir la presión de apertura y de cierre. En casos de drenaje ventricular externo se debe dejar gotear la muestra en lugar de aspirar para no arrastrar detritos Si sólo un mililitro o menos es obtenido, se debe reservrar la muestra para frotis, tinción de Gram y cultivo y dejar de lado la bioquímica. Se debe solicitar que se incube la muestra del LCR por un mínimo de 10 días.
A todos los pacientes con D-VP. con sitomatología abdominal se les debe hacer una radiografía simple de abdomen para ubicar la punta del catéter distal y un ultrasonido de abdomen para evidenciar cualquier colección que pudiera haber. En caso de D-VA, se debe hacer un ecocardiograma buscando vegetaciones.
Manejo
Una vez definida la infección por criterios clínicos y microbiológicos se debe de iniciar el tratamiento antibiótico y decidir el tipo de manejo neuroquirúrgico que se le dará al paciente.
Quirúrgico: El más agresivo es el retiro total o parcial del sistema con colocación de drenaje ventricular externo o exteriorización del sistema a un sistema cerrado y una vez esterilizado el LCR, hacer un reemplazo. Se ha asociado a un 94 % de cura en una serie de estudios revisados ( 7, 8, 22, 37, 49-54 ). La segunda modalidad es el reemplazo inmediato en el lado contralateral. Se ha asociado a un 71 % de curación en el 85 % de los estudios revisados ( 22, 48-49, 51-53, 55 ). La desventaja de esta modalidad es que si aún hay bacterias circulantes en el LCR, éstas colonizarán el sistema y posteriormente causarán una recaida. Estas dos modalidades están indicadas en caso de infección de la herida quirúrgica, en caso de exposición del sistema en cualquiera de sus partes, en caso de infección del túnel, en caso de infección por bacilos conformes Gram-negativos, en caso de hongos, de Bacillus sp, en caso de peritonitis con o sin perforación de víscera hueca, y en caso de pacientes con D-VA.
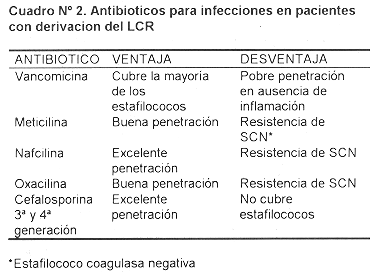
Antibiótico: El tratamiento antibiótico se debe instituir apenas se tome la muestra de LCR. Existen varias opciones terapéuticas dependiendo de su actividad contra los gérmenes más frecuentemente implicados y de su penetración al sistema nervioso central. Cuadro N° 2.
La vancomicina tiene la ventaja de cubrir la gran mayoría de los estáfilococos. El inconveniente es su pobre difusión a través de la barrrera hematoencefálica con poca reacción inflamatoria, como es el caso en este tipo de infecciones (56-58). Las penicilinas antiestafilocócicas, sobre todo la nafcilina penetran bien la barrera hematoencefálica, pero tienen el inconveniente de que del 60 al 80 % de los estafilococos coagulana negativa, y el 13 al 25 % de los S aureus son resistentes. Las cefalosporinas de tercera y cuarta generación tienen buena penetración, pero no son drogas adecuadas para infecciones por estafilococos; se reservan para infecciones por bacilos conformes Gram-negativos al igual que los aminoglucósidos. En caso de infección por estos gérmenes es preferible utilizar las cefalosporinas por el riesgo de nefrotoxicidad que aumenta significativamente a partir del 7° día con aminoglucósidos; se sabe que la duración del tratamiento en estos casos rara vez es inferior a los 21 días.
En términos generales, la terapia empírica inicial recomendada es una penicilina antiestafilocócica y ceftazidima para cubrir tanto estafilococos como bacilos coliformes Gram-negativos entéricos y no entéricos. Esto, si el paciente no luce séptico y no está críticamente enfermo. Si lo estuviera, es preferible inicir la cobertura contra cocos Gram-positivcos con vancomicina y una vez determinada la susceptibilidad del estafilococo, substituir la vancomicina por una penicilina antiestafilocócica tipo oxacilina, meticilina o nafcilina. En caso de infección por estafilococos, algunos expertos recomiendan la adición de rifampicina por su efecto sinergista con la vancomicina y las penicilinas antiestafilocócicas. La duración recomendada para infección por estáfilococos es de 15 días a partir del primer LCR estéril y de 17 a 21 días para bacilos conformes Gram-negativos.
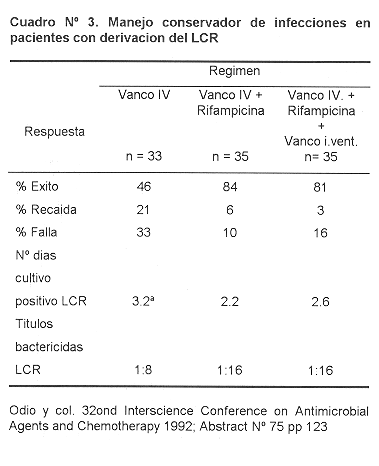
La administración concomitante de antibióticos instilados en el ventriculo a través del reservorio o de un cateter con ventriculostomía, no está indicada rutinariamente. Esta medida debe reservarse para casos intratables con terapia intravenosa, cuando los cultivos de LCR persisten positivos más allá de 7 días de tratamiento. Se han utilizado la vancomicina, la gentamicina, la amikacina, la cefazolina, y la cefalotina (16). Con las nuevas cefalosporinas, la experiencia es limitada. Esta modalidad tiene la ventaja de que se alcanzan concentraciones muy altas del fármaco en el ventriculo. La principal desventaja es su neurotoxicidad, dada generalmente por el preservante del antibiótico. Existe disparidad de opiniones con respecto a la dosis ideal, además, el tratamiento se dificulta por la necesidad de estar monitorizando la concentración de la droga en el LCR ventricular. Un estudio llevado a cabo en el Hospital Nacional de Niños con infección por estafilococos, sin infección de tejidos blandos, sin exposición del sistema y sin peritonitis, comparó vancomicina intravenosa, versus vancomicina intravenosa más rifampicina oral, verus vancomicina intravenosa más rifampicina oral, más vancomicina intrarreservorio, sin retirar el sistema ( 59). El porcentaje de éxito en los que recibieron terapia combinada fue de 84 y 81 sin que hubiera diferencia estadísticamente significativa. En los que recibieron vancomicina sola fue sólo de 46 (p< 0.05). El número de días con cultivo positivo del LCR fue menor en los que recibieron terapia combinada y los títulos bactericidas en el LCR fueron mayores.,Cuadro. N° 3.
Prevención
Profilaxis antibiótica: Existen muchos estudios encaminados a determinar si el uso profiláctico de antibióticos, administrados perioperativamente disminuye la incidencia de las infecciones. Las drogas más utilizadas han sido el Trimetroprim/Sulfametoxazole, la nafcilina, la oxacilina, la meticilina y la vancomicina. El TMP/SMX tiene excelente penetración al LCR aún en ausencia de inflamación . La desventaja es la alta resistencia de los estafilococos coagulasa.-negativa, tal y como lo demostró el estudio de Wang y col (60) . La nafcilina es la penicilina antiestafilocócica que mejor difunde al SNC en ausencia de inflamación meníngea. Con esta droga, al igual que con todas la penicilinas antiestafilocácicas, el inconveniente es la alta resistencia reportada de los estafilococos coagulasa- negativa (60-70 %) y de los S aureus (15-30 % ). La vancomicina es activa contra la mayoría de los estafilococos pero tiene el inconveniente de penetrar pobremente a través de meninges no inflamadas y de presentar interacciones con los anestésicos ( 61). En el metaanálisis de Langley y colaboradores ( 62), se analizaron 12 estudios prospectivos utilizando diferentes modalidades de beta-lactámicos; TMPISMZ y vancomicina. El de vancornicina hubo de suspenderse por la alta incidencia de efectos adversos asociados a su administración incluyendo un caso de shock anafilactoide ( 59, 63-66,60, 68-71 ). En cada uno de los estudios analizados el riesgo relativo promedio de infección estuvo por debajo de uno, sugiriendo beneficio del uso profiláctico de antibióticos. El estudio en el que se obtuvieron mejores resultados fue el de Ram Yoguev ( 65 ) quien utilizó nafcilina sola, o nafcilina más rifampicina versus placebo. Hubo un número significativamente menor de infecciones tempranas en el grupo de antibiáticos versus placebo; el efecto protector se limitó a la prevención de la infección temprana, no previno la tardía.
Enfoque de equipo: El enfoque holístico del equipo para la prevención de las infecciones asociadas a dervaciones del LCR es el que mejores resultados ha obtenido. Este incluye una evaluación cuidadosa de la integridad de la piel y del cuero cabelludo, que incluye no afeitar ni colocar vías en las áreas sobre o bajo las cuales se vaya a hacer el procedimineto quirúrgico. El paciente idealmente debe programarse a primera hora de la mañana, deben de operarse de primero los neonatos. Se recomienda no colocar derivaciones a más de 4 pacientes en un día, que la cirugía no se prolongue más allá de 20 minutos, y que no haya más de 4 personas en la sala de operaciones. El material de la derivación debe abrirse inmediatamente antes de su colocación, la permeabilidad de la válvula no se debe probar antes de su colocación. Se recomienda no practicar más de dos incisiones en la piel. Se deben manejar todos los materiales de la derivación con instrumentos. La tasa de infección se ha visto reducida cuando se utilizan derivaciones impregnadas de antibióticos. ( 72 ).
En resumen, la medida más importante en la prevención de estas infecciones es la adherencia estricta a la técnica aséptica tanto antes, como durante y después del acto quirúrgico.
Conclusiones
Se debe sospechar una infección asociada a una derivación del LCR en niños con cirugía previa, que se presenten con fiebre, alteraciones neurológicas, irritabilidad y/o evidencia de disfunción de la derivación. El análisis y el cultivo del LCR del reservorio son esenciales para el diagnóstico. La terapia antibiótico empírica debe incluír una penicilina antiestafilocócia y una cefalosporina de tercera o cuarta generación que tenga actividad contra P aeruginosa. Si el germen aislado fuera un bacilo conforme Gram-negativo u hongo, o hubiera infección de túnel o exposición del sistema, éste deberá ser retirado con colocación de drenaje ventricular externo. La profilaxis con nafcilina, o naficilina más rifampicina 6 ( nafcilina ) o 12 ( rifampicina ) horas antes de la cirugía puede reducir la incidencia de la infección temprana. La técnica aséptica estricta antes, durante y después del procedimiento quirúrgico y el manejo en equipo de estos pacientes son los métodos más importantes para prevenir las infecciones.
Bibliografía
2. Gardner P, Leipzig TJ, Sadigh M. lnfections of mechanical cerebrospinal fluid shuts. Curr Clin Top lnfect Dis, 1988;19:185-214. [ Links ]
3. Schoembaum SC, Gardner P, Shillito J. Infections of cerebrospinal fluid shunts epidemiology, clinical manifestations and therapy. J lnfect Dis, 1975;131:543-52 [ Links ]
4. Walters BC, Hoffman HJ, Hendrick EB, Humphreys RP. Cerebrospinal fluid shunt infection. lnfluences on management and subsequest outcome, Neurosurg, 1984; 60:1014-21. [ Links ]
5. Chadduck W, Adametz J. Incidence of seizures in patients with myelomeningocele: a mustifactorial analysis. Surg Neurol, 1988; 30:281-5. [ Links ]
6. McLone DG, Gzyewski D, Raimondi J, Sommers RC. Central Nervous system infections as a limiting factor in the intelligence of children with myelomeningocele. Pediatrics, 1982;70:338-42. [ Links ]
7. Odio C, GH McCracken , Jr,. and JD Nelson CSF shunt infections in pediatrics . A seven year experience. Am J Dis Child, 1984; 138:1103-08. [ Links ]
8. James HE, JW Walsh, HD Wiison, JD Connor, . Management of cerebrospinal fluid shunt infections: a clinical experience. Monogr. Neurol Sci .1984; 8:75-7 [ Links ]
9. Mates S, J Glaser and K Shapiro. Treatment of cerebrospinal fluid shunt infections with medical therapy alone. Neurosurgery, 1982; 11:781-83. [ Links ]
10. Choux M, L Genitori, D Lang, and G Lena. Shunt implantation: reducing the incidence of shunt infection. J Neurosurgery, 1992; 77:875-80. [ Links ]
11. Erashin Y, DG McLone BBStorrs and R Yoguev, Review of 3,017 procedures for the managemente of hydrocephalus in children. Concepts Pediatr Neurosurg,1986; 9:21-8. [ Links ]
12. Renier D, J Lacombe, A Pierre-kahn , C Sainte-Rose, and JF Hirsch. 1984. Factors causing acute shunt infection-computer analysis of 1, 174 operations. J Neurosurg,1984; 61:1072-1078. [ Links ]
13. Yogev R. 1985. Cerebrospinal fluid shunt infection. : a personal view, Pediatr lnfect Dis J, 1985; 4:113-18. [ Links ]
14. Schimke RT, Ph Black, VH Marck, and MN Swartz. 1961. lndolent Staphylococcus albus or aureus bacteremia after ventriculoantriostomy: role of foreign body in its initiation and perpetuation. N Engl J Med, 1961;264:264-70. [ Links ]
15. James HE. 1984. lnfections associated with cerebrospinal fluid prosthetic devices, P.23-41. In B Sugsarman and E J. Young (ed) lnfections associated with Prosthetic Devices, CRC Press, lnc, Boca Raton Fla [ Links ]
16. George R, L Leibrock and M Epstein. 1979. Long-term analysis of cerebrospinal fluid shunt infections: a 25 years experience. J Neurosurg, 1 979; 51:804-11. [ Links ]
17. Bisno AL, and Sternau L. Infections of Central Nervous System Shunts. In: Infections with Indwelling Medical Devices, 2ond ed , Edited by Alan L Bisno and Francis A Waldvogel . 1994 pp 91-109. [ Links ]
18. Ammirati M, and AJ Raimongi 1987. Cerebrospinal fluid shunt infections in children. Child's Nerv Syst, 1987; 3:106-1 09. [ Links ]
19. Caliaghan RP, SJ Cohen and GT Stewart 1961. Septicemia due to colonization of Spitz-Holter valves by staphylococci: five cases treated with methicillin. Br Med J , 1961; 5229:860-63. [ Links ]
20. Diaz-Mitoma F, GK Hardin, DJ Hoban, RS Roberts, and DE Low. 1987. Clinical significance of a test for slime production in ventriculoperitoneal shunt infections caused by coagulase-negatvie staphylococci. J lnfect Dis, 1987; 156:555-560. [ Links ]
21. 20 Ignelzi r, and WM Kirsch.1975. Follow-up analysis of ventriculoperitoneal and ventriculoatrial shunts fro hydrocephalus. J Neurosurg, 1975; 42:679-82. [ Links ]
22. Parry SW, JF Schuhmacker and RC Liewellyn. 1975. Abdominal pseudocysts and ascitis formation after ventriculoperitoneal shunt procedures. Report of four cases. J Neurosurg, 1975; 43:476-80. [ Links ]
23. Sells CJ, DB Shurtleff, and JD Loeser. 1977. Gram-negqative cerebrospinal fluid shunt-associated infections. Pediatrics, 1977; 59:614-18. [ Links ]
24. Shapiro S, J Boaz, M Kleiman J, Kaisbeck, and J Mealey. 1988. Origin of organisms infecting ventricular shunts. Neurosurgery, 1988; 22:868-72. [ Links ]
25. Ronan A, Geoffrey G, Hogg and Geoffrey L. Klug. 1995. Cerebrospinal fluid shunt infections in children. Pediatr lnfect Dis J, 1995; 14:782-6.
26. SelLs Cj, Shurtleff DB, and Loesser JD. Gramnegative cerebrospinal fluid shunt associated infections . Pediatrics, 1977; 50:614-8. [ Links ]
27. Christensen GD, Baddour LM, Hasty DL, Lowrance JH, Simpson WA. Microbial and foreign body factros in the pathogenesis of medical device infentions, In Bisno Al, Waldvogel FA, eds. Infections associated with indweiling medical devices. Washington DC, American Society for Microbiology, 1989:27-59. [ Links ]
28. Odio CM. lnfections associated with cerebrospinal fluid shunt catheters. In Donowitz L (ed): Hospital Acquired lnfection in the Pediatric Patient. Williams and Wiikins 1988; 99:103-108. [ Links ]
29. Hubschmann OR, Countee RW: Acute abdomen in children with infected ventriculoperitoneal shunts. Arch Surg, 1980; 115:305-7 [ Links ]
30. Hubschmann OR, Countee RW, Loeser JD: Gram-negative cerebrosppinal fluid shunt associated infections. Pediatrics, 1980; 59:6141 8. [ Links ]
31. Anderson FM: Ventriculocardic shunts. ldentification and control of practical problems in 143 cases. 1973,J Pediatr, 1973; 82: 222-27. [ Links ]
32. Holt RJ. Bacteriologic studies on colonized ventriculcatrial shunts. Dev. Med Child Neurol, 1970 ; 22 (Suppl):83-7. [ Links ]
33. Fokes EC, Jr. Occult infections of ventriculoatrial shunts, J Neurosurg, 1970 33:517-23. [ Links ]
34. Bruce AM, Lorber JH, Shedden WIH, Zachary RB. Persistent bacteremia following ventriculocaval shunt operations for hydrocephaius in infanta. Dev Med Child Neurol, 1963; 5:461-70 [ Links ]
35. Naito H, Toya S, Shizawa H, lizaka Y, Tsukumo D. High incidence of acuto postoperative meningitis and septicemia in patients undergoing craniotomy with ventriculoatrial shunt. Surg Gynecol Obstet, 1973; 137:810-12. [ Links ]
36. Rekate H L, Yonas H, White RJ, Nulsen FE. The acute abdomen in patients with ventriculoperitoneal shunts. Surg Neurol, 1979; 11:442-45. [ Links ]
37. Sekhar LN, Moosy J, Guthkelch AN, Malfunctioning ventriculoperitoneal shunts. Clinical and pathological features. J Neurosurg, 1979; 45:311-14. [ Links ]
38. Forwird K--r, Fewer HD and Stiver HG, Cerebrospinal fluid shunt infections: a review of 35 infections in 32 patients. J Neurosurg, 1983; 59:389-94. [ Links ]
39. Kaufman B A, and McLone DG. 1991 lnfections of cerebrospinal fluid shunt P. 561-585. In WM Scheid, RJ Whitley and DT Durack (ed). lnfections of the Central Nervous System Raven Press, Nrw York. [ Links ]
40. Maayhall CG, Archer NH, Lamb VA, Spadora AC, Baggett JW, Ward JD, and Narayan RK. Ventriculostomy-related infections. A prospective epidemiologic study. N Engl J Med, 1984; 310:553-59. [ Links ]
41. Hellbusch LC, Penn RG. Cerebrospinal fluid shunt infections by unencapsulated Haemophilus influenzae. Childs Nerv Syst, 1989; 5:315-7. [ Links ]
42. Renneis MS, Wald ER. Treatment of Haemophilus influenzae type b meningitis in children with cerebrospinal fluid shunts. J Pediatr; 1980; 97:424-6. [ Links ]
43. Carraccio CL, schwartz ML, Biotny KJ and Fisher MC. Ventricular fluid pleocytosis in children with ventriculoperitoneal shunts. 1996, Pediatr Infect Dis J, 1 996-1 1 5:705-6. [ Links ]
44. Vinchon M, Vallee L, Prin L, Desreumaux P, Dhellemmes P. Cerebrospinal fluid eosinophilia in shunt infections. 1992; Neuropediatrics, 19921 23:235-40. [ Links ]
45. Kjeidsberg CR, Krieg AS. Cerebrospinal fluid cell counts. In: Henry JB, ed. Clinical diagnosis and management by laboratory methods Philadelphia: Saunders, 1979;457-67. [ Links ]
46. Kontopoulos E, Minns RA, O'Hare AE, Eden OB. Sedimentation cytomorphology of the CSF in ventriculitis. 1986. Dev Med Child Neurol, 1986; 28:213-9. [ Links ]
47. Mine S, Sato A, Yamaura A, Tamachi S, Makino H, Tomioka H. Eosinophilia of the cerebrospinal fluid in a case of shunt infection: case report. Neurosurery, 1986; 19:835-6. [ Links ]
48. Pittman T, Williams D, Rathore M, Knutsen AP, Mueller KR. The role of ethylene oxide allergy in sterile shunt malfunctions. Br J Neurosurg, 1994; 8:41-5. [ Links ]
49. Salmon JH,. Adult hydrocephalus: evaluation of shunt therapy in 80 patients. 1972, J Neurosurg, 1972; 37:423-28. [ Links ]
50. Jame HE, Walsh JW, Wiison HD, Connor JD. Management of cerebrospinal fluid shunt infections: aclinical experience. Monogr Neural Sci , 19821 8:75-7. [ Links ]
51. Venes JL. Control of shunt infections: report of 150 consecutive cases. J Neurosurg, 1976; 45:311-14. [ Links ]
52. Shurtleff DB, Foltz EL, Weeks RD, and Loeser J. Therapy of Staphylococcus epidermidis infections associated with cerebrospinal fluid shunts. 1974, Pediatrics, 1974; 53:55-62. [ Links ]
53. Morrice J Jr., and Young DG. Bacterial colonization of Holter valves: a ten year survey. Dev Med Child Neurol , 1974; 16(Suppl 32 ):85-90. [ Links ]
54. Walters BC, Hoffman CH, Hendrick EB, Humphreys RP. Cerebrospinal fluid shunt infection. lnfluences on initial management and subsequent outcome. 1984, J Neurosurg, 1984; 60:1014-21. [ Links ]
55. Younger JJ, Christensen GD, Bartley DL, Simmons JC, and Barrett F. Coagulase-negative staphylococci isolated from cerebrospinal fluid shunts: importance of slime production, species identification, and shunt removal to clinical outcome. 1987, J lnfect Dis, 1987; 156:548-54. [ Links ]
56. Nicholas JL, Kamal ¡M, and Eckestein HB. Immediate shunt replacement in the treatment of bacterial colonization of Holtel valves.1970. Dev Med Child Neurol, 1970; 12(Suppl 22):110-13.
57. Congeni BL, Tan J, Salstrom SJ, Weinstein Li. Kinetics of vancomycin after intraventricular and intravenous admnistration. Pediatr Res, 1979; 13:459-62. [ Links ]
58. McGee SM, Kaplan SL, Mason EO. Ventricular fluid concentrations of vancomycin in children after intravenous and intraventricular admnistration. Pediatr lnfect Dis J1990; 9:138-9. [ Links ]
59. Bayston R, Hart CA, Barnicoat M. lntraventricular vancomycin in the treatment of ventriculitis associated with cerebrospinal fluid shunting and drainage. J Neurol,1987; 50:141923. [ Links ]
60. Odio CM, Salas JL, Herrera ML, , and McCracken GH. Treatment of CSF shunt infections. (Abstract N° 75), In: Program and
Abstracts of the 32ond Interscience Conference on Antimicrobial Agents and Chemotherapy. Anneheim, California. 1992.
61. Wang EEL, Prober CG, Hendrick BE, Hoffman HJ, Humphreys RP. Prophylactic sulfamethoxazole and trimethroprim in ventriculoperitoneal shunt surgery. A doubleblind, randomized, placebo-controlled trial JAMA, 1984;251:174-7. [ Links ]
62. Odio CM, Mohs E, Skiar F, Neison JD, McCracken GH Jr.. Adverse reactions to vancomycin used as prophylaxis for CSF shunt procederes. 1984. Am J Dis Child , 1984; 138:17-9. [ Links ]
63. Langley JM, LeBlanc JC, Drake J, and Milner R. Efficacy of antimicrobial prophylaxis in placement of cerebrospinal fluid shunts: MetaAnalysis. 1993. Clin lnfect Dis, 1993; 17:98-103. [ Links ]
64. Bayston R. Antibiotic prophylaxis in shunt surgery. 1975. Dev Med Child Neurol Suppl, 1975; 35:99-103. [ Links ]
65. Haines SJ, Taylor F. Prophylactic methicillin for shunt operation effects on incidence of shunt malfunction and infection. Child's Brain 1982; 9:10-22. [ Links ]
66. Yogev R, Shinco F, McLone D. Prophylaxis for ventriculo-peritoneal shunt surgery with nafcillin alone of in combination with rifampin (abstract N° 664). In: Program and abstracts of the 23rd lnterscience Conference on Antimicrobial Agents and Chemotherpay. Washington DC. American Society for Microbiology. 1983. [ Links ]
67. Djindjian M, Fevrier MJ, Otterbein G, Soussy JC. Oxacillin prophylaxis in cerebrospinal fluid shunting: results of a prospective randomized trial in 60 hydrocephalic patients. Surg Neurol, 1986; 25; 178:80. [ Links ]
68. Lambert M, MacKinnon AE, Vaishnav A. Comparison of two methods of phrophylaxis against CSF shunt infection . Z Kinderchir, 1984; 39(suppl 2): 109-10. [ Links ]
69. Blomstedt GC. Results of trimethoprim-sulfamethoxazole prophylaxis in ventriculostomy and shunting procederes. A Double-blind randomized trial.1985. J Neurosurg, 1985; 62:694-7. [ Links ]
70. Schmidt K, Gjerris F, Osgaard O, et al. Antibiotic prophyiaxis in cerebrospinal fluid shunting: a prospective randomized trial in 152 hydrocephalic patients. 1985. Neurosurgery, 1985; 17:1-5. [ Links ]
71. Reider MJ, Frewen TC, DelMaestro RF, Coyle A, Lovell S. The effect of cephalothin prophylaxis on postoperative ventriculoperitoneal shunt infections. 1987. Can Med Assoc J, 1987; 136: 935-8. [ Links ]
72. Blum J, Shwartz M, Voth D. Antibiotic single-dose prophylaxis of shunt infections. Neurosurg Rev, 1989; 12:39-44 . [ Links ]
73. Burke JF. The effective period of preventive antibiotic action in experimental incisions and delmal lesions. Surgery, 1961; 50:161-8. [ Links ]
74. Goummerova L, Hoffman H, Walters B, Humphreys R, Hendrick B. Perioperative antibiotic prophylaxis in shunt surgery (abstract N° 10). In: Scientific Program of the Annual Meeting of the American Association of Neurological Surgeons. Washington DC. American Association of Neurological Surgeons. 1989. [ Links ]
( * )Servicio de lnfectología y Neurocirugía, Hospital Nacional de
Niños, Dr. Carlos Saénz Herrera, San José, Costa Rica.
Dirección para correspondencia: Dra. Carla Odio, Servicio de lnfectología,
Hospital Nacional de Niños, Apartado 1654-1000, San José, Costa Rica.
Email: codio@hnn.sa.cr