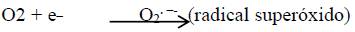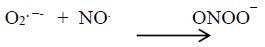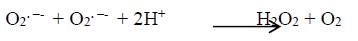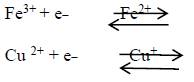Introducción
Los organismos vivos se desarrollan en condiciones aeróbicas y están expuestos a diversos agentes oxidantes generados intencionalmente o como subproductos. En general, estos oxidantes son de dos tipos: las especies reactivas del oxígeno y las especies reactivas del nitrógeno. Ambos tipos tienen funciones biológicas esenciales para el desarrollo celular normal 1.
No obstante, el aumento por encima del nivel normal de estos oxidantes puede resultar en una homeostasis deteriorada y conducir a diversas patologías, como algunas enfermedades neurodegenerativas, el cáncer, y la diabetes tipo 2 entre otras 2,3.
El objetivo de este trabajo es desarrollar el tema de las especies reactivas, principalmente las de oxígeno: su generación, los sistemas que mantienen su nivel dentro de límites fisiológicos, su función normal y las consecuencias de un aumento de su nivel por encima del valor normal, condición conocida como estrés oxidativo.
Especies reactivas
Los electrones dentro de los átomos ocupan regiones llamadas orbitales. Cada orbital puede albergar un máximo de dos electrones. Un radical libre es una especie que contiene uno o más electrones no apareados, es decir un electrón que se encuentra solo en su orbital 4. Debido al hecho que los electrones son más estables cuando están apareados en los orbitales, los radicales libres son reactivos frente a otras especies. Los electrones no apareados tienen una fuerte tendencia a formar pares de electrones para llegar a una configuración más estable. Un radical puede donar su electrón desapareado a otra molécula, o puede robar un electrón de otra molécula para formar un par electrónico. No obstante, si un radical toma un electrón de otra molécula o dona un electrón, la otra molécula se transforma en un radical libre.
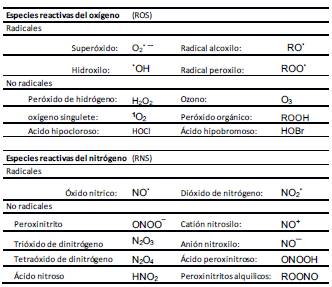
Entonces, una característica de los radicales libres es su tendencia a causar reacciones en cadena: un radical genera otro radical y así sucesivamente 5. Dentro de los seres vivos existen diversas sustancias reactivas (RS, del inglés “reactive species”) que tienen la capacidad de reaccionar con diferentes moléculas celulares. Hay tres clases de RS importantes a nivel celular. Ellas son 1 las especies reactivas del oxígeno (ROS, del inglés “reactive oxigen species”), 2 las especies reactivas del nitrógeno (RNS, del inglés “reactive nitrogen species”), y 3 las especies reactivas del cloruro (Tabla 1). Una especie reactiva puede ser un radical libre o no serlo.
Fuentes de ros
El término ROS se refiere a un grupo de moléculas conteniendo oxígeno con diferente reactividad química. Se les considera como metabolitos del oxígeno parcialmente reducidos que poseen una fuerte capacidad oxidante, aunque dicha capacidad varía entre las diferentes especies 6.
Los ROS incluyen especies radicales y no radicales. Del mismo modo, el término RNS se refiere a un grupo de moléculas conteniendo nitrógeno con diferente reactividad química 7.
En la tabla 1 se presenta una lista de ROS y RNS de importancia biológica. Los ROS son generados en varios sistemas celulares localizados en la membrana plasmática, el citosol, el retículo endoplásmico y la mitocondria.
Tabla 1: Principales especies reactivas del oxígeno y del nitrógeno.
Fuente: 4. Phaniendra, A. Jestadi, D. B. and Periyasamy, L. (2015). Free radicals: properties, sources, targets, and their implications in various diseases. Ind J Clin Biochem, 30(1), 11-26., 26. Biswas, S. K. (2016). Does the interdependence between oxidative stress and inflammation explain the antioxidant paradox? Oxidative Medicine and Cellular Longevity, 2016, 1- 9
Mitocondria. La mayoría de los ROS es generada a nivel mitocondrial. Los radicales superóxido, O2. 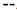 , son producidos en los complejos I y III de la cadena de transporte electrónico, mediante una transferencia de electrones al oxígeno molecular (8). El O2.
, son producidos en los complejos I y III de la cadena de transporte electrónico, mediante una transferencia de electrones al oxígeno molecular (8). El O2. 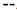 es el principal ROS producido y da origen a los demás ROS de importancia biológica: peróxido de hidrógeno, radical hidroxilo, radical peroxilo y el oxígeno singulete o individual 4.
es el principal ROS producido y da origen a los demás ROS de importancia biológica: peróxido de hidrógeno, radical hidroxilo, radical peroxilo y el oxígeno singulete o individual 4.
En condiciones normales hasta el 2por ciento de los electrones son desviados de la cadena de transporte electrónico y forman O2. 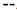 (9,10).
(9,10).
Bajo condiciones basales el superóxido y el peróxido de hidrógeno constituyen la mayoría de los ROS producidos dentro de la célula. En ausencia de mecanismos antioxidantes eficientes, la actividad mitocondrial llevaría a un aumento de la concentración del superóxido por encima del umbral, comprometiendo la sobrevivencia celular 11.
Retículo endoplásmico. En esta organela se producen ROS a través de una cadena de transporte electrónico cuya función es el metabolismo de los xenobióticos y la introducción de dobles enlaces en los ácidos grasos. Este sistema está constituido por un grupo de citocromos conocidos colectivamente como citocromo P450 y las enzimas b5 10.
NADPH oxidasas. Varias enzimas dentro de la célula producen ROS. Particularmente, la familia de las NADPH oxidasas (NOX) es considerada como una fuente importante de ROS. A nivel de la vasculatura se considera que esta enzima es la fuente primaria de ROS, particularmente de superóxido 12. Además, la NOX se considera un sistema enzimático responsable de la producción de ROS en enfermedades como la hipertensión, la aterosclerosis y la diabetes tipo 1 y 2 13.
La NOX es un complejo enzimático unido a la membrana que transfiere electrones del NADPH al oxígeno. Posee una estructura heterodimérica que comprende una subunidad catalítica, NOX, que tiene cinco isoformas conocidas (NOX1-5).
Estas difieren en su distribución tisular y en la cinética de formación de los ROS 9,13. Xantina oxidasa. Es una enzima citosólica que cataliza la oxidación de la hipoxantina a xantina y ácido úrico. La enzima existe en dos formas: xantina deshidrogenasa (XHD) y xantina oxidasa (XO). La forma XO es la principal forma productora de superóxido. La actividad de la XO está aumentada en los desórdenes inflamatorios de las vías aéreas, el daño isquémico por reperfusión, la aterosclerosis, la diabetes y en desórdenes autoinmunes 6.
Óxido nítrico sintetasa (NOS). Es una familia de enzimas llamadas óxido nítrico sintetasa (NOS, del inglés “nitric oxide synthases”) que generan óxido nítrico a partir de L-arginina, NADPH y O2.
La familia está integrada por varios miembros: NOS neuronal (nNOS), NOS endotelial (eNOS) y la NOS inducible (iNOS), todas ellas se localizan en el citosol. La forma eNOS es la fuente primordial de óxido nítrico (NO) en las células endoteliales vasculares (14).
En contraste a estas tres enzimas, la NOS mitocondrial (mtNOS) es una isoforma localizada en la mitocondria. Su localización en dicha organela asegura la formación de ONOO-, a partir de la presencia de NO y de O2. 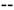 a nivel mitocondrial 3.
a nivel mitocondrial 3.
Esta enzima puede producir superóxido cuando se desacopla y este radical libre a su vez se combina con NO. originado peroxinitrito (ONOO¯).
El desacoplamiento de la NOS ocurre cuando existe un faltante relativo de cualquiera de las sustancias implicadas en la reacción: el sustrato arginina o los cofactores tetrahidrobiopterina (BH4) o NADPH. En estas condiciones la enzima produce superóxido y se genera, posteriormente, más peroxinitrito. A su vez el peroxinitrito oxida al cofactor BH4 manteniendo o acentuando el desacoplamiento de la enzima y favoreciendo la producción de más ROS y RNS 15-17.
El cofactor BH4 tiene un papel crucial en el mantenimiento de la integridad de la eNOS, estabilizando los dímeros de la enzima y la deficiencia de este cofactor ocasiona la transferencia de un electrón al oxígeno, dando origen al superóxido 6.
También se mencionan fuentes exógenas de ROS: el alcohol, los metales pesados (hierro, cobre, cobalto y cromo), solventes industriales, la luz ultravioleta, el humo del tabaco, la polución del aire y ciertas drogas (paracetamol y doxorubicin, entre otras) 4,8.
Sistemas antioxidantes
Debido a la necesidad de mantener los ROS y los RNS dentro de niveles compatibles con la función celular normal, los organismos han desarrollado mecanismos antioxidantes. Estos mecanismos son de dos tipos, enzimáticos y no enzimáticos.
Dentro de los mecanismos no enzimáticos se incluyen antioxidantes de bajo peso molecular como las vitaminas E y C, la bilirrubina, la biliverdina, el ácido úrico, el ácido ascórbico, el glutatión y los flavonoides 11,18. El ácido úrico se considera como un antioxidante extracelular. Los flavonoides detienen la oxidación de los lípidos y de otras moléculas por la donación de átomos de hidrógeno a los radicales, dejando radicales fenoxi intermediarios. Estos radicales son relativamente estables y no pueden iniciar reacciones de radicales en cadena 3. El glutatión (GSH) es un antioxidante abundante en el citosol, la mitocondria y el núcleo. Es sintetizado a partir de los aminoácidos glicina, cisteína y glutamato 19.También puede citarse a la proteína ferritina, encargada de secuestrar el hierro intracelular 20. Dentro de los oxidantes enzimáticos se incluye la enzima superóxido dismutasa (SOD, del inglés “superoxide dismutase”), que convierte el anión superóxido en peróxido de hidrógeno, H2O2.
En presencia de Fe2+ el H2O2 es parcialmente reducido a .OH (radical hidroxilo) por la reacción de Fenton (21).
Este último radical es extremadamente reactivo y puede atacar los lípidos de la membrana, las proteínas y el ADN 4. Entonces la remoción de H2O2 y de O2. -- se vuelve necesaria y beneficiosa.
Hay tres tipos de SOD: CuZnSOD (SOD1), presente en el citoplasma, en el núcleo y en los microsomas; MnSOD (SOD2), localizada en la matriz mitocondrial y la ECSOD (SOD3) localizada extracelularmente 22.
La SOD trabaja en conjunto con otras enzimas que remueven el peróxido de hidrógeno en las células humanas: la catalasa (CAT), la glutatión peroxidasa (GPx) y la peroxiredoxina (Prx).
La catalasa es una enzima tetramérica, dependiente del grupo hemo, que reduce el peróxido de hidrógeno a agua y oxígeno y que requiere de la presencia de NADPH para llevar a cabo su función 23.
La glutatión peroxidasa (Gpx) es una familia de enzimas que requieren del selenio para su actividad. Esta enzima reduce el peróxido de hidrógeno y los peróxidos orgánicos (ROOH) a agua o alcohol (ROH), respectivamente, utilizando glutatión reducido 3. La Gpx se localiza en el citoplasma y en la mitocondria. El glutatión oxidado debe ser regenerado para poder continuar funcionando y lo hace a través de la enzima glutatión reductasa 24.
La expresión de las tres principales clases de enzimas antioxidantes (SOD, CAT y Gpx) se eleva de una forma dependiente del nivel de los ROS. En la literatura se cita que dos reguladores principales de la respuesta celular al estrés oxidativo, los factores de transcripción NF-kB y AP-1, pueden unirse a sitios específicos en la región promotora de los genes de SOD2, Gpx y CAT en las células de músculo esquelético y estimular la producción de estas enzimas 23.
Las peroxiredoxinas comprenden una familia de enzimas que catalizan el metabolismo reductivo del peróxido de hidrógeno o los peróxidos lipídicos. Teóricamente las Prx son menos eficientes que la catalasa reduciendo al peróxido de hidrógeno 25.
Las tioredoxinas son otra clase de enzimas antioxidantes que reaccionan directamente con los peróxidos 15.
También se citan a las proteínas transferrina, ceruloplasmina y albúmina cuyo papel sería quelar o secuestrar extracelularmente iones metálicos, como el hierro o el cobre, evitando la producción del radical hidroxilo altamente tóxico por la reacción de Fenton 26.
Muchos metales de transición tienen varias valencias y los cambios de valencia los hace aceptar o donar electrones individuales. Esta característica hace a los iones metálicos muy buenos promotores de las reacciones con radicales libres 5.
Entonces, los iones de cobre y de hierro pueden convertir O2. 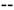 y H2O2 en el radical altamente nocivo .OH.
y H2O2 en el radical altamente nocivo .OH.
El investigador Halliwell indica que este radical reacciona tan rápido con las biomoléculas que ningún antioxidante a concentraciones fisiológicas es capaz de competir con las biomoléculas por el .OH generado. En vista de lo anterior la mejor estrategia para minimizar el daño causado por el .OH es remover el H2O2 ó secuestrar los metales de transición necesarios para la producción de .OH por la reacción de Fenton 21. A ambas estrategias recurren las células.
Función de las ros/rns
Los RS y especialmente los ROS son moléculas mensajeras que regulan una amplia variedad de procesos fisiológicos celulares incluyendo la proliferación, la diferenciación y la apoptosis 7,10.
Además, el NO tiene efectos antioxidantes, antiinflamatorios, de antiagregación plaquetaria, antiproliferativos de las células de músculo liso vasculares, de inhibición de la migración de dichas células y es antiapoptótico 27-29. Una de sus acciones antiinflamatorias más conocidas es reducir la expresión de varios mediadores inflamatorios y de moléculas de adhesión en la superficie de la célula endotelial 30.
Otra función muy conocida de los ROS es la defensa inmune contra agentes biológicos externos por medio del proceso inflamatorio 6.
Dos grupos de investigadores dan cuenta del papel jugado por los ROS/RNS en la regulación del metabolismo de la glucosa, induciendo un incremento en la captación de glucosa por parte de los adipocitos y de las células de músculo esquelético. En este caso se da una traslocación a la membrana del transportador de glucosa tipo 4 (GLUT4) y un incremento consecuente en la captación intracelular de glucosa 31,32. También a nivel de músculo esquelético los ROS participan en la diferenciación miogénica y en la regeneración del tejido muscular lesionado 23.
Mientras muchos ROS, tal como el .OH pueden causar daño irreversible a las macromoléculas, el blanco principal de un oxidante menos reactivo, tal como el H2O2, es el grupo tiol, o sulfhidrilo, de los residuos de cisteína presentes en muchas proteínas. Estas modificaciones causan cambios en la estructura y/o función de la proteína que alberga el grupo tiol modificado 10. Estas modificaciones pueden también alterar el destino subcelular de la proteína y modificar las interacciones proteína-proteína. De esta manera dichas modificaciones alteran la actividad de la proteína en cuestión.
Proteínas sensibles al estado redox, como las proteín fosfatasas de tirosina, tienen una cisteína reactiva en su sitio activo. Entonces, la oxidación reversible de esta cisteína inactivaría a la fosfatasa correspondiente, permitiendo la propagación de la señal del receptor tirosín quinasa mediada por la fosforilación de diferentes proteínas 11.
Chiarugi y colegas citan que las modificaciones proteicas dependientes del estado redox modulan los eventos tempranos de la transducción celular relacionados con el crecimiento y la muerte celular. Uno de los efectos de estas señales redox puede ser la inactivación de fosfatasas de tirosina, por medio de la oxidación de grupos sulfhidrilo críticos. La inactivación dependiente de H2O2 de las fosfatasas ocasionaría un cambio en el equilibrio hacia la fosforilación de proteínas 33.
Li y colaboradores citan la inactivación de la proteín fosfatasa 2A (PP2) en un residuo de cisteína por parte del peróxido de hidrógeno. La inactivación de PP2, que en su forma activa desfosforila la proteína Akt y bloquea la vía PI3K/Akt, activa la vía Akt y facilita la sobrevivencia celular. También la vía ERK es activada por una inhibición directa de las fosfatasas MAPK por los radicales hidroxilo 3.
En las células de mamíferos una variedad de estímulos inducen un incremento transitorio en los niveles de ROS y la inhibición específica de la generación de los mismos causa un bloqueo completo de la señalización o de la internalización de la señal dependiente de estímulo 34.
Los ROS son visualizados como reguladores fisiológicos de vías o cascadas de señalización intracelulares activadas por factores de crecimiento por medio de sus receptores tirosínquinasa 33. Los cambios temporales en el estado redox de la célula alteran vías de señalización, como la vía de las MAPKs y la de SIRT1. Estas vías regulan factores de transcripción nuclear como AP-1, que induce respuestas mitogénicas, y como NF-kB que induce respuestas inflamatorias 1,19.
Entonces los ROS causarían una modificación e inactivación oxidativa temporal de las fosfatasas, prolongando la acción de las proteín quinasas celulares. La disminución de los ROS atenuaría la inactivación oxidativa de estas fosfatasas suprimiendo las vías de señalización mediadas por las quinasas mencionadas 25.
Dentro de las diferentes especies de ROS que podrían actuar como segundos mensajeros el H2O2 tiene la ventaja de su mayor estabilidad y por ende de una vida media más prolongada. Además, la carencia de cargas le permite pasar libremente a través de las membranas celulares 31. No obstante, en exceso el peróxido de hidrógeno puede sobreoxidar los grupos tiol de las proteínas, reaccionar con metales libres formando .OH, causar peroxidación lipídica y contribuir al estrés oxidativo celular 25.
Estrés oxidativo y daño oxidativo
Las diferentes especies reactivas (ROS, RNS) pueden originar un estado conocido como estrés oxidativo, aunque normalmente cuando se habla de este estado se refiere básicamente a los ROS.
El estrés oxidativo es definido convencionalmente como un desbalance entre la generación de especies reactivas y la defensa antioxidante, encargada de la remoción de dichas especies (35). En el EO el desbalance se da a favor de un aumento significativo en la concentración de las sustancias o especies oxidantes reactivas.
Schmidt y colegas indican que es también necesario que el concepto de EO integre o incluya otras características de las RS como la localización subcelular y tisular, naturaleza química, cinética de formación y de degradación y tiempo de exposición 7.
Bajo condiciones normales los seres vivos mantienen un nivel basal de sustancias xidantes.
La homeostasis se debe a un balance o ajuste entre los mecanismos generadores de las especies reactivas y los sistemas de eliminación de las mismas. En el nivel basal se encuentra un cierto nivel de ROS y de moléculas modificadas por estas especies reactivas
A bajas concentraciones los ROS juegan un papel importante como mediadores de procesos de señalización intracelular, pero cuando su concentración se incrementa se vuelven nocivos.
Entonces, la concentración de las especies reactivas determina su “estado”: tóxica o beneficiosa 10. Este estado de aumento significativo de las especies reactivas por encima de su nivel basal se conoce como estrés oxidativo.
Otra definición, citada por Lushchak, incluye el efecto nocivo de los ROS: el estrés oxidativo es una situación donde la concentración basal de ROS es transitoria o crónicamente elevada, alterando el metabolismo celular y su regulación y dañando constituyentes celulares 24.
El EO puede resultar de dos situaciones generales: 1 niveles disminuidos de antioxidantes y/o 2 producción incrementada de las especies reactivas 11.
En una situación de EO las moléculas biológicas, el ADN, las proteínas y los lípidos de la membrana pueden resultar dañados en forma irreversible.
Muchas RS atraviesan las membranas celular y nuclear y oxidan biomoléculas. El ADN está sujeto al ataque por parte de radicales hidroxilo que genera una gran cantidad de productos modificados en la base o en el azúcar: 8- hidroxiadenina y 8-hidroxiguanina entre otros. El daño oxidativo al ADN ocasiona mutaciones génicas, inestabilidad microsatelital y afecta la unión de los factores de transcripción. Los RNS también pueden atacar al ADN y causar nitración y desaminación de las purinas 3,35.
Las proteínas sufren diversas modificaciones por parte de los ROS/RNS y representan casi el 70por ciento de los blancos de estas especies reactivas 36. Los ROS ocasionan modificaciones oxidativas tales como la oxidación de la metionina y la cisteína, derivados hidróxidos y carbonilos de la oxidación de las cadenas laterales de ciertos aminoácidos (lisina, arginina, prolina, treonina, cisteína e histidina). Los aminoácidos cisteína y metionina son particularmente propensos al ataque oxidativo de casi todos los ROS. Los RNS inducen nitración de las proteínas, tal como la 3- nitrotirosina 2. El daño oxidativo de las proteínas es irreversible e irreparable y las proteínas dañadas pueden activar proteosomas para la degradación de las proteínas oxidadas 37.
Los lípidos de membrana, especialmente los ácidos grasos poliinsaturados, son más susceptibles a la oxidación por radicales libres. La peroxidación lipídica ocasiona una pérdida de la fluidez de la membrana. La peroxidación lipídica es iniciada, cuando un radical libre toma un hidrógeno de un grupo CH2 en un ácido graso y origina un radical lipídico. Este radical puede reaccionar con el oxígeno molecular formando un radical peroxilo lipídico (LOO.). Este último radical sufre rearreglos originando endoperóxidos, que llevan finalmente a la formación de malondialdehido (MDA) y 4 hidroxil-nonenal (4-HNA), los productos finales tóxicos de la peroxidación lipídica que causan daño al ADN y a las proteínas 4,5,9.
También se producen derivados oxigenados del colesterol llamados oxisteroles generados a partir de reacciones involucrando los ROS/RNS. Estos compuestos han sido ligados a necrosis, aterosclerosis, inflamación e inmunosupresión 2. El daño oxidativo por ROS/RNS ha sido implicado en numerosas patologías: hepatitis crónica 38, hipertensión (12,39), resistencia a la insulina y diabetes tipo 2 1,8, enfermedades neurodegenerativas 3,40-42 y en la progresión del envejecimiento 15,36,43.
Conclusiones
Existe un nivel óptimo de ROS/RNS dentro del organismo, pues dichas especies llevan a cabo diversas funciones necesarias para la célula.
Para mantener un balance adecuado de las especies reactivas hay un equilibrio entre los sistemas formadores de dichas especies y los sistemas protectores o destructores de las mismas.
Los ROS/RNS llevan a cabo muchas de sus funciones modificando reversiblemente proteínas de diversa índole, especialmente en el grupo sulfhidrilo del aminoácido cisteína.
El estado de estrés oxidativo sobreviene cuando el nivel de ROS/RNS se incrementa por encima del nivel idóneo.
En el EO hay una modificación nociva de las moléculas biológicas: proteínas, ADN y lípidos de membrana.