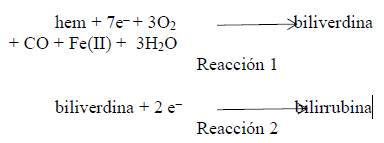Introducción
La ictericia es una manifestación característica de la enfermedad hepatobiliar. Cualquier paciente con una elevación de la concentración sérica de la bilirrubina debe ser investigado, pues las enfermedades responsables de la hiperbilirrubinemia van desde leves a graves 1. La bilirrubina se considera un marcador de la función hepática, aunque también se pueden presentar aumentos por causas extrahepáticas, de ahí la importancia de estudiar su metabolismo para poder comprender qué factores intervienen en su homeostasis. El propósito de este trabajo es revisar el metabolismo de la bilirrubina y su función como marcador de patología hepática y extrahepática. Además, se mencionan algunos aspectos que deben tomase en cuenta a la hora de realizar la determinación de la bilirrubina.
Metabolismo de la bilirrubina
El catabolismo del grupo hem a partir de todas las proteínas hémicas parece llevarse a cabo en la fracción microsomal de las células mediante un complejo enzimático llamado hem oxigenasa.
Cuando el grupo hem llega a los microsomas el hierro se halla en forma férrica, constituyendo la hemina. En una serie de pasos el ión férrico es liberado, se produce monóxido de carbono y biliverdina. Posteriormente, una enzima llamadabiliverdina reductasa reduce este compuesto a bilirrubina, un pigmento de color amarillo. Estas reacciones se llevan a cabo principalmente en las células del sistema retículoendotelial (mononuclear-fagocítico) 2,3.
La bilirrubina es el producto final del catabolismo del grupo hem. Cerca del 80por ciento se origina de la degradación de la hemoglobina de los eritrocitos en el sistema reticuloendotelial y el restante 20por ciento se origina de la eritropoyesis ineficiente en la médula ósea y de la degradación de otras proteínas hémicas 4. La bilirrubina producida, llamada bilirrubina no conjugada (BNC), es poco soluble en el plasma y su unión no covalente a la albúmina incrementa su solubilidad en el plasma. En esta forma, unida a la albúmina, este compuesto es transportado al hígado.
Dentro del citoplasma de los hepatocitos la BNC se une a la ligandina, una proteína que pertenece al grupo de las proteínas llamadas glutation Stransferasas 5,6 y es transportada al retículo endoplásmico donde tiene lugar su conjugación con el ácido glucurónico. Las UDP glucuronosil transferasas (UGT) constituyen una familia de enzimas que catalizan la transferencia del grupo UDP-ácido glucurónico a un gran número de compuestos exógenos y endógenos. Las UGTs humanas se dividen en dos familias, UGT1 y UGT2 7.
En el caso de la conjugación de la bilirrubina esta reacción es catalizada por la enzima glucuronosil ltransferasa difosfato 1A1 (UGT1A1) presente en el retículo endoplásmico 8. Esta reacción requiere de UDP-glucurónido como donador del grupo glucuronosilo. En un primer paso se produce el monoglucurónido de bilirrubina y posteriormente se le adiciona otro grupo originando diglucurónido de bilirrubina, la molécula de bilirrubina conjugada con dos grupos glucuronosilo. El proceso de conjugación vuelve a la bilirrubina más polar y más soluble en el plasma, de manera que puede excretarse fácilmente en la bilis.
La bilirrubina conjugada (BC) es secretada hacia los canalículos biliares por transportadores dependientes de ATP (ABCC2/MRP2). Casi toda la bilirrubina excretada en la bilis está en forma de diglucurónido de bilirrubina. 4,9,10. En el intestino la BC, por acción bacteriana, es transformada en los urobilinógenos, compuestos incoloros. En el ileon terminal y en el intestino grueso, una pequeña fracción de los urobilinógenos se reabsorbe y se vuelve a excretar por medio del hígado para constituir el ciclo entero hepático del urobilinógeno. En condiciones normales la mayor parte del urobilinógeno se oxida en el colon hacia urobilinas, compuestos coloreados, y éstos son excretados en las heces 11.
Debe anotarse que menos del 1 por ciento de la bilirrubina de la bilis es no conjugada. Es importante mantener una baja concentración de bilirrubina no conjugada (BNC), pues este compuesto parece ser un factor iniciador de los cálculos biliares 5.
Como bien lo indican Dutt y colegas la presencia de cálculos biliares está más estrechamente relacionada a la proporción de bilirrubina no conjugada que al grado de saturación de la bilis con colesterol. De modo que la bilirrubina y sus metabolitos juegan un importante papel en la formación de los cálculos de colesterol 12.
El efecto tóxico de la bilirrubina se explica porque puede inhibir la síntesis de ADN, desacoplar la fosforilación oxidativa e impedir la producción de ATP e inhibir la síntesis de ARN y de proteínas 4.
Lakovic y colegas utilizando ratones encontraron que la bilirrubina podía ser oxidada generando productos de oxidación de la bilirrubina que pueden ser responsables de la toxicidad de la bilirrubina in vivo 13. Los experimentos mostraron efectos directos de la bilirrubina y de sus productos de oxidación sobre la materia blanca del cerebro. Globalmente, el tratamiento con bilirrubina lleva a la muerte de neuronas, oligodendrocitos y astrocitos.
No obstante, la bilirrubina también es vista como una molécula con una función protectora. Un grupo de investigadores brasileños citan que esta molécula tiene propiedades antioxidantes y antiinflamatorias y que puede proteger a la LDL de ser oxidada 14. A nivel molecular la bilirrubina elimina los radicales peroxilo, hidroxilo y las especies reactivas del nitrógeno 15. En este caso su función sería de un compuesto antioxidante. Moon indica que hay una asociación inversa entre los niveles circulantes de bilirrubina y el riesgo de complicaciones cardiovasculares. Un bajo valor de bilirrubina sérica constituye un factor de riesgo significativo para la microangiopatía diabética (16). Otro grupo de investigadores encontró que pacientes diabéticos con síndrome de Gilbert tienen una prevalencia reducida de complicaciones vasculares comparado con pacientes diabéticos con niveles normales de bilirrubina 17.
Otro grupo encontró una asociación inversa entre el nivel de la bilirrubina sérica y la prevalencia de la enfermedad de hígado graso no alcohólico 18. Esta enfermedad está estrechamente relacionada con la resistencia a la insulin, la obesidad, la diabetes tipo 2, la dislipidemia y la enfermedad arterial coronaria.
Propiedades de la bilirrubina y su unión a la albúmina
La bilirrubina existe en la sangre principalmente unida a la albúmina por su escasa solubilidad en el plasma. Hay al menos dos sitios de unión en esta proteína para la bilirrubina y sus fotoisómeros 19. El sitio más fuerte e importante tiene una constante de afinidad muy grande, aproximadamente 1.4 X 107 l/mol a 37o C, y puede ser considerado como un sitio específico. Otros sitios secundarios tienen constantes de unión mucho menores 20.
La unión bilirrubina-albúmina depende de la concentración de ambas moléculas y de la afinidad de unión entre ellas. Albúmina 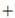 bilirrubina no unida (Bf) Albúmina-Bilirrubina unida De la ecuación química anterior puede notarse que hay una cierta cantidad pequeña de bilirrubina no conjugada no unida (llamada también bilirrubina libre o no unida a la albúmina, Bf). Esta cantidad, según Levitt y Levitt, es cerca de 1/50 000 la cantidad total de BNC sérica, en el orden de 0.16 nM 5.
bilirrubina no unida (Bf) Albúmina-Bilirrubina unida De la ecuación química anterior puede notarse que hay una cierta cantidad pequeña de bilirrubina no conjugada no unida (llamada también bilirrubina libre o no unida a la albúmina, Bf). Esta cantidad, según Levitt y Levitt, es cerca de 1/50 000 la cantidad total de BNC sérica, en el orden de 0.16 nM 5.
La fracción de bilirrubina no unida (Bf) se incrementa significativamente conforme la bilirrubina total se aproxima a la capacidad máxima de unión de la albúmina (1 gramo de albúmina une 8 mg de bilirrubina) o cuando la afinidad de la albúmina disminuye. Dicha afinidad de unión puede disminuir en la presencia de sepsis, acidosis, hipoxia, ácidos grasos libres y varias drogas de unión a la albúmina 21.
Además, de la ecuación anterior puede inferirse que incrementos en la BNC, manteniendo constantes el nivel de albúmina y la afinidad entre ambas moléculas, incrementarán la fracción Bf y por ende el riesgo de daño cerebral por la bilirrubina. Esto sucede porque los sitios de unión para la BNC en la albúmina se van saturando.
Debido a la gran cantidad de albúmina presente y a su gran afinidad por la bilirrubina, el nivel de Bf en el plasma depende esencialmente de su unión a la albúmina 22.
La unión albúmina-bilirrubina es reversible y hay un equilibrio dinámico donde la bilirrubina se une y se libera continuamente. Conforme la bilirrubina deja el espacio vascular más bilirrubina se disocia del reservorio de la bilirrubina unida.
La consecuencia de una disminución de la afinidad entre ambas moléculas es un aumento de la bilirrubina libre, y como la bilirrubina libre (Bf) es la única especie capaz de cruzar la barrera hematoencefálica, su nivel aumenta a nivel de tejido cerebral. Debido a que solamente la Bf puede cruzar dicha barrera, la bilirrubina libre plasmática es mejor indicador de neurotoxicidad que la bilirrubina total 23-25.
La bilirrubina no conjugada es una molécula muy poco soluble en agua y por su carácter anfipático e hidrofóbico puede atravesar las membranas celulares. Esta propiedad hace que la bilirrubina no conjugada y no unida a la albúmina sea neurotóxica 26.
La mayoría de la bilirrubina no conjugada está unida normalmente a la albúmina, resultando en muy bajos niveles de bilirrubina libre. No obstante, las concentraciones elevadas de bilirrubina total pueden exceder la capacidad de unión de la bilirrubina a la albúmina y ocasionar niveles elevados de bilirrubina libre 27.
De lo anterior cabe la pregunta ¿por qué no se determina la Bf a nivel clínico, si parece ser una medida de la fracción de bilirrubina relacionada con la patología cerebral asociada a la hiperbilirrubinemia?
Existe una técnica que utiliza la peroxidasa de rábano y que está basada en la observación que esta peroxidasa cataliza la oxidación de la BNC libre, no unida a la albúmina, por el peróxido de hidrógeno. La BNC unida a la albúmina no es oxidada en este proceso. La técnica fue desarrollada por Jacobsen y Wennberg 28,29. En un artículo posterior Ahlfors y colaboradores mencionan que la técnica ha sido automatizada, requiere de poco volumen ( 100 uL), es cuantitativa, rápida y barata. No obstante, presenta varios inconvenientes: (a) la hemoglobina es una peroxidasa débil y una hemólisis moderada (hemoglobina
100 uL), es cuantitativa, rápida y barata. No obstante, presenta varios inconvenientes: (a) la hemoglobina es una peroxidasa débil y una hemólisis moderada (hemoglobina  5g/dl)
5g/dl)
agrega actividad de peroxidasa que puede incrementar falsamente el valor de Bf. La hemólisis severa enmascara la absorbancia de luz de la BNC a 460 nm, disminuyendo falsamente la Bf e incrementando falsamente la bilirrubina total.
(b) la bilirrubina conjugada es más fácilmente oxidada que la BNC y a niveles mayores de 1 mg/dl incrementará la Bf. (c) el pH y la composición iónica del medio (particularmente los iones cloruro y fosfato) pueden alterar la unión y la Bf medida. (d) los fotoisómeros de la bilirrubina pueden interferir con la prueba de la peroxidasa. Otro problema mencionado por estos investigadores es la inestabilidad de los soluciones control de la BNC (30).
Prueba de laboratorio
La bilirrubina se considera como un marcador de función hepática y a la par de otras determinaciones bioquímicas (transaminasas, fosfatasa alcalina y gama glutamil transferasa entre otras) forma parte de un panel básico de pruebas para determinar en forma global la funcionalidad hepática. Tradicionalmente se determina la bilirrubina total y fraccionada. La bilirrubina total es la suma de la bilirrubina directa (conjugada) y la bilirrubina indirecta (no conjugada). Un aumento de la bilirrubina puede indicar disfunción o daño hepático a priori.
La medida de bilirrubina conjugada o directa y de la bilirrubina no conjugada o indirecta provee una indicación para pruebas diagnósticas adicionales, pero casi nunca brinda información suficiente para identificar el desorden causante de la patología. Un predominio marcado de BNC ( 80por ciento) es indicativo de carga aumentada de bilirrubina (hemólisis), de un aumento de la circulación entero hepática de BNC o de un defecto de conjugación (síndromes de Gilbert o de Crigler-Najjar).
80por ciento) es indicativo de carga aumentada de bilirrubina (hemólisis), de un aumento de la circulación entero hepática de BNC o de un defecto de conjugación (síndromes de Gilbert o de Crigler-Najjar).
Debe tenerse presente que el ayuno aumenta los niveles de bilirrubina no conjugada, principalmente por un aumento de la absorción intestinal resultando de una disminución de la motilidad intestinal (31). Esto se cumple si se utiliza el ensayo de diazo para la determinación de la bilirrubina.
Además, la gran variabilidad normal en la concentración de la BNC limita el valor de esta medición para identificar una hemólisis baja o moderada (5). Hay una serie de exámenes hematológicos que pueden arrojar luz (frotis de sangre periférica, nivel de haptoglobinas, recuento de reticulocitos y medición de la actividad de la enzima lactato deshidrogenasa) para el caso de un aumento marcado de BNC.
Un aumento marcado de BC es sugestivo de colestasis de origen hepático o extrahepático. La obstrucción extrahepática es causada normalmente por cálculos biliares, malignidad o alteraciones estructurales en la vía biliar. En los tres casos la presión aumentada en el sistema biliar ocasiona un reflujo de BC hacia el plasma. La BC sí puede aparecer en la orina, causando un oscurecimiento característico de la misma.
La colestasis intrahepática puede ser causada por una obstrucción al flujo biliar en el hígado (cirrosis biliar primaria o lesiones grandes del parénquima hepático), una carencia de la integridad del canalículo biliar o una secreción disminuida de la bilis secundaria a alguna droga. Además, puede ser un defecto hereditario que reduce el transporte de BC dentro del canalículo (Síndrome de Dubin-Johnson).
Cuando no hay un predominio neto de alguna de las fracciones de bilirrubina se habla de un problema hepatocelular, tal como en las varias formas de hepatitis o cirrosis. En la determinación de la bilirrubina debe tenerse especial cuidado con la exposición de la bilirrubina a la luz visible, pues sufre isomerización y oxidación en el suero. Rehak y colaboradores encontraron que para muestras normobilirrubinémicas y moderadamente hiperbilirrubinémicas había un decrecimiento de bilirrubina total del 59 por ciento y del 41 por ciento, respectivamente, en muestras de suero humano expuestos a la luz visible de un laboratorio y a temperatura ambiente. El descenso de la bilirrubina directa fue menor, 38 por ciento y 31 por ciento respectivamente. El descenso era proporcionalmente mayor en muestras con valores iniciales bajos de bilirrubina (32). Incluso, en muestras de control incubadas en la oscuridad había un pequeño descenso del 15 por ciento de la bilirrubina directa al cabo de las 24 horas. Todo esto lleva a estos investigadores a recomendar que la exposición de las muestras de suero a luz normal de laboratorio no sea mayor a las 2 horas para limitar la pérdida a menos del 10 por ciento.
La hemólisis y la lipemia constituyen dos interferentes para la determinación tanto de la bilirrubina directa como de la total, empleando el método clásico que utiliza el reactivo de diazo. La interferencia es mayor en la determinación de la bilirrubina directa, es decir, se requieren niveles menores de ambos interferentes para afectar el resultado de la prueba (15).
Otro posible factor de confusión en la utilización de la medición de la bilirrubina como indicador de disfunción hepática viene dado por la alta prevalencia del síndrome de Gilbert dentro de la población, entre 3-13por ciento (33).
Cabe notar que la presencia de bilirrubina en la orina indicaría presencia de BC, pues por su conjugación es una molécula soluble en el plasma. La BNC está fuertemente unida a la albúmina y esto impide su filtración glomerular y su aparición en la orina. Debe indicarse que en condiciones normales la bilirrubina conjugada no es detectada en sangre, a menos que su concentración se halle significativamente elevada por algún trastorno.
Por último, el método tradicional de medición de la bilirrubina emplea un reactivo conocido como diazo y se vale del hecho que la BNC es un “pobre” reactante sin un acelerador. No obstante, a altas concentraciones parte de la BNC puede reaccionar con el reactivo diazo sin la adición del acelerador ocasionando un falso aumento de la BC (34).
Hiperbilirrubinemia
La hiperbilirrubinemia se define como una concentración de bilirrubina superior a 19 uM (1.1 mg/dl). La ictericia, coloración amarillenta de la piel, de las membranas mucosas y de los fluidos corporales, se presenta a una concentración de 40 uM (2.4 mg/dl) de bilirrubina (35).
Tradicionalmente la hiperbilirrubinemia, y la ictericia, pueden clasificarse de dos formas, según su origen (prehepática, hepática y poshepática), ó según su tipo (conjugada y no conjugada). En la hiperbilirrubinemia prehepática predomina la bilirrubina no conjugada y en la hepática puede haber cuadros tanto de predominio de bilirrubina no conjugada como conjugada. En la hiperbilirrubinemia poshepática predomina la bilirrubina conjugada.
Hiperbilirrubinemia prehepática. En esta condición la producción de bilirrubina supera la capacidad del hígado de conjugar y excretar la bilirrubina. El hígado puede excretar 6 veces la carga diaria normal, antes de que aparezca la ictericia (35). La causa principal de sobreproducción de bilirrubina es el incremento en la destrucción de los glóbulos rojos (hemólisis) y la producción corresponde a bilirrubina no conjugada. La BNC es insoluble en el plasma y no es excretada en la orina. El cuadro más conocido es la hiperbilirrubinemia por incompatibilidad materno fetal.
Ictericia hepática.
Hay causas de origen genético donde se encuentra una actividad disminuida, en grado variable, de la enzima UGT1A1. Este es el caso de los síndromes de Crigler-Najjar y de Gilbert.
Ambos síndromes representan tres grados de hiperbilirrubinemia no conjugada. Los pacientes con el tipo I de Crigler-Najjar son incapaces de conjugar la bilirrubina y presentan concentraciones de bilirrubina de 20 a 50 mg/dl.
El tipo II de Crigler-Najjar presenta una pérdida severa, aunque parcial, de la actividad de la UGT1A1. La hiperbilirrubinemia es menos acusada ( 20 mg/dl). La forma más leve de hiperbilirrubinemia no conjugada es el síndrome de Gilbert y los niveles de bilirrubina en el suero fluctúan desde un valor normal hasta 5 mg/dl (8). El síndrome de Gilbert es la ictericia hereditaria más frecuente, afectando a cerca del 5por ciento de la población caucásica (41). Kaga y colegas reportan dos polimorfismos de la UGT responsables del síndrome de Gilberth, en el exón 1 (G71R) y en el TATA box de la región promotora del gen correspondiente (A(TA)7TAA) (36).
20 mg/dl). La forma más leve de hiperbilirrubinemia no conjugada es el síndrome de Gilbert y los niveles de bilirrubina en el suero fluctúan desde un valor normal hasta 5 mg/dl (8). El síndrome de Gilbert es la ictericia hereditaria más frecuente, afectando a cerca del 5por ciento de la población caucásica (41). Kaga y colegas reportan dos polimorfismos de la UGT responsables del síndrome de Gilberth, en el exón 1 (G71R) y en el TATA box de la región promotora del gen correspondiente (A(TA)7TAA) (36).
Otra causa de hiperbilirrubinemia, más frecuente, es la hepatitis de diverso origen: viral, cirrosis alcohólica, causada por drogas, cirrosis biliar primaria y otras (37-41).
También existen cuadros hereditarios de hiperbilirrubinemia conjugada, por ejemplo los los síndromes de Rotor y de Dubin-Johnson (42, 43).
En estos síndromes el problema se ubica posteriormente a la conjugación de la bilirrubina, básicamente son problemas relacionados con la excreción de la BC hacia la bilis.
Ictericia poshepática.
La causa principal es la obstrucción biliar debido a la presencia de cálculos biliares o por un carcinoma de páncreas, aunque hay una variedad de causas malignas y no malignas (44). En este cuadro se observa un aumento de la bilirrubina conjugada.
Ictericia neonatal
La hiperbilirrubinemia neonatal, definida como una concentración de bilirrubina total  5 mg/dl, es una condición clínica encontrada con mucha frecuencia. Cerca del 60por ciento de los neonatos a término presentan ictericia clínica durante la primera semana de vida 45. La ictericia neonatal es la condición más frecuente de hospitalización en la primera semana de vida y la gran mayoría de los recién nacidos ictéricos tienen bilirrubina no conjugada elevada 34. Usualmente la hiperbilirrubinemia se presenta en ausencia de alguna enfermedad y se le conoce como ictericia o hiperbilirrubinemia fisiológica.
5 mg/dl, es una condición clínica encontrada con mucha frecuencia. Cerca del 60por ciento de los neonatos a término presentan ictericia clínica durante la primera semana de vida 45. La ictericia neonatal es la condición más frecuente de hospitalización en la primera semana de vida y la gran mayoría de los recién nacidos ictéricos tienen bilirrubina no conjugada elevada 34. Usualmente la hiperbilirrubinemia se presenta en ausencia de alguna enfermedad y se le conoce como ictericia o hiperbilirrubinemia fisiológica.
La ictericia fisiológica se debe a un desarrollo insuficiente en el proceso de captación, transporte y conjugación de la bilirrubina en el hígado del recién nacido 46. Los recién nacidos sanos a término o casi a término (edad gestacional  35 semanas), sin factores de riesgo conocidos y cuyo nivel de bilirrubina indica un riesgo bajo o intermedio usualmente normalizan su nivel de bilirrubina espontáneamente sin necesidad de tratamiento (47). Para los pacientes con uno o más de los factores de riesgo conocidos y/o pacientes con niveles muy elevados de bilirrubina, la hiperbilirrubinemia prolongada puede resultar en una disfunción neurológica inducida por la bilirrubina o, en los casos más severos, en kernicterus (48).
35 semanas), sin factores de riesgo conocidos y cuyo nivel de bilirrubina indica un riesgo bajo o intermedio usualmente normalizan su nivel de bilirrubina espontáneamente sin necesidad de tratamiento (47). Para los pacientes con uno o más de los factores de riesgo conocidos y/o pacientes con niveles muy elevados de bilirrubina, la hiperbilirrubinemia prolongada puede resultar en una disfunción neurológica inducida por la bilirrubina o, en los casos más severos, en kernicterus (48).
Los neonatos a término o casi a término están en riesgo de kernicterus cuando la concentración de bilirrubina total excede los 25 a 30 mg/dl (428 a 513 umol/L). No obstante, si la medición de la bilirrubina directa excede el nivel de 1.5 a 2.0 mg/dl (26 a 34 umol/L) debe investigarse una ictericia colestásica (27). Además, en neonatos con ictericia a las 3 o más semanas de vida debe medirse el nivel de la bilirrubina conjugada y total para un diagnóstico de colestasis (49).
Benchimol y colegas citan como indicadores de colestasis neonatal un valor de bilirrubina directa  1.0 mg/dl (17umol/L) o un valor de bilirrubina directa
1.0 mg/dl (17umol/L) o un valor de bilirrubina directa  20por ciento de la concentración de la bilirrubina total, cuando la bilirrubina total
20por ciento de la concentración de la bilirrubina total, cuando la bilirrubina total  5.0 mg/dl (85umol/L) 50. No obstante, la colestasis neonatal se presenta en menos del 0.04por ciento a 0.2por ciento de los nacidos vivos según indican estos mismos investigadores. Otros investigadores indican que una ictericia que persiste por más de 2 semanas lleva a considerar un diagnóstico de colestasis 51. En cualquier caso una hiperbilirrubinemia conjugada nunca es normal o fisológica.
5.0 mg/dl (85umol/L) 50. No obstante, la colestasis neonatal se presenta en menos del 0.04por ciento a 0.2por ciento de los nacidos vivos según indican estos mismos investigadores. Otros investigadores indican que una ictericia que persiste por más de 2 semanas lleva a considerar un diagnóstico de colestasis 51. En cualquier caso una hiperbilirrubinemia conjugada nunca es normal o fisológica.
Merece especial atención la hiperbilirrubinemia por incompatibilidad dentro de los primeros días de nacido. La BNC se une a la albúmina, pero si su producción es elevada una mayor fracción permanece libre y por su hidrofobicidad es capaz de atravesar la barrera hemato-encefálica y acumularse en el cerebro. Algunas regiones cerebrales (principalmente los ganglios basales, el hipocampo, el cerebelo y algunas áreas del tallo cerebral) muestran gran sensibilidad a la toxicidad de la BNC 52.
También hay varios factores que causan una liberación o desplazamiento de la bilirrubina de su unión con la albúmina, pudiendo de ese modo acumularse en el cerebro. Entre esos factores se incluyen: sepsis, acidosis, hipoxia, ácidos grasos libres y varias drogas de unión a la albúmina 20,24. También hay una serie de factores de riesgo que incluyen prematuridad, anemia hemolítica, deficiencia de la glucosa 6 fosfato deshidrogenasa, temperatura inestable, insuficiente toma de leche materna e hipoalbuminemia 53-55. En ausencia de factores de riesgo los niveles mayores de bilirrubina no son neurotóxicos, tal y como lo demostraron Gamaleldin y colaboradores, concluyendo que en ausencia de factores de riesgo los neonatos tienen una mayor tolerancia para la hiperbilirrubinemia (hasta 31.5 mg/dl de bilirrubina total sin presentar neurotoxicidad) 53.
Iskander y colegas señalan que las guías de la Academia Americana de Pediatría para tratar la ictericia neonatal y prevenir el kernicterus están basadas en los niveles de bilirrubina total ajustados para la ausencia o la presencia de factores clínicos de riesgo (por ejemplo edad gestacional, sepsis, anemia hemolítica entre otros). No obstante, al ser la bilirrubina libre mejor indicador de neurotoxicidad que la bilirrubina total, idealmente debería determinarse el nivel de bilirrubina libre, aunque no existe una prueba rutinaria para medir la Bf. En ausencia de dicha prueba estos autores proponen la medición de la relación bilirrubina/albúmina. Dicha razón brindaría un mejor estimado de la Bf que la bilirrubina total, pues contiene 2 de los tres factores que determinan la Bf (bilirrubina total, albúmina y la afinidad albúmina-bilirrubina) 25.
A pesar de todo el razonamiento anterior el uso de dicha razón parece no mejorar el valor predictivo de la bilirrubina total para prevenir el daño neuronal en casos de hiperbilirrubinemia. Igual conclusión alcanzan Hulzebos y colegas: el uso de la relación bilirrubina/albúmina no mejora el manejo de los neonatos hiperbilirrubinémicos a término comparado con el uso del valor de la bilirrubina total 56.
Es de notar que la BNC está presente en el cerebro bajo condiciones normales a concentraciones nanomolares 57. A estas concentraciones la BNC brinda neuroprotección contra el estrés oxidativo a las neuronas en cultivo y solamente llega a ser tóxica a concentraciones celulares ligeramente mayores. Fisiológicamente la principal fracción de la bilirrubina proviene de la degradación periférica de la hemoglobina. No obstante, este pigmento es también producido dentro del cerebro por el catabolismo de otras proteínas que tienen el grupo hem. Las células neuronales poseen la maquinaria bioquímica necesaria para mantener una concentración intracelular de BNC con los efectos benéficos de la bilirrubina 52. El daño ocurriría solamente cuando estos mecanismos son sobrepasados por una concentración extracelular BNC.
Conclusiones
La bilirrubina es un producto del catabolismo del grupo hem. Inicialmente se produce bilirrubina no conjugada que a nivel hepático es conjugada para ser eliminada por la bilis.
En el plasma la bilirrubina se encuentra unida en su mayoría a la albúmina y solo una pequeña fracción se encuentra libre.
La fracción libre de la bilirrubina puede atravesar las membranas biológicas y acumularse a nivel cerebral. Esta característica la hace potencialmente patógena a altas concentraciones.
Hay diferentes causas de hiperbilirrubinemia (prehepática, hepática y poshepática) y algunas de ellas son genéticas. Además, en algunos casos solo hay aumento de la bilirrubina no conjugada o de la conjugada o de ambas.
La determinación de la bilirrubina se considera tradicionalmente como un marcador de disfunción hepática, aunque se requiere de otras pruebas para mejorar el diagnóstico.
En la determinación de la bilirrubina debe considerarse la presencia de algunos factores interferentes: lipemia y hemólisis. Además, la muestra debe protegerse de la luz para evitar un valor falsamente disminuido.
A nivel neonatal es de vital importancia estudiar la causa de un aumento significativo de la bilirrubina total (conjugada o no conjugada).