Introducción
Se describe el caso de una paciente de 69 años, hipertensa, ex-tabaquista, a quien en una mamografía de control se le detalla la presencia de microcalcificaciones heterogéneas y agrupadas, localizadas en el cuadrante superior externo de la mama izquierda, acorde con una clasificación de BIRRADS 4B. Esto se traduce en una sospecha de malignidad moderada, alcanzando un 40% de valor predictivo positivo.1,10(ver figura 1)

Fig 1 Ejemplificación de microcalcificaciones agrupadas y heterogéneas. La distribución agrupada se refiere a un mínimo de 5 calcificaciones en 1mm3. Nótese que las microcalcificaciones de la imagen tienen distintos tamaños y son irregulares o heterogéneas. Esto corresponde a un BI-RADS 4B. (Imagen con fines ilustrativos Tomado de Rev Chil Rad. 2016;22(2):80-91).
Dado al hallazgo anterior, el siguiente paso a seguir en el manejo clínico de la paciente fue realizar una biopsia estereotáxica de la lesión, es decir, guiada mamográficamente.3
La muestra enviada a patología la constituían 4 cilindros de tejido que medían 1.5 cmx 0.2 cm en promedio, de los cuales se obtuvo material viable en 3 de los 4 cilindros. Al estudio histológico se observó una proliferación ductal atípica que no comprometía 2 mm en extensión ni dos unidades ductales contiguas, por lo que el diagnóstico fue “hiperplasia ductal atípica” (HDA), y se recomendó una excisión más amplia de la lesión con el fin de caracterizarla adecuadamente
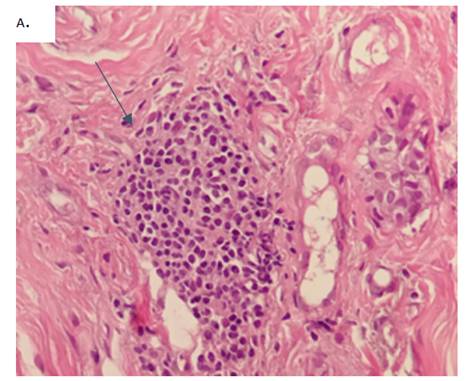
Figura 2. A Proliferación de células monomórficas, con núcleos aumentados de tamaño e hipercromáticos, equidistantes entre sí. Dichas células se restringen al ducto y están rodeadas de células mioepiteliales fusiformes
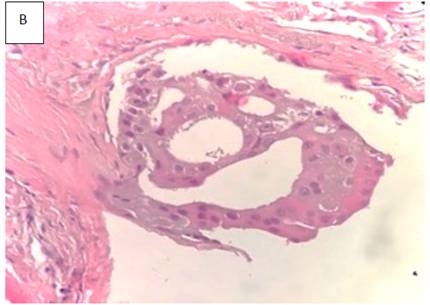
Fig 2. B Nótese la presencia de puentes rígidos, característicos en la HDA; la lesión también muestra una diferenciación de tipo apocrina, con citoplasma eosinofílico de tipo granular y vacuolado
En una segunda intervención, la paciente fue sometida a una biopsia guiada por arpón, y el espécimen enviado a Patología era sustancialmente más grande, compuesto por tejido mamario que medía 9x6x1cm. A la descripción macroscópica, se detallaron áreas sospechosas, las cuales se observaban de color blanquecino, de consistencia aumentada y mal definidas.
La pieza fue muestreada ampliamente y se incluyeron los márgenes quirúrgicos de rigor, identificándose una constelación de lesiones que se describen a continuación. La primera de ellas recapitulaba todos los hallazgos característicos de la hiperplasia ductal usual. (HDU) (ver figura 3).
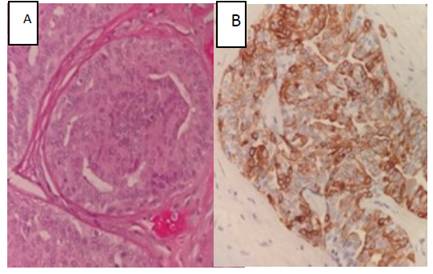
Figura 3 HDU. Proliferación de células con núcleos de diferentes formas y tamaños, superpuestos, orientados de manera desordenada. Se observan algunas inclusiones citoplasmáticas intranucleares y lúmenes alargados y serpentiginosos. B. La citoqueratina 5/6 dio una expresión en mosaico, como es típico de estas lesiones
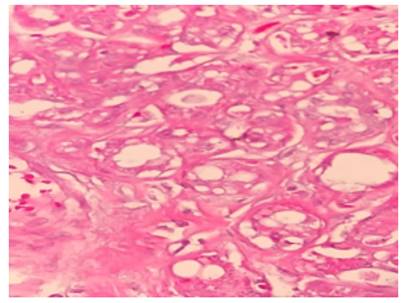
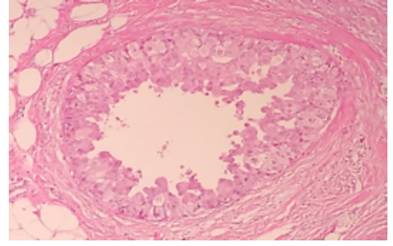
También aparecía en la muestra una lesión caracterizada por un cúmulo de glándulas con compresión variable y distorsión causada por la proliferación acompañante del estroma. Las glándulas o túbulos mostraban evidente morfología apocrina, y elevaron el índice de sospecha, pues existía la duda diagnóstica de si se trataba de un foco de adenosis esclerosante vs un foco de carcinoma microinvasor, particularmente por la coexistencia de carcinoma ductal in situ, lo cual se discutirá a posteriori. (figura 4)
El diagnóstico de adenosis esclerosante se pudo confirmar con la ayuda de la inmunohistoquímica (figura 5). Pero sin duda, el hallazgo más llamativo, era la presencia de carcinoma ductal in situ, el cual medía 1 cm de extensión mayor, tenía un alto grado nuclear (grado 3), y un patrón arquitectural de tipo cribiforme, micropapilar y sólido tipo comedonecrosis.
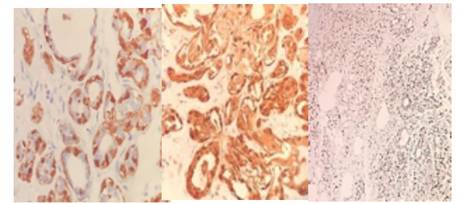
Figura 5 Marcadores de células mioepiteliales expresados en focos de adenosis esclerosante dentro de la lesión. De izquierda a derecha. S100 (positividad nuclear y citoplasmática), calponina (positividad en citoplasma), p63 (positividad puntiforme nuclear).
Asimismo, las características citológicas guardaban semejanza con las lesiones apocrinas de la mama. En cuanto a los márgenes, el margen inferior contenía carcinoma ductal in situ a menos de 1 mm de la tinta, mientras que el resto de los márgenes eran negativos, situándose a más de 1 cm de la lesión principal. Todas estas características se recapitulan a continuación (ver figuras de la 6 a la 9).
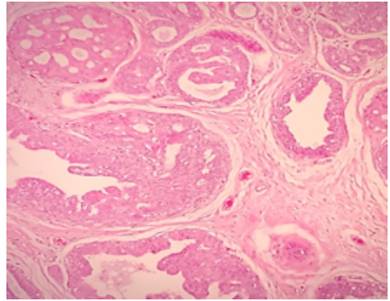
Figura 6 Cancerización del lobulillo por la presencia de una proliferación compleja de células con atipia marcada. Nótese el patrón cribiforme en la esquina superior izquierda y el patrón micropapilar en la esquina inferior izquierda. El estroma es desmoplásico
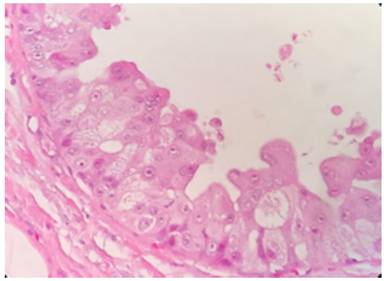
Figura 8 Características citológicas. Algunas células tienen un tamaño ≥ 2.5 el tamaño de un eritrocito. Nótense los nucléolos prominentes y rojizos, el citoplasma granular eosinofílico y las secreciones apicales propias de las lesiones apocrinas. La flecha indica una figura mitótica.
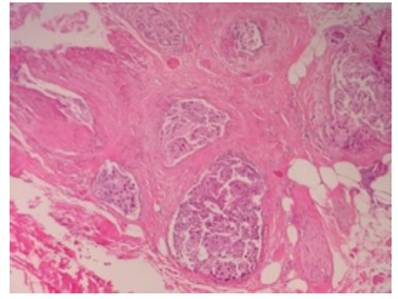
Figura 9 Margen inferior comprometido por el tumor. Obsérvese que la lesión está cerca de una fibra nerviosa sin llegar a infiltrarla (flecha)
La naturaleza apocrina de esta lesión fue ratificada por medio del uso de inmunohistoquímica, como se ejemplifica aquí.
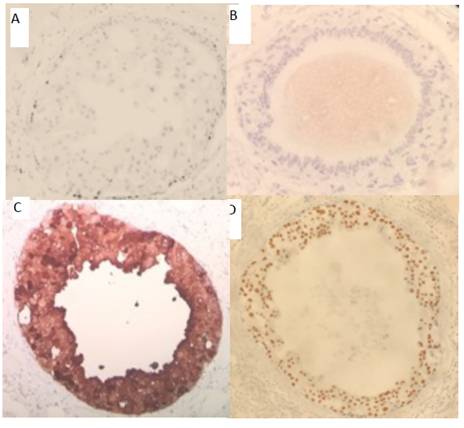
Figura 10 Carcinoma ductal in situ con diferenciación apocrina. Negatividad para estrógenos en A y para progesterona en B. Expresión citoplasmática de GCDFP15 en C. y positividad nuclear de receptores de andrógenos en D
Cabe aclarar que si bien es cierto en la mayoría de la lesión la expresión de receptores estrogénicos fue negativa, en otras áreas de la muestra la expresión fue fuerte e intensa, lo cual podría corresponder a áreas convencionales de hiperplasia ductal con atipia o a áreas de carcinoma ductal in situ, lo cual viene a suponer heterogeneidad dentro del mismo tumor.
Por último, por lo singular de este caso, se discutió en sesión hospitalaria interdisciplinaria, en conjunto entre: patología, cirugía oncológica y radiología, y se decidió que la conducta quirúrgica a seguir sería la mastectomía. A la paciente se le consultó su opinión al respecto, y ella avaló la decisión de los médicos tratantes.
DISCUSIÓN
Las microcalcificaciones, que en este caso constituyeron el primer signo clínico de enfermedad en la paciente, son el signo clínico más prevalente en 55% de los cánceres de mama no palpables, y son la principal forma de manifestación del carcinoma ductal in situ.10
La toma de biopsia de lesiones no palpables en la mama es una técnica que ha venido mejorando con la puesta en práctica de métodos tecnológicos más precisos, como lo son la biopsia estereotáxica y guiada por arpón. Anteriormente se recurría al uso del ultrasonido como guía sonográfica para la toma de la biopsia. La principal ventaja radicada en la no exposición a radiación ionizante, sin embargo, el US tiene como limitante el que sólo detecta una mínima cantidad de microcalcificaciones.11
Por otra parte, la biopsia estereotáxica capta hasta el 94% de las microcalcificaciones presentes, aún más si se utiliza un equipo de mamografía digital.1Cuando la biopsia es de mayor tamaño a una tipo trucut (p.e, una biopsia excisional), el radiólogo suele marcar el área sospechosa por medio de la colocación de un arpón o guía metálica.11
En cuanto al carcinoma in situ de la mama, históricamente fue descrito a principios del siglo XX por cirujanos interesados en la apariencia histológica de los tumores que ellos resecaban clínicamente.14El término en latín “in situ” revela la naturaleza no invasora de esta lesión, la cual tiene una prevalencia aproximada de 5% en mujeres mayores de 50 años, edad límite a partir de la cual la enfermedad va en ascenso. Factores de riesgo incluyen: historia familiar, mutación del gen BRCA, menopausia tardía, uso de terapia de reemplazo hormonal e índice de masa corporal elevado luego de la menopausia.14
Éstas suelen ser lesiones no papables, con anormalidades en la mamografía. En particular, las calcificaciones distróficas son el tipo de presentación típico en carcinomas con comedonecrosis 3,16, como lo era el presente caso.
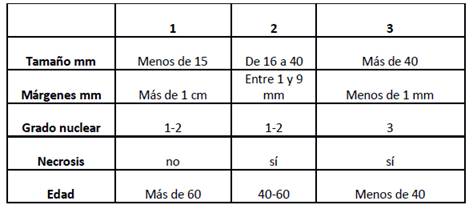
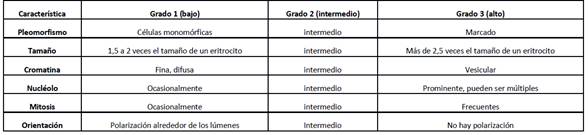
Además, el CA ductal in situ coexiste con lesiones proliferativas de la mama como la HDA, con quienes comparte alteraciones citogenéticas como la pérdida del 16q y 17p, y la ganancia del 1q.16El grado nuclear es uno de los valores pronósticos más importantes en el caso del CA in situ, y existen varias tablas que ayudan a su determinación ( ver tabla 1).
CARCINOMA IN SITU APOCRINO
El carcinoma in situ con características apocrinas se caracteriza por una proliferación de células apocrinas que muestran una atipia marcada, con núcleos aumentados de tamaño, nucléolos prominentes y membranas nucleares irregulares.
La comedonecrosis se encuentra invariablemente en casi todos los casos, y las lesiones suelen ser muy heterogéneas.12 Existe controversia en definir la atipia citológica en las lesiones apocrinas, pues éstas presentan agrandamiento nuclear y muy a menudo tienen nucléolos prominentes. Esto hace un ejercicio diagnóstico complejo el diferenciar entre CA ductales in situ apocrinos de bajo grado y lesiones con metaplasia apocrina.6 Por tanto, en estos casos a veces pesa más el patrón arquitectural (la presencia de comedonecrosis), la extensión de la lesión (CA in situ suelen tener tamaños mayores a 0.4 cm14) y la extensión lobulocéntrica de la lesión, como se logra constatar en el caso presentado.
Tabla 1 Graduación nuclear de los carcinomas in situ. Tomado de Arch Patholo Lab Med 2009; 133:15-25.
Cabe mencionar la concurrencia de los CA in situ de tipo apocrino con lesiones como la adenosis apocrina atípica y el carcinoma tubular. Un estudio retrospectivo de tipo cohorte de 37 pacientes diagnosticadas con adenosis esclerosante atípica, determinó que 3 pacientes (un 8% de la muestra), desarrolló progresión a cáncer, de los cuales 33% correspondía a carcinoma in situ in 66% a un carcinoma invasor.2,4,6
ALTERACIONES GENÉTICAS Y PERFIL INMUNOHISTOQUÍMICO
El número de alteraciones citogenéticas en los CA in situ e invasores de tipo apocrino es de 10.1, en comparación con 4.2 como promedio en la hiperplasia apocrina benigna.Las alteraciones más comunes son pérdidas de heterocigosidad: ganancias en 1q,2q,1p, y pérdidas de 1p, 22q,17q,12q y 16q.9
La sobreexpresión de HER2-neu también es común en por lo menos 47% de los CA ductales in situ apocrinos, particularmente en los de alto grado nuclear.12 El bcl2 es un gen antiapoptótico que inhibe la acción de caspasas mediada por mitocondrias y que se expresa en carcinomas de mama estrógenos (+), por lo que no es de extrañar que su expresión se encuentre disminuida en los carcinomas apocrinos.9
Adicionalmente, análisis de electroforesis en gel efectuados al líquido de quistes mamarios con diferenciación apocrina encontrados en mamas con enfermedad fibroquística, permitió la identificación de sustancias como la proteína globular mejor conocida como GCDFP15 por sus siglas en inglés.12,15
Es notorio que las lesiones apocrinas tienen un perfil de expresión único de receptores hormonales, siendo por lo general negativas para estrógenos y progesterona, y positivas para recetores de andrógenos. Este perfil no suele mantenerse por completo en los carcinomas invasores. Asimismo, una pequeña cantidad de carcinomas apocrinos in situ tiene positividad al menos focal para receptores de estrógeno (aproximadamente un 6%).6,9,15
BIOLOGÍA MOLECULAR Y POSIBLES DIANAS TERAPÉUTICAS
Normalmente, existe un efecto antagónico entre los estrógenos/progesterona y los andrógenos en el núcleo celular de las células ductales mamarias, lo cual supedita las diferencias embriológicas entre la mama masculina y femenina.8
Numerosos estudios ratifican el hecho de que los andrógenos se expresan en carcinomas de mama estrógenos (+), y que las pacientes con altos niveles de andrógenos en el tumor tienen una mejor sobrevida comparado con las que no lo tienen.8 Esto porque los andrógenos actúan como un gen supresor tumoral al unirse al ligando del receptor estrogénico en el núcleo celular y bloqueándolo. Sin embargo, en tumores estrógeno/progesterona (-), como el caso del apocrino, el receptor de andrógenos funciona más bien como un oncogen al unirse al ligando nuclear del receptor estrogénico y mimificar las funciones proliferativas del mismo sobre el epitelio ductal8 (figura 11).
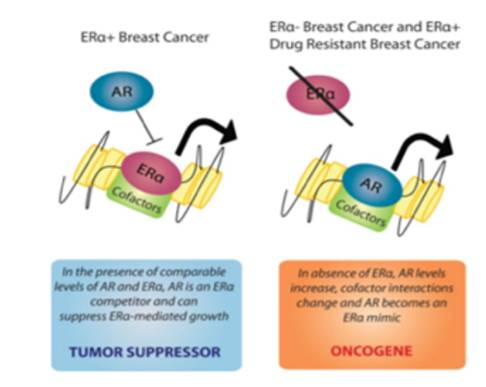
Figura 11 Efecto camaleónico del receptor de andrógenos sobre el tejido mamario. (Tomado de Molecular Endocrinology 26: 1252-1267, 2012)
De particular mención es que un estudio publicado en 2013 que siguió a 424 pacientes con tumores de mama estrógenos/progesterona (-), determinó que 12% de estas pacientes poseían tumores positivos para andrógenos, de las cuales un 19% se benefició de la toma de bicalutamide, un fármaco inhibidor de andrógenos7, lo cual deja en evidencia la importancia de reconocer y diagnosticar oportunamente los carcinomas in situ e invasores con diferenciación apocrina, con la finalidad de brindar a la paciente la mejor línea de tratamiento disponible para su caso específico.
CONDUCTA TERAPÉUTICA DE ACUERDO CON EL RIESGO DE RECURRENCIA DE LOS CA IN SITU
Si se aplicara el índice pronóstico de van Nuys modificado a nuestra paciente (tabla 2), el cual brinda un puntaje según el riesgo de recurrencia de la enfermedad, se puede determinar que lo más adecuado en el caso de nuestra paciente es la mastectomía. Siguiendo el esquema de la tabla 2 se recomienda: excisión entre 4-6 puntos, excisión+radioterapia entre 7-9 puntos y mastectomía entre 10-12 puntos.5
Es probable que también la misma se beneficie de radioterapia local, la cual ha probado disminuir la recidiva de estas lesiones en un 50%.13
CONCLUSIÓN
El carcinoma ductal in situ de la mama con características apocrinas es una lesión de muy baja incidencia, con rasgos morfológicos, biológicos e inmunofenotípicos distintivos. Si bien es cierto muchos carcinomas in situ y carcinomas invasores pueden tener diferenciación apocrina focal, esto no los convierte en lesiones apocrinas verdaderas.