Introducción
El riñón, así como sucede con otros órganos del cuerpo humano sufre cambios con el envejecimiento, tanto a nivel funcional como estructural, los cuales han sido motivo de estudio a lo largo de los años en seres humanos y animales. Estos cambios se han relacionado mayormente a factores externos que actúan sobre el organismo aunque también se ven influenciados por la acción de la genética. A su vez, podrían verse desencadenados y/o acelerados por otras patologías como lo son la Hipertensión Arterial o la Diabetes Mellitus.
Esta revisión bibliográfica intenta abarcar los principales cambios renales que han sido descritos a nivel morfológico asociados con la edad.
En cuanto a la fisiología y anatomía renal, este es un órgano cuya función principal es mantener la homeostasis del cuerpo humano, el cual contiene alrededor de un millón de nefronas; pequeñas unidades estructurales que se componen de dos partes: el glomérulo, ovillo de capilares sanguíneos, y un sistema de túbulos, donde ambas partes se encuentran interconectadas.
Su vasculatura se encuentra recubierta por células endoteliales frenestradas, que se encuentran separadas del espacio urinario (de la cápsula de Bowman) por la membrana basal. Dicha membrana, a su vez, se encuentra recubierta por células que parecen tener una función crucial en cuanto a mantener la estructura glomerular normal y la permeabilidad capilar, llamados podocitos. Además, entre las asas capilares se ubican las células mesangiales quienes sirven de sostén, secretan la matriz mesangial y regulan la hemodinámica intraglomerular. (Fisiología renal, Ulate, 2012, Wiggins, 2012, Hazzard, 2009)
Mecanismos de Envejecimiento
Existen múltiples teorías en relación a la razón u origen del proceso de envejecimiento humano; sin embargo, entre las más aceptadas se encuentra la teoría acerca de la acción de factores externos sobre un organismo normal y la teoría de la programación genética, donde estas ideas no son excluyentes entre sí, ya que una podría funcionar como desencadenante de la otra.
La primera incluye la acción del estrés oxidativo por medio de radicales libres de oxígeno (ROI), intermediarios en la cadena respiratoria, los cuales tienen la capacidad de producir cambios bioquímicos en diferentes sustancias para la función celular normal, incluyendo entre ellas lípidos, proteínas e incluso ácidos nucleicos con el subsecuente daño celular a nivel estructural y funcional. Es importante mencionar que el nivel de estas macromoléculas mencionadas que muestran daño oxidativo se ven aumentados en organismos de edad avanzada.
A su vez, la teoría de la acción de factores externos también incluye la presencia de productos de la glicosilación avanzada (AGEs) donde su interacción con receptores de células específicas está asociado al desarrollo de cambios funcionales y estructurales similares a los que caracterizan al envejecimiento renal, aunque estos efectos se pueden observar en diferentes órganos y sistemas. Esta teoría sobre los factores externos se ve apoyada por estudios relacionados a la restricción calórica en ratones donde aquellos con esta dieta restrictiva documentaron una mayor sobrevida libre de patología renal asociada al envejecimiento.
Además, existe una relación cercana entre AGEs y ROIs, ya que ROIs parecen ser generados en células posterior a su interacción con los receptores de AGEs, y estos últimos pueden sufrir daño oxidativo en este proceso para consecuentemente generar la acumulación de productos de la glicoxidación como carboximetil considerado un buen marcador de daño tisular relacionado con la edad avanzada.
En cuanto a la segunda teoría indicada, esta señala que la esperanza de vida de cualquier organismo está determinada por una programación genética específica; aunque, un mecanismo exacto para describir este proceso no se encuentra definido. (Sobamowo, Prabhakar, 2017, Wiggins, 2012, Abizanda, 2012, Tratado de Geriatría y Gerontología, Morales, 2017)
Cambios estructurales a nivel renal con el envejecimiento
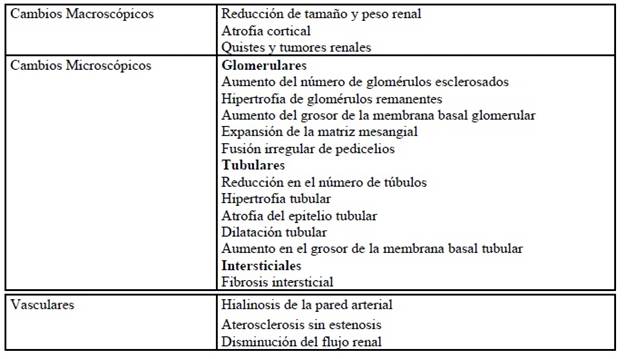
Como se mencionó anteriormente, el desarrollo del envejecimiento parece conllevar una serie de cambios tanto funcionales como estructurales, los cuales, se debe indicar, no son patognomónicos de este proceso ya que se encuentran presentes en diferentes patologías como lo son la hipertensión arterial y la diabetes mellitus. Para efecto del presente artículo se abordarán únicamente los cambios morfológicos renales asociados a la vejez nombrados en la Tabla 1. (Wiggins, 2012)
Cambios Macroscópicos
Reducción de tamaño y peso renal (Atrofia cortical)
La masa renal aumenta progresivamente desde 50 gramos al nacimiento y hasta 400 gramos o más a los 40 años. Después de esto disminuye a menos de 300 gramos al alcanzar la década de los 90 años. La pérdida de peso y tamaño es ocasionada por una reducción progresiva de la corteza renal con un ahorro relativo por parte de la hipertrofia tubular que conforma el volumen medular para compensar esta esclerosis y atrofia de las nefronas superficiales en la corteza.
Esta compensación en la disminución progresiva del peso renal mencionado se mantiene hasta los 50 años aproximadamente donde el volumen cortical declina en ambos sexos mientras el volumen medular disminuye solo en mujeres manteniéndose relativamente estable en hombres.
Según Nyengaard y Bendtsen quienes en su estudio desean determinar mediante una revisión de autopsias sobre el metabolismo y función renal según la edad, y sobre si un decline es causado por una menor cantidad o un menor tamaño glomerular; logran determinar que el tamaño renal está influenciado por factores tanto genéticos como ambientales. Es así como el número de glomérulos esta genéticamente indicado al nacimiento.
El tamaño renal es dependiente del número y tamaño de las nefronas mostrando una correlación negativa entre la edad, el número y tamaño glomerular siendo esta una razón por la cual el peso renal disminuye con la edad.
Una causa que puede ocasionar que no se objetive esta reducción en el peso es el no definir el aumento en la grasa renal asociado con la senectud donde no se logra distinguir el parénquima de otras estructuras no parenquimatosas. (Denic, Glassock, Rule 2016, Kappel, Olsen 1980, Nyengaard, Bendtsen, 1992, Sobamowo, Prabhakar 2017, Zhou, Rakheja, Yu, Saxena, Vaziri, Silva, 2008,E.Hoy, Douglas-Denton, Hughson 2003)
Quistes y tumores renales
La presencia de quistes parenquimales a nivel renal es un hallazgo común y generalmente benigno (a no ser que se presente una patología autosómica dominante renal o que se deba a malignidad). A su vez, con el envejecimiento su aparición se vuelve más frecuente, en mayor abundancia y tamaño.
Es importante resaltar que la aparición de tumores renales puede encontrarse relacionada a la acumulación de daño genético con pérdida del control del ciclo celular asociada, sin embargo sería necesaria una mayor investigación para aclarar este punto. (Denic, Glassock, Rule 2016, Martin, 2007).
Cambios Microscópicos
Glomerulares
Un glomérulo esclerótico se define como aquel donde se presenta una obliteración global, acelular de los ovillos en forma total o casi total.
Dicho esto, se conoce que con la senectud el número de glomérulos disminuye y también ocurre un cambio en su forma con una disminución en la lobulación y en la longitud del perímetro del ovillo glomerular relacionado al área total, con colapso del ovillo. Este es un proceso que típicamente inicia alrededor de los 40 años, que empieza de forma segmental con solo una parte de glomérulo tornándose acelular mientras la arquitectura normal se ve reemplazada por matriz celular.
El ovillo glomerular se adhiere a la cápsula de Bowman y luego progresivamente el glomérulo se esclerosa. También el espacio de Bowman se ocupa por un material hialino parecido a la matriz mesangial y se da el engrosamiento de la membrana basal glomerular; esto probablemente ocasionado por el desbalance entre la formación y la descomposición de la matriz extracelular en el glomérulo, donde finalmente el ovillo glomerular colapsa llevando al desarrollo de una esclerosis glomerular global y perdida de la capacidad de filtración de la nefrona.
Se desconoce cuál es exactamente el motivo que desencadena este proceso de eslcerosis que se da indiscriminadamente en la corteza renal. Sin embargo, lo que se conoce es que el ovillo glomerular normal aumenta de tamaño con la edad, y junto a esto se da una expansión de células endoteliales y mesangiales, para que así la proporción de células por área glomerular se mantenga constante. Mencionado esto y el conocer que los podocitos son postmitóticos: no son capaces de aumentar en número, se convierten en un menor porcentaje de población celular por área glomerular. Al aumentar el área que tienen que cubrir se cree que los podocitos podrían caerse de la membrana basal, dejando así, una zona descubierta la cuál actuaría como gatillo para el proceso de esclerosis.
Por ello se cree que la célula clave en glomeruloesclesis es el podocito, teoría que se evidencia con la presencia de mutaciones en proteínas que expresan los podocitos en enfermedades genéticas que manifiestan fenotipos de gomeruloesclerosis en forma temprana y acelerada. Otro factor que apoya esta hipótesis es que se ha logrado encontrar podocitos y sus constituyentes en la orina en asociación con glomeruloesclerosis.
Es por esto que existe el concepto de que la glomeruloesclerosis del envejecimiento en una “enfermedad del podocito” y que existe la hipótesis sobre que con su progresiva reducción numérica y funcional asociada a dicha incapacidad de reproducción, conlleva a decline glomerular y deterioro de la integridad de la membrana porosa. (Hazzard, 2009, Wiggins, 2012, Denic, Glassock, Rule, 2016).
Según Kaplan, Pasternack, Shah y Gallo, en su publicación realizada hace aproximadamente 4 décadas, en los hallazgos propuestos sugieren que en pacientes con edad menor o igual a 40 años la presencia de esclerosis glomerular en un porcentaje mayor al 10% se catalogó como relacionado a enfermedad, mientras en pacientes mayores de 40 años (principalmente los mayores de 50) existe un proceso transicional involutivo, esclerótico por lo que su relación con la presencia de una patología se vuelve menos clara.
Asimismo, Kremers y colaboradores en 2015 realizan un estudio cuyo interés se basa en determinar el límite superior normal para el número de glomérulos esclerosados en forma global.
En él determinan los predictores independientes de esta esclerosis: edad, número total de glomérulos y área de corteza. También estiman el percentil 95 para el número global de glomérulos esclerosados por el total de glomérulos, el cual en una biopsia, una sección con 17-32 glomérulos totales: el percentil 95 varía de 1 para una persona de 20 años y de 5.5 para una de 70 años. En otras palabras o en aras de resumen: valor mayor al dictado por el percentilo sugiere presencia de patología crónica en exceso de la esperada con el envejecimiento normal. (Kremers, Denic, Lieske, Alexander, Kaushik, Elsherbiny, Chakkera, Poggio, Rule 2015, Kaplan, Pasternack, Shah, Gallo, 1975, Sobamowo, Prabhakar, 2017, Denic, Glassock, Rule 2016)
Es razonable esperar que con el aumento en la glomeruloesclerosis global relacionada a la edad se genere una hipertrofia compensatoria en las nefronas restantes. La densidad glomerular correlaciona inversamente con el volumen promedio de glomérulos no esclerosados y el perfil de área tubular. Es por esto que cuando se da la hipertrofia de una nefrona, esta se aleja del glomérulo ocasionando una disminución de su densidad. La densidad glomerular es menor en biopsias en las que menos del 10% del total de glomérulos se encuentran escleróticos, lo que sugiere que la hipertrofia de la nefrona con la edad puede ser detectada en zonas sin nefroesclerosis significativa. La densidad glomerular es mayor con zonas con más del 10% de glomérulos escleróticos, sugiriendo así que en regiones de nefroesclerosis significativa la atrofia de las nefronas con la edad acerca a los glomérulos entre sí. (Denic, Glassock, Rule 2016)
Estos cambios, es necesario recordar, son también característicos de muchas condiciones renales y son a menudo vistos más frecuentemente en personas de edad avanzada haciendo en algunos casos difícil evaluar el rol de la edad en estos cambios. (Martin, 2007)
Tubulares
La pérdida de volumen secundaria a las lesiones secundarias a la glomeruloesclerosis global con atrofia de los túbulos correspondientes podría explicar el decline en el volumen cortical renal asociado a la edad. De la misma forma, la hipertrofia de los glomérulos no esclerosados y sus túbulos correspondientes podrían ayudar a mantener el volumen parenquimal renal con el envejecer, al menos hasta la mediana edad.
Con la pérdida glomerular la sección tubular de la nefrona generalmente se degenera y es reemplazada por tejido conectivo, la hipertrofia tubular ocurre entonces en las nefronas remanentes, principalmente en las del túbulo contorneado proximal. Esto parece resultar tanto de la hipertrofia como de la hiperplasia.
Con el adelgazamiento de la corteza hay una disminución en el largo del túbulo y el desarrollo de divertículos en el túbulo contorneado distal.
Con la pérdida de nefronas se genera una fibrosis intersticial tubular generalizada. (Hazzard, 2009, Denic, Glassock, Rule, 2016)
Vasculares
Las arterias renales están sometidas a un engrosamiento relacionado con el envejecimiento similar al visto en toda la circulación corporal. Las arterias pequeñas pueden tornarse tortuosas con presencia de irregularidades en su lumen.
La arteriosclerosis de las arterias pequeñas parece ser la causa de injuria isquémica sobre las nefronas que con el pasar del tiempo puede progresar a una glomeruloesclerosis global y atrofia tubular, cuyos principales cambios fueron mencionados en el apartado de glomeruloesclerosis.
Cuando el glomérulo se esclerosa es frecuente la formación de un shunt (derivación) arterio venoso entre la arteriola aferente y eferente, desarrollando una conexión directa que es muy importante para el mantenimiento de flujo medular mientas declina la perfusión cortical.
El flujo renal decrece con el envejecimiento en proporción al gasto cardíaco lo que predispone a falla renal aguda, anormalidades electrolíticas y sobrecarga de volumen.
Existe la posibilidad de infartos renales ya que una quinta parte del volumen circulatorio pasa a través del riñón cada minuto y es particularmente susceptible a embolización. (Hazzard, 2009, Denic, Glassock, Rule, 2916, Sobamowo, Prabhakar, Martin, 2007, Kubo M, 2003)
Conclusiones
Los riñones son órganos hemostáticos que no están exentos a cambios a nivel anatómico y funcional como consecuencia del paso de los años.
Existen dos teorías que respaldan principalmente estos cambios y que continúan siendo aún tema de investigación hoy en día y que tratan de explicar el mecanismo fisiopatológico exacto del porqué ocurre esto.
Con el envejecimiento la anatomía corporal cambia grandemente, a nivel renal este cambio se ve reflejado tanto de manera macroscópica como microscópica, así como ocurre también a nivel vascular; cada una de estas descripciones han sido producto de un sinfín de trabajos investigativos realizados mediante autopsias y también a través de biopsias tomadas a donantes renales vivos.
Dichos cambios tienen implicaciones también a nivel funcional que no son tema de discusión en esta revisión pero que deben ser tomadas en cuenta ya que la suma de ambas vuelve a nuestros pacientes vulnerables a otras patologías e incluso implica un cambio a la hora de realizar un abordaje terapéutico.