Introducción.
Las enfermedades cardiovasculares (ECV) constituyen la principal causa de muerte en el mundo y un grave problema de salud pública 1. Aunque la aterogénesis es un proceso multifactorial, las anormalidades en el metabolismo lipoproteico es uno de los factores claves, representando más del 50% del riesgo atribuible a la población de desarrollar una enfermedad cardiovascular 2.
La reducción del nivel de colesterol-LDL por medio del tratamiento con estatinas reduce el riesgo de las enfermedades cardiovasculares (ECV). En consecuencia, en los pacientes con alto riesgo cardiovascular, debido a la dislipidemia, la mayoría de las guías recomiendan el colesterol LDL como el primer blanco del tratamiento 3.
No obstante, luego de la disminución del colesterol LDL siempre queda un riesgo residual de sufrir ECV. Entonces ha habido un gran esfuerzo por descubrir y definir otros factores implicados en el riego cardiovascular. Diferentes hallazgos sugieren que los altos niveles de triacilglicéridos (TAG) y los bajos niveles de colesterol HDL contribuyen a este riesgo residual 4.
El propósito de este trabajo es describir la contribución de los triacilglicéridos al proceso de la aterogénesis y su papel como un factor de riesgo cardiovascular.
Metabolismo de las lipoproteínas ricas en tag.
Los TAG están formados por una molécula de glicerol esterificada con tres ácidos grasos y constituyen una fuente importante de energía para muchos órganos y tejidos. Los TAG son insolubles en el plasma y deben ser transportados, junto con el colesterol y los fosfolípidos, dentro de partículas esféricas llamadas lipoproteínas.
Las lipoproteínas son partículas macromoleculares esféricas que transportan lípidos en la sangre y presentan una parte central interna formada por lípidos no polares (TAG y colesterol no esterificado) y una monocapa superficial de lípidos polares (fosfolípidos y colesterol no esterificado). Además, tienen una o más apolipoproteínas asociadas a la partícula 5.
Hay cinco clases principales de lipoproteínas según su densidad: quilomicrones (QM), lipoproteínas de muy baja densidad (VLDL, del inglés “very low density lipoprotein”), lipoproteína de densidad intermedia (IDL, del inglés “intermediate density lipoprotein”), lipoproteína de baja densidad (LDL, del inglés “low density lipoprotein”) y lipoproteína de alta densidad (HDL, del inglés “high density lipoprotein”). Cada tipo particular de lipoproteína tiene una composición lipídica y función definidas. Adicionalmente, también cada partícula lipoproteica tiene su composición proteica característica. La apolipoproteína apo B100 es la principal proteína estructural de la VLDL y la apo B48 es la principal apolipoproteína del quilomicrón 6.
Conteniendo principalmente TAG en su parte central, los QM y las VLDL son las principales partículas transportadoras de TAG en el plasma y son también las lipoproteínas de mayor tamaño. Los QM transportan lípidos exógenos, obtenidos de la dieta y las VLDL lípidos endógenos. A ambos tipos de lipoproteínas, y a sus remanentes, se les conoce como las lipoproteínas ricas en TAG (TRL, del inglés “triglyceride-rich lipoproteins) 7, aunque propiamente hablando los remanentes de TRL son pobres en TAG y ricos en colesterol por la acción de la enzima lipoproteín lipasa (LPL) y de otras lipasas.
Los QM son sintetizados en el intestino a partir de los lípidos de la dieta y cuantitativamente hablando su principal constituyente son los TAG. Las VLDL son producidas en el hígado con ácidos grasos procedentes de tres fuentes endógenas: ácidos grasos provenientes de los ácidos grasos unidos a la albúmina, ácidos grasos procedentes de los remanentes de lipoproteínas captadas por el hígado y ácidos grasos sintetizados en el hígado. Estos ácidos grasos de todas estas fuentes forman los TAG de las VLDL 8. Ambos tipos de lipoproteínas adquieren varias apolipoproteínas (apo C-II, apo C-III y apo E) en la circulación a partir de la HDL.
A nivel de los capilares de los músculos, del tejido adiposo y del corazón, principalmente, los QM y las VLDL son metabolizadas por la LPL. La acción de esta enzima es hidrolizar los TAG de ambas partículas, liberando glicerol y ácidos grasos y originando una partícula remanente, remanente de QM y remanente de VLDL 9.
La apo E presente en la superficie de ambas lipoproteínas remanentes funciona como un ligando para la eliminación de ambas partículas por medio de diferentes receptores: el receptor de LDL (LDLR), la proteína relacionada al receptor de LDL (LRP, del inglés “protein related receptor LDL”), el receptor de VLDL y el receptor de apo E 10.
Una fracción importante de los remanentes de VLDL son eliminados por medio de los receptores citados y la otra mitad sufre lipólisis adicionales por medio de la LPL. Esta lipólisis adicional genera la IDL, una lipoproteína más pequeña y más densa. Una fracción de las partículas de IDL son tomadas por receptores del hígado, el resto interactúa con la lipasa hepática y es convertida en LDL, la principal lipoproteína fuente de colesterol para las células 5. Según Vergés aproximadamente el 90% de las IDL son convertidas en LDL 11.
La LDL es removida de la circulación por medio del LDLR presente en el hígado y en otros tejidos y órganos. El principal ligando para este receptor es la apo B-100 12. Las partículas de LDL interactúan débilmente con el receptor, lo cual resulta en una vida media prolongada de esta lipoproteína en el plasma (días) comparado con el resto de las partículas restantes (horas). La consecuencia de esto es que el colesterol LDL es la forma predominante de colesterol en el plasma humano 5.
En general, los TAG son transportados en el plasma en QM, VLDL y sus remanentes, creados durante el metabolismo lipoproteico y por eso se les conoce como TRL. Las TRL son altamente heterogéneas en su tamaño, densidad, composición y riesgo cardiovascular asociado. El riesgo vascular asociado depende del tamaño, la composición y la concentración lipídica de la partícula correspondiente 13.
Los triglicéridos y el riesgo cardiovascular
Los niveles de TAG son útiles para identificar individuos con riesgo alto de ECV, específicamente midiendo el nivel de TAG posprandial en la población no diabética. En los diabéticos es más difícil establecer esta relación, porque una vez que la diabetes se desarrolla los pacientes están expuestos a una gran variedad de otros factores de riesgo. Entonces el riesgo aportado por el nivel de TAG posprandial puede ser visto como un factor dentro de un océano de factores de riesgo en pacientes con diabetes mellitus 14.
Diferentes autores señalan que los niveles elevados de TAG se asocian o predicen un mayor riesgo de ECV 15,16.
Incluso, la literatura señala que la relación entre la hipertrigliceridemia y la enfermedad cardíaca coronaria se mantiene aun después de ajustar por la presencia de factores de riesgo asociados tales como niveles de colesterol HDL, edad, colesterol total, IMC, hipertensión, diabetes, fumado, consumo de alcohol, inactividad física y posmenopausia 17,18.
Kannel y colegas indican que la influencia de los TAG sobre la enfermedad arterial coronaria se extiende a través de los llamados valores normales, sin que exista un valor crítico 19.
A la inversa, la hipotrigliceridemia se asocia con un bajo nivel de riesgo de ECV 20. En consecuencia, el tratamiento de los TAG elevados reduce los eventos cardiovasculares, las muertes cardíacas y la mortalidad total 4.
Dentro de la literatura se hace la distinción entre la medición de TAG en ayunas y no en ayunas, o posprandial, señalándose que la asociación es más significativa entre los TAG posprandiales y la ECV 21-23. Toth señala que ambas determinaciones son predictores significativos de eventos cardiovasculares, pero que los niveles de TAG no en ayunas son predictores más fuertes 3. La razón obedece a que los TAG posprandiales reflejan el nivel de los remanentes de TRL, que se consideran más aterogénicos que las lipoproteínas intactas, debido a su menor tamaño y mayor contenido de colesterol. De forma más precisa, los TAG posprandiales determinan el nivel del colesterol presente en los remanentes de TRL 18.
Aunque también se señala el punto de vista que ambas determinaciones de TAG (en ayunas y posprandial) son igualmente predictivas de enfermedad cardíaca coronaria o de eventos cardiovasculares 24.
Los triglicéridos y la aterogénesis.
Algunos autores proponen que las TRL contribuyen directa e indirectamente a la progresión de la aterosclerosis 3,17.
Al respecto se proponen dos tipos de mecanismos: directo e indirecto (Figura 1).
Las lipoproteínas en la circulación normalmente fluyen hacia el interior y el exterior de la pared arterial por transcitosis.
Este transporte está restringido a las lipoproteínas con un diámetro menor de 70 nm. Entonces las partículas más grandes, los quilomicrones y las VLDL grandes (VLDL1), no pueden atravesar el endotelio 25 y el resto de las lipoproteínas, VLDL más pequeñas (VLDL2), LDL, remanentes de TRL y HDL, sí pueden hacerlo.
Estudios experimentales muestran que el tamaño de la partícula es un factor determinante del grado de aterogenicidad.
Mientras que los quilomicrones y las VLDL grandes no penetran la pared arterial, los remanentes de ambas partículas sí lo hacen y son retenidos por la matriz extracelular y posteriormente captados por los macrófagos hasta convertirse en las células espumosas. La acumulación tanto de remanentes de quilomicrones como de VLDL ha sido demostrada en placas ateroscleróticas humanas y de conejo 26-28.
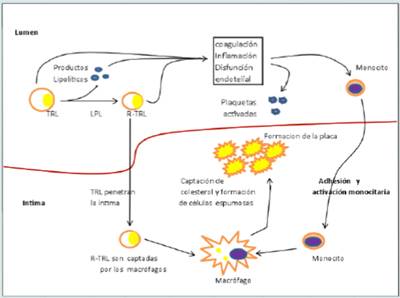
Figura 1 Mecanismos propuestos de la participación de las TRL en el proceso de la aterogénesis. LPL: lipoproteín lipasa, TRL: lipoproteínas ricas en triglicéridos, R-TRL: remanentes de lipoproteínas ricas en triglicéridos. (Adaptado de la referencia 3).
Las partículas remanentes de TRL se originan cuando los quilomicrones y las VLDL son hidrolizadas de sus TAG por la LPL y son posteriormente enriquecidas con ésteres de colesterol por la acción de la enzima CETP (del inglés “cholesterol ester transfer protein”) 23.
Para evitar la cascada aterogénica inflamatoria los remanentes de TRL deben ser eliminados del plasma por medio de receptores presentes en el hígado. En personas con enfermedad cardiovascular las TRL permanecen aumentadas en la circulación más allá de las 4-8 horas normales. Esta falla para eliminar estas partículas se asocia a una aterogénesis acelerada, pues dichas partículas causan disfunción endotelial, promoviendo la expresión aumentada de moléculas de adhesión endotelial, ocasionando un mayor pasaje de leucocitos a través del endotelio para alcanzar la capa íntima arterial 19.
Mecanismo indirecto.
En el mecanismo indirecto la hidrólisis de las TRL por parte de la LPL ocasiona una alta concentración de productos lipolíticos, tales como ácidos grasos oxidados y no oxidados, a lo largo del endotelio vascular o dentro de la íntima arterial. Estos productos lipolíticos, junto con las TRL, activan vías proinflamatorias, procoagulantes y proapoptóticas necesarias en la patogénesis de la aterosclerosis, incluyendo un mayor reclutamiento y unión de monocitos al endotelio, una expresión aumentada de moléculas de adhesión y una vasodilatación disminuida 29,30. Los productos liberados por acción de la LPL causan daño local e inflamación en las células endoteliales, dando lugar a un endotelio disfuncional 21. Los sitios de disfunción endotelial constituyen las localizaciones arteriales preferenciales para la penetración y acumulación de lipoproteínas y sus remanentes y para la formación de la placa de ateroma 7. Las TRL pueden también suprimir los efectos ateroprotectivos y antiinflamatorios de la HDL, bloqueando el eflujo de colesterol desde los monocitos y los macrófagos 17.
Biomarcador asociado al colesterol y a la apolipoproteína apo C-III.
Diversos investigadores, como Talayero y Sacks, no consideran a los TAG directamente aterogénicos, sino como biomarcadores del riesgo cardiovascular, a causa de su asociación con partículas remanentes aterogénicas y con la proteína apo C-III, una molécula proinflamatoria, proaterogénica y procoagulante 17.
Han y colaboradores establecen que el nivel de TAG está correlacionado significativamente con la cantidad de colesterol remanente en las TRL (r=0.96), entonces la cantidad de TAG puede representar el nivel del colesterol remanente 21. Ahora bien, como este colesterol está presente en partículas aterogénicas, puede afirmarse que el nivel de TAG se relaciona o correlaciona con parte del colesterol aterogénico.
De esta manera los TAG, y especialmente los TAG posprandiales, pueden servir de marcadores del colesterol aterogénico no presente en las LDL.
También se destaca la asociación de las TRL con la proteína apo C-III, una proteína pequeña de 8.8 Kilodaltons, secretada por el hígado y el intestino delgado y que circula unida a VLDL, quilomicrones y HDL 31.
La apo C-III promueve la hipertrigliceridemia por diferentes mecanismos: inhibición de la actividad de la LPL, interferencia con la unión de los remanentes de TRL a sus receptores hepáticos, por medio de la apo B o apo E, causando un retardo en el catabolismo de los remanentes de TRL, y por último, la promoción del ensamblaje y
la secreción de las VLDL en el hígado. Además, la apo C-III favorece un estado procoagulante y sus posibles consecuencias aterotrombóticas 32-34.
La apo C-III tiene efectos inflamatorios, pues a nivel del endotelio, mediante la activación de la vía NF-kB, aumenta la expresión de moléculas de adhesión en las células endoteliales (VCAM-1) y en los monocitos (integrina β1), contribuyendo a la disfunción endotelial y a un mayor reclutamiento de los monocitos 20. Además, ocasiona disfunción de las HDL, pues las partículas de HDL unidas a apo C-III se vuelven menos ateroprotectoras, determinándose que la concentración de apo C-III en las HDL es significativamente mayor en personas con enfermedad cardiovascular que en personas sin enfermedad cardiovascular. Esto último podría asociarse a una HDL disfuncional, que no protege a la célula endotelial. Debe recordarse que la disfunción endotelial se considera el primer paso en el proceso aterogénico.
A la partícula de HDL se le reconocen efectos antiinflamatorios, antioxidantes, antiapoptóticos y antitrombóticos.
Adicionalmente, participa en la protección y la reparación del endotelio. Una HDL disfuncional no tendría plenamente las propiedades citadas anteriormente 35-37.
Finalmente, en estudios con personas diabéticas tipo 2 los niveles aumentados de apo C-III se asocian a valores elevados de TAG, a fenotipos cardiometabólicos menos favorables y a un mayor grado de aterosclerosis, medido mediante el nivel de calcificación de la arteria coronaria 31.
La triada lipídica aterogénica.
La hipertrigliceridemia también se asocia con un nivel de colesterol HDL disminuido, con partículas LDL pequeñas y densas y con partículas de HDL pequeñas 38. En un contexto de TAG elevados y por acción de varias enzimas se origina dicho fenómeno.
La hipertrigliceridemia favorece el intercambio de colesterol esterificado de la HDL madura y de la LDL por TAG de la VLDL por medio de la enzima CETP. El resultado es una partícula de HDL y de LDL con mayor contenido de TAG y menor de colesterol esterificado 39. Estas partículas, con mayor contenido de TAG, sufren hidrólisis de sus TAG por parte de la enzima lipasa hepática originando una partícula más pequeña y densa (LDL pequeña y densa al igual que HDL pequeña) 40,41. Además, la HDL pequeña es removida rápidamente de la circulación, resultando en una baja concentración de colesterol HDL y un menor nivel de apo A-I, principal apolipoproteína de la HDL, y de partículas de HDL 42.
Un mayor tiempo de residencia de las TRL, que es lo mismo que decir un catabolismo retardado de las TRL, brinda mayores oportunidades para el intercambio de TAG por colesterol esterificado por parte de la CETP, resultando en un mayor enriquecimiento de TAG de las partículas de LDL y de HDL y resultando en una formación aumentada de partículas pequeñas y densas de LDL y pequeñas de HDL 14.
La combinación de colesterol HDL disminuido, predominio de LDL pequeña y densa y TAG aumentados constituye la llamada “triada lipídica aterogénica” y suele encontrarse en personas obesas, diabéticas tipo 2 ó con resistencia a la insulina 43,44. Como su nombre lo indica esta condición aumenta el riesgo de ECV a partir de sus tres componentes.
El predominio de las partículas LDL pequeñas y densas está ligado estrechamente a la prevalencia de riesgo cardiovascular. La razón obedece a la mayor facilidad con que estas partículas atraviesan la pared endotelial comparadas con las partículas de LDL de mayor tamaño. Una vez dentro de la capa íntima estas LDL pequeñas se asocian a los proteoglucanos, lo que aumenta su tiempo de residencia y permite su modificación estructural, originando LDL modificadas. Además, un menor tamaño las hace más susceptibles a sufrir modificaciones. Las LDL modificadas, siendo la LDL oxidada la más conocida, es captada sin ninguna limitación por los macrófagos de la pared arterial, originando las células espumosas, características del ateroma.
Conclusiones.
Los TAG son transportados principalmente en la sangre en las TRL: los quilomicrones y las VLDL.
Los remanentes de QM y de VLDL son partículas pequeñas y ricas en colesterol y por estas dos razones son consideradas partículas aterogénicas.
El nivel de TAG se relaciona con el nivel de colesterol presente en los remanentes de TRL, que son partículas aterogénicas. Además, un nivel aumentado de TAG se asocia con LDL pequeñas y densas, colesterol HDL disminuido y un menor nivel de partículas de HDL. Todas estas son condiciones proaterogénicas.
Por las razones citadas anteriormente el nivel de TAG, y especialmente de TAG posprandial, se asocia con el riesgo cardiovascular.
Se han propuesto dos mecanismos generales de aterogenicidad de las TRL: uno directo, penetración de la pared arterial y captación por los macrófagos; y otro indirecto, generación de productos lipolíticos, a partir de los QM y de las VLDL y por medio de la LPL, que causan disfunción endotelial.
Los TAG no son aterogénicos directamente, pero se constituyen en marcadores de situaciones que favorecen la aterogenicidad (colesterol remanente elevado, alto nivel de partículas de LDL pequeñas y densas, colesterol HDL disminuido y bajo nivel de partículas de HDL o de apo A-I) o de moléculas que la favorecen (apo C-III).














