Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Medicina Legal de Costa Rica
On-line version ISSN 2215-5287Print version ISSN 1409-0015
Med. leg. Costa Rica vol.27 n.2 Heredia Sep. 2010
Revisión Bibliográfica
Células Madre: Fuentes no embriónicas accesibles
Pedro Madriz de Haan*
* Médico residente de Anatomía Patológica, Hospital Dr. Rafael Ángel Calderón Guardia, Caja Costarricense del Seguro Social, Costa Rica. pedromadriz@gmail.com
Resumen
En los últimos años se ha variado en gran manera el tipo de enfoque que se le dio en algún momento a las células madre; estas han pasado de ser sólo una posibilidad lejana de tratamiento a convertirse en una alternativa real para el manejo de varias patologías dentro de las cuales destacan las de índole autoinmune. La obtención de las mismas no debe ser motivo de controversia en nuestro país ya que por métodos que no involucran embriones humanos es posible colectarlas de dos fuentes particulares y accesibles: 1) cordón umbilical 2) tejido adiposo.
Palabras clave
Cédulas madres, enfermedades autoinmunes, embriones humanos, cordón umbilical, tejido adiposo.
Abstract
In the past few years the angle in which stem cells are being evaluated has changed greatly from the way it was before, these are no longer just a distant possibility, they have become a real alternative for the treatment of several diseases, more importantly in the case of auto-immune diseases. The methods of obtaining the cells should not be a reason of controversy in our country; because it is possible to get the cells from two particularly and accessible sources: 1) umbilical cord and 2) adipose tissue.
Key words
Stem cell, auto-inmune diseases, human embriens, umbilical cord, adipose tissue.
Introducción:
Las células madre han venido a revolucionar de forma importante el planteamiento terapéutico de numerosas patologías, si bien es cierto este tema no es completamente nuevo, si es interesante conocer un poco más a fondo los pormenores de las fuentes de obtención de las mismas, que reúnan dos características importantes: primero que sean fáciles de obtener y segundo que no involucren la utilización de embriones humanos por las consideraciones éticas que esto puede conllevar en diferentes locaciones del mundo. Para satisfacer estas necesidades se utilizan dos métodos de obtención de células madre que se comentarán en este capítulo; el primero es la obtención de células madre de sangre de cordón umbilical y el segundo es a través del tejido adiposo del propio paciente. Aprovechándose de estos medios se pueden obtener células madre de diferentes subtipos que cumplirán diversas funciones en la economía del paciente; a continuación se comentan los pormenores de las mismas.
1. Células madre derivadas de sangre del cordón umbilical.
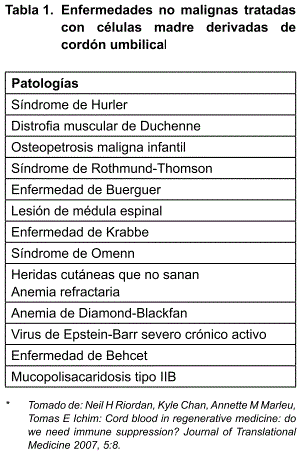
La primera ocasión en que se utilizó de forma amplia la sangre del cordón umbilical como una fuente de células madre fue en el tratamiento de neoplasias pediátricas malignas posterior a un acondicionamiento mielo-ablativo. Como los requerimientos de compatibilidad para este tipo de trasplante no son tan estrictos como para las otras fuentes de células madre hematopoyéticas, la sangre de cordón empezó a ganar aceptación en pacientes adultos que no contaban con donadores de médula ósea (1-6). Fuera del área de oncología, el uso clínico de sangre de cordón umbilical se ha expandido a varias áreas que van desde reconstituir un sistema inmune defectuoso(7), corregir anormalidades hematológicas(8), hasta inducir angiogénesis(9). En la tabla 1 se presentan ejemplos de patologías que han sido tratadas en estudios clínicos anteriores con buenos resultados. En adición a su uso clínico actual, la sangre de cordón está bajo intensa investigación experimental en modelos preclínicos de distintas patologías que van desde isquemia miocárdica, accidente vascular cerebral hasta regeneración muscular(10-13). Se anticipa que en los próximos años los usos de sangre de cordón se ampliarán hasta incluir patologías de origen no hematopoyético.
Es de suma importancia destacar que tipo de células se pueden obtener de la sangre derivada del cordón umbilical, así como sus características funcionales. De esta forma se puede ir anticipando el tipo de utilidad que se le dará a estas una vez que sean obtenidas. A continuación se presenta un resumen de las células regenerativas en la sangre de cordón, se comentarán sus características y las potenciales funciones de las mismas en tratamientos orientados a humanos.
Células con capacidad regenerativa encontradas en la sangre de cordón
En la sangre del cordón umbilical se encuentran varios tipos de células madres que se pueden utilizar de distintas maneras según sus características. Existen varias publicaciones que mencionan la habilidad regenerativa de estos subtipos en modelos pre-clínicos, estos estudios han arrojado interesantes datos y propiedades de las células en cuestión que podrán ser utilizadas en un futuro no muy lejano; esto en cuanto se resuelvan los pormenores que impiden realizar estudios clínicos a gran escala utilizando este tipo de tratamiento.
Células madre hematopoyéticas
En el cordón umbilical se pueden encontrar varias estirpes celulares, pero llama la atención la gran concentración de células madre hematopoyéticas, que es similar a la encontrada en la médula ósea: 0.1-0.8 células CD 34+ por 100 células nucleadas aproximadamente. Lo interesante es que contrastando con la médula ósea las células CD 34+ de la sangre del cordón poseen mayor potencial replicativo in vitro(14), números superiores de células iniciadoras de cultivos tardíos(15,16) y una mayor actividad de la telomerasa(17). El hecho de que las células derivadas de la sangre del cordón posean una actividad hematopoyética tan potente se puede atribuir al hecho de que la sangre del cordón se encuentra en una etapa de desarrollo mucho mas inmadura en comparación a las células madre derivadas del adulto. A favor de la actividad hematopoyética superior de la sangre de cordón se puede poner como ejemplo el hecho de que la reconstitución exitosa de la hematopoyesis post ablativa, ocurre en los pacientes recibiendo una décima parte de las células nucleadas en un injerto de cordón umbilical en comparación a uno de médula ósea (18).
Progenitores endoteliales y células estimulantes de la angiogénesis.
Además de ser una excelente fuente de células hematopoyéticas, la sangre de cordón contiene potentes células estimulantes de la angiogénesis. En un estudio la fracción de CD34+,CD11b+, que es aproximadamente menos de la mitad de la fracción de CD34+ de la sangre de cordón demostró poseer la habilidad de diferenciarse a células endoteliales funcionales in vitro e in vivo(19). En otro estudio las células VEGFR3+,CD34+ mostraron no sólo la habilidad de diferenciarse a células endoteliales in vivo, pero también ser capaces de expandirse aproximadamente 40 veces in vitro y aún así mantener su función angiogénica in vivo. El mismo estudio demostró que la concentración de esta fracción progenitora endotelial encontrada en las células de cordón CD34+ es casi diez veces mayor en comparación a las células encontradas en la médula ósea (20). Sin importar el fenotipo de las células de cordón con habilidad de estimular la angiogénesis; las células mononucleares no fraccionadas de cordón se han utilizado en numeroso modelos animales(21-23), así como en la clínica(9), para estimulación exitosa de angiogénesis. Las células mesenquimales que se obtienen del cordón umbilical secretan numerosas citoquinas y factores de crecimiento como el factor de crecimiento derivado del endotelio vascular y el factor de crecimiento fibroblástico tipo 2(24,25) que estimulan el proceso angiogénico. Inclusive, hay reportes de células mesenquimales que se diferencian directamente en células endoteliales, contribuyendo así en la angiogénesis (26).
Células madre mesenquimales
Las células madre mesenquimales son un tipo de células capaces de diferenciarse a varios tipos de tejidos no hematopoyéticos. Son el "complemento ideal" de las células CD34+ asistiéndolas en las diferentes funciones que cumplen, una forma sencilla de recordar su función es como la contraparte sólida de las células CD34+, ya que las mesenquimales son capaces de diferenciarse hacia diferentes tipos de órganos en la economía, in vitro se ha demostrado la capacidad de éstas de diferenciarse a tejido neuronal, hepático, osteoblástico y cardiaco(33-39). Otro aspecto importante de las células mesenquimales es su capacidad antiinflamatoria y antimoduladora; por ejemplo, ellas secretan de forma constitutiva citoquinas como IL-10 y FNT, manteniendo a pesar de esto su capacidad para presentar antígenos a las células T, sugiriendo que ellas pueden actuar como células presentadoras de antígenos tolerógenas (40-41). Una característica singular de estas es que se adhieren al plástico y expresan un fenotipo en su superficie celular no hematopoyético que es CD34-, CD45-, HLA-DR(7). Las fuentes de células madre mesenquimales son: médula ósea (28), tejido adiposo(29), placenta(30,31), cuero cabelludo(32) y la sangre de cordón umbilical(33). Es importante afirmar que ventajas ofrece la obtención de células mesenquimales de cordón sobre las otras fuentes; en un estudio reciente se comparó la capacidad de división de las células dependiendo de su origen y las células provenientes de la sangre de cordón fueron capaces de expandirse unas 20 veces, mientras que las derivadas de tejido adiposo se expandieron unas 8 veces y las derivadas de médula ósea lo hicieron unas 5 veces (42).
Células madre somáticas sin limitación
Células con marcadores y actividades que recuerdan a las células madre embriónicas se han encontrado en la sangre de cordón. Zhao et al identificaron una población de células CD 34- que expresaban OCT-4, Nanog, SSEA-3 y SSEA- 4, que eran capaces de diferenciarse a células mesodérmicas, ectodérmicas y endodérmicas.
Células madre obtenidas de tejido adiposo
El tejido adiposo ha atraído interés como una fuente alternativa de células madre, el porqué de esto se debe a factores como su facilidad de extracción, su alto contenido de células madre mesenquimales en comparación con la médula ósea y la capacidad de su expansión ex vivo; que puede ser similar o hasta superior a las células obtenidas de la médula ósea(42). Las células madre mesenquimales expandidas a partir de tejido adiposo son equivalentes o superiores a aquellas encontradas en la médula ósea en términos de su habilidad de diferenciación(43,44), potencial de estimulación de angiogénesis(45) y sus efectos moduladores de la inflamación(46). Dados los requerimientos y contaminaciones potenciales asociadas a una expansión extracelular ex vivo un procedimiento más simple sería utilizar células derivadas de tejido adiposo de forma primaria. Existen varios estudios en animales específicamente caballos y perros que muestran mejorías significativas en patologías como lesiones de cartílago y hueso; utilizando células adiposas autólogas no expandidas(47-49). Si estos resultados se pudieran extrapolar a modelos humanos, podrían anticipar resultados favorables en distintas patologías de índole muy variada, que brindarían la seguridad de no presentar una reacción injerto versus huésped, como se ha demostrado ampliamente en la cirugía cosmética(50-51), así como una disponibilidad prácticamente inmediata de materia prima. Lamentablemente la mayoría de estudios científicos se han concentrado células derivadas del tejido adiposo expandidas in vitro y se conoce poco de los potenciales efectos clínicos de todo el lipoaspirado que contiene un gran número de células además de las células madre mesenquimales, como ya dijimos, basados en la experiencia de la cirugía cosmética se podría afirmar que no habría mayor problema de hacer este tipo de auto-injerto. Sin embargo se debería establecer un marco de los diferentes tipos de componentes celulares que se encuentran en el tejido adiposo, para evaluar así los efectos que podrían tener estas sustancias de forma sistémica. Un ejemplo que valdría la pena mencionar serían las altas concentraciones de monocitos/macrófagos y el impacto potencial que estos pueden tener en ciertas situaciones clínicas; no se puede dejar de lado el hecho de que estas células son fabricas de citoquinas y los posibles efectos de estas en forma sistémica podrían influir de una forma importante dependiendo de la patología subyacente del paciente.
Al igual que se hizo con la sangre de cordón pasaremos a comentar los diferentes elementos presentes en el tejido adiposo, para de esta manera tener una mejor comprensión y lograr hacer una comparación de ambos tejidos con ventajas y desventajas de los mismos.
Células madre mesenquimatosas
La fracción mononuclear del tejido adiposo, conocida como la fracción vascular estromal fue descrita en sus inicios como una fuente activa mitóticamente de precursores adiposos por Hollenberg et al(52). Estas células recordaban a los fibroblastos morfológicamente y se demostró in vitro su capacidad para diferenciarse a pre-adipocitos y tejido adiposo funcional(53). Esto abrió el camino para pensar en las distintas capacidades del tejido adiposo como fuente de células progenitoras, pero no se habló del tejido adiposo como fuente de células madre hasta el año 2001 donde se habló del papel de las células madre mesenquimales presentes en el tejido adiposo y de la capacidad de las mismas para diferenciarse a diferentes líneas celulares: adiposas, musculares, cartilaginosas y óseas(54-55). Posterior a esta descripción inicial el mismo grupo reportó que posterior a la expansión in vitro de las células derivadas de la fracción vascular estromal tenían marcadores de superficie similares a los de las células madres mesenquimales derivadas de la médula ósea(56). Células mesenquimales pluripotenciales han sido aisladas del fluido de aspirado de la liposucción(57), lo que claramente brinda un gran potencial como materia prima de células madre mesenquimales al tejido adiposo, que dentro de sus ventajas ya comentadas y muy valiosas es la posibilidad de realizar injertos autólogos.
Células progenitoras endoteliales
Este es otro componente de la fracción vascular endotelial del tejido adiposo, un concepto común es que el tejido vascular continuamente restituye las células endoteliales dañadas con células madre derivadas de la médula ósea circulantes(58), y que la administración de precursores endoteliales celulares en animales que han tenido daño vascular puede inhibir la progresión de ateroesclerosis o re-estenosis(59-60). Miranville et al demostraron que la fracción estromal vascular humana aislada de tejido adiposo subcutáneo o visceral contiene una población de células CD34+ y CD133+(61). Estas células tenían la capacidad de formar colonias in vitro e in vivo la capacidad de producir angiogénesis. Otros autores han reportado células CD34 positivas en la fracción vascular estromal capaces de estimular la angiogénesis directamente o mediante la liberación de factores crecimiento como IGF- 1, HGF-1 y VEGF(62-65). La existencia de células CD34+ podría indicar la posibilidad de que estas tengan potencial no sólo como precursores angiogénicos sino con potencial hematopoyético; de hecho existe un reporte de un fenotipo con ambas capacidades, hematopoyéticas y angiogénicas aislado de la fracción vascular estromal(66). De estos datos se logra obtener la conclusión de que la fracción vascular estromal contiene al menos dos poblaciones mayores de células madre; una de estas conformada por células madre mesenquimales y otro donde se encuentran las células progenitoras endoteliales cada una de las mismas con las características que han sido mencionadas y por medio de las cuales se pueden ir sacando conclusiones en cuanto a las funciones que se les pueden dar a las mimas; ya que si se conocen estos datos el médico que lo estudie la hará con un fin terapéutico final, en estos momentos el tratamiento con células madre no se encuentra aprobado por la FDA, razón por la cual no se observan estudios a gran escala en humanos. De todas formas hay varios estudios en animales y tan pronto como sea posible realizarlos con humanos, con seguridad arrojarán resultados que no distarán mucho de esta contraparte.
Monocitos/macrófagos reguladores del sistema inmune
Se ha descrito que además de los componentes que ya han sido mencionados la fracción vascular estromal del tejido adiposo contiene monocitos y macrófagos. Estos cuentan con una capacidad pluripotencial descrita en otros trabajos(67,68) otra capacidad de estas células que resulta mas interesante mencionar y que además nos da espacio para soñar un poco con futuros tratamientos es la capacidad de intervenir con el sistema inmune. Trabajos anteriores sugerían que la cantidad de macrófagos encontrados en el tejido adiposo se relacionaba de forma directa con la cantidad de inflamación crónica de bajo grado propia del paciente obeso, esto se creía por experimentos que demostraron que los adipocitos eran capaces de inducir la secreción de TNF-alfa por los macrófagos in vitro(69). Estudios posteriores demostraron que los adipocitos eran capaces por si mismos de liberar TNF-alfa y leptina, que a su vez son capaces de estimular a los macrófagos a secretar mediadores inflamatorios(70). Según varios estudios posteriores en ratones y en humanos cuando los adipocitos son aislados del tejido adiposo, poseen propiedades antiinflamatorias caracterizadas por la alta expresión de IL-10 y del antagonista del receptor de IL- 1(1,72). Es interesante notar que estos macrófagos tienen un fenotipo particular M2, que se observa fisiológicamente en condiciones de inmunosupresión como tumores(73), síndrome antiinflamatorio post sepsis(74,75) o macrófagos deciduales asociados al embarazo(76). Se estima que la porción monocítica/macrofágica de la fracción vascular estromal es de un 10%. Con esto se amplía la gama de posibilidades terapéuticas de los macrófagos extraídos del tejido adiposo, ya que se añade una propiedad más, que resulta sumamente útil: la antiinflamatoria. De igual forma se debería valorar esta respuesta en estudios clínicos a gran escala y con parámetros de evaluación bien definidos, pero esto le correspondería a quienes se den a la tarea de diseñar los estudios, una vez que esto sea posible.
Células T reguladoras
El fenotipo particular de células T reguladoras se ha logrado obtener en ciertas condiciones, hay reportes que demuestran la aparición de las mismos cuando hay activación de las células T en ausencia del estímulo co-estimulatorio; así se generan células T inmuno-supresoras CD4+CD25+(77,78). Recordemos que en el tejido adiposo la activación de la inmunidad estaría asociada a una falta de co-estimulación por la actividad anti-inflamatoria de los macrófagos M2, lo que predispondría a la formación de células T reguladoras, es interesante conocer que una vez que la células T adquieren el fenotipo regulador, ellas se involucran en mantener los macrófagos en el fenotipo M2, estableciendo un círculo de retroalimentación(79). Además de esto en el tejido adiposo se encuentra una gran proporción de células mesenquimales que se sabe secretan TGF-beta(80), e interleucina-10(81), ambas involucradas en la generación de células T reguladoras. Hay estudios que han demostrado la capacidad de las células mesenquimales de producir células T reguladoras por si solas (82-84).
Como se ha logrado apreciar a lo largo de esta revisión las propiedades de las células madre son amplias y llaman de sobremanera la atención sus características inmosupresoras e inmunoreguladoras, angiogénicas y regenerativas de tejidos específicos. Todas estas nos dan una gran esperanza para futuros tratamientos estandarizados en humanos, además de estimular la búsqueda de nuevos usos de las mismas. Las fuentes de estas células madre (y las demás líneas celulares comentadas) son muy accesibles y no tienen ninguna involucración ética, el número de células madre necesarias para tratamientos no debe significar ningún problema, esto sin dejar de lado el hecho de que las células obtenidas pueden ser fácilmente expandidas en laboratorio. El tejido adiposo se puede obtener de un procedimiento tan sencillo como una miniliposucción, que representa mínimos riesgos para un paciente por ser una cirugía ambulatoria, además de tener una recuperación prácticamente inmediata y los cordones umbilicales se pueden obtener de forma universal; en ambas fuentes se deben utilizar procedimientos estandarizados para prevenir las contaminación de las células y para asegurar el mayor aprovechamiento posible. Este tema se puede prolongar desde muchos ángulos, las posibilidades alcanzarían inclusive para publicar varios libros, la idea de los autores es compartir un poco de las bases de la medicina celular, así como brindar una perspectiva de las utilizaciones terapéuticas de las células madre.
Recibido para publicación: 12 de marzo 2010 Aceptado: 15 de abril de 2010
Referencias
1. Askenasy, N., Kaminitz, A. y Yarkoni, S. (2008). Mechanisms of T regulatory cell function. Autoimmun Rev, 7, 370-375. 58. Gonzalez-Rey E, Gonzalez MA, Varela N, O’Valle F, Hernandez- Cortes P, Rico L, Buscher D, Delgado M: Human adipose- derived mesenchymal stem cells reduce inflammatory and T-cell responses and induce regulatory T cells in vitro in rheumatoid arthritis. Ann Rheum Dis 2009 in press. [ Links ]
2. Astori, G., Vignati, F., Bardelli, S, Tubio, M., Gola, M., Albertini, V., Bambi, F., Scali, G., Castelli, D., Rasini, V., Soldati, G. y Moccetti, T. (2007). "In vitro" and multicolor phenotypic characterization of cell subpopulations identified in fresh human adipose tissue stromal vascular fraction and in the derived mesenchymal stem cells. J Transl Med 2007, 5:55. [ Links ]
3. Bastard, J. P., Maachi, M., Lagathu, C., Kim, M. J., Caron, M., Vidal, H., Capeau, J. y Feve, B. (2006). Recent advances in the relationship between obesity, inflammation, and insulin resistance. Eur Cytokine Netw, 17, 4-12. [ Links ]
4. Black, L. L., Gaynor, J., Adams, C., Dhupa, S., Sams, A. E., Taylor, R., Harman, S., Gingerich, D. A., y Harman, R. (2008). Effect of intraarticular injection of autologous adipose-derived mesenchymal stem and regenerative cells on clinical signs of chronic osteoarthritis of the elbow joint in dogs. Vet Ther, 9, 192-200. [ Links ]
5. Black, L. L., Gaynor, J., Gahring, D., Adams, C., Aron, D., Harman, S., Gingerich, D. A. y Harman, R. (2007). Effect of adipose-derived mesenchymal stem and regenerative cells on lameness in dogs with chronic osteoarthritis of the coxofemoral joints: a randomized, double-blinded, multicenter, controlled trial. Vet Ther, 8, 272-284. [ Links ]
6. Boquest, A. C., Shahdadfar, A., Fronsdal, K., Sigurjonsson, O., Tunheim, S. H., Collas, P. y Brinchmann, J. E. (2005). Isolation and transcription profiling of purified uncultured human stromal stem cells: alteration of gene expression after in vitro cell culture. Mol Biol Cell, 16, 1131-1141. [ Links ]
7. Botta, R., Gao, E., Stassi, G., Bonci, D., Pelosi, E., Zwas, D., Patti, M., Colonna, L., Baiocchi, M., Coppola, S., Ma, X., Condorelli, G. y Peschle, C. (2004). Heart infarct in NODSCID mice: therapeutic vasculogenesis by transplantation of human CD34+ cells and low dose CD34+KDR+ cells. Faseb J, 18, 1392-1394. [ Links ]
8. Brzoska, E., Grabowska, I., Hoser, G., Streminska, W., Wasilewska, D., Machaj, E. K., Pojda, Z., Moraczewski, J. y Kawiak, J. (2006). Participation of stem cells from human cord blood in skeletal muscle regeneration of SCID mice. Exp Hematol, 34, 1262-1270. [ Links ]
9. Cai, L., Johnstone, B. H., Cook, T. G., Liang, Z., Traktuev, D., Cornetta, K., Ingram, D. A., Rosen, E. D., March, K. L. (2007). Suppression of hepatocyte growth factor production impairs the ability of adiposederived stem cells to promote ischemic tissue revascularization. Stem Cells, 25, 3234-3243. [ Links ]
10. Casiraghi, F., Azzollini, N., Cassis, P., Imberti, B., Morigi, M., Cugini, D., Cavinato, R. A., Todeschini, M., Solini, S., Sonzogni, A., Perico, N., Remuzzi, G. y Noris, M. (2008). Pretransplant infusion of mesenchymal stem cells prolongs the survival of a semiallogeneic heart transplant through the generation of regulatory T cells. J Immunol, 181, 3933- 3946. [ Links ]
11. Cho, S. W., Gwak, S. J., Kang, S. W., Bhang, S. H., Song, K. W., Yang, Y. S., Choi, C. Y. y Kim, B. S. (2006). Enhancement of Angiogenic Efficacy of Human Cord Blood Cell Transplantation. Tissue Eng. [ Links ]
12. Cornetta, K., Laughlin, M., Carter, S., Wall, D., Weinthal, J., Delaney, C., Wagner, J., Sweetman, R., McCarthy, P. y Chao, N. (2005). Umbilical cord blood transplantation in adults: results of the prospective Cord Blood Transplantation (COBLT). Biol Blood Marrow Transplant, 11, 149-160. [ Links ]
13. De Ugarte, D. A., Alfonso, Z., Zuk, P. A., Elbarbary, A., Zhu, M., Ashjian, P., Benhaim, P., Hedrick, M. H. y Fraser, J. K. (2003). Differential expression of stem cell mobilization-associated molecules on multilineage cells from adipose tissue and bone marrow. Immunol Lett, 89, 267-270. [ Links ]
14. Di Lanni, M., Del Papa, B., De Ioanni, M., Moretti, L., Bonifacio, E., Cecchini, D., Sportoletti, P., Falzetti, F. y Tabilio, A. (2008). Mesenchymal cells recruit and regulate T regulatory cells. Exp Hematol, 36, 309-318. [ Links ]
15. Fu, Y. S., Cheng, Y. C., Lin, M. Y., Cheng, H., Chu, P. M., Chou, S. C., Shih, Y. H., Ko, M. H. y Sung, M. S. (2006). Conversion of human umbilical cord mesenchymal stem cells in Wharton’s jelly to dopaminergic neurons in vitro: potential therapeutic application for Parkinsonism. Stem Cells, 24, 115-124. [ Links ]
16. Gaben, A. M., Aron, Y., Idriss, G., Jahchan, T., Pello, J. Y. y Swierczewski, E. (1983). Differentiation under the control of insulin of rat preadipocytes in primary culture. Isolation of homogeneous cellular fractions by gradient centrifugation. Biochim Biophys Acta, 762, 437-444. [ Links ]
17. Gang, E. J., Jeong, J. A., Han, S., Yan, Q., Jeon, C. J. y Kim, H. (2006). In vitro endothelial potential of human UC blood-derived mesenchymal stem cells. Cytotherapy, 8, 215-227. [ Links ]
18. Glick, J. M. y Adelman, S. J. (1983). Established cell lines from rat adipose tissue that secrete lipoprotein lipase. In Vitro, 19, 421-428. 23. [ Links ]
19. Gustafsson, C., Mjosberg, J., Matussek, A., Geffers, R., Matthiesen, L., Berg, G., Sharma, S., Buer, J. y Ernerudh, J. (2008). Gene expression profiling of human decidual macrophages: evidence for immunosuppressive phenotype. PLoS ONE, 3, e2078. [ Links ]
20. Hayashi, O., Katsube, Y., Hirose, M., Ohgushi, H. e Ito, H. (2008). Comparison of osteogenic ability of rat mesenchymal stem cells from bone marrow, periosteum, and adipose tissue. Calcif Tissue Int, 82, 238-247. [ Links ]
21. Hildbrand, P., Cirulli, V., Prinsen, R. C., Smith, K. A., Torbett, B. E., Salomon, D. R. y Crisa, L. (2004). The role of angiopoietins in the development of endothelial cells from cord blood CD34+ progenitors. Blood, 104, 2010-2019. [ Links ]
22. Hogan, C. J., Shpall, E. J., McNulty, O., McNiece, I., Dick, J. E., Shultz, L. D. y Keller, G. (1997). Engraftment and development of human CD34(+)- enriched cells from umbilical cord blood in NOD/LtSz-scid/scid mice. Blood, 90, 85-96. [ Links ]
23. Hollenberg, C. H. y Vost, A. (1969). Regulation of DNA synthesis in fat cells and stromal elements from rat adipose tissue. J Clin Invest, 47, 2485-2498. [ Links ]
24. Hong, S. H., Gang, E. J., Jeong, J. A., Ahn, C., Hwang, S. H., Yang, I. H., Park, H. K., Han, H. y Kim, H. (2005). In vitro differentiation of human umbilical cord blood-derived mesenchymal stem cells into hepatocyte-like cells. Biochem Biophys Res Commun, 330, 1153-1161. [ Links ]
25. Hu, C. H., Wu, G. F., Wang, X. Q., Yang, Y. H., Du, Z. M., He, X. H. y Xiang, P. (2006). Transplanted human umbilical cord blood mononuclear cells improve left ventricular function through angiogenesis in myocardial infarction. Chin Med J (Engl), 119, 1499-1506. [ Links ]
26. Hutson, E. L., Boyer, S. y Genever, P. G. (2005). Rapid isolation, expansion, and differentiation of osteoprogenitors from full-term umbilical cord blood. Tissue Eng, 11:1407-1420. [ Links ]
27. Ichim, T. E., Zhong, R., Min, W. P. (2003). Prevention of allograft rejection by in vitro generated tolerogenic dendritic cells. Transpl Immunol, 11, 295-306. [ Links ]
28. Jaing, T. H., Hung, I. J., Yang, C. P., Chen, S. H., Sun, C. F. y Chow, R. (2005). Rapid and complete donor chimerism after unrelated mismatched cord blood transplantation in 5 children with beta-thalassemia major. Biol Blood Marrow Transplant, 11, 349-353. [ Links ]
29. Jeong, J. A., Gang, E. J., Hong, S. H., Hwang, S. H., Kim, S. W., Yang, I. H., Ahn, C., Han, H. y Kim, H. (2004). Rapid neural differentiation of human cord blood-derived mesenchymal stem cells. Neuroreport, 15, 1731-1734. [ Links ]
30. Kadivar, M., Khatami, S., Mortazavi, Y., Shokrgozar, M. A., Taghikhani, M. y Soleimani, M. (2006). In vitro cardiomyogenic potential of human umbilical vein- derived mesenchymal stem cells. Biochem Biophys Res Commun, 340:639-647. [ Links ]
31. Kang, X. Q., Zang, W. J., Bao, L. J., Li, D. L., Song, T. S., Xu, X. L. y Yu, X. J. (2005). Fibroblast growth factor-4 and hepatocyte growth factor induce differentiation of human umbilical cord blood-derived mesenchymal stem cells into hepatocytes. World J Gastroenterol, 11, 7461-7465. [ Links ]
32. Kern, S., Eichler, H., Stoeve, J., Kluter, H. y Bieback, K. (2006). Comparative Analysis of Mesenchymal Stem Cells from Bone Marrow, Umbilical Cord Blood or Adipose Tissue. Stem Cells. [ Links ]
33. Keyser, K. A., Beagles, K. E. y Kiem, H. P. (2007). Comparison of mesenchymal stem cells from different tissues to suppress T-cell activation. Cell Transplant, 16, 555-562. [ Links ]
34. Kim, Y., Kim, H., Cho, H., Bae, Y., Suh, K. y Jung, J. (2007). Direct comparison of human mesenchymal stem cells derived from adipose tissues and bone marrow in mediating neovascularization in response to vascular ischemia. Cell Physiol Biochem, 20, 867-876. [ Links ]
35. Klein, A. W. (2001). Skin filling. Collagen and otherinjectables of the skin. Dermatol Clin, 19:491-508. Ix [ Links ]
36. Knippenberg, M., Helder, M. N., Doulabi, B. Z., Semeins, C. M., Wuisman, P. I. y Klein, J. (2005). Adipose tissue-derived mesenchymal stem cells acquire bone celllike responsiveness to fluid shear stress on osteogenic stimulation. Tissue Eng, 11, 1780-1788. [ Links ]
37. Knutsen, A. P. y Wall, D. A. (2000). Umbilical cord blood transplantation in severe T-cell immunodeficiency disorders: two-year experience. J Clin Immunol, 20, 466-476. [ Links ]
38. Laporte, J. P., Lesage, S., Portnoi, M. F., Landman, J., Rubinstein, P., Najman, A., y Gorin, N. C. (1998). Unrelated mismatched cord blood transplantation in patients with hematological malignancies: a single institution experience. Bone Marrow Transplant, 22 Suppl 1, S76-7. [ Links ]
39. Le Ricousse, S., Barateau, V., Contreres, J. O., Boval, B., Kraus, L. y Tobelem, G. (2004). Ex vivo differentiated endothelial and smooth muscle cells from human cord blood progenitors home to the angiogenic tumor vasculature. Cardiovasc Res, 62, 176-184. [ Links ]
40. Lekakis, L., Giralt, S., Couriel, D., Shpall, E. J., Hosing, C., Khouri, I. F., Anderlini, P., Korbling, M., Martin, T., Champlin, R. E. y De Lima, M. (2006). Phase II study of unrelated cord blood transplantation for adults with highrisk hematologic malignancies. Bone Marrow Transplant, 38, 421-426. [ Links ]
41. Leor, J., Guetta, E., Feinberg, M. S., Galski, H., Bar, I., Holbova, R., Miller, L., Zarin, P., Castel, D., Barbash, I. M. y Nagler, A. (2006). Human umbilical cord blood-derived CD133+ cells enhance function and repair of the infarcted myocardium. Stem Cells, 24, 772-780. [ Links ]
42. Liu, C. H. y Hwang, S. M. (2005). Cytokine interactions in mesenchymal stem cells from cord blood. Cytokine, 32:270-279. [ Links ]
43. Liu, J., Lu, X. F., Wan, L., Li, Y. P., Li, S. F., Zeng, L. Y., Zeng, Y. Z., Cheng, L. H., Lu, Y. R. y Cheng, J. Q. (2004). Suppression of human peripheral blood lymphocyte proliferation by immortalized mesenchymal stem cells derived from bone marrow of Banna Minipig inbredline. Transplant Proc, 36, 3272-3275. [ Links ]
44. Mantovani, A., Sozzani, S., Locati, M., Allavena, P. y Sica, A. (2002). Macrophage polarization: tumor-associated macrophages as a paradigm for polarized M2 mononuclear phagocytes. Trends Immunol, 23, 549-555. [ Links ]
45. Mayer, H., Bertram, H., Lindenmaier, W., Korff, T., Weber, H. y Weich, H. (2005). Vascular endothelial growth factor (VEGF-A) expression in human mesenchymal stem cells: autocrine and paracrine role on osteoblastic and endothelial differentiation. J Cell Biochem, 95, 827-839. [ Links ]
46. Mehta, A., Brewington, R., Chatterji, M., Zoubine, M., Kinasewitz, G. T., Peer, G. T., Chang, A. C., Taylor Jr, F. B. y Shnyra, A. (2004). Infection-induced modulation of m1 and m2 phenotypes in circulating monocytes: role in immune monitoring and early prognosis of sepsis. Shock, 22, 423-430. [ Links ]
47. Minana, M. D., Carbonell, F., Mirabet, V., Marin, S. y Encabo, A. (2008). IFATS collection: Identification of hemangioblasts in the adult human adipose tissue. Stem Cells, 26, 2696-2704. [ Links ]
48. Miranville, A., Heeschen, C., Sengenes, C., Curat, C. A., Busse, R. y Bouloumie, A. (2004). Improvement of postnatal neovascularization by human adipose tissue- derived stem cells. Circulation, 110, 349-355. [ Links ]
49. Riordan, N., Chan, K., Marleau, A. y Ichim, T. E. (2007). Cord blood in regenerative medicine: do we need immune suppression? Journal of Translational Medicine, 5, 8. [ Links ]
50. Newcomb, J. D., Ajmo, C. T. Jr., Sanberg, C. D., Sanberg, P. R., Pennypacker, K. R., y Willing, A. E. (2006). Timing of cord blood treatment after experimental stroke determines therapeutic efficacy. Cell Transplant, 15, 213-223. [ Links ]
51. Ng, Y. Y., Van Kessel, B., Lokhorst, H. M, Baert, M. R, Van Den Burg, C. M., Bloem, A. C. y Staal, F. J. (2004). Gene-expression profiling of CD34+ cells from various hematopoietic stem-cell sources reveals functional differences in stem-cell activity. J Leukoc Biol, 75, 314-323. [ Links ]
52. Noel, D., Caton, D., Roche, S., Bony, C., Lehmann, S., Casteilla, L., Jorgensen, C. y Cousin, B. (2008). Cell specific differences between human adiposederived and mesenchymal-stromal cells despite similar differentiation potentials. Exp Cell Res, 14, 1575-1584. [ Links ]
53. Odegaard, J. I., Ricardo, R. R., Goforth, M. H., Morel, C. R., Subramanian, V., Mukundan, L., Eagle, A. R., Vats, D., Brombacher, F., Ferrante, A. W. y Chawla, A. (2007). Macrophage-specific PPARgamma controls alternative activation and improves insulin resistance. Nature, 447, 1116-1120. [ Links ]
54. Planat, V., Silvestre, J. S., Cousin, B., Andre, M., Nibbelink, M., Tamarat, R., Clergue, M., Manneville, C., Saillan, C., Duriez, M., Tedgui, A., Levy, B., Penicaud, L. y Casteilla, L. (2004). Plasticity of human adipose lineage cells toward endothelial cells: physiological and therapeutic perspectives. Circulation, 109, 656-663. [ Links ]
55. Portmann, C. B., Schoeberlein, A., Huber, A., Sager, R., Malek, A., Holzgreve, W. y Surbek, D. V. (2006). Placental mesenchymal stem cells as potential autologous graft for pre- and perinatal neuroregeneration. Am J Obstet Gynecol, 194, 664-673. [ Links ]
56. Rauscher, F. M., Goldschmidt, P. J., Davis, B. H., Wang, T., Gregg, D., Ramaswami, P., Pippen, A. M., Annex, B. H., Dong, C. y Taylor, D. A. (2003). Aging, progenitor cell exhaustion, and atherosclerosis. Circulation, 108:457-463. [ Links ]
57. Ryan, J. M., Barry, F., Murphy, J. M. y Mahon, B. P. (2007). Interferon-gamma does not break, but promotes the immunosuppressive capacity of adult human mesenchymal stem cells. Clin Exp Immunol. [ Links ]
58. Sakabe, H., Yahata, N., Kimura, T., Zeng, Z. Z., Minamiguchi, H., Kaneko, H., Mori, K. J., Ohyashiki, K., Ohyashiki, J. H., Toyama, K., Abe, T. y Sonoda, Y. (1998). Human cord bloodderived primitive progenitors are enriched in CD34+c-kit- cells: correlation between longterm culture-initiating cells and telomerase expression. Leukemia, 12, 728-734. [ Links ]
59. Salven, P., Mustjoki, S., Alitalo, R., Alitalo, K. y Rafii, S. VEGFR-3 and CD133 identify a population of CD34+ lymphatic/vascular endothelial precursor cells. Blood, 101, 168-172. [ Links ]
60. Sanz, G. F., Saavedra, S., Jiménez, C., Senent, L., Cervera, J., Planelles, D., Bolufer, P., Larrea, L., Martin, G., Martinez, J., Jarque, I., Moscardo, F., Plume, G., Andreu, R., de la Rubia J, Barragan E, Solves P, Soler MA, Sanz MA: Unrelated donor cord blood transplantation in adults with chronic myelogenous leukemia: results in nine patients from a single institution. Bone Marrow Transplant 2001, 27:693-701. [ Links ]
61. Sata, M., Fukuda, D., Tanaka, K., Kaneda, Y., Yashiro, H. y Shirakawa, I. (2005). The role of circulating precursors in vascular repair and lesion formation. J Cell Mol Med, 9, 557-568. [ Links ]
62. Schonberger, S., Niehues, T., Meisel, R., Bernbeck, B., Laws, H. J., Kogler, G., Enzmann, J., Wernet, P., Gobel, U. y Dilloo D. (2004). Transplantation of haematopoietic stem cells derived from cord blood, bone marrow or peripheral blood: a single centre matched-pair analysis in a heterogeneous risk population. Klin Padiatr, 216, 356-363. [ Links ]
63. Shih, D. T., Lee, D. C., Chen, S. C., Tsai, R. Y., Huang, C. T., Tsai, C. C., Shen, E. Y. y Chiu, W. T. (2005). Isolation and characterization of neurogenic mesenchymal stem cells in human scalp tissue. Stem Cells, 23, 1012-1020. [ Links ]
64. Song, G. Y., Chung, C. S., Jarrar, D., Chaudry, I. H. y Ayala, A. (2001). Evolution of an immune suppressive macrophage phenotype as a product of P38 MAPK activation in polymicrobial sepsis. Shock, 15, 42-48. [ Links ]
65. Suganami, T., Nishida, J. y Ogawa, Y. (2005). A paracrine loop between adipocytes and macrophages aggravates inflammatory changes: role of free fatty acids and tumor necrosis factor alpha. Arterioscler Thromb Vasc Biol, 25, 2062-2068. [ Links ]
66. Sumi, M., Sata, M., Toya, N., Yanaga, K., Ohki, T. y Nagai, R. (2007). Transplantation of adipose stromal cells, but not mature adipocytes, augments ischemia-induced angiogenesis. Life Sci, 80 ,559-565. [ Links ]
67. Theunissen, K. y Verfaillie, C. M. (2005). A multifactorial analysis of umbilical cord blood, adult bone marrow and mobilized peripheral blood progenitors using the improved ML-IC assay. Exp Hematol, 33, 165-172. [ Links ]
68. Tiemessen, M. M., Jagger, A. L., Evans, H. G., Van Herwijnen, M. J., John, S. y Taams, L. S. (2007). CD4+CD25+Foxp3+ regulatory T cells induce alternative activation of human monocytes/macrophages. Proc Natl Acad Sci USA, 104, 19446-19451. [ Links ]
69. Togel, F.,Hu, Z., Weiss, K., Isaac, J., Lange, C. y Westenfelder, C. (2005). Administered mesenchymal stem cells protect against ischemic acute renal failure through differentiation-independent mechanisms. Am J Physiol Renal Physiol, 289, F31-42. [ Links ]
70. Tomonari, A., Takahashi, S., Ooi, J., Nakaoka, T., Takasugi, K., Uchiyama, M., Tsukada, N., Konuma, T., Iseki, T., Tojo, A. y Asano, S. (2006). Cord blood transplantation for acute myelogenous leukemia using a conditioning regimen consisting of granulocyte colonystimulating factor-combined high-dose cytarabine, fludarabine, and total body irradiation. Eur J Haematol, 77, 46-50. [ Links ]
71. Tomonari, A., Tojo, A., Takahashi, T., Iseki, T., Ooi, J., Takahashi, S., Nagamura, F., Uchimaru, K. y Asano, S. (2004). Resolution of Behcet’s disease after HLA-mismatched unrelated cord blood transplantation for myelodysplastic syndrome. Ann Hematol, 83, 464-466. [ Links ]
72. Tondreau, T., Meuleman, N., Delforge, A., Dejeneffe, M., Leroy, R., Massy, M., Mortier, C., Bron, D. y Lagneaux, L. (2007). Mesenchymal stem cells derived from CD133- positive cells in mobilized peripheral Journal of Translational Medicine, 5, 8 Recuperado de http://www.translational-medicine.com/content/5/1/8 Page 8 of 9. y Blood and cord blood: proliferation, Oct4 expression, and plasticity. Stem Cells 2005, 23, 1105-1112. [ Links ]
73. U rbich, C. y Dimmeler, S. (2005). Risk factors for coronary artery disease, circulating endothelial progenitor cells, and the role of HMG-CoA reductase inhibitors. Kidney Int, 67, 1672-1676. [ Links ]
74. Vaananen, H. K. (2005). Mesenchymal stem cells. Ann Med, 37, 469-479. [ Links ]
75. Varma, M. J., Breuls, R. G., Schouten, T. E., Jurgens, W. J., Bontkes, H. J., Schuurhuis, G. J., Van Ham, S. M. y Van Milligen, F. J. (2007). Phenotypical and functional characterization of freshly isolated adipose tissuederived stem cells. Stem Cells Dev, 16, 91-104. [ Links ]
76. Vet-Stem Recuperado de: [http://www.vetstem.com] [ Links ]
77. Wang, Y., Wang, Y. P., Zheng, G., Lee, V. W., Ouyang, L., Chang, D. H., Mahajan, D., Coombs, J., Wang, Y. M., Alexander, S. I. y Harris, D. C. (2007). Ex vivo programmed macrophages ameliorate experimental chronic inflammatory renal disease. Kidney Int, 72, 290-299. [ Links ]
78. Ye, Z., Wang, Y., Xie, H. Y., Zheng, S. S. (2008). Immunosuppressive effects of rat mesenchymal stem cells: involvement of CD4+CD25+ regulatory T cells. Hepatobiliary Pancreat Dis Int, 7, 608-614. [ Links ]
79. Yoshimura, K., Shigeura, T., Matsumoto, D., Sato, T., Takaki, Y., Aiba Kojima, E., Sato, K., Inoue, K., Nagase, T., Koshima, I. y Gonda, K. (2006). Characterization of freshly isolated and cultured cells derived from the fatty and fluid portions of liposuction aspirates. J Cell Physiol, 208, 64-76. [ Links ]
80. Zannettino, A. C., Paton, S., Arthur, A., Khor, F., Itescu, S., Gimble, J. M. y Gronthos, S. (2008). Multipotential human adipose-derived stromal stem cells exhibit a perivascular phenotype in vitro and in vivo. J Cell Physiol, 214, 413-421. [ Links ]
81. Zeyda, M., Farmer, D., Todoric, J., Aszmann, O., Speiser, M., Gyori, G., Zlabinger, G. J. , Stulnig, T. M. (2007). Human adipose tissue macrophages are of an anti-inflammatory phenotype but capable of excessive proinflammatory mediator production. Int J Obes (Lond), 31, 1420-1428. [ Links ]
82. M. Stulnig, T. M. (2007). Adipose tissue macrophages. Immunol Lett, 112, 61- 67. [ Links ]
83. Zhang, X., Mitsuru, A., Igura, K., Takahashi, K., Ichinose, S., Yamaguchi, S. y Takahashi, T. A. (2006). Mesenchymal progenitor cells derived from chorionic villi of human placenta for cartilage tissue engineering. Biochem Biophys Res Commun, 340, 944-952. [ Links ]
84. Zuk, P. A., Zhu, M., Ashjian, P., De Ugarte, D. A., Huang, J. I., Mizuno, H., Alfonso, Z. C., Fraser, J. K., Benhaim, P. y Hedrick, M. H. (2002). Human adipose tissue is a source of multipotent stem cells. Mol Biol Cell, 13, 4279-4295. [ Links ]