Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Médica del Hospital Nacional de Niños Dr. Carlos Sáenz Herrera
Print version ISSN 1017-8546
Rev. méd. Hosp. Nac. Niños (Costa Rica) vol.36 n.1-2 San José Jan. 2001
Dra.Patricia Venegas *
Introducción
Desde hace 100 años se conoce la participación de la oncogénesis en el cáncer humano. En 1960 la citogenética fue la primera herramienta que permitió identificar un marcador cromosómico en un proceso maligno, tratándose del bien conocido cromosoma Filadelfia (Ph) en la leucemia mielocítica crónica (LMC). En 1970 con el bandeo cromosómico se descubrió que el Ph era una translocación eromosómica entre los brazos largos del cromosoma 9 y los brazos largos del cromosoma 22. Sucesivamente se fueron reportando cambios cromosómicos asociados con varios procesos malignos hematológicos.
La citogenética convencional (CC) es usada hoy en día como una llave de oro estándar y la técnica FISH (fluorescense in situ hibridization), introducida por los años 80, logró ser una técnica molecular complementaria para la CC que permitió obtener nueva e importante información genética (3), su utilización en el diagnóstico y pronóstico de la LMC continúa en constante evolución (1).
Estas técnicas de citogenética molecular (CM) son una poderosa arma, muy sensible y que pueden ser aplicadas con CC en el diagnóstico y en el manejo de pacientes con cáncer, su aplicación en el diagnóstico prenatal es también de alto impacto (5).
Su método es reproducible, relativamente fácil de llevar a cabo y adecuado para el monitoreo de pacientes con LMC (7).
En niños con leucemia linfocítica aguda (LLA), la citogenética juega un papel esencial para su diagnóstico y pronóstico. La CC complementada con FISH es segura y altamente efectiva en la detección de alteraciones cromosómicas involucradas en los procesos malignos. Las técnicas moleculares son las adecuadas para la identificación precisa de los cambios genéticos específicos.
Los cambios cromosómicos pueden ocurrir en su estructura o en su número cromosómico. Los siguientes son cambios estructurales que tienen un alto impacto en el pronóstico: t(9;22) (q34;q11) y BCR/ABL, rearreglos en 11q23 involucrando al MLL,T (12;21) (p13;q22) con la fusión ETV6/AML1, t(1;19) (q23;p13) con E2A/PBX1, t(8;14) (q24;q32) y el gen de las inmunoglobulinas.
Las alteraciones en el número de cromosomas tiene también un efecto importante en el pronóstico.
CC, FISH y análisis moleculares son los procesos complemetarios para la guía en el manejo de los pacientes con LLA (4).
Además del FISH y el CC, técnicas de biología molecular, como el southem blot y el RT-PCR son utilizadas para la detección de la t(9;22) o BCR/ABL (6).
El FISH es muy utilizado para monitorear respuesta al tratamiento en diferentes enfermedades hematológicas y se recomienda su uso en el diagnóstico inicial y el seguimiento del paciente con Ph+ especialmente después de transplante de médula ósea (8).
FISH está más dirigido en la detección de la enfermedad mínima residua (EMR) (2) y es importante en casos donde falla la CC(10) y en donde existe un bajo porcentaje de células Ph+(8).
En niños con LLA el Ph+ se encuentra en un 5% de los pacientes y es de muy mal pronóstico, por lo que su detección rápida y precisa es importante para ubicar al paciente en alto riesgo y dar una terapia intensiva.
El FISH puede ser llevado a cabo tanto en metafase (C-FISH) como en Interfase (I-FISH)
a-) Indicaciones para el uso de FISH en interfase (I-FISH):
1-Alteraciones numéricas
2-Duplicaciones específicas
3-Deleciones específicas
4-Rearreglos específicos
5-Mosaicismo
b-) Indicaciones para el uso de FISH en metafase (M-FISH)
1- Marcadores cromosómicos
2- Material pegado a un cromosoma de origen desconocido
3-Rearreglo cromosómico
4-Sospecha de una ganancia o pérdida de un segmento cromosómico
5-Mosaicismo.
Materiales y Métodos
Se recibió una muestra de médula ósea de un adulto con leucemia mielocítica crónica donde la citogenética fue inconclusa. La muestra fue llevada directamente a "shock hipotónico" para obtener células en interfase y aplicar la técnica de I-FISH.
Se procedió a la detección BCR/ABL de la fusión génica de la t(9;22)(q34;q11) por FISH usando sondas VYSIS.
Las sondas fueron LSI BCR/ABL de la Compañía Vysis Inc, Downers Grove, IL.
Los fluorocromos utilizados fueron: ABL(SpectrumOrange)/BCR (Spectrum Green).
Resultados
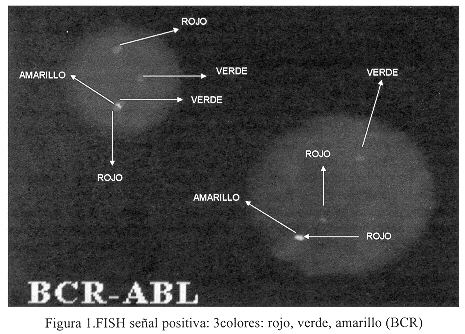
Las láminas hibridizadas fueron rastreadas con un microscopio de fluorescencia. Se analizaron 200 células en interfase. En la Figura 1 se ve la imagen de la célula positiva por mostrar las 3 señales de fusión BCR/ABL: rojo-verde-amarillo capturada por un programa Vysis Quips FISH. La señal roja y verde muestra los restantes cromosomas normales 9 y 22, respectivamente.
Discusión
La sonda LSI BCR/ABL aplicada en este estudio consistió de una mezcla de una sonda ABL marcada directamente con el fluorocromo Spectrum Orange y una sonda BCR, marcada directamente con el fluorocromo Spectrum Green. Esta sonda de doble color permitió detectar la fusión de los genes BCR/ABL de la translocación 9;22, como se muestra en las células en internase de la Figura 1. Este marcador cromosómico permitirá ubicar al paciente en un mejor pronóstico, monitorear y detectar la enfermedad mínima residual en el transcurso de su enfermedad.
El I-FISH llevado a cabo permitió detectar la fusión génica Major (M) Filadelfia en este paciente con LMC, también puede ser usada para detectar el Minor(m) Filadelfia en LLA.
El cromosoma Filadelfia (Ph),t (9;22)(q34;q11.2) es detectado por CC en una minoría de pacientes con leucemia aguda (10). La translocación cromosómica (Ph+) se encuentra en un 95% de pacientes con LMC y un 30% de adultos con LLA generando un gen Quimérico BCR/ABL. Hay 3 tipos de fusión transcriptos: p21 OBCR-ABL en LMC y LLA, p190BCRABL principalmente en LLA y p230BCR-ABL en LMC, cada una de las cuales depende de la localización de los puntos de quiebra dentro del gen BCR.
En núcleos normales en interfase, la sonda dará 4 señales(dos rojas y dos verdes) sobre ambos cromosomas homólogos 9 y22 en 9q34 y 22q 11.2 respectivamente.
En la Figura 1 se muestra la señal positiva, los núcleos con la translocación muestran 3 señales, uno rojo, uno verde y uno verde amarillento indicando la señal de fusión entre los genes BCR y ABL, convirtiendo al paciente en LMC, Ph+, BCRJABL+.
La identificación del cromosoma Filadelfia es importante porque permite el diagnóstico diferencial de la LMC de la siguiente manera:
Leucemia granulocítica crónica (LGC) (95% de todos los LMC,90% son Ph+,5% son Ph-BCR/ABL+), LMC atípica (peor sobrevida que LGC), leucemia mielomonocítica crónica (un subtipo de síndrome mielodisplásico), leucemia neutrofilica crónica (Ph-BCR/ABL-) y LMC juvenil (Ph-BCR/ABL). Algunos casos de trombocitopenia esencial son Ph+ (1).
Más de la mitad de los casos de LLA que presentaban cariotipo normal, guardaban aberraciones cromosómicas que pudieron ser demostrados con I-FISH en y con Spectral Karyotyping (SKY) (9).
La agudeza del diagnóstico citogenético ha mejorado en los últimos 10 años.
El FISH, una técnica CM ha jugado un papel importante en la detección de rearreglos submicroscópicos únicos que ayuda a identificar los locus cromosómicos que contienen genes que participan en el proceso leucomogénico, y que permitirá identificar los pacientes de alto riesgo.
Resumen
El I-FISH, una técnica de citogenética molecular, es un nuevo test clínico que debe ser realizado y estandarizado en todos los laboratorios de citogenética tanto en Genética clínica como oncohematológica.
El cromosoma Filadelfia positivo en este paciente con LMC servirá de marcador cromosómico favorable y permitirá el monitoreo y detección de la enfermedad mínima residual en el transcurso de su enfermedad. Es importante también en casos donde el diagnóstico inicial es inconcluso.
Summary
I-FISH is a new elinical test to be set up and standardized in all clinical cytogenetics and onco-hematology cytogenetics laboratory.
Philadelphia positive in this CML patient show an important favourable prognostic marker and will be a reliable for monitoring this patient and for detection of the minimal residual disease. Also is very important in cases when the initial diagnosis is inconclusive.
Bibliografía
1- Ashida T. & Kanamaru A.: Differential diagnosis of chronic myeloid leukemia and the related disorders. Nippon Rinsho 59:12,2001 [ Links ]
2- Cuneo A., Bigoni R., Emmanuel B. et al: Fluorescence in situ hybridization for the detection and monitoring of the Ph-positive clone in chronic myelogenous leukemia: comparison with metaphase banding analysis. Leukemia 12:11,1998. [ Links ]
3- Glassman A.: Cytogenetics, in situ hybridization and molecular approaches the diagnosis of cancer. Ann. Clin. Lab. Sci. 28:6, 1998. [ Links ]
4- Harrison C.: The detection and significance of chromosomal abnormalities in childhood acute lymphoblastic leukaemia. Blood Rev. 15:1, 2001.
5- Jobanputra Y, Kriplani A., Chodhry V. et al: Detection of chromosomal abnormalities using fluorescence in situ hybridization (FISH). Natl . Med. J. India 11:6 1998. [ Links ]
6- Kato C & Naoe T.: Genetic diagnosis of chronic myeloid leukemia. Nippon Rinsho 59:12,2001. [ Links ]
7- Kobzev Y, Domracheva E. & Zakharova A.: Fluorescence in situ hybridization studies of interphase nuclei assessing response to therapy in patients with chronic myeloid leukemia. Cancer Genet. Cytogenet. 106:2, 1998. [ Links ]
8- Mohr B., Bomhauser M., Platzbeeker U. et al: Problems with interphase fluorescence in situ hybridization in detecting BCR/ABL-positive cells in some patients using a novel technique with extra signals. Cancer Genet. Cytogenet.127:2, 2001. [ Links ]
9- Nordgren A., Schoumans J., Soderhall S. et al: Interphase fluorescence in situ hybridization and spectral karyotyping reveals hidden genetic aberrations in children with acute lymphoblastic leukemia and a normal banded karyotypes. Brit. J. Haematol. 114:4,2001.
10- Wells S., Phillips C. & Farhi D.: Detection of BCRabl in acute leukemia by molecular and cytogenetic methods. Mol. Diagn. 1:4,1996. [ Links ]
* Laboratorio Clínico, Sección de Citogenética. Hospital Nacional de Niños "Dr. Carlos Sáenz Herrera".C.C.S.S, San José, Costa Rica.













