Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Médica del Hospital Nacional de Niños Dr. Carlos Sáenz Herrera
Print version ISSN 1017-8546
Rev. méd. Hosp. Nac. Niños (Costa Rica) vol.35 n.1-2 San José Jan. 2000
Las células fagocíticas, como los neutrófilos, monocitos, macrófagos y eosinófilos (conocidos como los fagocitos profesionales), logran destruir a los agentes infecciosos una vez formado el fagolisosoma, por la producción de compuestos tóxicos para ellos, por medio de vías dependientes del oxígeno y vías independientes del oxígeno, que conllevan la producción de proteínas bactericidas como la lisozima, lactoferrina y proteínas canónicas antimicrobianas (7,10).
En las vías dependientes del oxígeno, la célula aumenta sus requerimientos de oxígeno (estallido respiratorio), para convertirlo enzimáticamente en metabolitos de alta toxicidad que son liberados directamente en la vacuola fagocítica; durante este proceso, la NADPH oxidasa de la membrana plasmática se une con un citocromo b único en la membrana de los gránulos específicos, este complejo en presencia de una quinona, reduce el oxígeno al anión superóxido (O). El ión superóxido, gracias a la enzima superóxido dismutasa, es transformado rápidamente en peróxido de hidrógeno (HO). También puede ser convertido en ácido hipocloroso (HOCI) y también producirse el radical hidroxilo (OH) (16).
La NADPH oxidasa está conformada por cuatro unidades principales, la gp 91 phox, p22 phox, p47 phox y la p67 phox, las cuales en los leucocitos inactivados se localizan en diferentes sitios de la célula (14).
Los defectos en la actividad de los fagocitos, sean cualitativos o cuantitativos, predisponen a los pacientes a infecciones por ciertas bacterias y hongos. Estos defectos pueden deberse a: un menor número de células fagocíticas, alteración de la respuesta quimiotáctica, disminución en la capacidad de adherencia, disminución en la capacidad de fagocitosis o reducción de la capacidad para destruir a los microorganismos (16).
De los tantos trastornos descritos sobre la anormalidad del poder de destrucción de los microorganismos por los fagocitos, el más estudiado corresponde a la Enfermedad Granulomatosa Crónica (EGC), donde la inmunidad celular y humoral se mantienen normales, así como la capacidad fagocítica de dichas células.
La EGC es un síndrome poco frecuente que afecta preferentemente a niños varones, aunque se han descrito casos en sujetos de mayor edad. Edwards & Cohen-Abbo (3) describen un caso de osteomielitis en un paciente con EGC de 18 años y Glaser et al. diagnostican un paciente de EGC a los 43 años de edad (5).
La mayoría de los casos implican defecto en alguna de las cuatro principales proteínas constituyentes del complejo enzimático que transfiere electrones del NADPH al oxígeno, para crear los oxidantes microbicidas. Estos defectos se pueden heredar de una forma autosómica recesiva: EGC autosómica, o ligados al cromosoma X: EGC ligada a X. Los portadores maternos de la EGC ligada a X muestran dos poblaciones de células fagocfticas, una normal y otra con el defecto (4).
La consecuente deficiencia en la producción de peróxido de hidrógeno y otros compuestos letales para los microorganismos, predispone al paciente a infecciones que suelen ser severas y difíciles de tratar. Estas infecciones predominan en los ganglios linfáticos (adenitis supurativa), tejido subcutáneo, pulmones (neumonías o abscesos pulmonares), hígado (abscesos hepáticos recidivantes) y huesos, presentándose además manifestaciones gastrointestinales tales como diarrea, abscesos perianales y obstrucciones causadas por la formación de granulomas (14), los cuales se desarrollan cuando la continua activación de los macrófagos los induce a adherirse unos con otros, asumiendo una forma epiteloide, inclusive formando células gigantes multinucleares al fusionarse entre ellos. Dichas células gigantes desplazan a las células del tejido normal, formando nódulos palpables y liberando altas concentraciones de enzimas líticas, que destruyen el tejido alrededor. En estos casos, la respuesta puede llevar a un daño de los capilares sanguíneos y una necrosis tisular externa (8).
Entre los microorganismos involucrados en dichas infecciones tenemos principalmente especies del género Staphylococcus y ciertas bacterias Gram negativas, en especial Escherichia coli, Serratia marrescens y Salmonella (1). También se reportan infecciones por Candida y Aspergillus, así mismo algunos casos por Pneumocystis caraii (6,11).
Se ha demostrado que las bacterias catalasa negativa no representan un problema para estos pacientes, debido a que dichos microorganismos producen HO durante su propio metabolismo, el cual no puede ser degradado al no haber catalasa presente, lo que las inhabilita a sobrevivir, aún en fagocitos defectuosos (8). Otra posible explicación a esta situación es que el HO de origen bacteriano puede colaborar con la mieloperoxidasa, la cual está presente en los fagocitos de los pacientes con EGC, para formar suficiente HOCI y eliminar al agente infeccioso (15).
Entre los ejemplos citados en la literatura de este tipo de microorganismos tenemos: Streptococcus pneumoniae (15) y Haemophilus influenzae (4).
Clínica y bioquímicamente la EGC es un desorden muy heterogéneo, debido a la existencia de muchos sistemas antimicrobianos que parcialmente pueden compensar el defecto en la vía de muerte dependiente de oxígeno; además, el origen genético de este síndrome es muy complejo (2,12).
La terapia en los pacientes con EGC se basa sobre todo en la aplicación de antibióticos y antimicóticos que controlen las infecciones declaradas. Los corticoides son prescritos como antiinflamatorios con el propósito de reducir la capacidad de fagocitosis y así permitir una mejor acción de los antibióticos sobre las bacterias, mientras éstas permanecen extracelularmente (11).
En cuanto al NBT, tenemos que éste es una sal de tretrazolio soluble en agua, de color amarillo, con fórmula empírica CHNOCl y con peso molecular de 817,674 g/mol (17).
El método se fundamenta en el hecho que el NBT en presencia de O es reducido a formazán, una sustancia de color azul-negro que se deposita como partículas insolubles dentro de las células, este ensayo es una prueba indirecta utilizada para evaluar desórdenes de la fagocitosis y del sistema bactericida dependiente del oxígeno, es la prueba estándar para la detección de la EGC, debido a que las células de las personas que sufren este mal dan la reacción alterada o no la dan del todo. Solubilizar el formazán obtenido utilizando hidróxido de potasio (KOH) y dimetil sulfóxido (DMSO), presume de aumentar la sensibilidad del ensayo y de extender sus aplicaciones (13).
Métodos basados en la citometría de flujo han sido desarrollados, donde se utiliza 2,7 diclorofluoresceína- diacetato (DCFH-DA), valiéndose del hecho de que esta sustancia difunde fácilmente a través de las membranas plasmáticas para ser hidrolizada y ser convertida en un sustrato impermeable y no fluorescente, la 2,7 diclorofluorescina (DCFH), que es oxidada por el peróxido de hidrógeno para volverse un fuerte fluorocromo, el 2,7-diclorofluresceína (DCF) que puede ser cuantificado por citometría de flujo (18). Ensayos similares únicamente varían el sustrato a utilizar, como por ejemplo la dihidrorhodamina 123 en sustitución del DCFH-DA (15).
Material y Métodos
1. Recolección de la muestra.
El estudio implicó muestras de sangre total, obtenidas por punción venosa; se recogieron 5 ml por persona, utilizando heparina sódica como anticoagulante. Las muestras se evaluaron durante las 24 horas posteriores a su colección. No se aceptaron muestras coaguladas, refrigeradas o congeladas. Cuando fue necesario, se almacenaron a temperatura ambiente, no más de 24 horas.
2. Preparación de los estimulantes.
Con ayuda del nefelómetro del equipo VITEK, se prepararon concentraciones bacterianas correspondientes al estándar 0,5 ; 1,0 ; 2,0 y 3,0 de McFarland.
Para solución salina se calibró el 0% y el 100% de transmitancia con una solución fuerte de tinta azul y un tubo con solución salina estéril, respectivamente.
Se prepararon las concentraciones disolviendo con ayuda de un palillo de madera estéril las colonias bacterianas en la solución salina.
Se traspasó la mitad de cada una a tubos de vidrio y se pusieron en agua hirviendo por diez minutos, para obtener las respectivas concentraciones de bacterias muertas.
Para plasma humano: se calibró el 0% y el 100% de transmitancia con una solución fuerte de tinta azul y un tubo con plasma estéril diluido 1:2, respectivamente.
Para las bacterias muertas, se centrífugo la mitad del volumen de las inactivadas en salina y se resuspendió el precipitado en igual volumen de plasma.
Se preparó el lipopolisacárido liofilizado (LPS), según especificaciones del fabricante.
3.Preparación de leucocitos.
A 5 ml de la sangre heparinizada, se le agregaron 4 ml de Dextrán-70 al 6% en solución salina. Se mezcló con cuidado y se dejó sedimentar por 30-60 minutos a 37°C.
Luego, con ayuda de una pipeta Pasteur se obtuvo la capa superior rica en leucocitos y se colocó en un tubo limpio. Se centrifugó a 2000 rpm por 5 minutos y se descartó el sobrenadante.
Se hemolizaron los glóbulos rojos contaminantes, resuspendiendo el botón de células cuidadosamente en 4 ml de NHCI al 0,8% para luego volver a centrifugar y hacer el proceso dos veces más.
Se lavó tres veces, centrifugando y resuspendiendo el botón de células blancas en 4 ml de PBS IX estéril. Se resuspendieron las células lavadas en 5 ml de PBS.
Se procedió a determinar el número total de células, con ayuda de una cámara de Neubauer y se examinó la viabilidad utilizando azul tripán, para lo cual se mezclaron bien 50 ul de la solución de células con 50 ul de azul tripán.
Se ajustaron concentraciones a 5 millones de células / ml, utilizando PBS IX.
4.Reducción del NBT.
Se preparó el NBT según indicaciones del fabricante (Img/ml).
Se pipetearon 100, 150 y 200 ul de células a los hoyos asignados respectivamente en la placa de microELISA de 96 hoyos, fondo plano.
De ahí en adelante, se agregaron 100 ul de las diferentes concentraciones de bacterias vivas y muertas, tanto en la solución salina como en el plasma. Para el LPS se pipetearon 5, 10, 15 y 20 ul.
Se le agregó a los pocillos blanco 100 ul de salina o plasma, según suspensiones bacterianas utilizadas.
Se pipetearon 1 00 ul de NBT a cada pocillo, excepto a los asignados como blancos.
Se incubó por 30 minutos a 37°C, en incubadora con atmósfera al 5% de CO2.
Posterior a la incubación, se hicieron tres lavados para eliminar el NBT no reducido, pipeteando 300 ul de metanol al 70% directamente a cada pocillo de la placa, para luego sedimentar las células haciendo uso de la centrífuga refrigerada para placas. Se descartó el sobrenadante con ayuda de una pipeta Pasteur.
5.Solubilización del NBT reducido.
A cada pocillo, se le agregó primero 120 ul de KHO 2M, luego 140 ul de dimetilsulfóxido (DMSO).
Inmediatamente se mezcló el contenido de los hoyos para completar la solubilización del formazán, valiéndose de una pipeta Pasteur. Se leyó la DO a 650 nm en un lector para microELISA.
6.Preparación de la curva de calibración.
Se agregaron 120 ul de KHO 2M a cada pocillo, luego 140 ul de DMSO.
Se pipetearon 0, 5, 10, 20, 30, 40 ul de NBT diluido 1:8 (1,25 x 10mg/ml) a los respectivos pocillos, se homogenizó bien y se leyó igual a las muestras.
Resultados
a) Estudio de los estimulantes.
Se obtuvo un precipitado color azul oscuro en los pocillos donde las células fueron incubadas junto a alguno de los estimulantes empleados. Este fue más evidente para las bacterias vivas, leve para las muertas y casi indetectable para el LPS y las células sin estimulante. Los pocillos designados como blanco no presentaron evidencia alguna de su formación.
Al agregar KOH y DMSO se obtuvo una disolución de color azul turquesa. La intensidad del color desarrollado fue directamente proporcional a la cantidad del precipitado observado.
Finalmente, se obtuvieron lecturas de densidad óptica superiores para las bacterias vivas utilizadas como estimulante, dicha densidad óptica fue mayor conforme la concentración de bacterias fue más alta. Las bacterias muertas arrojaron valores inferiores a los anteriores y por último, el LPS presentó los valores más bajos, revelando casi ningún efecto sobre la DO conforme su concentración aumentó (Figura 1).
b) Estudio de las diferentes concentraciones de células.
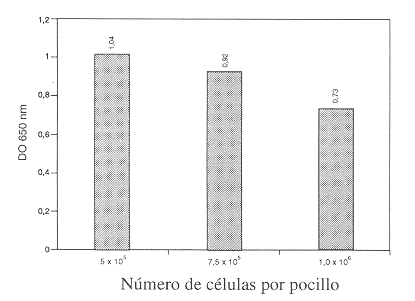
Como lo ilustra la Figura 2, se lograron mayores densidades ópticas al utilizar el menor número de células fagocíticas por pocillo (5 x 10 células/ pozo), las lecturas disminuyeron conforme el número de células agregadas fue mayor.
c) Estudio del medio de suspensión.
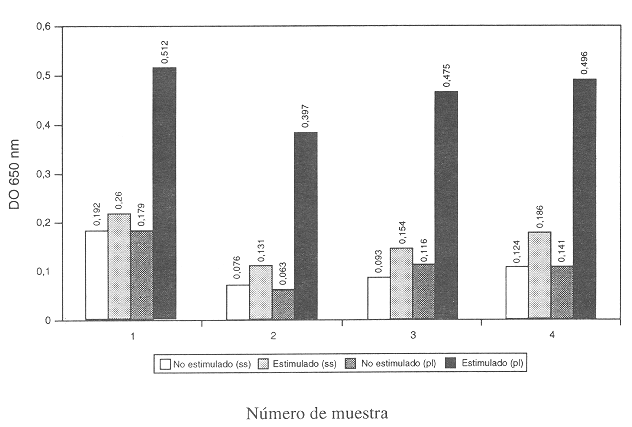
Los resultados obtenidos al utilizar plasma o solución salina como medio para preparar la suspensión de bacterias se muestran en el Cuadro 1 y la Figura 3. Como se observa en los cambios de estimulación dados en el Cuadro 1, se lograron incrementos mayores de DO al emplear bacterias vivas resuspendidas en plasma, las mismas bacterias utilizadas en solución salina mostraron sólo un ligero incremento de DO con respecto a las células no estimuladas.
d) Curva de calibración.
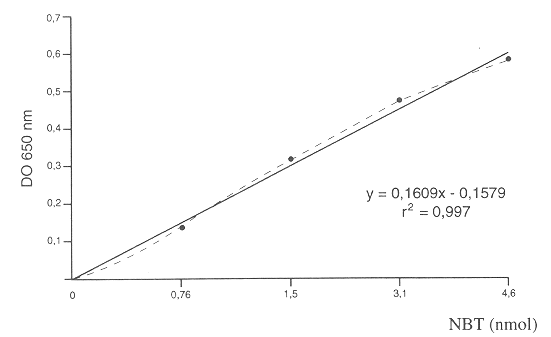
La curva de calibración resultante al disolver cantidades de NBT conocidas en KOH y DMSO se muestran en la Figura 4. Se logró una relación lineal entre los diferentes puntos (r= 0,997). La DO mostró un aumento directamente proporcional a la cantidad de NBT disuelto.
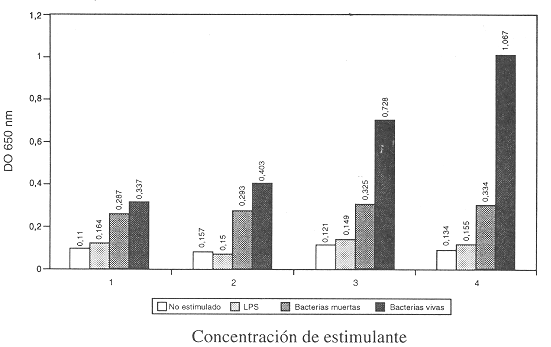
Nota: 1,2,3 y 4 tanto para las bacterias vivas como muertas corresponde al 0,5; 1,0; 2,0; 3,0 del estándar de McFarland, respectivamente. Para el LPS corresponde a 5, 10, 15, y 20 ul dispensados (no expresados en concentración debido a que no es especificada por fabricante).
| | | |||||||
| | | | | | | | | |
| | | | | | | | | |
| | | | | | | | | |
| | | | | | | | | |
| | | | | | | | | |
| | | | | | | | | |
| | | | | | | | | |
| | | | | | | | | |
| | | | | | | | | |
| | | | | | | | | |
| | | | | | | | | |
| | | | | | | | | |
| | | | | | | | | |
| | | | | | | | | |
| | | | | | | | | |
| | | | | | | | | |
| | | | | | | | | |
| | | | | | | | | |
Est. Estimulado
No est. No estimulado
Cambio Est: Cambio de estimulación
Discusión
La prueba del NBT es ampliamente utilizada para el estudio de la EGC, debido a que detecta anormalidades en el consumo del O post-fagocítico en las células polimorfonucleares, el cual se encuentra reducido en esta enfermedad.
La solubilización del formazán agregando KOH y DMSO fue la metodología de elección para el estudio, debido a que permite la fácil lectura de la prueba haciendo uso de un espectrofotómetro, además, Rook et al. recalcan que con esta opción se logra una mayor sensibilidad y exactitud en la prueba, necesitándose menos cantidad de células para lograr resultados significativos (13).
Inicialmente, se probaron varios tipos de estimulantes del sistema fagocítico (bacterias vivas, bacterias muertas y LPS), y a la vez se montaron en diferentes concentraciones, con el objetivo de determinar cuál estimulante y a qué cantidad era capaz de producir un aumento significativo en la cantidad de NBT reducido por los polimorfonucleares. Según los resultados obtenidos, se observó un mayor rendimiento al utilizar como estimulante bacterias vivas, debido probablemente a que su uso reproduce una situación más precisa del fenómeno a que da lugar "in vitro" cuando el organismo responde ante una infección bacteriana activa; la optimización de los resultados al utilizar la concentración más alta, obedece al hecho de que más células son incitadas a fagocitar el NBT soluble y a la vez a reducirlo a una tasa mayor, debido al aumento en la liberación de sustancias reductoras dentro del fagolisosoma. El uso del nefelómetro en la preparación de las diferentes concentraciones obedece al simple hecho de agilizar el procedimiento.
Al comparar entre el uso de plasma y solución salina para realizar las suspensiones del estimulante, se pensó en encontrar cuál de los medios ofrecía las mejores condiciones para mantener a las bacterias vivas e íntegras hasta el momento de ser utilizadas. En este trabajo se obtuvo una diferencia significativa entre estas dos variables (p<0,05) a favor del uso del plasma,
Debido probablemente a que las bacterias en esta suspensión encuentran un medio rico en nutrientes que les es favorable. La posible reducción inespecífica de NBT por parte del plasma se refuta, por el hecho de que tanto los blancos montados para el plasma como para la solución salina presentan densidades ópticas semejantes (Cuadro 1).
También se comprobó una diferencia significativa al comparar los resultados obtenidos entre las células no estimuladas y las estimuladas usando el plasma (p<0,05), la diferencia no fue significativa con respecto a la solución salina (p>0,05).
En cuanto al volumen de NBT empleado, se observó un mayor rendimiento al utilizar 150 ul por hoyo (datos no mostrados), no obstante, se adoptó la utilización de 100 ul por hoyo en respuesta a la limitación en el volumen máximo que se puede utilizar por pocillo.
Contrario a lo que se esperaba, el uso de un mayor número de células desembocó en valores inferiores de densidades ópticas (Figura 2), aspecto explicable por el hecho de que un alto número de células favorece la formación de sobrecapas en el fondo de los pocillos a la hora de centrifugar, las cuales se pueden perder en el proceso de lavado.
Finalmente, la obtención de una curva de calibración que cumple la ley de linealidad de Lambert y Beer, permite la conversión de lecturas de densidad óptica a nanomoles de NBT reducido (Figura 4), lo que transforma a la técnica en un método cuantitativo que elimina la subjetividad en el conteo microscópico a la que está expuesta la prueba tradicional de preparación y tinción de frotis (9).
El uso de placas para microELISA ofrece como gran ventaja el poder analizar un gran número de muestras simultáneamente, en una forma sencilla y cuantitativa, utilizando pequeños volúmenes de reactivos y pocas cantidades de las células a estudiar. Según los resultados obtenidos, bajo las condiciones descritas se obtiene la optimización de la técnica propuesta si se utilizan 500 mil células por pocillo, se emplea como estimulante bacterias vivas (E. coli) al 3,0 de MacFarland resuspendidas en plasma humano diluido 1:2 y se agregan 100 ul de NBT 1 mg/ml) por pocillo.
Resumen
La enfermedad granulomatosa crónica (EGC), es un padecimiento en el cual las células fagocíticas se ven imposibilitadas de producir sustancias microbicidas por las vías dependientes del oxígeno. Esta anormalidad puede evaluarse en el laboratorio haciendo uso de la prueba del nitroazul de tetrazolio (NBT), el cual es afectado directamente por la cantidad de superóxido producido y liberado en el fagolisosoma. Existen muchos y diversos protocolos a seguir a la hora de llevar a cabo dicho análisis. Aquí se describe la estandarización de un método simple, donde el formazán producto de la reducción del NBT es solubilizado con ayuda de KOH y dimetilsulfóxido (DMSO), determinándose la densidad óptica de la disolución resultante en un lector de placas para microELISA. La técnica logra simplificar y agilizar el estudio de pacientes sospechosos de EGC que acudan al Hospital Nacional de Niños, debido a que permite incluir un mayor número de muestras por análisis, además permite cuantificar el NBT reducido por interpelación en una curva de calibración tipo Lambert y Beer.
Agradecimiento
A la Licda. Isabel Yock por su ayuda en el análisis estadístico de datos.
Bibliografía
1. Dale D. : Anormalidades de los leucocitos. In: Thorn A (ed). Medicina Interna Harrison. Ediciones Científicas La Prensa Médica Mexicana, S.A. México D.F. 357-365, 1985. [ Links ]
2. Ding C., Kume A., Björguindottir H. et al.: High-LeveI Reconstitution of Respiratory Burst Activity in a Human X-Iinked Chronic Granulomatous Disease (X-CGD) Cell Line and Correction of Murine X-CGD Bone Marrow Celis by Retroviral-Mediated Gene Transter of Human gp91 phox.Blood 88: 1834, 1996. [ Links ]
3. Edwars K. & Cohen-Abbo A. : Multifocal Osteomielytis caused by Paecilomyces varioti in a Patient with Chronic Granulomatous Disease. Infection. 1:55, 1995. [ Links ]
4. Forehand J. & Johnston R. : Chronic Granulomatous Disease: Newly Defined Molecular Abnormalities Explain Disease Variability and Normal Phagocyte Physiology. Current Opinion in Pediatrics 6:668, 1994. [ Links ]
5. Glaser J., Gahr M. , Mann O. et al. : Chronic Granulomatosis: a rare Differential Diagnosis in Liver Granulomas in Adulthood. Dtsch. Med. Wochen Schr. 18:646,1995. [ Links ]
6. Griscelli C. : Las Deficiencias Inmunitarias. In: Bach J (ed). Inmunología. Editorial Limussa. México D.F. 799-823, 1984. [ Links ]
7. Jiménez R. & Sáenz G. : Leucocitos: Producción, cinética y función. Anormalidades cualitativas y cuantitativas. In: Sáenz G. (ed). Hematología Analítica. Editorial Nacional de Salud y Seguridad Social. San José, Costa Rica 53-86, 1995. [ Links ]
8. Kuby J. : Immunodeficency Diseases. In: Kuby J (ed). Immunology. WH Freeman and Company. New York 507-521, 1997. [ Links ]
9. Lomonte B. & Rojas L. Prueba de Reducción del NBT por leucocitos. In: Lomonte B, Rojas L. (eds.). Inmunología: Manual de Laboratorio. Editorial de la Universidad de Costa Rica. San José, Costa Rica 124-127, 1996. [ Links ]
10. Maderazo E. & Ward P. : Phagocytic Cells: Polymorphonuclear Cells and Monocytes. In: Henry J. (ed). Clinical Diagnosis and Management by Laboratory Methods. W.B. Saunders Company. Philadelphia. 848-859, 1979. [ Links ]
11. Marques A., Kwon-Chung K., Holland S. et al.: Suppurative Cutaneus Granulomata Caused by Miccroascus cinereus in a Patient with Chronic Granulomatous Disease. Clin. Infect. Dis. 1: 110, 1995. [ Links ]
12. Peña M. : Evaluación del Sistema Inmune. In: Fernández E, González J. , Oriol A. (eds). Inmunología. Ediciones Pirámide, S.A. Madrid. 150-173, 1982. [ Links ]
13. Rook G., Steele J., Umar S.et al. : A Simple Method for the Solubilization of Reduced NBT, and its Use as s Colorimetric Assay for Activation of Human Macrophages by Interferon- . J. Imm. Methods 82: 161, 1985. [ Links ]
14. Roos D., de Boer M., Kuribayashi F. et al. : Mutations in the X-Iinked and Autosomal Recessive Forms of Chronic Granulomatous Disease. Blood 87:1663,1996. [ Links ]
15. Sadler D. & Keren D.: Surface Markers Assays in Immunodeficiency Diseases. In: Kereti D., Hanson C., Hurtubise P. (eds). Flow Cytometry and Clinical Diagnosis. American Society of Clinical Pathologists. Chicago 309-356, 1993. [ Links ]
16. Spitznagel J. : Defensas constitutivas del cuerpo. In: Schaechter M., Medoff G., Eisenstein B., Guerra H (eds). Microbiología. Mecanismos de las Enfermedades Infecciosas. Enfoque Mediante Resolución de Problemas. Editorial Médica Panamericana. Buenos Aires 110-132, 1994. [ Links ]
17. Stossel T. & Cohn Z. : Phagocytosis. In: Williams C., Chase M. (eds). Methods in Immunology and immunochemistry. Academic Press. New York 261-301, 1976. [ Links ]
18. Vuorte J., Jansson S. & Repo H. : Standarization of a Flow Cytometic Assay for Phagocyte Respiratory Burst Activity. Scand. J. Imm. 43:329, 1996. [ Links ]
* Facultad de Microbiología, Universidad de Costa Rica. San José, Costa Rica.
** División Inmunología, Laboratorio Clínico, Hospital Nacional de Niños "Dr. Carlos Sáenz Herrera". C.C.S.S. San José, Costa Rica.













