Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Médica del Hospital Nacional de Niños Dr. Carlos Sáenz Herrera
Print version ISSN 1017-8546
Rev. méd. Hosp. Nac. Niños (Costa Rica) vol.34 suppl.0 San José Jan. 1999
La infección por el Virus de la Inmunodeficiencia Humana (VIH) se ha convertido en una realidad de salud en todos los países del mundo. El VIH afecta hombres, mujeres y niños de todas las edades, credo y condición socioeconómica. De acuerdo a las cifras de la Organización Mundial de la Salud la pandemia ha producido 13,9 millones de muertes, actualmente hay 33,4 millones de seres humanos infectados y en 1988 murieron 2,5 millones de personas a causa del VIH. El 3,6% de los infectados vivos corresponde a < 15 años de edad, al igual que el 23% de los que han fallecido (40). En Costa Rica los < 18 años representan el 2,9% del total de los casos vivos.
La evidencia de la presencia de una nueva enfermedad, se produjo en el mundo occidental en la década de los 80; sin embargo, existe evidencia de la presencia del VIH en sueros obtenidos en países de Africa Central en 1959(48). La diseminación del VIH se dio en la década de los 70, varios años antes de la descripción del primer caso en 1981 en los Estados Unidos(48,51). El VIH como etiología se identificó en 1983(48,51) y en 1985 estaba disponible una prueba de laboratorio diagnóstico, basada en la detección de anticuerpos contra el VIH(47). La infección por VIH en niños fue reportada, por primera vez, por Rubinstein en New York en 1982(48). Posteriormente empezaron a aparecer reportes en New Jersey, San Francisco y Florida(48). En Costa Rica el primer caso en niños se documentó en 1984.
La epidemia de infección por VIH ha sido progresiva, al igual que su comprensión que los estudios de investigación que permiten elaborar las diferentes estrategias de prevención y tratamiento. Entender el virus y la enfermedad ha permitido la evolución del concepto pesimista de una enfermedad terminal, a uno optimista de una enfermedad crónica que con tratamiento adecuado permite una buena calidad de vida a los pacientes. Con la educación sobre la enfermedad se redujo el terror, la discriminación y la irracionalidad en la actuación del público y el personal de salud hacia los pacientes.
Para el final del milenio, estamos enfrentando una enfermedad nueva con la capacidad de: hacer el diagnóstico, tamizar los productos sanguíneos, identificar factores de riesgo para la transmisión y elementos de pronóstico, utilizar medicamentos que interfieren con la biología del VIH y que permiten tratar al paciente y prevenir la infección en los recién nacidos y en personal de salud expuesto, mostrar solidaridad y comprensión ante el drama humano de la enfermedad y abordarla con trabajos de equipos multidisciplinarios; todo lo cual representa muchas actividades orientadas a controlar una enfermedad con la que entramos en contacto hace 30 años.
Epidemiología
En Costa Rica el primer caso de infección por VIH se detectó en 1983 en un paciente hemofílico en la fase sintomática de la enfermedad. Las pruebas para el tamizaje de 100% de las sangres en bancos de sangre se introdujeron en octubre de 1985. Los datos epidemiológicos más importantes se presentan en el Cuadro 1.
Al principio de la epidemia en 1985, se creó la Clínica para la atención del paciente pediátrico con infección por VIH (CIVIH-HNN) en el Hospital Nacional de Niños "Dr. Carlos Sáenz Herrera". En esa época alrededor de 90% de los casos < 18 años de edad correspondían a hemofílicos. Para 1985, catorce niños habían fallecido como consecuencia de la infección por VIH e iniciaron control en la clínica 29 pacientes. A partir de 1994 se observa un cambio en la epidemiología. Con el tamizaje de los productos sanguíneos y la introducción de normas de calidad para los productos de coagulación, no se registraron más casos infectados por productos sanguíneos. En su lugar aparecieron los hijos e hijas de madres VIH+. A partir de entonces alrededor del 90% de los casos en edad pediátrica se originan en transmisión perinatal. Este cambio marcó una diferencia importante en el abordaje del problema, pasamos a atender individuos VIH+, a trabajar con equipos multidisciplinarios en la atención de familias VIH+. La madre y/o el padre infectados y la alteración en su salud producen un cuidado de menor calidad para el niño o niña, abandono, orfandad y dificultades para una buena adherencia al tratamiento. A partir de 1994 se hace muy importante el abordaje en conjunto de la problemática biológica, social y económica de la infección por VIH. Una tercera etapa en la atención del problema se da a partir de noviembre de 1997 cuando por dictamen legal se obliga al estado a proveer el tratamiento con antiretrovirales a los pacientes VIH+. A partir de entonces iniciamos la atención del paciente como enfermo crónico y cuantificamos cambios importantes en morbilidad, calidad de vida y mortalidad.
| N° | % | |
| | ||
| Total | 1502 | 100,0 |
| Vivos | 656 | 43,7 |
| Edad 0-19 años 20-49 años | 68 1290 | 4,5 85,9 |
| Sexo Mujeres Hombres | 150 1352 | 10,0 90,0 |
| Vía de transmisión Homosexual/bisexual Heterosexual Perinatal Productos sanguíneos Drogas iv | 955 315 25 63 18 | 63,6 21,0 1,7 4,2 1,2 |
| | ||
Fuente: Depto. Control Sida, Ministerio de Salud (datos al 15/11/1998).
Biología del VIH
Los dos serotipos de VIH (1 y 2) conocidos, son miembros de la familia Retroviridae, subfamilia Lentivirnae. Otros miembros de esta familia infectan monos, mandriles y chimpancés (4,9). El virión de VIH contiene una cápside que está formada por la proteína principal de la cápside (p24), la proteína de la nucleocápside (p7/p9), el genoma formado por 2 cadenas (diploide) de ARN de banda simple y polaridad positiva y las tres enzimas virales (transcriptasa inversa (TI), integrasa y proteasa (PA)) (4,9). Al igual que todos los retrovirus, el genoma del VIH utiliza la TI para producir una molécula de ADN (provirus), que se integra en el ADN cromosomal de la célula huésped. El gen polimerasa codifica las enzimas TI, integrasa y PA. Estas enzimas son las que catalizan la transcripción inversa, integración del ADN proviral y procesamiento de las proteínas de la cápside viral. Todo el proceso lleva a al generación de los componentes virales de la núcleo-cápside y de moléculas de regulación del virus. La inhibición de los productos del gen polimerasa con antiretrovirales es una terapia antiviral efectiva porque bloquea la replicación viral (4).
La cápside viral está rodeada por una matriz proteica (p17) colocada debajo de la membrana fosfolipídica (MFL). Esta MFL está formada por una membrana derivada de la célula huésped y un complejo proteico tetramérico del virus, en el cual cada subunidad está formada por dos proteínas de membrana unidas no covalentemente (gp-120 proteína exterior de la MFL y gp-41 proteína de transmembrana). El complejo proteico de la MFL facilita la entrada del virus a la célula por la unión a CD4 de gp120. La gp41 participa en la fusión del a MFL con la membrana celular de la célula huésped. Las proteínas estructurales del virus están codificadas por diferentes genes: gag(p17,p24, p7/p9), pol (PA, TI e integrasa) y env (gp160). Gp160 luego de ser procesada por la proteasa celular, da origen a gp120 y gp41. Además los genes tat, rev, vif, nef, vpu y vpr codifican las proteínas reguladoras (4, 9).
El VIH tiene una importante variabilidad genética. Se han demostrado variaciones entre diferentes aislamientos, e incluso dentro de un mismo paciente. La aparición continua de variantes virales se explica por la baja exactitud de la traducción de la TI y por la alta tasa de producción viral, que se ha determinado en valores de hasta 109 viriones por día. Esta habilidad de mutar explica la aparición de resistencia contra los antiretrovirales y la capacidad del virus de escapar a la acción de los anticuerpos neutralizantes y de células citotóxicas generales como mecanismos de defensa por el huésped (4).
El VIH puede mostrar variaciones funcionales en su tropismo pro células de diferente origen. Algunas variantes del virus muestran preferencia por la infección de macrófagos y otras por la de linfocitos T. Los virus con trofismo por macrófagos pueden ser más efectivos infectando a través de membranas mucosas y su evolución in vivo dar origen a variantes con tropismo para la célula T, en esta forma del tropismo de la variante del VHI puede relacionarse con la forma de transmisión(4).
El análisis genético del VIH ha mostrado dos grupos diferentes: M y O. En la mayoría de los casos los virus son del grupo M. Dentro del grupo M hay 10 subtipos (A-J). Las cepas del grupo O han sido identificadas en individuos de origen africano. Esta variabilidad es importante para el desarrollo de vacunas contra el VIH(4).
CD4 es el receptor principal de VIH en las células del ser humano. Recientemente se ha demostrado que la presencia de receptores accesorios (RA) es necesaria para que HIV-1 infecte la célula huésped. Estos RA son moléculas de superficie que normalmente funcionan como receptores de quimioquinas (proteínas con capacidad quimiotáctica y propiedades de citoquina). Varias quimioquinas pueden bloquear los receptores e interferir con la infección por VIH-1, algunas incluso son secretadas por los linfocitos CD8+. El receptor alfa de quimioquiana, CXCR-4 (fusina) es un RA de virus con tropismo por linfocitos. El receptor beta de quimioquinas, CCR-5 es RA de virus con tropismo por macrófagos. Individuos que son homocigotos para una deleción de 32 nucleótidos ( aquí va un triángulo32) en CCR-5 muestran una gran resistencia a la adquisición por transmisión sexual del VIH-1(4, 9, 22, 50). A nivel de sistema nervioso central se ha demostrado neurotropismo por medio de hibridización in situ e inmunohistoquímica. El VlH infecta los astrocitos; sin embargo, la transcripción es restringida y los astrocitos subcorticales son un reservorio del virus. La infección produce la pérdida de funciones muy diferenciadas de los astrocitos requeridas para dar soporte a las neuronas. El virus llega al sistema nervioso por medio de macrófagos infectados que transfieren la infección a microglia, a células gigantes multicucleadas y a otros macrófagos. No hay evidencia de lesión directa sobre las neuronas; sin embargo, productos secretados por células infectadas, como gp120 resultan tóxicos y los monocitos infectados producen neurotoxinas(39).
Diagnóstico
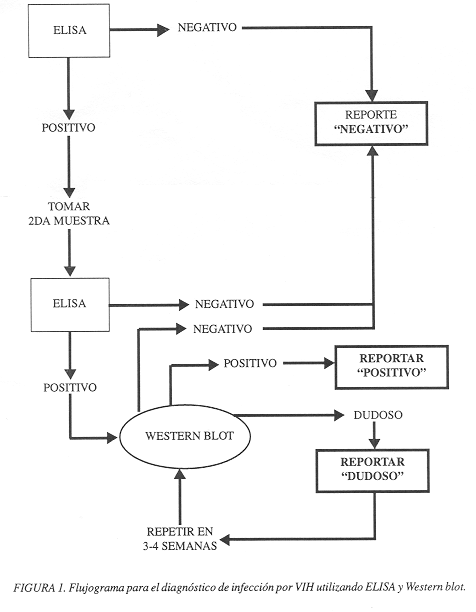
En el diagnóstico de infección por VIH, debemos tomar en cuanta la edad del paciente. Si se trata de un caso con menos de 18 meses de edad, no debemos utilizar pruebas que determinan anticuerpos (ELISA, Western blot), porque éstas no pueden distinguir entre los anticuerpos transferidos por la madre al niño durante el embarazo y los que el niño produce. En > 18 meses de edad los exámenes que detectan anticuerpos tienen utilidad diagnóstica. ELISA Y Western blot (Wb) son pruebas que determinan la presencia de anticuerpos tipo inmunoglobina G contra las proteínas del VIH. El ELISA determina anticuerpos contra un conjunto de proteínas, y el Western blot determina anticuerpos contra cada una de las proteínas del VIH. ELISA es una prueba de tamizaje con alta sensibilidad, pero el diagnóstico debe comprobarse con un Wb que tiene más especificidad. El Wb permite identificar los pacientes con anticuerpos contra proteínas por VIH e identifica los falsos positivos detectados por ELISA (25)(figura1).
Se han detectado falsos positivos con el Wb por lo que se recomienda que individuos con un Wb que no identifica la banda p31 deben ser corroborados con otras pruebas como reacción en cadena de polimerasa para VIH (PCR-ARN-VIH)(27).
La prueba de ELISA se reporta como no reactiva si la lectura del suero del paciente está por debajo del punto de corte de la corrida efectuada y como reactiva si está por encima. Una prueba de ELISA reactiva requiere una segunda muestra de suero; si ésta es reactiva, se debe enviar para comprobación por Wb. El Wb se reporta como positivo al identificar 2 de las 3 proteínas diagnósticas de VIH-1 (p24, gp41 y gp120/160)(10). El resultado de los exámenes se debe dar al paciente después de tener dos ELISA reactivos y un Wb positivo. Siempre se discuten los resultados con la ayuda de una persona con experiencia en consejería para pacientes VIH positivos(2, 25, 47).
En los menores de 18 meses de edad, el diagnóstico se efectúa buscando evidencia de integración del genoma de VIH en el genoma de las células mononucleares del niño o niña. La técnica de laboratorio que se utiliza es una reacción en cadena de polimerasa para VIH (PCR-VIH-ADN), la cual tiene una sensibilidad de 31-100% y una especificidad de 50-100%, dependiendo de la edad en que se use(41). El momento más corto efectivo para tomar el examen es a los 3 meses de edad. Esta prueba tiene una sensibilidad de 95% o más después del primer mes de vida(37, 43). La muestra para PCR-VIH-ADN, se debe recolectar en tubos con EDTA, 3-4 ml extraídos de una vena periférica, no congelar y enviar al laboratorio que debe realizar el examen dentro de las 24 horas después de extraído.
Cuando están disponibles el cultivo viral y la determinación de p24, se pueden utilizar para el diagnóstico de infección en < 18 meses de edad.
Transmisión perinatal
Las formas de transmisión en la edad pediátrica son perinatal (TP), por transfusión de productos sanguíneos, sexual y por uso de drogas intravenosas.
La TP se dan en recién nacidos hijos de madres VIH+ y puede ocurrir durante la gestación (in uterus), el período de labor, el parto (intraparto) y el posparto vía lactancia materna.
Un niño se considera infectado in uterus si los estudios de PCR-ARN-VIH o PCR-ADN-VIH son positivos en las primeras 48 horas de vida. Infección intraparto se define cuando los estudios virológicos son negativos en las primeras 48 horas de edad, pero se positivizan después de la primera semana de vida(6).
Se ha estimado que 13 a 40% de las madres infectadas conVIH-1 transmiten el virus a sus recién nacidos(7,31). Los anticuerpos maternos tipo inmunoglobulina G anti-VIH-1 persisten en sus hijos o hijas hasta por 15 meses. Se han descrito casos en los que se ha demostrado que el hijo(a) de estas madres VIH positivas puede aclarar el virus después de haber sido infectado perinatalmente(7).
La transmisión del VIH de la madre al niño (a) se ha demostrado en los períodos intrauterino, intraparto y posparto. El VIH-1 ha sido detectado en placenta y en tejido fetal. El tiempo de inicio de la clínica en los casos infectados, indica que la transmisión intrauterina ocurre en un 17-40% y la intraparto en el 60-80%. Se ha estimado que el 92% de toda la transmisión ocurre durante los 2 meses previos al parto o durante éste, y que el 65% ocurre durante el período intraparto(49).
El primer gemelo que nace tiene más del doble de riesgo de infección que el segundo gemelo, lo cual se asocia con exposición más prolonga a secreciones infectantes en el tracto genital(23).
Varios factores se asocian al fenómeno de baja transmisión madre-niño (a). La semejanza en el complejo de histocompatibilidad (HLA) Clase I entre madre y producto está asociada con mayor transmisión, los pares con diferencia en las específicidades HLA A, B y C son los que muestran los porcentajes de transmisión menores(29).
Los factores maternos asociados a la transmisión del VIH al recién nacido son: el número de linfocitos CD4+, enfermedad por VIH avanzada, parto vaginal(53), una alta concentración en plasma del virus (52), corioamioitis, presencia de enfermedades de transmisión sexual, tiempo de ruptura de membranas, duración del período de labor, lesión de canal de parto con exposición a sangre materna (45). El comportamiento sexual de la madre durante el embarazo está asociado con la transmisión del VIH. Mujeres con más de un compañero sexual durante el primer trimestre de embarazo tienen mayor porcentaje de transmisión (20, 34, 35, 57).
Los factores asociados al virus son: la presencia de cepas de virus inductoras de sincicio, antigenemia p24(45) y aislamientos maternos con tropismo por macrófagos.
Un meta análisis realizado por "The International Perinatal HIV Group" utilizando datos de 15 estudios de cohorte prospectivos, demostró que la cesárea electiva reduce el riesgo de transmisión perinatal de VIH-1(54). El efecto evaluado es independiente del producido por la profilaxis con Zidovudina. El estudio reporta los datos de 8533 pares madre-hijo (a) y demuestra que la posibilidad de transmisión vertical de VIH-1 disminuyó aproximadamente 50% con el uso de cesárea electiva, cuando se le compara con otros tipos de parto. El riesgo de transmisión se redujo en 87% cuando se utilizó profilaxis con Zidovudina y parto con cesárea. Las tasas de transmisión vertical fueron de 2% en el grupo Zidovudina-Cesárea y 7,3% en el grupo sólo Zidovudina(54).
Un factor fetal es la presencia de mutaciones en los genes que codifican para los receptores de quimioquinas, las cuales confieren protección contra la infección por VIH. Se han encontrado tasas mas altas de prematuridad y retardo en el desarrollo intrauterino en niños infectados cuando se les compara con pares expuestos pero que resultan serovertores(38).
La alimentación con leche materna de una madre VIH+, produce un 14% de riesgo de transmisión del VIH. La prolongación de la lactancia materna por más de 15 meses se asocia con un aumento de 1,9 veces en el riesgo de infección. El riesgo de transmisión de VIH-1 excede los beneficios potenciales de la lactancia materna después entre los 3 y 7 meses de edad. El calostro y la leche temprana pueden representar más riesgo que la lactancia tardía, por su alto contenido de células(35).
Presentación clínica
La aparición de las manifestaciones clínicas en el paciente infectado por VIH es variable. Es un estudio 200 niños y niñas infectados seguidos desde el nacimiento, el inicio de síntomas se presentó como promedio a los 5,2 meses y probabilidad de permanecer asintomático fue de 12,0% a los 12 meses y de 6,1% a los 5 años de edad (24). Enfermedad grave se desarrolló en 43% de los casos a los 65 meses de edad promedio. Durante el primer año de vida los pacientes presentaron linfadenopatías, esplenomegalia, hepatomegalia, falla para progresar, fiebre y diarrea. En el segundo año de vida se comenzó a detectar la presencia de enfermedad neurológica. Un 2% nacieron con evidencia clínica de enfermedad y mostraron hepatomegalia, esplenomegalia y alteraciones neurológicas. Los niños y niñas infectadas perinatalmente progresan en forma diferente que los adultos y su enfermedad avanza más rápido. La disminución de los conteos de linfocitos CD4 en edad temprana antes del inicio de los síntomas se correlaciona con su aparición. Se ha observado una correlación entre bajo peso al nacer e inicio temprano de síntomas, por lo que esta condición es un marcador de progresión rápida de la enfermedad. La edad de inicio de los signos es un marcador del curso clínico, si es temprana se asocia a progresión rápida y muerte temprana(24).
En general la sintomatología asociada a la inmunodeficienca provocada por el VIH, se presenta como síndrome infeccioso, síndrome de desgaste o enfermedad neurológica.
El síndrome infeccioso se manifiesta como infección recurrente por las etiologías usuales de acuerdo a la edad del niño o niña (haemophilus influenzae, Streptococcus pneumoniae y virus) o infecciones por organismos oportunistas (Pneumocystis carinii, Mycobacterium, Candida albicans, Citomegalovirus), (2, 31, 34, 47)
En un estudio de 42 pacientes con episodios de fiebre, se identificó una frecuencia de 1,8 episodios de fiebre por niño por año de seguimiento. Los casos con PR tuvieron 4 veces más episodios que los de PL. El S. pneumoniae fue el germen más frecuentemente aislado en este grupo (28).
El síndrome de desgaste se produce por varios factores: reducción del apetito, diarrea crónica, malabsorción e infección gastrointestinal por el VIH y oportunistas (2, 31, 47).
La enfermedad neurológica producida por VIH se observa solamente en los niños infectados. Hay evidencia de que la exposición en el útero no produce alteraciones neurológicas en los serovertores. La enfermedad neurológica es más grave en los casos en que hay evidencia de síntomas y signos producidos tempranamente en los primeros años de vida (2, 5, 31, 47).
La encefalopatía puede ocurrir en una forma progresiva o en otra estática. El compromiso del sistema nervioso incluye deficiencias cognoscitivas generalizadas, motoras y de lenguaje, y alteraciones de grado variable del neurodesarrollo (5, 39). El deterioro del lenguaje en el niño infectado por VIH es frecuente, se identifica en ausencia de alteraciones del examen neurológico y precede al deterioro de habilidad cognoscitiva global (19). La encefalopatía estática se manifiesta inicialmente como un retraso no progresivo del neurodesarrollo, puede mejorar espontáneamente o desarrollar una encefalopatía progresiva. Esta última compromete el crecimiento del cerebro, que se asocia a un pequeño aumento en la circunferencia cefálica o una pérdida del volumen cerebral demostrada por estudios de imágenes seriados. Los niños (as) con encefalopatía progresiva no obtienen o pierden etapas de desarrollo y adquieren deficiencias motoras simétricas como paresias, trastornos de marcha y alteraciones del tono y de los reflejos. En niños mayores y adolescentes, la demencia asociada con VIH produce dificultad de concentración, respuestas mentales lentas, cambios de comportamiento y trastornos motores (39).
Tratamiento
Profilaxis de la transmisión perinatal: una intervención profiláctica, que reduce la transmisión perinatal, es el uso de antiretrovirales durante el embarazo y postparto en el recién nacido. El estudio ACGO76 demostró que el uso de Zidovudina (AZT, Retrovir, Glaxo-Wellcome) interrumpe la transmisión perinatal de VIH. En este estudio se logró una reducción de 67,5% en la tasa de transmisión en los pares que recibieron profilaxis con AZT(18). Estudios recientes indican que regímenes más cortos pueden interrumpir la transmisión en porcentajes importantes, pero por debajo de los demostrados en el ACTGO76. Las tasas de transmisión cuando se usa AZT prenatal son de 6,1%, intraparto 10,0% y en las primeras 48 horas de vida del recién nacido 9,3%. En ausencia de AZT la tasa de transmisión fue de 26,6% y cuando se comenzó después del tercer día de vida de 18,4% (56).
En el futuro se van a presentar los casos de madres VIH+ con diagnóstico y tratamiento con terapia antiretroviral triple, en las cuales tenemos que decidir con ellas los beneficios y riesgos de continuar el tratamiento, sustituirlo sólo por AZT, continuar todo el embarazo o suspender el tratamiento hasta la 14 semana de gestación. En la consejería de estas madres tenemos que tomar en cuenta el riesgo de utilizar medicamentos durante el embarazo de los cuales no tenemos información sobre teratogenicidad y toxicidad del feto y recién nacido. Hasta el momento sólo hay información de seguridad con AZT. Debemos discutir también las consecuencias para la madre: generación de cepas resistentes o aumento de la carga viral si sustituimos terapia triple por monoterapia. Es importante discutir también con la madre que recibe AZT cuál es la opción terapéutica del parto: ¿debe continuar con antiretrovirales o no? En la mayoría de los casos, los antiretrovirales, son medicamentos en los que la seguridad en el embarazo no ha sido determinada y no hay tampoco evidencia de seguridad en animales. Existen estudios en animales que no demuestran riesgo para el feto al usar otros antiretrovirales, pero no hay estudios bien controlados en mujeres embarazadas (8, 14, 32, 36)(Cuadro 2).
El uso de AZT antes del embarazo reduce el impacto de la profilaxis; en un estudio de pacientes francesas la tasa de transmisión fue de 20% en madres que ya habían recibido AZT antes del embarazo, contra 5% en madres que lo iniciaron al momento del embarazo(30).
Manejo del niño (a) hijo de una madre VIH+ durante los primeros 18 meses de edad: En los casos en que durante el embarazo se identifica a la madre como VIH+ es conveniente una cita preparto con personal de la CIVIH-HNN para conocer a la madre, discutir el uso de AZT durante las primeras 6 semanas de vida del recién nacido y conversar aspectos de pronóstico. Si el recién nacido inicia AZT a las 8 horas de edad, su madre debe acudir en las siguientes 48 horas del egreso a una cita a la CIVIH-HNN en la cual se programan los estudios de laboratorio necesario para monitorear el AZT y se revisar la dosis, frecuencia y problemas asociados al tratamiento. Los estudios de laboratorio que se deben tomar para monitorear el AZT son transaminasas y hemograma, en la cita a los 8-10 días de edad aprovechamos para tomar la muestra para tamizaje neonatal, citometría de flujo para cuantificar CD4 y CD8 e inmunoglobulinas. En esta misma cita tomamos una muestra de sangre de la madre para cuantificar CD4, CD8 e inmunoglobulinas. Los controles después de las 6 semanas de uso de AZT se realizan cada 2 meses para evaluar peso, talla, circunferencia cefálica, examen físico y desarrollo psicomotor, aplicar vacunas y discutir sobre la alimentación del niño (a). A los tres meses se deben tomar los siguientes estudios de laboratorio: conteo de CD4 y CD8, hemograma, inmunoglobulinas y PCR-ADN-VIH. Los exámenes de ELISA se realizan a los 3, 9, 12 y 18 meses de edad. Cuando se tenga definido el diagnóstico del caso, se debe dar la información al padre y la madre con la consejería que corresponda. A partir de las 8 semanas de edad y hasta definir si el niño (a) se infectó, se debe dar profilaxis con Trimetoprin/sulfametoxazol (13). No se debe aplicar BCG al nacer ni vacunas que contengan virus polio vivos. La lactancia materna se suspende y se continúa la alimentación con fórmula y la introducción de rutina de los otros alimentos.
| Período | Indicaciones |
| | |
| Preparto A partir de la semana 14 | AZT 200 mg por vía oral, tres veces al día |
| Labor Hasta ligar el cordón umbilical | AZT intravenoso, 2mg/kg pc a pasar en 1 hora, cotinuar con 1 m/kg pc/hora en infusión continua hasta el parto |
| Recién nacido | AZT jarabe a 2mg/kg pc/dosis cada 6 horas durante las primeras 6 semanas de vida. Iniciar a las 8-12 horas de edad. |
Los niños(as) nacidos de madres VIH+ han estado expuestos al VIH y son seropositivos porque tienen anticuerpos transferidos por sus madres. Evolucionan como serovertores (cuando no se infectan), o bien como infectados con diferente grado de inmunosupresión (11, 12). En Costa Rica el 19% de los hijos de madres VIH+ se infectan. Este porcentaje va a ser mucho menor en los próximos años, como resultado del tamizaje de la embarazada y de la aplicación del protocolo de profilaxis a las madres detectadas como VIH positivas (55).
Uso de antiretrovirales: Con el desarrollo de la terapia antiretroviral triple (dos inhibidores de transcriptasa inversa y un inhibidor de proteasa), se han abierto nuevas posibilidades en el tratamiento del paciente infectado por VIH. Efecto directo del uso de antiretrovirales son reducción en la mortalidad, mejor calidad de vida y reducción en la morbilidad y en el número de hospitalizaciones. El uso de antiretrovirales redujo la mortalidad en pacientes VIH positivos en los Estados Unidos de 29,4/100 años-persona en 1995 a 8,8/100 años-persona en 1997 y disminuyó la incidencia de infecciones oportunistas (42). En Europa la mortalidad pasó de 23,3/100 años-persona en 1995 a 4,1/100 años-persona en 1997. En esta población se asocia la reducción en la mortalidad al uso de antiretrovirales; en 1997 la tasa de mortalidad para no tratados fue de 65,4/100 años-persona, de 7,5 para los casos con doble terapia y 3,4 para los pacientes con triple terapia (33).
En Costa Rica se aprobó el uso de terapia triple a partir de noviembre de 1997. Los niños reciben dos inhibidores de TI asociados a un inhibidor de PA. La combianción más frecuente es Zidovudina + Lamivudina (3TC , Glaxo-Wellcome asociados a Melfinavir (Viracept
, Roche) o Indinavir (Crixivan
, Merck Sharp & Dohme). Otros ITI utilizados son Didanosina (ddi, Videx
, Bristol-Myers Squibb) y Estavudina (d4t, Zerit
, Bristol-Myers Squibb) (3, 15, 16) (Cuadro 3).
Quimioprofilaxis de la exposición ocupacional al VIH. El riesgo promedio de adquirir el VIH a través de la exposición percutánea de sangre infectada es de 0,3% y de 0,09% si éste es en membranas mucosas (17, 21). El riesgo aumenta cuando la herida es profunda, hay evidencia de restos de sangre en el instrumento que produjo el accidente o éste ha estado en contacto con la vena o arteria del paciente y si el contacto fue con un paciente que fallece por el VIH dentro de los siguientes 60 días después del accidente laboral. La mayor posibilidad de transmisión está ligada al inóculo y a la exposición a grandes volúmenes de sangre o a un paciente con una alta carga viral. Una exposición de alto riesgo se define como aquella con todos los factores de riesgo descritos y debe recibir profilaxis con triple terapia antiretroviral (17, 21). En Costa Rica el caso se considera como un accidente laboral; está considerado como tal dentro de la cobertura de las pólizas del lnstituto Nacional de Seguros. El trabajador que tiene un accidente de alto riesgo con un paciente VIH+ debe tratarse con 2ITI (AZT+ 3·TC) y 1 IPA (Indinavir) por 6 semanas (Cuadro 4).
Pronóstico
Los dos estudios de laboratorio que permiten evaluar pronóstico en pacientes VIH positivos son el número absoluto o porcentaje de linfocitos CD4+ y la medición de la cantidad de ARN del VIH en plasma o carga viral. La carga viral y el conteo de linfocitos CD4+ predicen la evolución clínica del paciente en forma independiente. La reducción del riesgo de la progresión de la enfermedad entre 49% y 64% se observa por cada reducción de un log 10 en la carga viral. Valores < 10.000 copias/ml en carga viral y conteos mayores de 500 células CD4+X1061 en < 6,5 años de edad o mayores de 200 células CD4+ X1061 en > 6,5 años de edad, están asociados con una tasa de avance de la enfermedad menor del 5% (49). El hallazgo de conteos de linfocitos CD4+ y de lifocitos CD8+ por debajo del percentilo 5 en los primeros meses de vida, se conoce como disfunción tímica (DT). La DT se ha asociado con mayor mortalidad y es independiente de la carga viral. De este grupo los infectados in uterus mostraron mayor mortalidad que los infectados intraparto (36).
En un estudio de niños hemofílicos VIH positivos se identificaron varios factores asociados a mortalidad: el conteo absoluto de lifocitos CD4+, anergia en piel, atrofia muscular no asociada a hemofilia, talla para edad y alteraciones neurosicológicas. Sin embargo el mejor predictor de muerte asociada a infección por VIH fue la presencia de atrofia muscular no asociada a hemofilia (1, 26, 58).
| | | | | | | |
| | ||||||
| Zidovudina | AZT, Retrovir | Inhibidor TI/AN | Cápsulas 100 mg Jarabe 10 mg/m | 160 mg/m2 cada 8 horas Rango 90-180 mg/m2 Adolescentes 200 mg tid o 300 mg bid | Se puede administrar con alimentos | Granulocitopenia Anemia Cefalea |
| Lamivudina | 3TC, Epivir | Inhibidor TI/AN | Tabletas 150 mg | 4 mg/kg cada 12 horas Adolescentes 150 mg bid | Se puede administrar con alimentos. TMP/SMX aumenta los niveles | Cefalea, fatiga, exantema, náusea, diarrea, dolor abdominal, pancreatitis |
| Didanosina | ddl, Videx | Inhibidor TI/AN | Tabletas 100 mg | 90mg/m2 cada 12 horas rango 90-150 mg/m2 Adolescentes>60 kg 200 mg bid Adolescentes<60 kg 125 mg bid | Administrar con ayuno de 1 hora | Diarrea, dolor abdominal, náusea, vómito, |
| Estavudina | d4t, Zerit | Inhibidor TI/AN | Cápsulas 40 mg | 1 mg/kg cada 12 horas Adolescentes>60 kg 40 mg bid Adolescentes 30-60 kg 30 mg bid | Se puede administrar con alimentos | Cafalea, exantemas, trastornos gastrointestinales |
| Nelfinavir | Viracept | Inhibidor PA | Tabletas 250 mg Polvo 200 mg/cdta | 25-30 mg/kg cada 8 horas Adolescentes 750 mg bid | Se puede administrar con alimentos | Diarrea náusea, vómito, cefalea |
| Indinavir | Crixivan | Inhibidor PA | Cápsula 200 mg Cápsula 400 mg | Adolecentes 200 mg cada 8 horas | Requiere ayuno Hidratación | Náusea, vómito, dolor abdominal, nefrolitiasis, ictericia |
TI:Transcriptasa inversa
AN: análogo de nicleósido
PA: proteasa
| Tipo de exposición | Fuente de exposición | Recomendación |
| | ||
| Percutánea | Sangre Otros fluidos o tejidos | Utilizar AZT+3TC+IND/NEL Ofrecer uso de antiretrovirales |
| Membrana mucosa | Sangre u otros fluidos o tejidos | Ofrecer uso de antiretrovirales |
| Piel | Sangre u otros fluidos o tejidos | Valorar extensión y gravedad de la exposición y ofrecer uso de antiretrovirales |
Indinavir (IND) 800 mg tid v.o. por día o Nelfinavir (NEL) 750 mg tid v.o. por día
Tiempo de tratamiento: 4 semanas
Bibliografía
1. Abrams E., Matheson P., Thomas P. et al: Neonatal predictors of infection status and early death among 332 infants at risk of HIV-1 infections monitored prospectively from birth. New York City perinatal HIV transmission collaborative study group. Pediatrics 96:451, 1995. [ Links ]
2. American Academy of Pediatrics: HIV infection. En: Peter G (ed) 1997. Red Book: Report of the Committee on Infectious Diseases (24ed). p. 279, 1997. [ Links ]
3. American Academy of Pediatrics. Antiretroviral therapy and medical management of pediatric HIV infection and 1997 USPHS/SIDA report on the prevention of opportunistic infections in persons infected with human immunodeficiency virus. Pediatrics 102(4Part2): 1005, 1998. [ Links ]
4. Barré-Sinoussi F.: HIV as the cause of AIDS. Lancet. 348:31, 1996. [ Links ]
5. Belman A., Muenz L., Marcus J. et al.: Neurologic status of human immunodeficiency virus-1 infected infants and their controls: a prospective study from birth to 2 years. Pediatrics 98: 1109, 1996. [ Links ]
6. Bryson Y., Luzuriaga K., Sullivan J., et al.: Proposed definitions for in utero versus intrapartum transmission of HIV-1. N. Engl. J. Med. 327:1246, 1992. [ Links ]
7 Bryson Y., Pang S., Wei L., et al.: Clearance of HIV infections in aperinatally infected infant. N. Engl. J. Med. 332:833, 1995. [ Links ]
8. Bulterys M & Lepage P.: Mother-to-child transmission of HIV. Curr. Opin. Pediat. 10:143, 1998. [ Links ]
9. Burger H. & Weiser B.: Biology of HIV-1 in women and men. Obstet. Gynecol. Clin. N.A. 24: 731, 1997. [ Links ]
10. CBER-FDA. Revised recommendations for the prevention of human immunodeficiency virus (HIV) transmission by blood and blood products. Bethesda, Md: Center for biologics evaluation and research, Food and Drug Administration; April 23, 1992. [ Links ]
11. Center for Disease Control and Prevention. 1993 revised classification system for HIV and expanded case surveillance definition for AIDS amon adolescents and adults, MMWR 43(RR-17): 1, 1992. [ Links ]
12. Center for Disease Control and Prevention. 1994 revised classification system for human immunodeficiency virus infection in children less than 13 years of age. Official authorized addenda: human immunodeficiency virus infection codes and official guidelines for coding and reporting ICD-9-CM. MMWR 43(RR-12): 1, 1994. [ Links ]
13. Centers for Disease Control and Prevention. 1995 revised guidelines for prophylaxis against Pneumocystis carinii pneumonia for children infected with or perinatally exposed to Human Immunodeficiency Virus. MMWR 44(RR-4): 1, 1995. [ Links ]
14. Centers for Disease Control and Prevention. Public Health Service task force recommendations for the use of antiretroviral drugs in pregnant women infected with HIV-1 for maternal health and for reducing perinatal HIV-1 transmission in the United States. MMWR 47(RR-2): 1, 1998. [ Links ]
15. Centers for Disease Control and Prevention. Guidelines for the use of antiretroviral in pediatric HIV infection. MMWR 47(RR-4): 1, 1998. [ Links ]
16. Centers for Disease Control and Prevention. Report of the NIH panel to define principles of therapy of HIV infection and guidelines for the use of antiretroviral agents in HIV infected adults and adolescents.. MMWR 47(RR-5): 1, 1998. [ Links ]
17. Centers for Disease Control. Public health service guidelilnes for the management of health-care woker exposures to HIV and recommendations for postexposure prophylasis. MMWR 47(RR-7): 1, 1998. [ Links ]
18. Connor E., Sperling R., Gelber R. et al.: Redution of maternal-infant transmission of human immunodeficiency virus type 1 with zidovudine treatment. Pediatric AIDS clinical trials group protocol 076 study group. N. Engl. J. Med. 331: 1173, 1994. [ Links ]
19. Coplan J., Contello K., Cunningham C. et al.: Early language development in children exposed to or infected with human immunodeficiency virus. Pediatrics 102(1):e8, 1998. Disponible en: URL:http://www.pediatrics.org/cgi/content/full/102/1/e8. [ Links ]
20. Critchlow C.& Kiviat N.: Detection of human immunodeficiency virus type 1 and type 2 in the female genital tract: implications for the understanding of virus transmission. Obstet. Gynecol. Surv. 52: 315, 1997. [ Links ]
21. Daily J.: Postexposure prophylaxis for HIV. AIDS Clin. Care 9:59,1997. [ Links ]
22. Dean M., Carrington M., Winkler C. et al.: Genetic restriction of HIV-1 infection and progression to AIDS by a deletion allele of the CKR5 structural gene. Science 273:1856, 1996. [ Links ]
23. Duliege A., Amos C., Felton S. et al.: Birth order, delivery route, and concordance in the transmission of human immunodeficiency virus type 1 from mothers to twins. J. Pediat.126:625, 1995. [ Links ]
24. Galli L., Matino M., Tobo P., et al. Onset of clinical signs in children with HIV-1 perinatal infection AIDS 9: 455, 1995. [ Links ]
25. Gürtler L.: Difficulties and strategies of HIV diagnosis. Lancet 348: 176, 1996. [ Links ]
26. Hoots W., Mahoney E., Donfield S. et al.: Are there clinical and laboratory predictors of 5-year mortality in HIV-infected children and adolescents with hemophilia? J. Acquir. Immune Defic. Syndr. Hum. Retroviral. 18:349, 1998. [ Links ]
27. Kleinman S., Busch M., Hall L., et al.: False-positive HIV-1 test results in a low-risk screening of voluntay blood donation. JAMA 280:1080, 1998. [ Links ]
28. Lichenstein R., Kind J., Farley J. et al.: Bacteremia in febrile human immunideficiency virus-infected children presenting to ambulatory care settings. Pediat. Infect. Dis. J. 17:381, 1998. [ Links ]
29. MacDonald K., Embree J., Njenga S. et al.: Mother-child class I HLA concordance increases perinatal human immunodeficiency virus type1. J. Infect. Dis. 177: 551, 1998. [ Links ]
30. Mayaux M., Teglas J., Mandelbrot L. et al.: Acceptability and impact of zidovudine for prevention of mother-to-child human immunodeficiency virus-1 transmission in France. J. Pediat. 131:857, 1997. [ Links ]
31. Melvin A. & Frenkel L.: Pediatric HIV-1 infection. Obstet. Gynecol. Clin. North. Amer. 24: 911, 1997. [ Links ]
32. Mirochnick M., Fenton T., Gagnier P. et al.: Pharmacokinetics of Nevirapine in human immunodeficiency virus type 1 infected pregnant women and their neonates. J. Infect. Dis. 178: 368, 1998. [ Links ]
33. Mocroft A., Vella S., Benfield T. et al.: Changing patterns of mortality across Europe in patients infected with HIV-1. Lancet 352: 1725, 1998. [ Links ]
34. Mofenson L.: Epidemiology and determinants of vertical HIV transmission. Sem. Pediat. Infect. Dis. 5: 252: 265, 1994. [ Links ]
35. Mofenson L.: Mother-child HIV-1 transmission: timing and determinants. Obstet. Gynecol. Cli. North Am. 24: 759, 1997. [ Links ]
36. Nahmias A., Clark W., Kourtis A. et al.: Thumic dysfunction and time of infection predict mortality in human immunodeficiency virus-infected infants. J. Infect. Dis. 178: 680, 1998. [ Links ]
37. Nelson R., Price L., Halsey A. et al: Diagnosis of pediatric human immunodeficiency virus infections by means of a commercially available polymerase chain reaction gene amplification. Arch. Pediat. Adolesc. Med. 150: 40, 1996. [ Links ]
38. Nielsen K.: Pediatric HIV infection.
Disponible en URL: http://www.helathcg.com/hiv/cme/pediatrics/print.asp., 1998.
39. Ojukwu I.: Neurologic manifestations of infection with HIV. Pediat. Infect. Dis. J. 17: 343, 1998. [ Links ]
40. ONUSIDA: La epidemia de SIDA: situación en diciembre de 1998.
Disponible en: URL: http://www.who.it/emc-hiv/december1998/ward98s.pdf.
41.Owens D., Holodniy M., McDonald T. et al.: A meta-analytic evaluations of the polymerase chain reaction for the diagnosis of HIV infection in infants. JAMA 275:1342, 1996. [ Links ]
42. Palella F., Delaney K., Moorman A. et al.: Declining morbidity and mortality among patients with advanced human immunodeficiency virus infection. N. Engl. J. Med. 338: 853, 1998. [ Links ]
43. Palumbo P., Knok S., Waters S. et al.: Viral measurements by polymerase chain reaction-based assays in human immunodeficiency virus-infected infants. J. Pediat. 126:592, 1995. [ Links ]
44. Palumbo P., Raskino C., Fiscus S. et al.: Predictive value of quantitative plasma HIV RNA and CD4+ lymphocyte count in HIV-infected infants and children. JAMA 279: 756, 1998. [ Links ]
45. Peckman C. & Gibb D.: Mother-to-chil transmission of the human immunodeficiency virus. N. Engl. J. Med. 333: 298, 1995. [ Links ]
46. Pitt J. & Cotton D.: Treating the HIV-infected pregnant woman and her child. AIDS Clin. Care 9:91, 1997. [ Links ]
47. Pizo P. & Wilfert C.: Pediatric AIDS: the challenge of HIV infection in infants, children, and adolescents (2 ed). Williams and Wilkins. Baltimore, 1993. [ Links ]
48. Porras O.: Infección por el virus de la inmunodeficiencia humana en niños. Rev. Méd. Hosp. Nal. Niños 28: 163, 1993. [ Links ]
49. Rouzioux C., Costagliola D., Burgard M. et al.: Estimated timing of mother-to-child human immunodeficiency virus type 1 (HIV-1) trasmission by use of a Markov model: the HIV infection in newborn french collaborative study group. Amer. J. Epidemiol. 142: 1330, 1995. [ Links ]
50. Samson M., Libert F., Doranz B. et al.: Resistance to HIV-1 infection in Caucasian individuals, bearing mutant alleles of the CCR-5 chemokine receptor gene. Nature 382: 722, 1996. [ Links ]
51. Shilts R.: And the band played on. New York: St. Martin`s Press, 1987. [ Links ]
52. Sperling R., Shapiro D., Coombs R.: Maternal viral load, Zidovudine teatment, and the risk to trasmission of human immunodeficiency virus type 1 from mother to infant. N. Engl. J. Med. 335: 1621, 1996. [ Links ]
54. The International Perinatal HIV Group. The mode of delivery and the risk of vertical transmission of human immunodeficiency virus type1 – a meta-analysis of 15 prospective cohort studies. N. Engl. J. Med. 340, 1999.
Disponible en URL:http://www.nejm.org/content/HIV.asp.
53. The European Collaborative Study. Vertical transmission of HIV-1: maternal immune status and obstetric factors. AIDS 10:1675, 1996. [ Links ]
55. Van Vliet A. & van Roosmalen J.: Worldwide prevention of vertical human immunodeficiency virus (HIV) transmission. Obstet. Gynecol. Surv. 52:301, 1997. [ Links ]
56. Wade N., Birkhead G., Warren B. et al.: Abbreviated regimens of zidovudine prophylaxis and perinatal transmission of the human immunodeficiency virus. N. Engl. J. Med. 339: 1409, 1998. [ Links ]
57. Wiznia A. & Lambert G.: Pavlakis S. Pediatric HIV infection. Med. Clin. North Amer. 6: 1309, 1996. [ Links ]
58.Yogev R.: HIV viral load. Pediat. Infect. Dis. J. 17: 247, 1998. [ Links ]
* Servicio de Inmunología. Hospital Nacional de Niños Dr. Carlos Sáenz Herrera C.C.S.S., San José, Costa Rica.
E-mail:oporrasm@cariari.ucr.ac.cr













