Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Médica del Hospital Nacional de Niños Dr. Carlos Sáenz Herrera
Print version ISSN 1017-8546
Rev. méd. Hosp. Nac. Niños (Costa Rica) vol.30 n.1-2 San José Jan. 1995
Introducción
Cuando el organismo no es suplido por la dieta, de la glucosa necesaria para llevar a cabo la glicólisis, existe una vía metabólica responsable de la formación de glucosa a partir de precursores diferentes a los carbohidratos; este proceso es llamado gluconeogénesis ("formación de un nuevo azúcar"). En los animales los precursores importantes de la glucosa son lactato, piruvato, glicerol y la mayoría de los aminoácidos. La biosíntesis de la glucosa es de absoluta necesidad en todos los mamíferos, ya que el cerebro, el sistema nervisoso, la médula renal, testículos, eritrocitos y tejidos embriónicos utilizan la glucosa sanguínea como su única fuente de energía. La gluconeogénesis es capaz de mantener los niveles de glucosa sanguínea aún mucho tiempo después de que toda la glucosa de la dieta ha sido absorbida y completamente oxidada (10, 16, 17).
En el estado de ayuno, la producción de glucosa se realiza en el hígado mediante la glucogenolisis y la gluconeogénesis; problemas en cualquiera de estas dos vías llevan a la hipoglicemia (8, 16). En los niños esta fase es similar a la de los adultos, sólo que ocurre más rápidamente. La producción de cuerpos cetónicos, lactato y piruvato aumentan en mayor grado en los niños y su producción de glucosa endógena por gluconeogénesis es de 6-8 mg/kg/min y está por lo tanto, en relación al peso corporal, mucho más alta comparada con los adultos (1-3 mg/kg/min). Así la tolerancia al ayuno en los niños es menor y es más marcada en menores de 8 años los cuales, en ayuno, fácilmente presentan cetosis e hipoglicemia (2).
Del mismo modo que la conversión glicolítica de la glucosa en piruvato es la vía central en el catabolismo de carbohidratos, la conversión de piruvato en glucosa es la vía central en la gluconeogénesis. Estas dos vías no son idénticas; existen tres pasos en la glicólisis que son esencialmente irreversibles y no pueden ser utilizados en la gluconeogénesis, por lo tanto para estas reacciones específicas existen enzimas propias para la glicólisis y para la gluconeogénesis. Una de estas reacciones irreversibles en la gluconeogénesis es la transformación de la fructosa 1,6-difosfato en fructosa 6-fosfato la cual es catalizada por la enzima fructosa 1,6 difosfatasa (F1, 6 diPasa, EC 3.1.3.11) (8, 16, 18).
La deficiencia de la actividad enzimática de la F1,6 diPasa es un desorden metabólico de origen primario, autosómico, recesivo (25). El primer caso fue descrito en 1970 en una niña de 5 años y medio, la cual presentó problemas de hipoglicemia y acidosis metabólica desde los 6 meses de edad (3). Los pacientes con esta deficiencia enzimática, presentan un bloqueo de la gluconeogénesis a partir de aminoácidos, lactato glicerol y fructosa; la salida de glucosa del hígado puede continuar, mientras las reservas del glucógeno estén presentes; en el momento en que esta reserva se agota, se produce hipoglicemia en un corto periodo de tiempo, la cual no responde a la administración de glucagón. Como resultado de la hipoglicemia se produce un aumento en la lipólisis, lo que conlleva a cetosis, además existe un acúmulo de alanina y parte de las triosas fosfato que se convierten a lactato, de esta forma se explica la acidosis metabólica severa, la cetosis y la hipoglicemia presentes en el ayuno prolongado de estos pacientes (9, 12, 19); sin embargo, ellos presentan a veces una hipoglicemia en la fase postprandial, por lo que se postula que algunos de los metabolitos acumulados como consecuencia del bloqueo inhiben la gluconeogénesis (15).
Otras complicaciones asociadas con este desorden metabólico son: hepatomegalia, hiperventilación, irritabilidad, hipotonía muscular, letargo, vómito y si no se maneja a tiempo puede causar la muerte (1, 3, 22).
Entre los valores de laboratorio más comunes reportados en un cuadro severo con hepatomegalia y acidosis en niños con deficiencia en la actividad de la F1,6 diPasa, se encuentran: pH sanguíneo 6,92; glicemia < 50 mg/dl; urea > 25 mg/dl; ácido láctico > 40 mg/dl; ácido úrico aumentado y fosfato inorgánico disminuido; el análisis de orina revela en muchos de los casos cetonas, proteínas y cristales de urato (3, 15, 19).
Cerca del 50% de los casos se presentan en la primera semana de vida, probablemente como resultado de una alta dependencia de la gluconeogénesis por la homeostasis durante el periodo neonatal (11).
Posteriormente algunos pacientes presentan infecciones febriles, vómitos y episodios de hipoglicemia, a este nivel es indispensable tener un tratamiento en el cual se debe evitar el ayuno, sobre todo en período de infecciones, en el que existe un catabolismo proteico con exceso de alanina, consumo aumentado de energía, e ingesta disminuida de alimento. Debe de restringirse la fructosa y tener una dieta balanceada, con una distribución de calorías de 56%, 32% y 12% para carbohidratos, lípidos y proteínas respectivamente (2, 6, 10, 25).
El pronóstico es muy satisfactorio ya que con un tratamiento adecuado conforme avanzan en edad los pacientes, van decreciendo los problemas hasta llevar una vida normal.
Se han realizado varios estudios sobre la deficiencia de la actividad de la F1, 6 diPasa en animales y humanos donde se prueba la actividad enzimática en diferentes tejidos como: hígado, rinón, intestino, músculo esquelético, cerebro y placenta (20, 23). Además se ha detectado la actividad enzimática en ciertas líneas celulares tumorales como HL-60, así como también en leucocitos de sangre periférica y en cultivo de monocitos y mononucleares (6, 13, 14, 20). El método de análisis más utilizado es el espectrofotométrico, que se basa en la medición de la reducción del NADP a NADPH.
El papel de la F1,6 diPasa en hígado y riñón es ciertamente esencial en el proceso de la gluconeogénesis, por lo que el diagnóstico absoluto de la deficiencia en esta enzima se realiza a partir de biopsias de hígado en niños con cuadros compatibles con esta enfermedad.
Dado que estudios demuestran la presencia de la enzima en leucocitos de sangre periférica, la determinación de la actividad de esta enzima en dichas células facilitaría el diagnóstico de la deficiencia enzimática de este desorden metabólico (6, 13, 14, 17, 19, 25).
Basados en este principio, la finalidad de este trabajo es estandarizar el método de detección de la enzima a partir de muestras obtenidas de una forma menos invasiva que la biopsia hepática, como sería la toma de una muestra de sangre venosa, y proveer de esta manera, las bases para el estudio de la deficiencia de F1,6 diPasa.
Materiales y Métodos
Aislamiento de leucocitos a partir de sangre periférica. Para el aislamiento de las células se utiliza el método de Sáenz et al. (24), con las siguientes modificaciones: 10 ml de sangre fresca heparinizada (20 UI/ml) se centrifuga a 3000 g, 10 min. Se aspira la capa blanquecina de leucocitos, se le agregan 6,5 ml de saponina al 0,1% en solución salina y 7,5 ml de solución salina bufferizada, pH 7,2 (PBS), se mezcla por inversión durante 4 minutos hasta obtener una suspensión libre de coágulos, luego se centrifuga a 500 g, 10 min a 4ºC. Se resuspenden las células con 2,0 ml de PBS, se homogenizan en un Vortex durante 30 s y se procede a centrifugar a 500 g, 10 min a 4ºC. El botón se resuspende en 0,8 ml de PBS, se determina la viabilidad de las células con azul tripán al 0,2% y se almacenan a -20ºC hasta su utilización.
Detección de la actividad de la F1,6 diPasa (F1,6 diPasa). Todos los pasos a continuación se realizan en baño de hielo. Las células de descongelan, se resuspenden y se sonican tres veces por 2 s. Se centrifuga la suspensión a 5000 g, 10 min a 4ºC. El sobrenadante se concentra por ultrafiltración en tubos Centricon 10 (Amicon, USA) a 2000 g, 1 h a 4ºC. Para la recuperación total del concentrado se invierte el Centricon 10 y se centrifuga a 500 g, 2 min a 4ºC, al concentrado se le determina la concentración de proteínas por el método de Bradford (5), con albúmina bovina como solución estándar de referencia.
La detección de la actividad enzimática se basa en el método de Melancon et al.(19) con algunas modificaciones: en un volumen final de 1,0 ml la mezcla de reacción contiene buffer 50 mM glicina- 5 mM MgCl pH 9,4; 3,5 UI fosfoglucoisomerasa (PGI), 1 UI de glucosa 6-fosfato deshidrogenasa (G6P-Dhasa); 2 mM fructosa 1,6 difosfato, 200 ul del concentrado de leucocitos (100-200 ug de proteína) se incuba en un baño de agua durante 6 minutos a 35ºC. Rápidamente se le agregan 0,4 mM de NADP pH 6,6; se mezcla bien, y realiza una lectura inmediata a 340 nm y luego cada 30 s hasta completar 2 min. La actividad catalítica específica (b) se obtiene mediante la siguiente fórmula:

Para la estandarización del método de detección de la actividad de la fructosa 1,6 diPasa en leucocitos, se realizaron varias modificaciones del método espectrofotométrico citado con mayor frecuencia en la literatura; las modificaciones se llevaron a cabo en el buffer empleado, en la concentración de las enzimas utilizadas (PGI, Glu 6PDHasa) y en la utilización de la técnica de ultrafiltración; todo culminó con el desarrollo de un método por el cual se puede medir la actividad enzimática de una manera óptima. En la figura 1 se presenta la diferencia de actividades enzimáticas medidas con y sin las modificaciones.
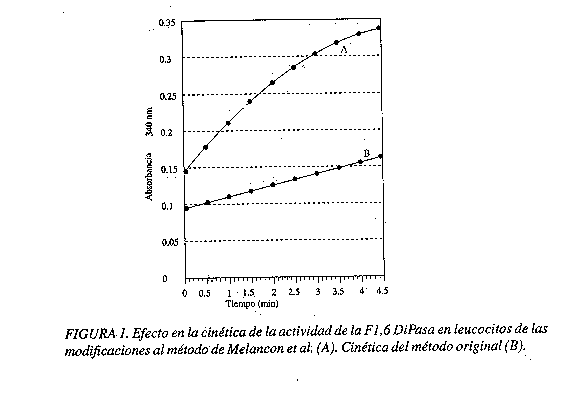
Por tratarse de un método cinético es necesario estandarizar el tiempo de lectura de las absorbancias en los puntos en que se obtenga una cinética lineal, para lo cual, a partir de la Figura 1A se observa que hasta los 2 minutos hay una relación directamente proporcional entre la absorbancia y el tiempo, a partir de este punto la relación pierde un poco esa linealidad.
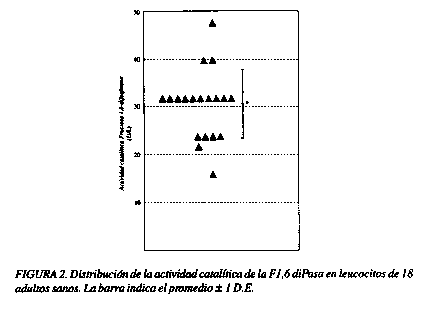
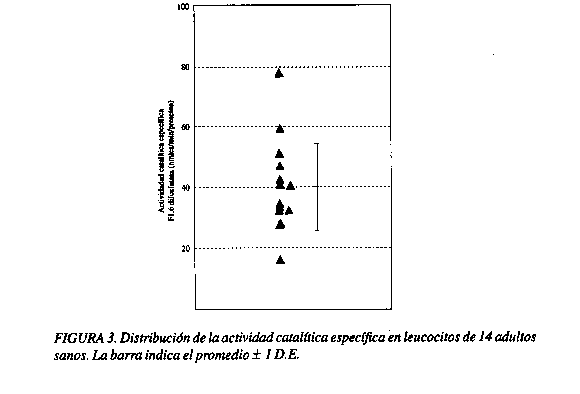
Una vez que se logró obtener una medida estable de la actividad enzimática y un adecuado cambio en la absorbancia con respecto al tiempo, se procedió a realizar la detección de la actividad de la F1, 6 diPasa en adultos sanos. En el Cuadro 1 se presenta el promedio, la desviación estándar y el ámbito de la actividad catalítica y la actividad catalítica específica de la F1, 6 diPasa obtenida de leucocitos de 18 y 14 adultos respectivamente.
| Actividad catalítica | | |
| | | |
En las figuras 2 y 3 se muestra la distribución obtenida para la actividad catalítica (Figura 2) y la actividad catalítica específica de la fructosa 1,6 diPasa en leucocitos (Figura 3). En dicha distribución se observa que un 70% de la población estudiada quedó comprendida entre los límites del promedio ± 1 DE.
En el presente trabajo se desarrolló un método reproducible para la detección de la actividad de la fructosa 1,6 diPasa en leucocitos.
En el primer lugar se estandarizó la obtención de los leucocitos a partir de sangre periférica utilizando una proporción de sangre: saponina: PBS que permita la lisis de los eritrocitos, pero sin afectar la viabilidad de los leucocitos. Al comparar esta técnica con la de Bøyum (4), en la cual, mediante Ficoll, se aislan únicamente las células mononucleares, se obtiene que el número de células aisladas es mayor, ya que se obtienen tanto mononucleares como polimorfonucleares y la viabilidad de las células es muy semejante.
Una vez aislados los leucocitos es necesaria la destrucción de las membranas para la liberación de enzimas y otros componentes del citoplasma. La sonicación, es un método más rápido que el proceso de congelar y descongelar las células realizado por ciertos autores (10, 15, 19, 21).
Para la detección de la actividad enzimática , se realizaron varias modificaciones al método espectrofotométrico citado en la literatura (13, 15, 19), cada una de las cuales mejoró la cinética de la actividad enzimática; sin embargo, el aumento en la actividad detectable se logró principalmente con el uso del Centricon 10; la ultrafiltración no sólo permite una concentración eficiente de las proteínas sino que elimina posibles sustancias interferentes de bajo peso molecular que afecten la actividad enzimática.
Las modificaciones posteriores se basaron en los siguientes puntos: se realizó un cambio de buffer, de 25 mM Tris pH 7,8 se pasó un buffer de glicina pH9,4 basados en el trabajo realizado por Melancon et al. (19), donde estudian el efecto de pH sobre la actividad de la enzima en diferentes células. Se detectó que la solución de NADP presentaba un pH de 3,5 por lo que al ser agregado directamente a la cubeta antes de medir la actividad enzimática, producía grandes variaciones en el pH de la reacción; se utilizó, por eso, una solución de NADP de pH 6,6. Las dos modificaciones posteriores se basaron en la concentración de dos reactivos: la fructosa 1,6 difosfato (sustrato) y la enzima fosfoglucoisomera (PGI). Al sustrato se le duplicó su concentración para asegurarse de que la enzima actuaría en condiciones saturables y se incrementó la concentración de PGI de 1 U/ml a 3,5 U/ml en la mezcla de reacción al comprobar, a través de la reacción con su sustrato (fructosa 6 fosfato), que su concentración era insuficiente.
La actividad enzimática se reportó como actividad catalítica y actividad catalítica específica siendo la diferencia entre ambas de que la segunda involucra en los cálculos la concentración de proteínas de la muestra. En la figura 2 se observa valores de actividad catalítica muy similares entre las personas utilizadas para la estandarización, mostrando el método una buena precisión con respecto al promedio, lo cual nos indica que la metodología utilizada es reproducible.
En la determinación de la actividad catalítica específica se observa una mayor dispersión en los valores, esto puede tener explicación en la cantidad de proteína detectada, ya que no sólo la enzima F1,6 diPasa está presente en la reacción, sino también de otras proteínas de los leucocitos. Lo anterior por cuanto en muestras que mantienen igual actividad catalítica (31,7 U/L), se observa una actividad catalítica específica que oscila entre 32,1 y 77,7 nmol/min/mg de proteína, con lo que se concluye que la actividad catalítica específica es un valor propio de cada muestra determinada por la concentración de proteínas y la actividad de la enzima. Por esta razón, lo más adecuado para la determinación de la actividad enzimática, es medir la actividad catalítica.
En el Cuadro 2 se muestra la actividad catalítica específica de la F1,6 diPasa en leucocitos de sangre periférica, descrita en la literatura por varios investigadores, utilizando la técnica espectrofotométrica. En ella se observa el notable aumento de los niveles de actividad enzimática obtenidos por la técnica estandarizada en el presente trabajo, comparable únicamente con la técnica del cultivo celular de monocitos, la cual se cataloga como un método novedoso en el que se obtiene una mejor actividad (13).
| | | | |
| Melancon et al. (19) Lohrer et al. (17) Kodoma et al. (15) Burlina et al (7) Bührdel et al (6) Shin Y.S. (25) Kikawa et al. (13) Presente estudio | | | |
(a)Valores mínimo y máximo (ámbito)
(b)Actividad F1,6 diPasa de cultivo de monocitos
- No indicado
Este trabajo representa un importante avance en cuanto a aumentar los niveles de la actividad catalítica específica detectable y permitirá realizar investigaciones futuras en la determinación de la enzima fructosa 1,6-difosfata en leucocitos. Estas investigaciones serán de suma importancia en el desarrollo de las bases para los estudios en nuestro país con niños y adultos jóvenes que presentan esta deficiencia enzimática.
El número de determinaciones realizadas es aún bajo para poder definir los valores de referencia en Costa Rica para la actividad de la F1,6 diPasa en leucocitos; sin embargo, es suficiente para poder definir la metodología a seguir para el estudio de la eficiencia de la F1, 6 diPasa en nuestro país.
Resumen
En el presente estudio se estandariza la técnica para la determinación de la actividad de la enzima fructosa 1,6 difosfatasa en leucocitos aislados de sangre periférica, dicha enzima es de gran importancia en el proceso de la gluconeogénesis, su deficiencia es causada por un desorden metabólico de origen primario, autosómico, recesivo, que se manifiesta principalmente con hipoglicemia y acidosis metabólica. Proponemos un método diferente al tradicional de detección que se basa en el análisis enzimático realizado en biopsias de hígado. Los valores de la actividad catalítica específica en adultos sanos obtenidos por la técnica utilizada en este estudio, comparados con los de otros autores, demuestran que mediante la metodología estandarizada en este trabajo se detecta una mayor actividad enzimática.
Bibliografía
1. Adams A., Redden C. & Mehahen S.: Characterization of human Fructose -1,6-hiphophatase in control and deficient tissues. J. Inher. Metab. Dis. 13:829, 1990. [ Links ]
2. Baerlocher K.: Hypoglykämien im Kindersalter. Monatsschr. Kinderheilkd. 136:597, 1988. [ Links ]
3.Baker L. & Winegrad A.: Fasting hypoglycaemia and metabolic acidosis associated with deficiency of hepatic fructose 1,6 Diphosphatase activity. Lancet 2:13, 1970. [ Links ]
4. Bøyum A.: Isolation of lymphocytles, granulocytes and macrophages, Scand. J. Immunol. 5:9, 1976. [ Links ]
5. Bradford M.: A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal. Biochem. 72:248, 1976. [ Links ]
6. Bührdel P., Böhme H. & Didt L.: Biochemical and clinical observation in four patients with fructose - 1,6- diphosphatase deficiency. Eur. J. Pediat. 149:574, 1990. [ Links ]
7. Burlina A., Poletto M., Shin Y. et al: Clinical and observation on three cases of fructose - 1,6- diphosphatase deficiency. J. Inher. Metab. Dis. 13:263, 1990. [ Links ]
8. Devlin T.: Textbook of biochemistry. Wiley-Liss, New York 1158 p., 1992. [ Links ]
9. Dremsek P., Sacher M., Stögman W. et al.: Fructose - 1,6-diphosphatase deficiency: glycerol excretion during fasting test. Eur. J. Pediat. 144:203, 1985. [ Links ]
10. Elpeleg O., Hurvitz H., Branski D. et al.: Fructose -1,6- diphosphatase deficiency: a 20-year floow-up. Amer. J. Dis. Child. 143:140, 1989. [ Links ]
11. Fisher P. & Hecker W.: Rezidivierende Azidose nit Hipoglykämie bei einem Säugling: Fruktose - 1,6-Diphosphatase-Mangel. Klin. Pädiat. 202:73, 1990. [ Links ]
12. Hommes F., Campell R., Steinharf C. et al.: Biochemical observation on case of hepatic fructose - 1,6-diphosphatase deficiency. J. Inher. Metab. Dis. 8:169, 1985. [ Links ]
13. Kikawa Y., Takano T., Nakai A. et al.: Detection of heterozygotes for fructose - 1,6-diphosphatase deficiency by measuring fructose -1,6-disphosphatase activity in monocytes cultures with calcitriol. Clin. Chim. Acta 215:81, 1993. [ Links ]
14. Kikawa Y., Takamo T., Nakai A. et al.: Monocytes not lymphocytes, show increaced fructose - 1,6-diphosphatase activity during cultured. J. Inher. Metab. Dis. 16:913, 1993. [ Links ]
15. Kodoma H., Okabe I., Gunji Y. et al.: Neonatal hyperlactasemia and hypoglycaemia caused by delayed maturation of fructose - 1,6- diphosphatase activity. J. Pediat. 113:898, 1988. [ Links ]
16. Lehninger A., Nelson D. & Cox M.: Principles of biochemistry. Worth Publishers, New York. 1013 p, 1993. [ Links ]
17. Lohrer R., Ibel H., Holzapel H. et al.: Fructose - 1,6-diphosphatasese-mangel. Monatsschr. Kinderheilkd. 135:112, 1987. [ Links ]
18. Mayes A.: Gluconeogénesis y control de la glucosa sanguínea. Cit. En Murray R., Mayes P., Granner D. et al. eds: Bioquímica de Harper. Editorial Manual Moderno. México, 1994. [ Links ]
19. Melancon S., Khachadurian A., Nadler H. et al.: Metabolic and Biochemical studies in fructose - 1,6-diphosphatase deficiency. J. Pediat. 82:650, 1973. [ Links ]
20. Mizunuma H. & Tashina Y.: Mouse thymona cell line expresses a gluconeogenic enzyme; fructose -1,6-diphosphatase. Biochem. Biophys. Res. Commun. 158:929, 1989. [ Links ]
21. Mizunuma H. & Tashina Y.: Survey of fructose -1,6-diphosphatase isoenzyme in rat organs and ontogenic expression of the enzyme in rat fetus. Int. J. Biochem. 22: 883, 1990. [ Links ]
22. Moses S., Bashan N., Flasterstein B. et al.: Fructose -1,6-diphosphatase deficiency in Israel. Israel J. Med. Sci. 27:1, 1991. [ Links ]
23. Paparmarcaki T. & Tsolas O.: Demostration of fructose -1,6-diphosphatase in human term placenta. Experientia 47:67, 1991. [ Links ]
24. Sáenz G., Barrantes A. & Chaves M.: Hematología analítica. Editorial Universidad de Costa Rica, San José, 778 p. 1987. [ Links ]
25. Shin Y.: Diagnosis of fructose -1,6-diphosphatase deficiency using leukocytes; enzyme activity in three female patients. Clin. Invest. 71:115, 1993. [ Links ]
* Departamento de Bioquímica, Escuela de Medicina. Universidad de Costa Rica, San José, Costa Rica. E-mail:silvia@cariari.ucr.ac.cr













