Introducción
La mosca blanca (Bemisia tabaci, Gennadius; hemíptera: Aleyrodidae)) es una de las especies plaga más ampliamente distribuidas en regiones tropicales y subtropicales del mundo. Se adapta mejor a regiones costeras y con altitudes inferiores a los 1000 m.s.n.m, aunque también se ha observado en ambientes por encima de esa altura, principalmente la del biotipo B. De esta manera, B. tabaci se ha convertido en una de las plagas agrícolas más dañinas en todo el mundo en los últimos 20 años (1), (2) pues ha ocasionado pérdidas económicas que se estiman en cientos o incluso miles de millones de dólares al año (3). En los lugares en que está presente, afecta a numerosas especies, comúnmente a plantas pertenecientes a las familias Cruciferae, Cucurbitaceae, Solanaceae y Leguminosae, entre otras.
Este hemíptero es dañino por su directa alimentación del floema, lo cual debilita a la planta, también por sus excreciones, que sirven de fuente nutricional para el desarrollo de hongos que interfieren con la cantidad de radiación solar que llega a las hojas (4). Aún así, el daño más severo lo causa como vector de un gran número de virus del género begomovirus (Geminiviridae), los cuales son responsables de enfermedades arrasadoras, que pueden acabar hasta con el 100% de las cosechas (5), (6).
La aplicación de insecticidas sintéticos como los cloronicotinilos, los piretroides y los organofosforados es la práctica más utilizada en Costa Rica y el mundo para el combate de la mosca blanca y en ocasiones se hace de manera irracional, lo que incrementa los costos de producción y en la mayoría de los casos, no logra un combate eficiente de la especie en condición de plaga (7), (8). Se ha comprobado que el uso convencional de insecticidas es poco o nada funcional en el control de B. tabaci (9). pues su plasticidad genética y la brevedad de su ciclo de vida le confieren a esta especie gran capacidad de adaptación y a su vez, le permiten desarrollar rápidamente altos niveles de resistencia (10).
Frente a esta situación, se hace necesario reducir la cantidad de productos químicos aplicados a los cultivos e integrar métodos alternativos que permitan un buen control de la plaga y aminoren los impactos ambientales (11).
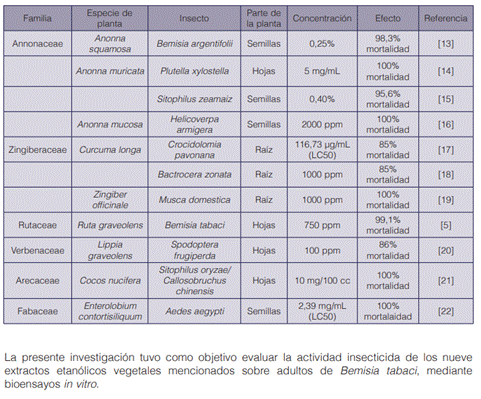
Los extractos botánicos representan una opción promisoria como fuente de productos naturales bioactivos, más seguros y de bajo costo. Las plantas producen metabolitos secundarios para protegerse del ataque de otros organismos; estos compuestos pueden ser utilizados por su potencial insecticida o repelente (12). Para la realización del presente proyecto se hizo una búsqueda bibliográfica previa de especies que han sido reportadas en la literatura con actividad insecticida (cuadro 1).
Las hojas y la corteza de E. cyclocarpum han presentado actividad biocida; en ellas se encuentran saponinas, glucósidos cianogénicos, taninos y triterpenos, entre otros (23). C. longa y Z. officinale se utilizan de manera empírica como insecticidas caseros, y algunos estudios han comprobado esta actividad, la cual se puede atribuir a flavonoides, cumarinas, taninos, sesquiterpenos y monoterpenos, entre otros compuestos presentes en sus rizomas (24), (25), (26), (27).
Balqis et al. (28) demostraron el potencial tóxico de frutos de V. merrillii, atribuido a alcaloides, taninos, flavonoides, triterpenos y saponinas. Asimismo, ocurre con L. graveolens, y R. graveolens, que han sido reportadas con efecto insecticida debida a terpenos, flavonoides, taninos, cumarinas y otras moléculas con actividad biológica (20), (29), (5), (30), (31). Finalmente, las semillas de A. muricata han demostrado su actividad insecticida contra dípteros, hemípteros, blatodeos y coleópteros; principalmente se asocia esta con las acetogeninas (32), (33), (34).
Metodología
Obtención del material vegetal y extractos etanólicos
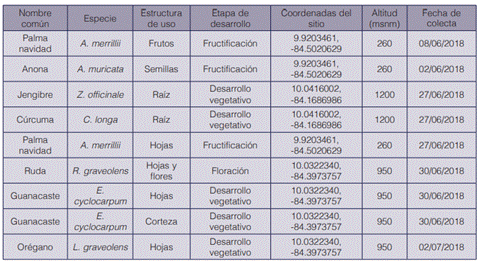
El material vegetal se recolectó de distintas partes del país (cuadro 2), siguiendo la normativa establecida por la Comisión Nacional para la Gestión de la Biodiversidad (CONAGEBIO) con respecto a la investigación y uso de los recursos de la biodiversidad.
El material se limpió y se secó en un horno a 50 °C durante 3 días. Una vez seco se molió para obtener partículas finas que se sometieron a extracción con etanol. Por cada 100 g de material seco se adicionaron 700 ml de etanol al 96 %. A este material se le hicieron dos extracciones seguidas, con etanol fresco. La primera extracción se realizó aplicando sonicación durante 30 min y la segunda, aplicando sonicación 30 min y dejándola en reposo por aproximadamente 18 h. El extracto obtenido de las dos extracciones se filtró al vacío en un embudo Büchner acoplado a un matraz de Kitasato; luego se concentró en un rotavapor a 40 °C y a presión reducida. Una vez concentrado el extracto, este se liofilizó y de cada muestra, se preparó una solución de 5000 mg/L en una mezcla de etanol al 96 % y agua (1:1), para la realización de los bioensayos. Esta concentración fue elegida de acuerdo a la revisión bibliográfica realizada de las especies vegetales.
Bioensayos con extractos etanólicos
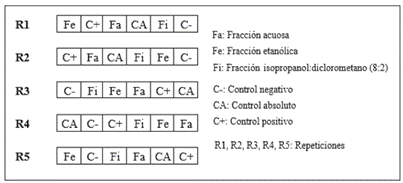
Los bioensayos fueron realizados con adultos de B. tabaci, para lo cual se utilizó un diseño de bloques completos al azar, con nueve tratamientos y tres controles (figura 1), cada uno de ellos con cinco repeticiones.
Para evaluar los efectos de los extractos en adultos de B. tabaci, se siguió la metodología establecida por Baldin et al. (11) con previas modificaciones. La unidad experimental consistió en un recipiente plástico de 1 L con un respiradero tapado con malla antiáfidos, al cual se introdujo una plántula de tomate (Solanum lycopersicum) de aproximadamente 20 días de germinada, previamente asperjada con 3 ml del tratamiento correspondiente. Cada recipiente se inoculó con 20 insectos introducidos a través de dos orificios, en los que se acopló un aspirador de insectos. Estos recipientes se mantuvieron en condiciones de invernadero con un fotoperiodo típico (figura 2).
Se utilizaron un control positivo con imidacloprid como compuesto activo (Premise 20 SC), un control negativo con el vehículo de aplicación (etanol 96 % + agua, 1:1) y un control absoluto en que no se rociaron las plantas. El conteo de insectos muertos se realizó a las 24, 48 y 72 h, y se aceptó una mortalidad no mayor al 10 % en el control negativo. Con el propósito de eliminar la mortalidad de los insectos por causas ajenas al tratamiento, se determinó la mortalidad corregida (MC) según la fórmula de Abbott (ecuación 1) (35). También se realizó un análisis de varianza y comparación múltiple de medias de Tukey (P = 0,05), utilizando el programa estadístico Design Expert®, para evaluar diferencias significativas entre tratamientos.
Fraccionamiento del mejor extracto y bioensayo
Con el fin de hacer una aproximación al tipo de compuesto responsable de la actividad biocida, el extracto con mejor desempeño (R. graveolens) se fraccionó con solventes de polaridad creciente (isopropanol: diclorometano (8:2), etanol 96% y agua), en una columna de cromatografía. Primero se elaboró una cabeza de fracción mezclando 304 mg de extracto crudo con 1,5 g de resina Diaion® HP-20SS;, que se diluyeron en una mezcla de etanol y agua (3:1); esta mezcla se llevó a sequedad en un concentrador SpeedVac. Se hicieron pasar 50 ml de cada solvente por la columna con ayuda de una bomba de succión. Cada fracción se colectó en balones; este procedimiento se realizó por duplicado de manera simultánea.
Cada fracción se llevó a sequedad en un rotavapor y se liofilizó. De cada una de ellas, se prepararon concentraciones de 5000 mg/L con las que se realizó un bioensayo de toxicidad con adultos de B. tabaci, empleando cinco repeticiones. El bioensayo se dispuso en bloques completos al azar (figura 3), manteniendo los mismos controles y monitoreando la temperatura y la humedad relativa.
Resultados y discusión
Obtención de extractos etanólicos vegetales
El rendimiento cuantitativo y cualitativo de la extracción, en gran medida se debe al solvente utilizado, pero no se cuenta con un método ni un solvente definidos, pues estos dependerán de la naturaleza de los compuestos por extraer, así como de factores tales como la naturaleza de la muestra, la concentración del solvente, la temperatura, el tiempo de contacto, el tamaño de partícula y la relación masa-solvente, entre otros (36).
En este trabajo se utilizó etanol debido a que es el solvente por excelencia en las extracciones vegetales por su bajo costo, baja toxicidad y eficiencia de extracción (37).
La extracción realizada fue asistida por sonicación, cuyos efectos mecánicos ocasionan la ruptura de las paredes celulares, facilitando la liberación de los componentes de la célula; también, inducen una mayor penetración del solvente en dichas células, aumentando los rendimientos de extracción, lo que a su vez reduce la necesidad de altas temperaturas operativas, permitiendo así la extracción de compuestos termolábiles (38).
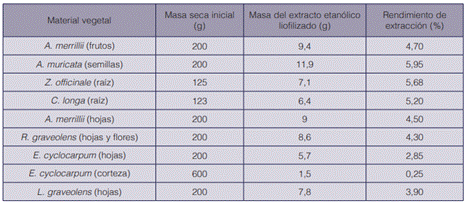
Una vez obtenidos todos los extractos etanólicos de las plantas en estudio, se determinó la masa de los extractos liofilizados así como su porcentaje de rendimiento, tomando como referencia la masa seca inicial del material utilizado de cada especie vegetal (cuadro 3).
El porcentaje de rendimiento más bajo lo presentó la corteza de E. cyclocarpum, con tan solo un 0,25%. Tomando en cuenta que el disolvente utilizado fue etanol, se puede considerar que en la corteza de esta especie se encuentran una menor cantidad de metabolitos secundarios con polaridades altas.
Por otra parte, el porcentaje de rendimiento de extracción más alto lo presentó A. muricata (semillas) con un 5,95%. Las semillas son órganos de reserva en donde se da acumulación de metabolitos secundarios (39). Algunos autores han reportado buenos rendimientos de extracción a partir de semillas con etanol (40), (41) que superan los obtenidos por medio de métodos tradicionales como el prensado o el que utiliza hexano.
Con respecto a las condiciones del invernadero de experimentación durante el tiempo en que transcurrió el bioensayo, la temperatura osciló entre 15,9 °C y 31,1 °C y la humedad relativa entre 26,1% y 60,7%. Estos dos factores abióticos influyeron en la dinámica poblacional y el desarrollo de B. tabaci. En el desarrollo de esta especie, se ha encontrado que 26 °C es la temperatura óptima para el crecimiento de la población, ya que muy baja (< 17 °C) o muy alta (> 32 °C), se retrasa el desarrollo (42). Con respecto a la humedad relativa, se conoce que las poblaciones se desarrollan mejor cuando es alta (>60%), a menos de ese valor, se reduce la ovoposición. No obstante, el rango en que osciló este parámetro permite la supervivencia del insecto (1).
En todos los tratamientos, incluidos los controles, se observó un aumento en la mortalidad conforme aumentaban las horas de exposición. Asimismo, en presencia tanto del control negativo como del absoluto la mortalidad fue menor del 10% al término de las 72 h, lo cual da validez a los datos que dio el bioensayo (cuadro 4).
El control positivo (imidacloprid) fue el que mostró más actividad tóxica, pues se alcanzó un 82,2% de mortalidad al término de las 72 h.
A pesar de su eficiencia y su uso intensivo actual, existen registros sobre resistencia al imidacloprid en B. tabaci, observados por primera vez en 1996, en invernaderos en la región de Almería, en el sur de España. Otros estudios demostraron que las poblaciones de B. tabaci, en las áreas de cultivo de algodón de Arizona, se volvieron ligeramente menos susceptibles al imidacloprid, de 1995 a 1997 (43), (44). Es por esto que el imidacloprid actualmente está en riesgo de inefectividad por resistencia, debido principalmente a la sobredosificación y a la alta frecuencia de aplicación (9), (45).
Cuadro 4 Mortalidad media (%) (±DS) de adultos de B. tabaci en plántulas de tomate rociadas con extractos etanólicos, en los diferentes periodos de evaluación (n=5)
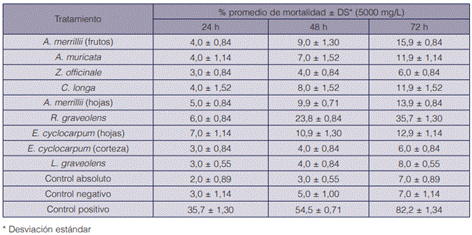
Ningún extracto etanólico ocasionó más de 16% de mortalidad media a las 72 h, a excepción del extracto de R. graveolens, el cual en promedio ocasionó la muerte de un 35,7 % de los insectos en ese periodo. La prueba del análisis de la varianza y comparación múltiple de medias de Tukey mostró diferencias significativas entre este extracto y todos los demás tratamientos. Esto sugiere que el extracto etanólico de ruda posee algún grado de actividad tóxica, aunque no tan efectiva como el insecticida imidacloprid.
Algunos autores han reportado altos niveles de toxicidad de extractos de ruda en mosca blanca. Romero et al. (5) evaluaron un extracto etanólico de R. graveolens en adultos de B. tabaci, utilizando hojas de calabacín y obtuvieron un 99,1 % de mortalidad a las 72 h. Por otro lado, un extracto hidroalcohólico de ruda recolectada en Colombia evidenció actividad insecticida (43,81 %) sobre Trialeurodes vaporariorum al ser aplicado por inmersión (30).
La baja mortalidad alcanzada con ruda y los demás extractos en comparación con los estudios citados (cuadro 1) puede obedecer a varias causas. El material de origen vegetal presentó variabilidad en el tipo y la concentración de sus compuestos debido a factores como la época del año, la ubicación geográfica, el tipo de suelo, la edad del material y el estado fenológico, entre otros.
La observación anterior se complementa con el hecho de que se ha encontrado que existen variaciones circadianas de los metabolitos secundarios presentes en las plantas. Duarte et al. (46) observaron que las hojas de Lippia alba contienen más carvona (terpenoide) en horas de la noche. Por ende, queda claro que una complicación difícil de paliar en el proceso de investigación de extractos vegetales para el desarrollo de insecticidas es la heterogeneidad propia de los materiales de origen natural. Debido a esto, se hace necesario generar información de la composición de metabolitos secundarios de las plantas y su relación con las condiciones del entorno en el cual se encuentran. Al generarse información de estas variaciones, se podría llegar a estandarizar el uso del material vegetal e incluso, a evaluar condiciones de estrés a las cuales este puede ser sometido para incrementar la producción de cierto tipo de metabolitos.
Obtención de fracciones y evaluación en bioensayos
Los resultados de los bioensayos sobre la actividad insecticida de los extractos etanólicos vegetales no fueron satisfactorios, tomando en cuenta que la concentración usada fue alta (5000 mg/L) y que la mortalidad máxima obtenida con el extracto crudo fue de tan solo 35,7%. A pesar de ello, se decidió fraccionar el extracto y evaluar la actividad tóxica de cada fracción. Luego de la obtención de las tres fracciones del extracto etanólico, se calculó el rendimiento de extracción de cada una, que dio como resultado un rendimiento total del 94 %.
Al evaluar los efectos de cada una de las particiones fitoquímicas en bioensayos, nuevamente el imidacloprid fue el que causó mayor mortalidad en adultos de B. tabaci, un 84,2 % a las 72 h. Además, tanto en el control negativo como en el absoluto la mortalidad no superó el 10 %, situación que valida los resultados obtenidos (cuadro 5).
De las particiones fitoquímicas evaluadas, la fracción isopropanol:diclorometano (Fi) causó la actividad tóxica más marcada, con un 38,7 % de mortalidad a las 72 h. Además, fue la que se acercó más a la tendencia mostrada por el extracto crudo, lo cual sugiere que los compuestos presentes en ella podrían ser los principales causantes de dicha actividad. Por su parte, la fracción acuosa (Fa) ocasionó tan solo un 17,9 % de mortalidad a las 72 h, debido a su concentración de componentes hidrofílicos de mayor polaridad, como los azúcares o los derivados azucarados como las saponinas (8).
En el caso de la fracción etanólica (Fe), al término de las 72 h hubo un 27,8 % de mortalidad, pero se comenzaron a ver síntomas de fitotoxicidad (enrollamiento, necrosis en las puntas de hojas y deshidratación del tejido foliar) en la plántula de tomate; a pesar de esto, la mortalidad en este tratamiento fue baja. Barboza et al. (47) también reportaron fitotoxicidad en hojas de cedro, por la partición del diclorometano de un extracto metanólico de R. graveolens al 0,0092 % m/v.
Los resultados obtenidos en este trabajo sugieren que los principales compuestos responsables de la actividad insecticida en adultos de B. tabaci son de baja polaridad, debido a que la fracción menos polar fue la más activa. Esto coincide con lo reportado por Cárdenas, Lugo y Rozo (48), quienes evaluaron las concentraciones letales al 50% (CL50) y 90% (CL90), las cuales indican la concentración a la cual se espera que una sustancia produzca la muerte del 50% o 90% de los individuos, respectivamente. Los autores compararon la CL50 y CL90 obtenidas con extractos de ruda sobre larvas de mosquitos y sugieren que los solventes no polares concentran mejor las sustancias larvicidas contenidas en R. graveolens.
En vista de que la mosca blanca B. tabaci tiene un historial de generación de resistencia a los insecticidas utilizados para su combate (45), se recomienda recurrir al uso de la mayor cantidad de medidas no químicas, por lo que enfocar los controles en el manejo integrado de plagas haciendo uso de la fracción de R. graveolens obtenida en esta investigación (Fi) podría resultar una herramienta eficaz para mantener bajos niveles poblacionales de la plaga.
Un factor importante que considerar en la búsqueda de métodos alternativos para este fin es que además de ser eficaces para combatir las plagas, deben ser ambientalmente benignos y rentables económicamente. Una concentración efectiva muy alta, implicaría una alta demanda de materia prima para obtener el producto, aspecto de gran importancia, pues una de las barreras en el desarrollo de los plaguicidas botánicos ha sido el uso sostenible de la materia prima (5).
Cuadro 5 Mortalidad media (%) (±DS) de adultos de B. tabaci en plántulas de tomate rociadas con las fracciones del extracto crudo, en los diferentes periodos de evaluación
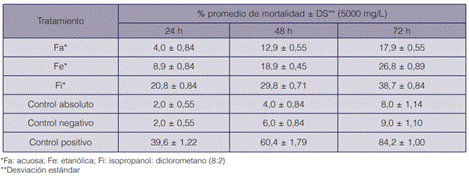
Luego de haber obtenido tan solo un 38,7 % de mortalidad con la Fi, se consideró que no era viable realizar el cálculo de la CL50. En lugar de ello, se sugieren estudios posteriores que involucren extracciones del follaje de ruda con diferentes solventes y fraccionamientos más finos, que permitan una mejor aproximación a los compuestos activos contra B. tabaci.
Conclusiones
Los rendimientos cuantitativos de la extracción etanólica llevada a cabo fueron del 0,25 % al 5,95 %. Los extractos etanólicos de las especies vegetales evaluadas mostraron baja actividad insecticida en los adultos de B. tabaci a la concentración de 5000 mg/L. El extracto etanólico de R. graveolens fue el más activo contra adultos de B. tabaci, ya que ocasionó un 35,7 % de mortalidad al término de las 72 h.
Aunque aún son necesarios estudios adicionales para el aislamiento de sustancias y la estandarización del uso del material vegetal, los hallazgos presentados demuestran la existencia de un potencial en R. graveolens para ser usado como insecticida natural contra la mosca blanca.
Las tres particiones fitoquímicas del extracto crudo de R. graveolens mostraron actividad insecticida en el orden del 17,9 al 38,7 % en los adultos de B. tabaci, a la concentración de 5000 mg/L. Al término de las 72 h, la fracción etanólica comenzó a generar fitotoxicidad en las plántulas de tomate. Los hallazgos sugieren que la fracción menos polar (isopropanol: diclorometano (8:2)) es la que concentra los principales compuestos activos contra adultos de B. tabaci, por lo que se sugieren estudios posteriores que se centren en la búsqueda de compuestos de baja polaridad, de esta especie.