Introducción
A lo largo de los años, el uso y consumo de las plantas medicinales se ha vuelto costumbre y parte del conocimiento tradicional de las diferentes poblaciones alrededor del mundo. Estas especies vegetales traen grandes beneficios tanto para la salud individual como colectiva y es por su gran utilidad y demanda, que se han convertido en un recurso de interés para diversas áreas de investigación, principalmente la farmacéutica, la médica y la biotecnológica (1).
Las plantas del género Phyllanthus, de la familia Phyllanthaceae han sido estudiadas por su acción antiviral (2). Diversas investigaciones han revelado que las plantas de este género poseen metabolitos que inducen la apoptosis celular, lo cual les proporciona un gran potencial en la prevención del cáncer (3)-(4). Estudios fitoquímicos realizados a extractos y cultivos in vitro de Phyllanthus sp. demuestran que compuestos como alcaloides, flavonoides, lignanos, fenoles, taninos y terpenoides poseen actividad antitumoral.
Específicamente la especie P. acumminatus se ha empleado en diversas actividades como control de plagas, conservación de alimentos y usos medicinales, como el tratamiento de trastornos del aparato urinario, enfermedades hepáticas, infecciones intestinales, ictericia y diabetes y dermatitis, entre otras (5). Esta especie posee la capacidad de producir compuestos fenólicos con alto poder antioxidante, lo cual se ha comprobado por medio de diferentes análisis químicos y espectrofotométricos (6).
Para la obtención de los metabolitos de interés a partir de plantas silvestres como P. acuminatus, el cultivo de tejidos o de células vegetales es una alternativa beneficiosa debido a que su producción es independiente de los factores externos y proporciona disponibilidad de nutrientes al material vegetal, además de que es posible controlar las condiciones para alcanzar mejor rendimiento, estabilidad genética y calidad del cultivo. El cultivo in vitro de Phyllanthus sp. suele ser sencillo, ya que no requiere de cuidados exigentes (2)-(7).
Para la obtención de metabolitos secundarios en plantas, se han empleado diversos sistemas; sin embargo, uno de los más recomendados es el cultivo de raíces y brotes, ya que estos se caracterizan por tener un patrón metabólico muy similar al de los órganos en la planta y pueden o no haber sido sometido a procesos de transformación genética (8). El uso de la técnica de hairy roots o raíces pilosas busca una mayor producción de raíces adventicias con el fin de aumentar la cantidad de metabolitos secundarios que obtener. Además, se ha demostrado que la transformación de raíces con la bacteria Agrobacterium rhizogenes genera altas respuestas de enraizamiento por parte de la planta, ya que tiene la capacidad de infectar las plantas por medio de heridas e inducir la producción de raíces adventicias. (9)-(10)-(11).
Este trabajo se realizó, precisamente con el objetivo de establecer un sistema de cultivo in vitro de raíces pilosas de Phyllanthus acuminatus mediante transformación genética con Agrobacterium rhizogenes, que permitiera un posterior cultivo a escala para la obtención de extractos a base de compuestos con potencial anticancerígeno.
Metodología
Establecimiento de vitro plantas de Phyllanthus acuminatus
Los frutos maduros utilizados para introducción en laboratorio fueron recolectados en Santa Teresita de Turrialba, Cartago, Costa Rica (latitud: 9.583934, longitud: -83.384280). La desinfección de semillas se basó en los protocolos descritos por Catapan y colaboradores (8) y Jiménez y colaboradores (2). Se logró optimizar el protocolo de introducción mediante el corte de la cubierta seminal, dejando el embrión al descubierto para su germinación.
El medio de cultivo utilizado en esta etapa compuso de sales y vitaminas M&S (12) al 100%, complementado con 3% m/v de sacarosa, gelificado con Phytagel® a un pH 5.7. La temperatura de germinación fue de 25±2 °C, con un fotoperíodo de 16 h de luz y 8 h de oscuridad. El porcentaje máximo de germinación obtenido a los 30 días de la introducción fue de 30.75%; no obstante, posteriormente a dicho período de evaluación, la germinación de semillas continuó. El medio de multiplicación utilizado correspondió a un M&S (12) al 100% más ácido naftalenacético (ANA) como regulador de crecimiento a una concentración de 0.5 mg/mL; el subcultivo del material se realizó mediante microestacas con dos nudos.
Transformación de microestacas de P. acuminatus con A. rhizogenes
Se verificó la densidad óptica de los cultivos bacterianos de la cepa silvestre Ar15834 a 600 nm de longitud de onda, es decir, OD600. Se prepararon diluciones hasta obtener un valor de OD600 entre 0.6 y 1 y para realizar la agro-infección, se procedió a eliminar las ramas adyacentes de las plántulas, de esa manera se extrajeron microestacas que fueron sometidas a dos tipos de tratamiento de agro-infección, respectivamente.
El tratamiento 1 consistió en realizar varias heridas con bisturí a la altura de la mitad del explante y colocarlo en un matraz estéril. Luego, se cubrieron las estacas con los cultivos bacterianos, y la mezcla se agitó por 20 min. Posteriormente, los explantes fueron separados del cultivo bacteriano con un colador; se secó el exceso de bacteria de las estacas con papel filtro WhatmanTM n.° 3 autoclavado, y finalmente, se lavaron con abundante agua destilada estéril y se secaron nuevamente en papel filtro WhatmanTM n.° 3 autoclavado.
El tratamiento 2 involucró los pasos anteriormente descritos, exceptuando que, en lugar de realizar cortes en las microestacas, estas fueron sometidas a un proceso de desecación en el flujo de la cámara por un período de 20 min, antes de ser colocadas en contacto con el cultivo bacteriano.
Las estacas se cultivaron de manera horizontal en medio M & S (12) 100%, 3% m/v de sacarosa y Phytagel como gelificante, a un pH de 5.7, a 25°C y un fotoperiodo de 16 h luz y 8 h oscuridad. Todo el material fue evaluado diariamente y se subcultivó según la presencia de la bacteria en el medio, por un período de al menos 6 semanas. El medio de subcultivo del material vegetal fue M&S 100% como el anterior, pero complementado esta vez con el antibiótico Ceftriaxona® a una concentración de 500 µg/ml (determinado mediante pruebas de resistencia a antibióticos, tanto de las bacterias como de las plantas). Las estacas subcultivadas se expusieron a una temperatura de 25±2 °C y un fotoperiodo de 16 h luz y 8 h oscuridad con luz difusa. Todo el material se evaluó diariamente y se subcultivó según se consideró necesario.
Al aparecer las primeras formas de raíces pilosas, aproximadamente 10 semanas después de la agro-infección, fueron separadas del explante y se subcultivaron en medio M & S (12) 100%. Las raíces pilosas fueron recolectadas transcurrido un período de 30 semanas aproximadamente, se secaron durante 48 h a temperatura ambiente y posteriormente 2 h a 70°C, para ser molidas y utilizadas en la elaboración de extractos crudos.
Resultados y discusión
Cultivo de vitroplantas de Phyllanthus acuminatus
En la figura 1 se presentan las fotografías de las plántulas de P. acuminatus cultivadas en el laboratorio, tanto en la etapa de germinación de la semilla (a) como en la de multiplicación del material (b).

Figura 1 Plántulas in vitro de Phyllanthus accuminatus: a. Germinación in vitro (3 semanas); b. Micropropagación (4 semanas)
La etapa de introducción del material vegetal, en este caso mediante la semilla, resultó bastante compleja, debido a la resistencia mecánica de la cubierta seminal en esta especie, por lo que implicó la propuesta de varios protocolos de germinación. La escarificación por lijado de la superficie de las semillas, la aplicación de ácido giberélico antes de la desinfección del material y el corte en la cubierta seminal probaron ser estrategias efectivas para promover la germinación in vitro. Se ha reportado que la cubierta seminal de algunas semillas actúa como una barrera física que impide la entrada de agua hacia el interior y limita el intercambio de gases entre el embrión y el medio, imposibilitando el crecimiento embrionario (13). Por tanto, al eliminar o disminuir esta barrera, el ácido giberélico cumplió su función como promotor de la división celular y el corte en la testa facilitó la germinación de las semillas.
Transformación de microestacas de P. acuminatus con A. rhizogenes
Tal y como se evidencia en las figuras 2 y 3, se produjo el crecimiento in vitro de raíces pilosas de la especie P. acuminatus, con el protocolo 1 de transformación genética, lo cual confirmó los resultados observados por diversos investigadores en otras especies del género Phyllanthus (14)-(15). La inducción de este tipo de crecimiento organogénico ha tenido por objeto en otros trabajos el estudio de sus capacidades medicinales contra el cáncer de mama (4) y el virus de la hepatitis B (14).
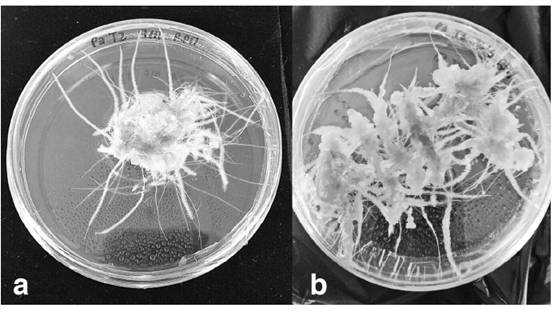
Figura 2 Crecimiento de raíces pilosas de Phyllanthus acuminatus: a. Raíz subcultivada con 15 semanas desde la agro-infección b. Raíces subcultivadas con 24 semanas desde la agro-infección

Figura 3 Multiplicación de raíces pilosas de Phyllanthus acuminatus después de 30 semanas y posterior al proceso de transformación genética, creciendo de forma individual en un medio MS sin reguladores
La transformación genética en la especie se alcanzó mediante un proceso de agro-infección mediado por la cepa Ar15834 de Agrobacterium rhizogenes. Setamam y colaboradores (16) señalan que la importancia del uso de esta bacteria radica en que resulta ser muy barato y resulta ser un método de transferencia directa de genes, lo cual disminuye el rearreglo de transgenes y favorece una integración eficiente de transgenes al genoma de la planta. Asimismo, se reporta que las raíces pilosas obtenidas a partir de A. rhizogenes se caracterizan por contar con gran estabilidad genética y biosintética, ya que el crecimiento mejora respecto del que proporciona un regulador y es más rápido (17).
El crecimiento de las raíces pilosas fue muy similar al observado por Garro y colaboradores, Bhattacharyya y Bhattacharya, y Kumar et al. (9) (14) y (15), quienes han llevado a cabo también procesos de transformación genética para la inducción de crecimiento de este tipo de raíces (hairy roots). En sus investigaciones se pudo observar la alta capacidad e independencia de las raíces para crecer sin el uso de reguladores de crecimiento, y destacó la gran cantidad de vellosidades o pelos radicales a lo largo de todo el segmento de raíz (figura 4). Estas raíces generaron además brotes radicales que crecieron y se ramificaron con mucha facilidad.
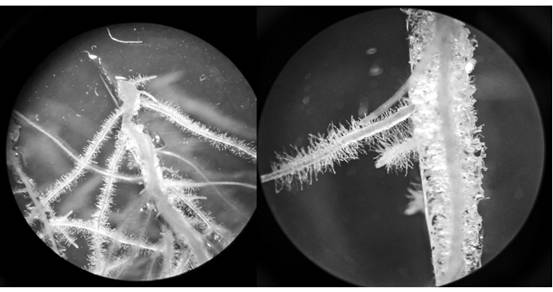
Figura 4 Raíces pilosas de P. acumminatus observadas en microscopía óptica (aumento 10X), creciendo en medio M&S 100% a las 20 semanas de inducción por transformación genética con A. rhizogenes.
Se ha demostrado que la transformación de raíces con la bacteria A. rhizogenes tiene grandes ventajas como que evita la variación somaclonal porque inhibe la inducción a callo (9)-(10)-(11). Sin embargo, en los resultados obtenidos se observó que las raíces pilosas crecieron mejor y más rápido en presencia de callo (figura 2), y aquellas raíces cultivadas individualmente crecieron más lentamente.
Conclusiones
El cultivo celular de P. acuminatus se logró con éxito a partir de la germinación in vitro de semillas de campo.
Se realizó el cultivo en medio semisólido de raíces pilosas (hairy root) a partir de su inducción por transformación genética mediada por Agrobacterium rhizogenes, cepa Ar15834. La confirmación del resultado se realizó por medio de microscopía óptica y con base en la morfología típica mostrada.
Se recomienda continuar la investigación con el análisis de los perfiles bioquímicos de muestras vegetales in vitro y de campo, para poder determinar la eficiencia de los sistemas biotecnológicos propuestos en la producción de compuestos fenólicos de interés medicinal.
En una etapa posterior se espera alcanzar el escalamiento en medio líquido de los cultivos organogénicos de raíces pilosas.
Agradecimientos
Agradecemos a la Vicerrectoría de Investigación y Extensión por el aporte de los recursos necesarios para la realización de este estudio, dentro de un proyecto de investigación VIE-TEC.
También se agradece el apoyo y colaboración de la empresa Laboratorios LISAN, S.A. con quienes se ha establecido un convenio de investigación conjunta que permitirá el análisis de los compuestos bioactivos presentes en la raíces pilosas de P acumminatus.
Al Dr. Edmundo Lozoya y la M. Sc. Marta Betancourt, en la Unidad de Biotecnología del Centro de Investigación y Estudios Avanzados del IPN (Irapuato-México), por la donación de la cepa Ar15834 de Agrobacterium rhizogenes, así como por su apoyo y colaboración con el grupo de investigación en las técnicas de transformación genética de plantas.














