Introducción
Las Myrtaceae están constituidas por 2900 especies de regiones cálidas de ambos hemisferios (tropicales y subtropicales). Son plantas raramente herbáceas, generalmente árboles o arbustos perennifolios, se caracterizan por sus cavidades esquizógenas ricas en aceites esenciales, como el género Syzygium [1]-[2].
La investigación de las semillas y frutos de Syzygium cumini reporta la presencia de alcaloides, aminoácidos, flavonoides, glicósidos, saponinas, taninos, triterpenoides, sesquiterpenos, antocianinas y componentes como α-pineno [3]-[7]. Se le han atribuidos propiedades farmacológicas como: antidiabética [8]-[10], hipolipidémica [11], antioxidante [12], antiinflamatoria [13]-[14] , anticonvulsionante [15], gastoprotector [16]-[17], entre otros.
En este trabajo se determinó la composición química de los extractos etéreos del fruto de Syzygium cumini utilizando Cromatografía de Gases-Espectrometría de Masas -CG EM- (MSD, Agilent technologies 5973) , usando las bases de datos Nist, Wiley y adams.
Metodologia
Material vegetal
La especie Syzygium cumini (L.) Skeels (Myrtaceae) Jambool, fue recolectada en el municipio de Barranquilla (Atlántico), Km. 7 antigua vía a Puerto Colombia, identificada por el botánico Jhon Infante Betancour del Herbario Nacional Colombiano, bajo el número COL 521217.
Preparación de los extractos
Se partieron de 300 g del fruto maduro de Syzygium cumini, de los cuales 150 g se pusieron en secado a temperatura ambiente aprox. 27°C evitando el deterioro del mismo por 6 días a la sombra, obteniendo dos tipo de material vegetal (maduro y seco). Se colocaron ambos en maceración con éter de petróleo durante tres meses, se filtraron y concentraron en un Rotaevaporador Büchi R-205 a 38 °C, los extractos se conservaron al vacío en un desecador durante 15 días y rotulados como SC1 y SC2 [18].
Cromatografía de gases-espectrometría de masas (CG-EM)
Los extractos etéreos del fruto maduro (SC1) y fruto seco (SC2) fueron aplicados a un CG-EM por inyección directa al equipo cromatográfico. El análisis se realizó usando un cromatógrafo de gases Agilent Technologies 6890 Plus acoplado a un detector selectivo de masas (MSD, Agilent Technologies 5973) operado en el modo de barrido completo de radiofrecuencias (full scan), con una columna DB-5MS (J & W Scientific, Folsom, CA, EE.UU) [5 % - fenil - poli (dimetilsiloxano), 60 m x 0.25 mm x 0.25 μm], inyección en modo split (50:1), Viny = 1 μL.
Resultados y Discusión
El análisis del cromatograma del extracto etéreo fruto maduro de S. cumini por espectrometría de masas mostró su primera señal a partir de los tiempos de retención de 17 min a 21 min donde se identificaron 5 compuestos, a los 33 min hasta 42 min, registraron un total de 16 compuestos, siendo complementados con 10 compuestos restantes hasta 73 min. El cromatograma (Figura 1) corresponde al corrido de la muestra hasta 85 min.
El cromatograma del extracto etéreo fruto seco de S. cumini, mostró su primera señal a partir de los 16 min, identificando 14 compuestos hasta los 16 min. De 33 min a 44 min se presenció un grupo de señales donde se identificaron 11 compuestos. El cromatograma (Figura 2) corresponde al corrido de la muestra hasta los 85 min.
En el Cuadro 1 se muestran los constituyentes químicos identificados, los tiempos de retención (TR min) y la cantidad relativa expresada en porcentaje para la muestra etérea del fruto maduro y seco.
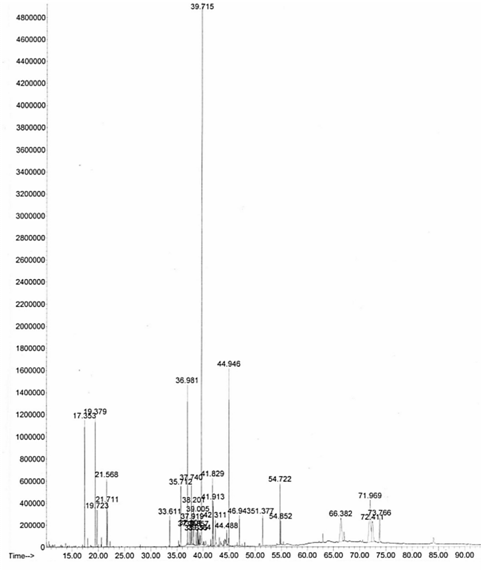
Figura 1: Cromatogramas del análisis por CG-EM de los extractos etéreos de fruto maduro de S. cumini hasta 85 min.
Se lograron identificar 27 componentes, que constituyen el 92% de la composición química del SC1 (fruto maduro). En la tabla 1 se muestran los compuestos que se encontraron en mayor cantidad: β-guaieno (32,8 %), triterpeno (Derivado de la amirina) (9,8%), triterpeno (Derivado de la amirina) (5,6%), trans-cariofileno (5,4%), triterpeno (4,7%), β-pineno (4,1%) y α- Pineno (3,9% ).
Se lograron identificar 29 componentes, que constituyen el 90,1% de la composición química del SC2 (fruto seco). Se muestran en la tabla 1, los compuestos que se encontraron en mayor cantidad: β-guaieno (26,2 %), benzoato de bencilo (14,7%), trans-cariofileno (4,5%), salicilato de bencilo (3,9%), 4-etil-o-xileno (3,4%) y p-cimeno (3,0%).
Al comparar los extractos SC1 y SC2, se identificaron similitudes entre los compuestos reportados, para las dos muestras se presentaron como constituyente mayoritario β-guaieno, la siguiente similitud entre las muestras fue trans-cariofileno. Posteriormente, presentaron diferencias entre los diversos compuestos mayoritarios identificados entre las muestras de S. cumini.

Figura 2: Cromatogramas del análisis por CG-EM de los extractos etéreos de fruto seco de S. cumini hasta 85 min
Análisis de sus patrones de fragmentación
En el análisis por CG-EM de la muestra SC2 (fruto seco) se identificaron la gran mayoría de los compuestos revelados en el análisis de la muestra SC1 (fruto maduro), pero se evidenciaron en el extracto etéreo del fruto seco otros compuestos como ésteres aromáticos y sesquiterpenos.
Por consiguiente, se muestran los dos (2) compuestos de mayor abundancia relativa de los extractos etéreos del fruto maduro y seco de S. cumini.
β-Guaieno. Este metabolito es un sesquiterpeno, presentó un tiempo de retención de 39,71 min y una cantidad relativa de 32,8% (cuadro 1) en la muestra SC1 (fruto maduro), mientras en la muestra SC2 (fruto seco) presentó un tiempo de retención de 39,68 min y una cantidad relativa de 26,2% (cuadro 1), se caracteriza por ser el componente mayoritario en ambos extractos, su espectro de masa mostró un ion molecular de m/z 204, siendo su mismo pico base y posee otros picos con menor intensidad de m/z 189, m/z 175, m/z 161, m/z 147, m/z 133, m/z 119, m/z 105 , m/z 91, m/z 77, m/z 67, m/z 55 y m/z 41.
Cuadro 1 Identificación por CG-EM de los compuestos presentes en los extractos etéreos del fruto de Syzygium cumini
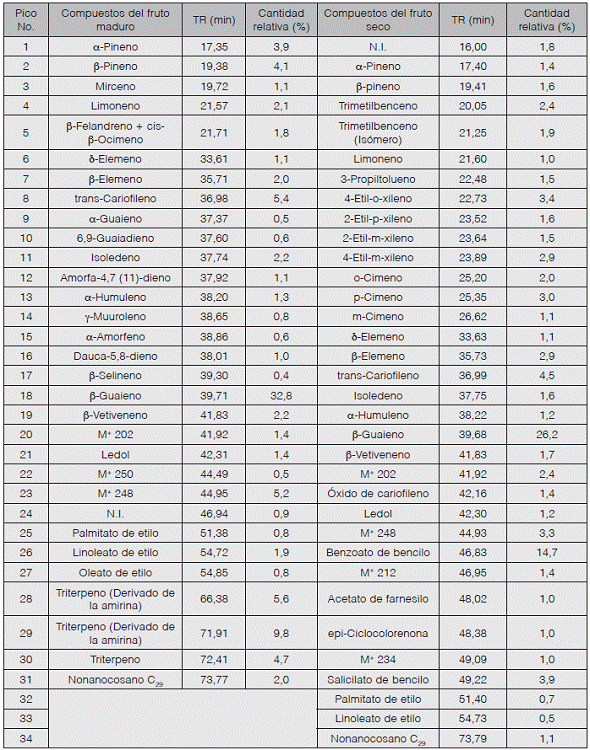
N.I.: No identificado.
Trans-cariofileno. Es un hidrocarburo sesquiterpénico, presentó un tiempo de retención de 36,98 min y una cantidad relativa de 5,4% (cuadro 1) en la muestra SC1 (fruto maduro), mientras en la muestra SC2 (fruto seco) presentó un tiempo de retención de 39,99 min y una cantidad relativa de 4,5% (cuadro 1), se caracterizó por su espectro de masas mostró un ión molecular de m/z 204, un pico base de m/z 93 y otros picos con menor intensidad de m/z 189, m/z 175, m/z 161, m/z 147, m/z 133, m/z 105, m/z 93, m/z 79, m/z 69 y m/z 41.
Algunos compuestos que fueron identificados en el cromatograma del fruto maduro no fueron revelados en el cromatograma de fruto seco, esto podría ser debido a la volatilidad de algunos compuestos presentes en el fruto maduro. La presencia de nuevos compuestos identificados en el espectro de fruto seco podría deberse a diferentes reacciones entre ellas termolábiles o fotoquímicas al exponer el fruto al secado y a la luz, que pudo originar ruptura de los enlaces de los compuestos presentes en el fruto y así generar nuevos constituyentes [19]-[20].
Así mismo, [3]; mostró la presencia de aceite esencial en el fruto de S. cumini, identificando diversos sesquiterpenos, pero en distintas cantidades relativas; como es el caso del α-pineno (30,89%) que en las muestras analizadas que se encontraron porcentajes que varían entre 17 y 18%. mostrándose la abundancia de compuestos mono- o sesqui- hidrocarburos terpénicos, siendo comunes en aceites esenciales [21]-[22].
Conclusiones
Por Cromatografía de gases-espectrometría de masas en el extracto etéreo de fruto maduro fueron identificados: cinco (5) monoterpenos, cuatro (4) hidrocarburos, once (11) sesquiterpenos, tres (3) ésteres y tres (3) triterpenos. En el extracto etéreo de fruto seco fueron identificados: tres (3) monoterpenos, un (1) hidrocarburo, ocho (8) sesquiterpenos, cinco (5) ésteres, diez (10) compuestos aromáticos, lo que muestra una gran diversidad de componentes encontrados demuestra que el género Syzygium, que podrían tener propiedades terapéuticas como antiséptica debido al contenido de compuestos terpénicos; así mismo se evidencia la variación en la composición química de la especie vegetal, por manejar dos metodologías diferentes en la elaboración de los extractos.














