Introducción
Se considera que el agua es el solvente universal y, según Teijón y Garrido (2006), esta propiedad está relacionada con su estructura molecular, que le permite disolver con facilidad compuestos iónicos y compuestos polares y solubilizar otros de carácter lipídico. Esta característica distintiva le confiere al agua una gran importancia, ya que puede tener diversas aplicaciones; sin olvidar que es un elemento esencial para el mantenimiento de la vida en el planeta.
El agua potable es aquella que se puede ingerir y que abastece a los seres humanos y satisface sus necesidades, ya que su composición química no presenta contaminantes objetables (microorganismos, sustancias químicas o agentes infecciosos, entre otros). Estos contaminantes pueden tener efectos nocivos en las personas, convirtiendo al agua en un peligro, de hí la necesidad de su potabilidad (Ramos, Sepúlveda & Villalobos, 2003). Por todas estas razones, el conocimiento de la calidad del agua es fundamental y, con más razón, de aquella destinada al consumo humano (Castellanos, Pérez & Rico, 1997).
Para comprobar si el agua que se consume es efectivamente potable, se toman muestras y se someten a análisis químicos con el fin de determinar su conductividad eléctrica, la densidad, el pH (grado de acidez o alcalinidad), la dureza total, la dureza cálcica, el calcio y el magnesio por absorción atómica, la alcalinidad total, parcial e hidróxida y los cloruros. Estos análisis permiten saber si el agua cumple con los parámetros establecidos que definen si es potable o no (Campos, 2000).
Fundamento
La importancia del agua, según Voet, Voet & Pratt (2008), radica en que es el medio en el que ocurre la mayoría de las reacciones bioquímicas, dado que los reactivos y productos de las reacciones metabólicas, los nutrientes y los productos de desecho dependen del agua para transportarse dentro de las células y entre ellas. Por otro lado, las aplicaciones del agua en la industria son numerosas, dada su economía y disponibilidad relativa. Se utiliza como fluido refrigerante, para la producción de vapor, como disolvente, vehículo de arrastre y como materia prima sujeta a transformación química (Vian, 2006).
La contaminación del agua tiene un gran impacto tanto en la salud como en el medio ambiente. Según Morell y Hernández (2000), la apreciable concentración de componentes indeseables (por ej., cloruros, nitratos y metales pesados) limita la viabilidad del líquido y aumenta su toxicidad, por lo que el estudio de la contaminación, la medición de sus efectos y el control de su evolución son aspectos de suma importancia.
Es imprescindible monitorear aspectos como la potabilidad, la presencia de coliformes fecales, el cloro libre, la alcalinidad, la cantidad de sólidos suspendidos, la conductividad y la dureza, ya que los contaminantes provienen de diferentes prácticas humanas que afectan su calidad y, por ende, todas las actividades y organismos que dependen de ella.
En Costa Rica, el Reglamento para la Calidad del Agua Potable (Decreto Nº 32327-S) (Poder Ejecutivo, 2005) fue publicado en el diario oficial La Gaceta N° 84, del 3 de mayo de 2005. Su objetivo es establecer los niveles máximos que deben tener aquellos componentes o características del agua que pueden representar un riesgo para la salud de la comunidad o ser inconvenientes para la preservación de los sistemas de abastecimiento en beneficio de la salud pública. Además, el artículo 15 indica que todo ente operador de sistemas de abastecimiento de agua está obligado a entregar copia de los informes de su programa de control de calidad al Ministerio de Salud.
En cuanto a las pruebas incluidas en este estudio, según Galvín (2003), la conductividad se ve afectada por el tipo de sales presentes, tiempo de disolución, temperatura, gases disueltos, pH y factores que afectan la solubilidad. En el caso de las aguas tratadas, la conductividad debe situarse en el rango de 1000 y 500. Según el Reglamento para la Calidad del Agua Potable (Poder Ejecutivo, 2005), la conductividad debe encontrarse en 400 . También es importante mencionar que, en el agua, las sales minerales son buenas conductoras, mientras que las materias orgánicas y coloidales tienen una conductividad baja (Seoánez, 2001).
Con respecto a la densidad, se trata de una propiedad que indica la cantidad de masa que contiene un determinado volumen y en el caso de las aguas potables es un parámetro importante, ya que la cantidad de sólidos disueltos y no disueltos la hacen variar (Rodríguez, Vargas & Gómez, 2009). También debe considerarse que, según Heyward (2006), la densidad depende de la temperatura y la presión; con una temperatura de 20 °C la densidad es de 0.99820 g/mL, mientras que a 27 °C es de 0.99650 g/mL, por lo que la temperatura de trabajo también tiene incidencia en la densidad y debe considerarse. Es importante determinar la densidad en las aguas ya que, según Seoánez (2001), es un indicador de la cantidad de materiales que llegan a un cuerpo receptor (contaminación mecánica).
El pH es un importante parámetro operativo de la calidad del agua. Las aguas demasiado ácidas disuelven los metales empleados en las conducciones (plomo, cobre, zinc), los cuales, al ser ingeridos, afectan negativamente la salud. El pH aceptable para agua potable varía entre 6.5 a 8.5 como valor guía (Jiménez, 2001). Según Galvín (2003), para las aguas de consumo humano, los valores extremos pueden causar irritación en las mucosas, irritación en órganos internos y hasta procesos de ulceración.
Cuando se hace referencia a la dureza del agua, se habla de la representación de la concentración de cationes metálicos multivalentes presentes en ella. Se clasifica en agua carbonatada (sensible al calor, precipita a altas temperaturas) y no carbonatada (no removible por calor, como sulfatos, nitratos y cloruros). La dureza más común es la del calcio y el magnesio, razón por la cual estos elementos solo se toman en consideración para determinar esta característica en el laboratorio (Jiménez, 2001). Cuando se encuentran en cantidades importantes, se dice que el agua es “dura” y significa que contiene sales incrustantes, dificulta la cocción de legumbres e impide la formación de espuma del jabón. Las aguas duras contienen de 150 a 300 mg/L como CaCO3, se considera que una dureza de 80 a 100 mg/L como CaCO3 es aceptable en agua potable (Jiménez, 2001). En Costa Rica el parámetro recomendado para agua potable es de 400 mg/L como CaCO3, con un valor máximo admisible de 500 mg/L. Es importante preguntarse qué pasaría si se obtuvieran valores mayores al máximo permitido por esta regulación; por un lado, es bueno ya que el cuerpo humano necesita el calcio para los huesos y el magnesio para los procesos metabólicos, pero en exceso pueden producir desde simples asperezas en la piel y/o endurecimiento del cabello hasta cálculos renales, aumentar la incidencia de ataques cardíacos o estar relacionados con anomalías del sistema nervioso y varios tipos de cáncer (Rodríguez, 2010). Sin embargo, los beneficios y consecuencias para la salud son todavía un tema de discusión.
La llamada “agua dura” contiene un alto nivel de minerales y cantidades variables de compuestos, en particular sales de magnesio y calcio, que son las causantes de la dureza. Además, el grado de dureza es directamente proporcional a la concentración de estas sales (Rodríguez, 2009). Por su parte, “el agua blanda”, cuya dureza es inferior a 100 mg/L, puede tener una capacidad amortiguadora reducida y resultar, por lo tanto, más corrosiva para las tuberías, por lo que ciertos metales pesados como cobre, zinc, plomo y cadmio pueden estar presentes en el agua potable. El grado de corrosión y solubilización de los metales también depende del pH, la alcalinidad y la concentración de oxígeno disuelto (Neira, 2006).
Por su parte, la alcalinidad expresa la capacidad que tiene el agua de mantener su pH a pesar de recibir una solución ácida o alcalina. Corresponde principalmente a los hidróxidos, carbonatos y bicarbonatos de los iones Ca2+, Mg2+, Na+, K+ y NH+ 4; los más comunes son los de calcio y magnesio. La alcalinidad se determina mediante la titulación con un ácido y el resultado se expresa como mg CaCO3/L. El principal efecto de la alcalinidad es su reacción con ciertos cationes en el agua, lo que conduce a la formación de precipitados (Jiménez, 2001). Sabiendo que la alcalinidad es la capacidad de neutralizar un ácido; sobre la alcalinidad hidróxida podemos decir que: si se precipita el carbonato por adición de exceso de cloruro de bario, el ion hidróxido se puede valorar satisfactoriamente en presencia del carbonato precipitado (Laitinen & Harris, 1982). Según Ramalho (2003) la alcalinidad del agua potable rara vez excede los 300 ppm pero en caso de aguas residuales domésticas es de 250 ppm. Cabe recalcar que dicho parámetro no está reportado en ningún nivel de control del Reglamento para la Calidad del Agua Potable en Costa Rica.
En cuanto a la presencia de cloruros (Cl-), estos se pueden encontrar en el agua como sales de calcio o magnesio y eso reduce el sabor salado, pero de igual manera esta se debe acoplar al rango establecido, ya que un alto contenido de cloruros puede causar corrosión en las tuberías metálicas y en las estructuras (Arnedo, Azofra, Usón & Zapata, 2009).
De esta forma, sentamos las bases principales para realizar los análisis físico-químicos a distintas muestras de agua de la zona occidental del país, con el fin de emitir un criterio sobre la potabilidad de las aguas incluidas en esta investigación.
Metodología
Las pruebas se realizaron en el laboratorio de química del Recinto de Grecia de la Universidad de Costa Rica (UCR), específicamente con los estudiantes del curso de Laboratorio de Procesos Industriales en el primer ciclo de 2015, correspondiente al tercer año de la carrera de Bachillerato y Licenciatura en Laboratorista Químico. Las muestras se tomaron de aguas para el consumo humano de distintas zonas de la región de Occidente del país, incluyendo Grecia, Naranjo, San Ramón, Poás, Zarcero, San Carlos y Esparza.
Las pruebas comprendieron la determinación de la conductividad, la densidad, el pH, la dureza total, la dureza cálcica, el calcio, el magnesio, la alcalinidad total y la presencia de cloruros, en todos los casos por triplicado para cada muestra de agua. Todas las pruebas se efectuaron de acuerdo con el Manual de Laboratorio de Procesos Industriales de Rodríguez et al. (2009) y posteriormente se compararon los resultados con lo establecido en el Reglamento para la Calidad del Agua Potable.
En el primer análisis se determinó la conductividad eléctrica con un conductímetro calibrado, tomando las lecturas con el equipo directamente a la muestra respectiva. Luego se determinó la densidad utilizando el densímetro directamente en la muestra colocada en una probeta; el pH se midió con el pH-metro recién calibrado con buffer de pH 4, 7 y 10, antes de la medición de las muestras. Las siguientes pruebas consistieron en determinar la dureza total y la dureza cálcica de las muestras. Para el primer caso se usó EDTA 0,01 M como titulante y ENT como indicador, además de la disolución amortiguadora amoniaco-cloruro de amonio pH 10; para el segundo caso, el titulante fue EDTA 0,02 M, murexida como indicador y NaOH para precipitar el magnesio. También se determinó el calcio y el magnesio por absorción atómica, utilizando una curva de calibración mixta para ambos elementos, llegando a concentraciones de 20 y 100 mg/L para magnesio y calcio, respectivamente, manteniendo concentraciones de 0,1% en cloruro de lantano para eliminar interferencias. Para la alcalinidad se utilizaron valoraciones ácido-base, empleando HCl 0,02 M como titulante y fenolftaleína, naranja de metilo y verde bromocresol como indicadores. Por último, para la prueba de cloruros se empleó el método argentométrico, utilizando nitrato de plata 0.01 M como titulante, en presencia del indicador cromato de potasio.
Resultados y discusión
En las pruebas se analizaron muestras de agua para el consumo humano de diferentes zonas del país (Grecia, Naranjo, San Ramón, Poás, Zarcero, San Carlos y Esparza). Según la procedencia del agua, los análisis evidenciaron distintos resultados. La finalidad del estudio fue establecer si lo obtenido en los análisis era acorde con lo permitido según el decreto NO32327-S del Reglamento para la Calidad del Agua Potable en Costa Rica.
En el Cuadro 1 se presentan los resultados de las pruebas efectuadas a las distintas muestras, destacándose que todas ellas cumplen con los criterios establecidos por la regulación vigente en el país sobre la calidad del agua potable.
Cuadro 1 Resultados obtenidos en las pruebas de calidad efectuadas a muestras de agua potable de la región de Occidente y los respectivos valores recomendados y máximos admisibles.
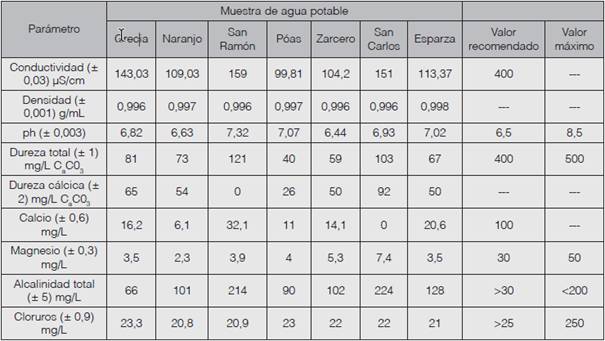
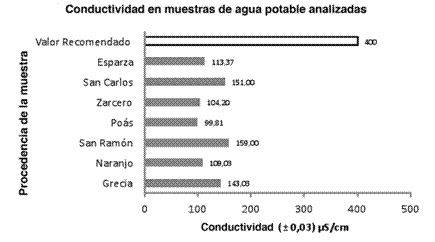
Inicialmente, en la primera prueba se determinó la conductividad eléctrica de todas las muestras de agua potable incluidas en el estudio. Este análisis se realizó con el objetivo de evidenciar la presencia de electrolitos disueltos, ya que el agua pura no debería presentar conductividad eléctrica alguna, por su ausencia de electrolitos, a diferencia del agua potable, que presenta algunos electrolitos disueltos (Cabrerizo, 2008). Como se ilustra en la Figura 1, la muestra de agua que presentó la menor conductividad fue la de la zona de Poás, con 99,81 µS/ cm, y la de mayor conductividad fue la proveniente de San Ramón, con 159 µS/cm. En todos los casos los valores están dentro de los parámetros establecidos por el citado Reglamento, ya que se encuentran por debajo del valor recomendado, que es de 400 µS/cm; esto quiere decir que el agua analizada no presenta riesgo para la ingesta humana según el parámetro de la conductividad.
Seguidamente se realizó la prueba de densidad, que se considera una medida muy importante ya que varía con la presencia o no de los sólidos disueltos (Rodríguez et al., 2009). La densidad del agua normalmente corresponde a un valor de 1,0000 g/mL, por lo que las muestras de agua analizadas se encuentran bien ya que están cercanas a este parámetro, todas ligeramente por debajo del valor indicado, oscilando entre 0,9960 y 0,9980 g/mL experimentalmente, lo que hace prever que se trata de agua con pocos sólidos disueltos.
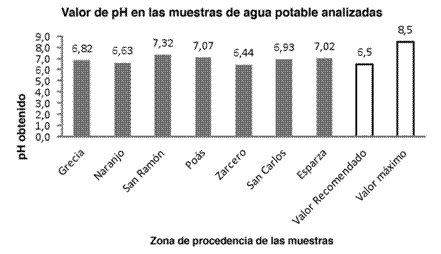
En cuanto a la determinación del pH, este es un factor muy importante ya que, dependiendo de su valor, se puede identificar si una muestra carece de nutrientes o presenta niveles de toxicidad. La medida del pH debe estar en alrededor de 6,5 para ser un valor recomendable. Las aguas con un pH bajo pueden incrementar la corrosión de los tubos de acero; además, el pH influye en los procesos de coagulación química, desinfección y el control de la corrosión (Raudel, 2003). Al analizar los resultados obtenidos, donde el valor recomendado por el Reglamento para la Calidad del Agua Potable es de 6,5 y el máximo admisible es de 8,5, se tiene que todas las muestras analizadas están dentro de lo especificado, ya que se obtuvo 6,44 como valor mínimo de pH en el caso de la muestra de agua de Zarcero y 7,32 como valor máximo de pH obtenido en el caso de San Ramón. Además, cabe señalar que las aguas de Grecia, Naranjo y Zarcero se destacan como las mejores en cuanto al pH, ya que su valor se encuentra muy cercano a lo recomendado, tal y como se ilustra en la Figura 2. Según Mora y Mata (2003), la variabilidad del pH de un sector a otro puede verse influenciada por el tratamiento aplicado al agua o por el tipo de cuenca del cual proviene, debido a la riqueza de minerales que esta posee, lo que altera el potencial de hidrógeno presente en el agua.
La prueba para determinar la dureza conllevó un análisis independiente para establecer la dureza cálcica de las muestras analizadas. La dureza total del agua corresponde a la suma de la concentración de iones polivalentes, y su determinación se realiza por medio de valoraciones complejométricas a pH cercano a 10 en un medio amoniacal; mientras que en la dureza cálcica se determina solo la concentración de calcio y el análisis se realiza a pH 13 sin amoniaco (Harris, 2007). La dureza total se mide como CaCO3 y la presencia de aguas duras puede tener consecuencias económicamente importantes (Snoeyink, 1980). El problema de la dureza se refleja más en aguas subterráneas, como el agua de naciente, que en aguas superficiales como la de los ríos, ya que por lo general estas arrastran más minerales como calcio y magnesio que aumentan la dureza.
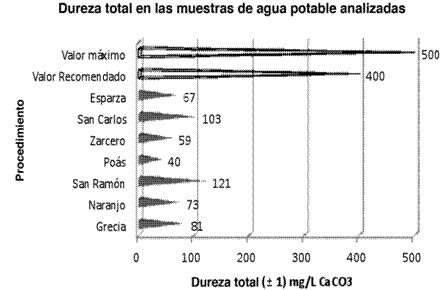
En el análisis específico de dureza total, los resultados obtenidos oscilaron entre valores de 40 y 121 mg/L de CaCO3, correspondientes a las muestras de agua potable de Poás y San Ramón, respectivamente. Como se ilustra en la Figura 3, todos los casos presentaron valores muy por debajo de lo recomendado, y cabe destacar que esta característica específica hace referencia a la suma de las concentraciones de los cationes metálicos, principalmente iones de calcio y magnesio presentes en el líquido, como se señaló anteriormente.
El Reglamento para la Calidad del Agua Potable establece que el valor recomendado es de 400 mg/L CaCO3 con un máximo permitido de 500 mg/L CaCO3. Con base en los resultados expuestos y su comparación con lo establecido por el decreto No. 32327-S, se puede decir con toda certeza que estos son bastante favorables, ya que los valores no se salen de lo admisible en ninguna muestra, todo lo contrario, más bien se encuentran muy por debajo de la concentración recomendada. Es pertinente señalar que la concentración de cationes metálicos en todos los casos es relativamente baja, sobre todo en los casos de Zarcero, Esparza, Grecia y Naranjo y, aunque la concentración de CaCO3 en San Ramón es un poco más alta, de igual forma se encuentra lejos de considerarse peligrosa o nociva para la salud humana. Es vital resaltar la importancia de controlar la dureza del agua potable, ya que las aguas blandas y duras han sido relacionadas con problemas cardíacos y cálculos renales, respectivamente. (Alfaro & Mora, 1999).
En el caso de los resultados de la prueba de dureza cálcica, estos oscilan entre 26 y 92 mg/L CaCO3 para las muestras de Poás y San Carlos, respectivamente, y en la muestra de agua de San Ramón no se detectó dureza cálcica, lo que las ubica dentro de los parámetros establecidos en el Reglamento para todos los casos. El decreto en cuestión establece como valor recomendado para la concentración de dureza cálcica en agua potable 100 mg/L como calcio, por lo cual, si el valor recomendado se considera como el que genera el mínimo riesgo, entonces la presencia de dureza cálcica en el agua potable analizada no genera ningún riesgo, por lo que su consumo no se puede considerar perjudicial para la salud humana.
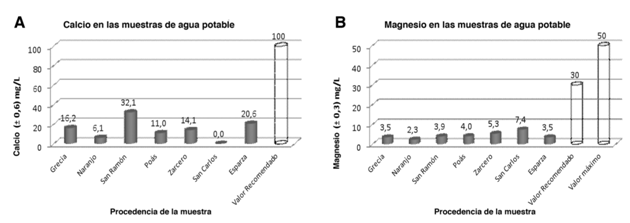
Seguidamente, los resultados para la determinación de calcio y magnesio por absorción atómica (ver figura 4A y 4B, respectivamente) evidencian que, en todos los casos, las cantidades de ambos elementos son óptimas para el consumo humano, puesto que sus valores están dentro de los recomendados por el Reglamento, que corresponden a 100 mg/L y 30 mg/L para calcio y magnesio, respectivamente. Los resultados oscilan entre 0 y 32,1 mg/L para las muestras de San Carlos y San Ramón, respectivamente, en el caso del calcio; además de 2,3 y 7,4 para las muestras de Naranjo y San Carlos, respectivamente, con respecto al magnesio.
En los resultados de alcalinidad, la cual expresa la capacidad que tiene un agua de mantener su pH a pesar de recibir soluciones ácidas o alcalinas, esta corresponde principalmente al contenido de carbonatos, bicarbonatos e hidróxidos. El rango de la alcalinidad en aguas domésticas, es decir, el agua potable, oscila en valores de 50 a 200 mg/L CaCO3. El principal efecto de la alcalinidad es que reacciona con ciertos cationes que se encuentran en el agua, lo que provoca precipitados no deseados en las tuberías de agua (Jiménez, 2001).
A nivel internacional se acepta una alcalinidad mínima de 20 mg de CaCO3/L para mantener la vida acuática (Goyenola, 2007). Además, cuando las aguas tienen alcalinidades inferiores son propensas a la contaminación, porque no tienen la capacidad para oponerse a las modificaciones que generen disminuciones del pH. Aunque el rango de la alcalinidad total llega a un máximo de 200 mg/L, en países como Colombia se admite un valor de 100 mg/L.
En esta prueba se obtuvieron resultados favorables para las muestras de agua de las zonas de Grecia, Naranjo, Poás, Zarcero y Esparza, que se encuentran dentro del rango de lo que se admite como normal en la alcalinidad del agua potable, oscilando entre 66 y 128 mg/L para las muestras de Grecia y Esparza, respectivamente. En los casos de San Ramón y San Carlos, las muestras no cumplen con los valores recomendados para la alcalinidad total, establecidos en un máximo de 200 mg/L (recomendado mayor a 30 mg/L) según la literatura consultada, ya que estos fueron de 214 y 224 mg/L, respectivamente. Dado que la alcalinidad de las aguas superficiales está determinada generalmente por el contenido de carbonatos, bicarbonatos e hidróxidos, esta se toma como un indicador de dichas especies iónicas (Baird, 2001).
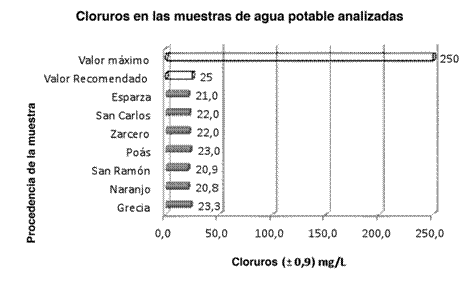
La prueba final fue la determinación de cloruros. Este análisis resulta muy importante porque todas las aguas naturales contienen este componente, sin embargo, se debe verificar su concentración dado que puede dañar la salud. En este caso, los resultados oscilaron entre 20,8 y 23,3 mg/L Cl- correspondientes a las muestras de Naranjo y Grecia, respectivamente, como se ilustra en la Figura 5.
Según el decreto No. 32327-S, se considera como un valor idóneo 25 mg/L Cl- y como un valor máximo admisible 250 mg/L Cl-. Partiendo de lo estipulado en el Reglamento para la Calidad del Agua Potable, se puede destacar que en su totalidad las aguas en estudio se encuentran bastante bien en este aspecto, pues se encuentran muy por debajo del límite permitido y ni siquiera llegan al valor recomendado, lo cual es favorable en todo sentido. Es destacable que el agua de Grecia presenta una concentración un poco mayor de cloruros con respecto a las otras muestras, no obstante, esto es algo que no debe causar preocupación ya que no presenta ningún inconveniente en cuanto al consumo humano. La concentración de cloruros en aguas naturales es muy variable, pues depende de las características de los terrenos que atraviesan. Dicha concentración es menor comparada con la del ion en aguas residuales, ya que la actividad humana necesariamente la incrementa (Melgarejo, 2003).
Consideraciones finales
Con base en lo establecido por el decreto No. 32327-S, se puede concluir que el agua de las siete zonas comprendidas en el estudio reúne las condiciones mínimas para la ingesta del líquido por el ser humano.
Es importante destacar que los factores determinantes en la alteración del sabor del agua potable en cada región, corresponden al nivel de dureza y alcalinidad presente en el agua, debido a que pueden arrastrar metales que no le pertenecen.
Con respecto al valor del pH, es deseable mantener este parámetro en 6,5 como condición estable en aguas destinadas al consumo humano, a raíz de que la alteración de dicho factor puede traer consecuencias adversas por falta de nutrientes o presencia de sustancias que generan toxicidad para la salud humana.
En cuanto a la dureza total y la presencia de calcio y magnesio en el agua, estos son parámetros importantes que se deben controlar, ya que su cuantificación determina la potabilidad del agua, debido a que la presencia de iones de calcio y magnesio en exceso puede producir problemas cardiovasculares y sabores indeseados en el líquido.
La alcalinidad total es otro parámetro importante de controlar, ya que ayuda a verificar si el agua presenta la concentración adecuada de carbonatos, bicarbonatos e hidróxidos que hacen que no disminuya el pH en presencia de ácidos. Es decir, se debe verificar y controlar que el agua no sea propensa a acidificarse, ya que de lo contrario dejaría de ser potable.
El contenido elevado en cloruros puede causar problemas de potabilidad en las aguas de consumo humano (daños estomacales y renales), además de acelerar la corrosión de conducciones y estructuras metálicas. Por eso es necesario verificar su presencia en las cantidades recomendadas.
La presencia de minerales y iones Cl- depende en gran medida del terreno por donde atraviese la fuente principal de abastecimiento (río, naciente, etc.), por lo tanto, es de suma importancia regular las concentraciones de estos elementos para asegurar una buena calidad del agua que se consume diariamente.