Introducción
La nanotecnología puede ser aplicada en la resolución o mejoramiento de problemas relacionados con la calidad del agua, siendo la síntesis de nanopartículas una alternativa a estudiar. Es posible proveer soluciones a problemas del agua mediante la remoción de contaminantes tales como bacterias, virus, metales pesados o plaguicidas (Yean, 2008). Este tipo de alternativas en el tratamiento del agua se reconocen como económicas, eficaces, eficientes y sostenibles. Su uso permite que los procesos de tratamiento sean menos contaminantes en comparación con los métodos tradicionales; además, en general, se necesita menos mano de obra, capital y energía.
Específicamente, en las aplicaciones destinadas al tratamiento de agua de consumo humano contaminada con arsénico se han utilizado nanopartículas magnéticas de óxido de hierro para adsorber al contaminante y, posteriormente ser removidas aplicando campos magnéticos externos. En este sentido, se han presentado aplicaciones hasta pruebas de laboratorio, a nivel de dispositivos magnéticos aplicados, actualmente se encuentran solo bajo patentes.
Las nanopartículas magnéticas de óxido de hierro son susceptibles a la oxidación por el aire durante la síntesis o al ser agregadas a un sistemas acuosos (Kadakia, 2008), perdiendo su propiedad magnética. El control del tamaño y la polidispersidad son muy importantes debido a que las propiedades de los nanocristales dependen fuertemente de la dimensión de las nanopartículas; sólo partículas de magnetita con un tamaño menor de 30 nanómetros exhiben propiedades superparamagnéticas que las hacen propensas a los campos magnéticos (Luciano-Carlos, F., García-Einschlag, M., González-Mártire, 2013).
El carácter magnético de la estructura del óxido de hierro varía de la hematita (α-Fe2O3), maghemita (γ-Fe2O3) y de magnetita (Fe2O4). Las condiciones de síntesis tienen un efecto en la estructura final del óxido de hierro (Teja & Koh, 2009), siendo indispensable el uso de un emulsificante durante la síntesis en fase líquida para estabilizar la fase de magnetita. Este emulsificante provee alternativas para posibles modificaciones estructurales, además de estabilizar las nanopartículas de hierro con diámetros menores a los 20 nanómetros, dado que en este rango muestran comportamientos super-paramagnéticos a temperatura ambiente (Teja & Koh, 2009).
Dependiendo de la aplicación, se encuentran en la literatura varios métodos para sintetizar nanopartículas magnéticas, por ejemplo: coprecipitación, micelas inversas, tecnología de micro-emulsión, síntesis sol-gel, reacciones hidrotérmicas, reacciones de hidrólisis y termólisis, síntesis de inyección de flujo (Laurent et al., 2008).
En este trabajo se utilizó la técnica de coprecipitación con emulsión por inversión de fases, junto con su caracterización por medio de rayos X, termo-gravimetría, microscopia de trasmisión electrónica y espectroscopia de infrarrojo (FTIR y Raman). Todas estas técnicas confirman la naturaleza magnética de las partículas de hierro y su estabilización a nano-escala.
Materiales y métodos
Materiales
Se utilizaron sales de hierro como cloruro de hierro (II)∙4 H2O y cloruro de hierro (III) ∙6 H2O de la casa comercial MERCK usados tal y como se recibieron. Solventes como isopropanol (Grado de síntesis, Merck), metanol (grado HPLC, Merck), tetrahidrofurano (Grado de síntesis, MERK) y nitrógeno (ultra alta pureza 99,999%), amoniaco (grado de síntesis) y ácido esteárico (Grado industrial 90 %) fue recristalizado en isopropanol antes de ser utilizado.
Método
La síntesis de las nanopartículas se basó en la metodología reportada por Moore et al, con algunas modificaciones (Moore, Evans, Shen, & Hodson, 2001). Básicamente se tomaron 1,14 gramos (4,2 mmoles) de FeCl3 y se disolvieron en 75 ml de isopropanol, previamente purgado con nitrógeno (99,999%) y se mantiene con agitación constante a 50 °C. A esta disolución de hierro (III) se le agregó 0,47 gramos (2,4 mmoles) de FeCl2, manteniendo una proporción Fe3+/ Fe2+ 2:1 por 40 minutos. Luego, se añadió amoniaco acuoso, gota a gota, no más de 1 ml, dándose la precipitación de un sólido negro. Estas partículas debieron de ser lavadas con metanol, usando un imán o centrifugación para promover la sedimentación. Se mezclaron 284 mg de ácido esteárico en 50 ml de metanol y se agrega esta disolución a las partículas lavadas. Esta mezcla se colocó en un baño ultrasónico por 5 minutos para promover la formación y estabilización de las micelas. Finalmente, se disuelven las partículas en tetrahidrofurano (THF).
Análisis
La espectroscopia de Raman y de trasmisión de infrarrojo (FTIR) fueron llevados a cabo en un equipo Thermo DXR (láseres de 780 y 532 nm) y un Thermo Nicolet 380, respectivamente. El análisis termogravimétrico se realizó en un equipo TA modelo SDTQ600, a 10 °C/min en atmósfera inerte de nitrógeno con un flujo de 10 ml/min. Mientras que el análisis de difracción de rayos X se realizó en un PANalytical modelo Empyrean. Finalmente las micrografías de trasmisión electrónica se obtuvieron en un Microscopio Electrónico JEOL modelo Jem-2100, con un potencial de 100 kV.
Resultados
La disolución de sales de hierro Fe3+/Fe2+ presenta un color naranja que cambia con la formación un precipitado negro al agregar el amoniaco en atmósfera de nitrógeno, como se muestra en la reacción de la Figura 1a. Este precipitado (óxido de hierro) es sensible a campos magnéticos (fase magnetita). La muestra fue lavada con metanol y estabilizada con ácido esteárico. La presencia de oxígeno tiene un efecto en la síntesis, favoreciendo la fase de hematita (color naranja), con propiedades paramagnéticas. El cambio de fase se puede dar en ausencia del ácido esteárico (surfactante), por lo que la estabilización de las nanopartículas es fundamental, para mantener naturaleza magnética de las partículas. Se espera, dada la interacción con el solvente polar (metanol), que la cola del surfactante este aglomerada (Figura 1,b) pero al cambiar el solvente a tetrahidroxifurano (THF) (Figura 1,c) se da una inversión de fases, dado que colas del ácido carboxílico se solventarán dispersando más eficientemente las nanopartículas (figura 1,b).
El THF puede ser fácilmente evaporado, permitiendo realizar análisis de composición y estructura a las nanopartículas tal como se muestra en la figura 1.
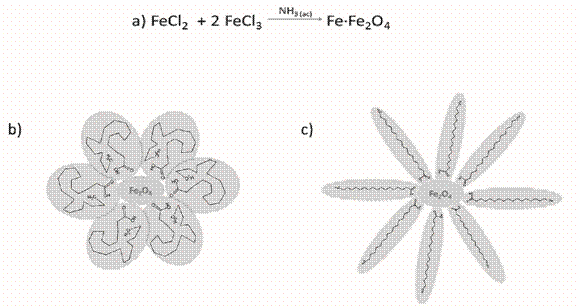
Figura 1: a) reacción para la formación de óxido de hierro, b) partícula estabilizada por ácido esteárico en propanol (solvente polar) y c) partícula estabilizada en tetrahidrofurano.
Respecto a la composición química, la difracción de rayos x (Figura 2,a) coincide con los datos reportados por Sun en el 2002 (Sun & Zeng, 2002), utilizando una fuente de radiación de cobalto. En las muestras estabilizadas con ácido esteárico evidencian señales a 22, 36, 42, 51, 68 y 75 grados, que coinciden con los valores reportados para las nanopartículas de hierro (Sun & Zeng, 2002). El difractograma de las nanopartículas presenta ruido, apreciable respecto a la muestra de hematita pura (Figura 2,b). Esto se puede deber a la presencia del emulsificante, rico en señales en la misma región (véase Figura 2,c).
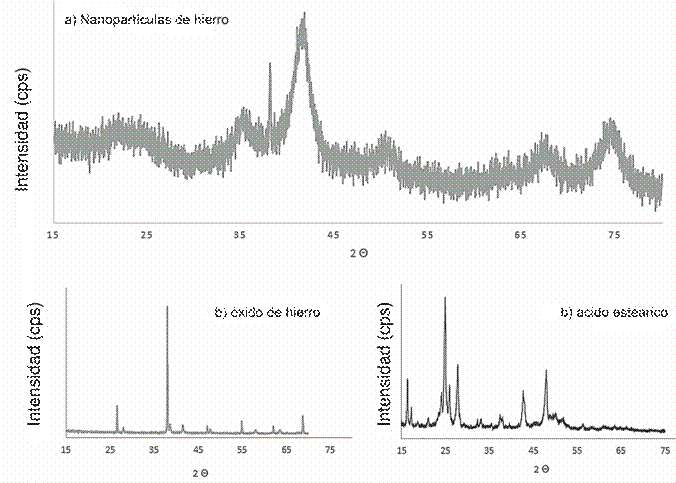
Figura 2: Difractometría de rayos x, para la magnetita (a) y para el hematita (b) obtenida utilizando la misma metodología pero en ausencia de emulsificante (c).
La naturaleza de la sustancia fue confirmada utilizando espectroscopia de Raman, la muestra de referencia óxido de hierro (hematita) (Figura 3,b) muestra señales fuertes a 226, 292 y 409 cm-1, la relación de intensidad entre las señales 226/292 cm-1 en la hematita indican alguna heterogeneidad y cristalinidad a micro-escala (Chourpa et al., 2005); mientras tanto la muestra de magnetita presenta picos no resueltos a 671 y 712 cm-1 (Figura 3,a) ausentes en la muestra de hematita y que coinciden con la señal de la magnetita pura (de Faria, Silva, & de Oliveira, 1997) (Shebanova & Lazor, 2003).
El análisis termogravimétrico (Figura 4,a) demuestra la presencia de aproximadamente 3% de contenido de agua en la muestra, posiblemente proviene del agua atrapada en la nano-partícula durante el proceso de síntesis. La temperatura inicial de descomposición (onset) a 180 °C, con un máximo pico de descomposición de 290 °C coincide con el proceso de descomposición del ácido esteárico utilizado como emulsificante (ver Figura 4,b). Existe un segundo proceso térmico a 317 °C con un pico máximo de descomposición de 380 °C, asociado al cambio de fase del óxido de hierro (de FeOOH a Fe2O3) (Feng, 1993). En la composición de las nanopartículas se puede estimar que alrededor de un 9% pertenece al ácido esteárico (dado que se descompone completamente a 300 °C), mientras que debido a la pérdida de agua asociado al cambio de fase del óxido de hierro, se pierde aproximadamente un 11% de la masa, dejando cenizas de un 70% que corresponden al óxido de hierro.
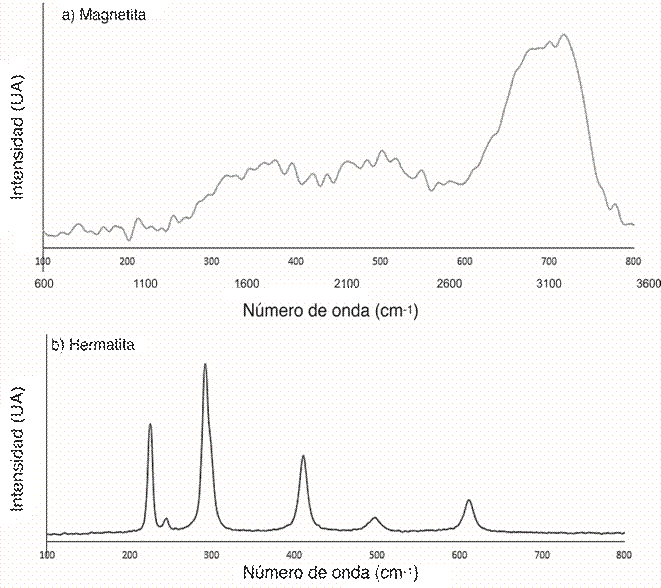
Figura 3: Espectroscopia de Raman de las nanopartículas magnéticas de hierro estabilizadas con ácido esteárico (a) y la hematita obtenida utilizando la misma metodología en ausencia de surfactante (b).
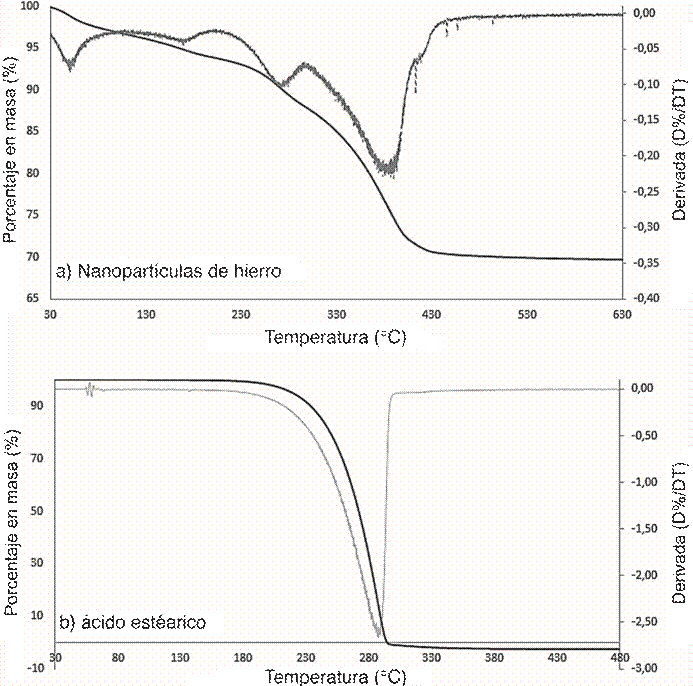
Figura 4: Termogramas de las nanopartículas de hierro estabilizadas con ácido esteárico (a) y del ácido esteárico recristalizado (b).
La interacción entre el óxido de hierro y el ácido carboxílico fue reportada por Zhang en 2006, ellos indican que mediante espectroscopia de infrarrojo (FTIR) es posible observar la interacción entre óxido de hierro y el grupo carboxilo del ácido esteárico, utilizado como emulsificante (Zhang, He, & Gu, 2006). Mediante la espectroscopia de infrarrojo es posible apreciar la perdida de la banda a 1697 cm-1 (ver Figura 5, curva superior), correspondiente a la señal del ácido esteárico y casi desaparece cuando se analiza en las nanopartículas estabilizadas (ver Figura 5, curva inferior). Lo que confirma la interacción de las nanopartícula con el grupo carboxílico del emulsificante. Además es posible observar la presencia de una señal ancha entre los 3000 y 3600 cm-1, debido a agua retenida durante la síntesis observada en el análisis termogravimétrico.
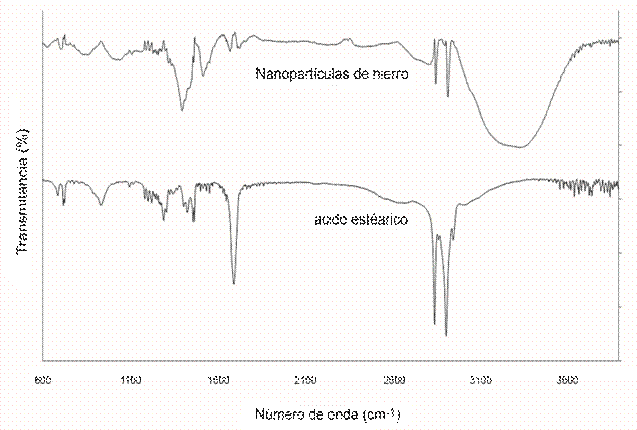
Figura 5: espectro de infrarrojo de las nanopartículas magnéticas de hierro estabilizadas con ácido esteárico (arriba) y el ácido esteárico recristalizado (abajo).
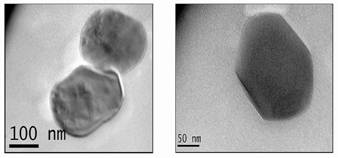
Finalmente el análisis de la nanoestructura se realizó por microscopia de transmisión electrónica (Figura 6), que permite observa partículas en el rango de los 150 nanómetros. El tamaño de las partículas está definido por el surfactante, que funciona como matriz y presenta una interaccionando con el óxido de hierro, como demuestra la técnica de FTIR. Las variaciones en la concentración y/o el material van a tener un efecto en la forma final de la nanopartícula, de allí la importancia de continuar la investigación en las variables que afectan la síntesis, para lograr un mayor control en las propiedades finales de las nanopartículas.
Conclusiones
Es posible sintetizar nanopartículas de hierro en el rango de los 150 nanómetros con propiedades magnéticas, por inversión de fases, empleando ácido esteárico como estabilizador. El grupo carboxilo del ácido esteárico muestra una interacción con las partículas de hierro, lo que permite mantener la fase magnetita estable y con esto conservar las propiedades magnéticas. Estas partículas pueden ser usadas en la remoción de contaminaciones del agua o como aditivo en otras aplicaciones.