Introducción
Todos los estudiantes de las licenciaturas del área de química, encuentran en el laboratorio, la comprobación de lo que se les enseña en la pizarra. Esta situación, además de ser una afirmación de la vocación del estudiante con la realidad de su carrera, fundamenta y apoya los modelos de trabajo teóricos (Pérez y Rincón, 2003). Desafortunadamente, el trabajo experimental es caro ya que, en la mayoría de los casos, es necesario utilizar instrumentos de medida. En los laboratorios de Química Analítica de la Facultad de Estudios Superiores Cuautitlán, unidad periférica de la Universidad Nacional Autónoma de México, una de las metodologías instrumentales de uso más común es la potenciometría a intensidad nula, una instrumentación analítica muy amigable, (Harris, 2012) "de bajo costo" comparada con métodos tales como absorción atómica, cromatografía de gases o de líquidos o espectrofotometría UV-visible. Pero, aun siendo una técnica "de bajo costo" cada potenciómetro cuesta, aproximadamente US$700 (Pérez. Rincón, Hernández y Romero, 2011). Considerando el número de estudiantes que se atienden en nuestros laboratorios, se necesitan funcionando correctamente 20 potenciómetros cuyo promedio de vida útil es de aproximadamente 6 años. Si se muestra una alternativa para sustituir dichos potenciómetros, por instrumentos de mayor duración y menor precio, se tendrá plenitud en cubrir el trabajo experimental a bajo costo. Esto es lo que se pretende lograr con el presente desarrollo experimental, en donde se demuestra estadísticamente, que es lo mismo utilizar un potenciómetro ($700) que un multímetro ($90 dólares) como sistema indicador del fin de valoración.
Objetivo
Mediante valoraciones convencionales utilizadas en química analítica (acido-base, redox, complejométricas y de halogenuros), se comprobará, a través de la prueba estadística t de Student, que es equivalente utilizar un multímetro que un potenciómetro como instrumento de detección del volumen del punto de equivalencia, con el fin de sustituir en labores docentes, el potenciómetro por el multímetro.
Metodología
Valoraciones
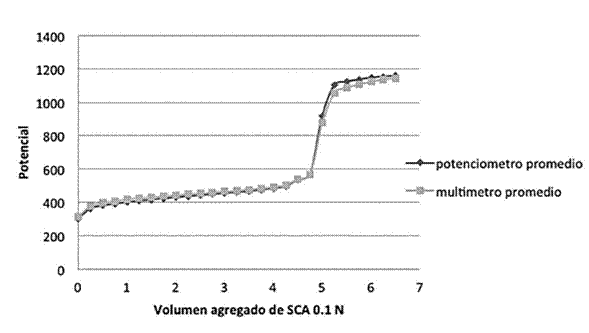
Redox: se vertieron, por separado, nueve alícuotas de 5 ml de Sulfato ferroso amoniacal (SFA) 0.1M, en ácido sulfúrico al 5%, (Orozco 1979) en un vaso de fondo cóncavo donde se sumergieron los electrodos de platino, uno conectado al potenciómetro y el otro al multímetro. Las valoraciones se realizaron con sulfato cérico amoniacal (SCA) 0.1M, utilizando una bureta de 10 ml, añadiendo volúmenes de 0.25 ml como se muestra en la Figura 1. Se registraron los respectivos resultados y se graficaron.
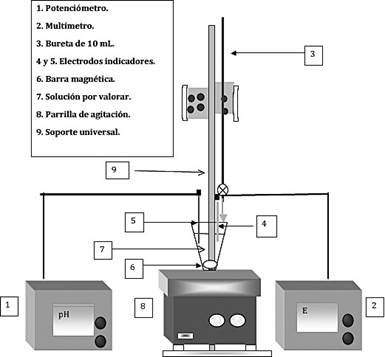
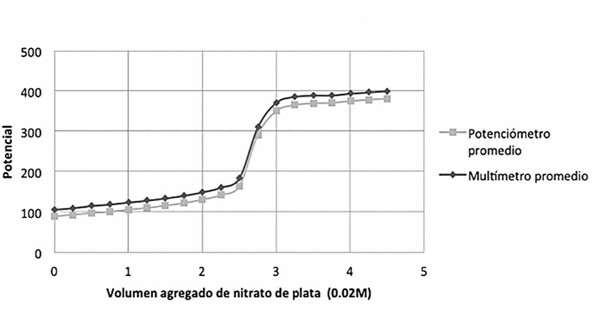
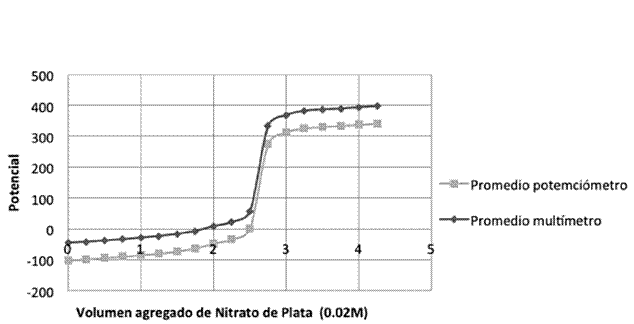
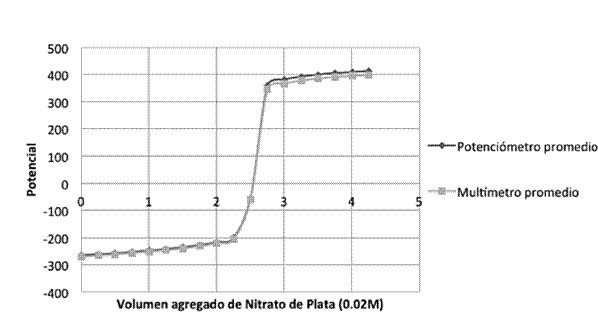
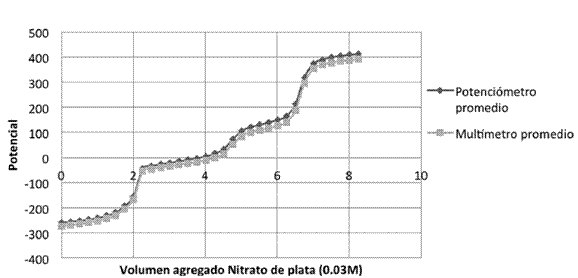
Halogenuros: se vertieron, por separado, nueve alícuotas de 5 ml de Cloruro de potasio, nueve alícuotas de 5 ml de Bromuro de potasio, y nueve alícuotas de 5 ml de Yoduro de potasio, por último nueve alícuotas de 5 ml de una mezcla de los tres a una concentración de 0.011M, en un vaso de fondo cóncavo, las cuales se valoraron, con nitrato de plata (0,02M). El montaje experimental se muestra en la Figura 2 (los electrodos de plata se conectaron uno al multímetro y otro al potenciómetro). La valoración se realizó con una bureta de 10 ml, añadiéndose volúmenes de 0,25 ml. Se registraron los respectivos resultados y se graficaron.
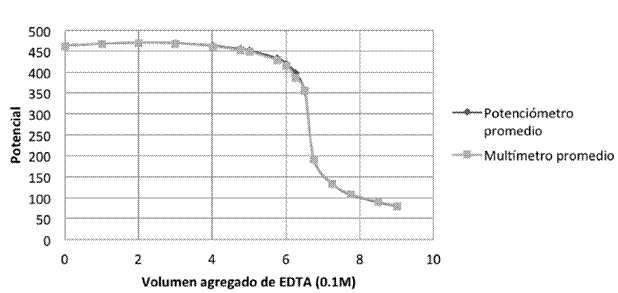
Complejos: se vertieron nueve alícuotas de 5 ml, por separado de una mezcla de (SFA) y Sulfato férrico 0.001M y 0.013M, a pH de 2.4 en un vaso de fondo cóncavo, cada una de las alícuotas se valoró con EDTA (0.01 M), el montaje experimental fue equivalente al utilizado en la valoración de óxido-reducción. Se registraron los respectivos resultados y se graficaron.
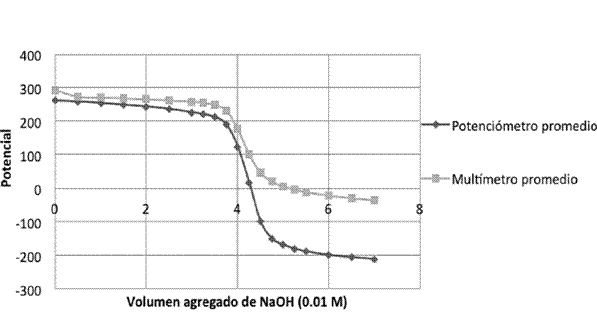
Ácido-base: se tomaron nueve alícuotas de 5 ml de solución de ácido nítrico 0,008M se valoraron con hidróxido de sodio (0,01 M). El montaje experimental fue similar al de la valoración de halogenuros, con la diferencia de que a un potenciómetro se conectó el electrodo combinado de vidrio y al multímetro un electrodo Posai-Posai (Pérez, Rincón, Tenorio 2013) separados por un puente de agar. La titulación se realizó adicionando volúmenes de 0,25 ml. Se registraron los respectivos resultados y se graficaron (Figura 3).
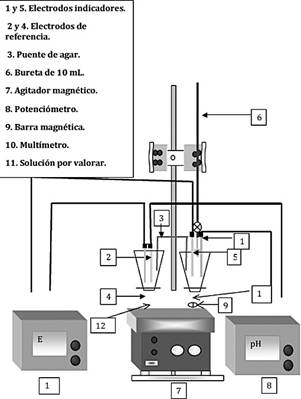
Figura 2: Esquema del montaje experimental utilizado para las valoraciones complejométricas y de halogenuros.
Resultados
I. Redox
Cuadro 1: Se presentan los volúmenes de puntos de equivalencia (V.P.E.) De las nueve valoraciones de 5 ml de SFA (0.1 M) con SCA (0.1 M), obtenidos mediante un potenciómetro y un multímetro.
| Valoración N.° | V P.E (potenciómetro) | V P.E (multímetro) |
|---|---|---|
| 1 | 4.75 | 4.75 |
| 2 | 5 | 5 |
| 3 | 5 | 5 |
| 4 | 5.25 | 5.25 |
| 5 | 5 | 5 |
| 6 | 5 | 5 |
| 7 | 5 | 5 |
| 8 | 5 | 5 |
| 9 | 5 | 5 |
| V promedio 5mL | V promedio 5mL |
Halogenuros
Cloruros
Cuadro 2: Se presentan los V.P.E. de las 9 valoraciones, de 5 ml de cloruro de potasio (0,011 M) con nitrato de plata (0,02 M).
| Valoración N.° | V.P.E ml (POTENCIÓMETRO) | V.P.E ml (MULTIMETRO) |
|---|---|---|
| 1 | 2.75 | 2.75 |
| 2 | 2.75 | 2.75 |
| 3 | 3 | 3 |
| 4 | 3 | 3 |
| 5 | 3 | 3 |
| 6 | 2.75 | 2.75 |
| 7 | 2.75 | 2.75 |
| 8 | 2.75 | 2.75 |
| 9 | 2.75 | 2.75 |
| V promedio 2.833 | V promedio 2.833 |
Bromuros
Cuadro 3: Se presentan los V.P.E. de las 9 valoraciones, de 5 ml de bromuro de potasio (0,011 M) con nitrato de plata (0,02 M).
| Valoración N.° | V.P.E ml (POTENCIÓMETRO) | V.P.E ml (MULTIMETRO) |
|---|---|---|
| 1 | 2.75 | 2.75 |
| 2 | 3 | 3 |
| 3 | 2.75 | 2.75 |
| 4 | 2.75 | 2.75 |
| 5 | 2.75 | 2.75 |
| 6 | 2.75 | 2.75 |
| 7 | 2.75 | 2.75 |
| 8 | 2.75 | 2.75 |
| 9 | 2.75 | 2.75 |
| V promedio 2.7777 | V promedio 2.7777 |
Yoduros
Cuadro 4: Se presentan los puntos de equivalencia de las 9 valoraciones, de 5 ml de yoduro de potasio (0,011 M) con nitrato de plata (0,02 M).
| Valoración No. | V.P.E ml (POTENCIÓMETRO) | V.P.E ml (MULTIMETRO) |
|---|---|---|
| 1 | 2.75 | 2.75 |
| 2 | 2.75 | 2.75 |
| 3 | 2.75 | 2.75 |
| 4 | 2.75 | 2.75 |
| 5 | 2.75 | 2.75 |
| 6 | 2.5 | 2.5 |
| 7 | 2.75 | 2.75 |
| 8 | 2.75 | 2.75 |
| 9 | 2.5 | 2.5 |
| V promedio 2,6944 | V promedio 2,6944 |
Cloruros, bromuros y yoduros
Cuadro 5: Se presentan los puntos de equivalencia de las nueve valoraciones de 5 ml de los tres halogenuros en la misma solución con nitrato de plata (0,03 M).
| Yoduros | Bromuros | Cloruros | ||||
|---|---|---|---|---|---|---|
| V.P.E ml (P) | V.P.E ml (M) | V.P.E ml (P) | V.P.E ml (P) | V.P.E ml (P) | V.P.E ml (P) | |
| 1.75 | 1.75 | 5.25 | 5.25 | 7 | 7 | |
| 2.25 | 2.25 | 5 | 5 | 7 | 7 | |
| 2.25 | 2.25 | 4.75 | 4.75 | 6.75 | 6.75 | |
| 2.25 | 2.25 | 4.75 | 4.75 | 6.75 | 6.75 | |
| 2.25 | 2.25 | 4.75 | 4.75 | 6.5 | 6.5 | |
| 2.25 | 2.25 | 5 | 5 | 6.75 | 6.75 | |
| 2.25 | 2.25 | 4.75 | 4.75 | 6.75 | 6.75 | |
| 2.25 | 2.25 | 5 | 5 | 6.75 | 6.75 | |
| 2.25 | 2.25 | 5 | 5 | 6.75 | 6.75 | |
| V promedio 2.1944 | V promedio 2.1944 | V promedio 4.9166 | V promedio 4.9166 | V promedio 6.7777 | V promedio 6.7777 | |
Complejometría
Cuadro 6: Se presentan los puntos de equivalencia de las 9 valoraciones de la solución que contiene 5 ml de hierro (II) (0,001M) y hierro (III) (0,013M) con EDTA (0,01 M).
| # de Valoración | V P.E (potenciómetro) | V P.E (multímetro) |
|---|---|---|
| 1 | 6.75 | 6.75 |
| 2 | 6.75 | 6.75 |
| 3 | 6.75 | 6.75 |
| 4 | 6.75 | 6.75 |
| 5 | 6.75 | 6.75 |
| 6 | 6.75 | 6.75 |
| 7 | 6.75 | 6.75 |
| 8 | 6.75 | 6.75 |
| 9 | 6.75 | 6.75 |
| V promedio 6.75 | V promedio 6.75 |
Ácido-base
Cuadro 7: Se presentan los puntos de equivalencia de las 9 valoraciones de la solución que contiene 5 ml de ácido nítrico (0008M) con idróxido de sodio (0.01M).
| Valoración N.° | V. P.E (potenciómetro) | V. P.E (multímetro) |
|---|---|---|
| 1 | 4 | 4 |
| 2 | 4.25 | 4.25 |
| 3 | 4 | 4 |
| 4 | 4.25 | 4.25 |
| 5 | 4.25 | 4.25 |
| 6 | 3.75 | 3.75 |
| 7 | 3.75 | 3.75 |
| 8 | 3.75 | 3.75 |
| 9 | 4 | 4 |
| V promedio 4,00 | V promedio 4,00 |
Conclusiones
Las pruebas estadísticas realizadas para los cuatro tipos de valoraciones potenciométricas usuales en química analítica (ácido-base, redox, complejos y valoración de halogenuros) muestran que es equivalente, como instrumento de fin de valoración, un potenciómetro a un multímetro, ya que no existe diferencia significativa entre ambos métodos; además, las respuestas para ambos instrumentos de medida son rápidas. Para todos los casos como el multímetro no tiene la misma calibración que el potenciómetro las gráficas obtenidas son las mismas que para el potenciómetro, pero con un desfase de alrededor de 20 unidades, que al sumárselas, dan las mismas gráficas que el potenciómetro. Para el caso de tres metodologías (redox, complejos y valoración de halogenuros) los mismos electrodos que se utilizan en potenciometría, son utilizados en las valoraciones con multímetro. Para el caso de las valoraciones ácido base, se puede utilizar también el electrodo de vidrio combinado usual, pero por su elevada resistencia, la estabilización de las lecturas se hace muy lenta, para lo que se sustituyó dicho electrodo por un electrodo Posai-Posai (Pérez, S.J. de J., Rincón, A.S., C., Tenorio, M.H, 2013) la posible instrumentación de esta metodología en los laboratorios de docencia, mejoraría el equipamiento de dichos laboratorios (por el precio de un potenciómetro se pueden adquirir 9 multímetros). Logrando con esto que ningún estudiante quede sin equipo de medida, y consecuentemente se logre el objetivo pretendido para el trabajo de laboratorio de los estudiantes del área de química, que es refrendar, con el trabajo de laboratorio, su vocación de estudiantes de una carrera licenciatura teórico-práctica.