Introducción
El Si es un nutrimento no esencial para las plantas, se caracteriza por ser el segundo elemento de mayor abundancia y disperso en la corteza terrestre, superado por el oxgeno (Quero 2008, Seron 2004). El Si representa entre 0,1% y 10% del peso seco de las plantas superiores, por lo que se encuentra en mayor porción en monocotiledóneas que en dicotiledóneas (Epstein 1999, Aguirre et al. 2007). Este nutrimento puede llegar a concentrarse en las plantas en cantidades superiores a Ca, Mg, P, y K, principalmente en Poaceae (Epstein 1999 y Ahmed et al. 2012). El Si se absorbe de manera energéticamente pasiva de la solución del suelo en forma de ácido monosilícico y es depositado en la pared celular en forma de polímero hidratado o sílice amorfo (Ma y Yamaji 2006, Carneiro et al. 2010 citado por Lobo 2013), que se impregnan en una fina capa de 2,5 μm (Epstein 1999, Pilon et al. 2013). Esta forma es ligeramente soluble en las hojas y corteza, lo cual convierte el ácido silícico en sílice coloidal y, posteriormente, en gel de sílice (“Opalo o fitólitos” SiO2-nH2O), mediante un proceso de polimeración o policondensación (Savant et al. 1997 y Da Costa et al. 2005, Barros et al. 2010).
El Ca es un catión divalente esencial para el desarrollo de las plantas superiores que se caracteriza por estar presente en rocas sedimentarias que emergieron de los levantamientos de los pisos marinos de la corteza terrestre (Hardy 1970, Buol 2003, Jaramillo 2011). Se encuentra entre un 0,1 y 5% del peso seco de las plantas superiores, con una movilidad limitada en las células (Marschner y Marschner 2012). Este nutrimento se absorbe en forma pasiva, por lo que es transportado por la corriente transpiratoria de la planta hacia las células del tallo y hojas (Nath 2015). Posee un papel importante en la estructura de la planta, debido a que da estabilidad en la pared celular, promueve formación de pectatos y oxalatos, participa en la división celular, en regulación estomática, en procesos enzimáticos y hormonales, entre otros (Benton 1997, Mengel et al. 2001, Taiz y Zeiger 2006).
El Si y Ca se encuentran involucrados en la tolerancia al estrés producido por problemas bióticos. Estudios realizados con Si evidenciaron su importancia en la activación de genes que proveen la producción de enzimas, que son correlacionadas con los mecanismos de defensa de las plantas (Chérif et al. 1994, Bélanger et al. 1995, Fawe 1998 citado por Tsai et al. 2004, Liang et al. 2015). Por otro lado, tanto en Si y Ca se acumulan en la pared celular, aspecto que previene el ingreso de haustorios en las células (Datnoff et al. 2007, Ma y Yamaji 2006). Al estar fortalecida la pared celular, la segregación de enzimas liberadas por los hongos tampoco dañan la pared (Fauteux et al. 2005), lo cual evita el ingreso del patógeno y dificulta el proceso de infección en las plantas (Epstein 1999, Arauz 2011, Anderson 2012).
La fertilización foliar es una herramienta utilizada en la actualidad para suplir nutrimentos complementarios a los requerimientos en la nutrición de las plantas. La absorción foliar de nutrimentos se realiza por diversos mecanismos en los tejidos, lo cual inicia la penetración a través de la capa cerosa de la cutícula en forma de difusión pasiva (Marschner y Marschner 2012, Nath 2015). Luego, estos son guiados hacia unas prolongaciones llamadas ectositodos, que conectan la parte externa de la cutícula hasta las paredes primarias celulares (matriz). Posteriormente, los nutrimentos son depositados sobre la pared celular y movidos mediante una ruta apoplástica hacia otras paredes celulares vecinas (Mengel et al. 2001, Taiz y Zeiger 2006). La velocidad de absorción de los diferentes nutrimentos varía según el intercambio catiónico y la valencia del ión aplicados en la hoja, los iones monovalentes penetran con mayor facilidad que los iones de mayores valencias (Trinidad y Aguilar 1999).
Los viveros de palma aceitera generalmente son afectados por enfermedades foliares, que reducen el crecimiento y el vigor de las plantas entre un 10 - 20% (Ulloa y Ramírez 2011, Ulloa y Serrano 2012). Investigaciones realizadas por Turner y Bull (1967), Renard y Quillec (1979), Turner (1981) citados en Ulloa y Serrano (2012), reportaron la presencia de agentes causales que provocan lesiones importantes en las láminas foliares en vivero, entre estos se encuentran: Botryodiplodia sp., Melanconium sp., Colletotrichum sp. [Glomerella sp.] y Curvularia sp. Investigaciones en Costa Rica encontraron Colletotrichum gloeosporioides, que afecta láminas foliares (Ortiz y Fernández 2000). Sin embargo, las agentes causales de enfermedades reportadas en vivero pueden ser ocasionales según el crecimiento de la planta, condiciones climatológicas y manejo.
El objetivo de esta investigación fue evaluar el efecto de distintas fuentes de Si y Ca rociados en hojas para evaluar el crecimiento y severidad de Complejo Necrosis Foliar en viveros de palma aceitera.
Materiales y métodos
La investigación se llevó cabo en los viveros de la Compañía Palma Tica S.A., ubicada en Coto 47 en el cantón de Corredores en Puntarenas, Costa Rica. Esta zona se encuentra en la llanura aluvial de Coto-Corredores, con una elevación aproximada entre 24 - 30 msnm. La precipitación promedio anual registrada varía entre 3800 - 4500 mm. Se procedió a medir las condiciones climatológicas durante el periodo de evaluación, que comprendió de julio de 2014 a marzo 2015, se registró una precipitación total 2051 mm. La temperatura promedio durante el periodo fue Max: 36,4oC y Min: 26,5 oC, con una humedad relativa promedio de 87,4% y una radiación solar promedio de 377,2 Wat.m-2.
Se ubicó una zona de vivero donde fue frecuente la presencia de enfermedades foliares, homogénea entre sus dimensiones con un área de 4752 m2. Se utilizaron 3480 bolsas con suelo aluvial Inceptisol, las cuales se utilizan comúnmente en vivero, cada una contenía 20 L de suelo. Las bolsas fueron distribuidas en campo, de manera que en los boquetes presentaran filas de 30 plantas, posteriormente, se etiquetaron con números continuos (1 - 1080) y se dejaron 2 filas (plantas bordes) entre las etiquetadas. Las bolsas estuvieron 60 días en reposo mientras crecían las plantas de etapa de pre-vivero.
Se utilizaron fertilizantes foliares con concentraciones superiores a 9% de Si y 7% de Ca que fueran soluciones concentradas para mejorar su solubilidad y evitar obstaculizar las boquillas de aplicación. Se seleccionaron 4 fuentes foliares de Ca, 3 fuentes de Si y una fuente de Ca con fitoalexinas (Cuadro 1).
Cuadro 1 Características químicas de fertilizantes foliares con Ca y Si asperjados en vivero de E. guineensis en la región Coto, Costa Rica.
| Productos | % p/v | ||||||||
| CaO | N | SiO2 | K2O | B | MgO | S | Cu | P2O5 | |
| Cal56 | 56,0 | 6,9 | - | - | - | - | - | - | - |
| Supa Cobre | 30,6 | - | - | - | - | - | - | 5,6 | - |
| Polisulfuro de calcio | 7,5 | - | - | - | - | - | 15,0 | - | - |
| Calcimax | 14,3 | - | - | - | 0,64 | - | - | - | - |
| Sifol Plus | 2,5 | - | 20,0 | 9,0 | - | - | - | 1,3 | 18,0 |
| Firmeza KCS | 9,8 | 1,8 | 11,0 | 6,0 | - | - | 4,1 | - | - |
| Stan SKH | - | - | 20,0 | 18,0 | - | - | - | - | - |
| Alexin | 4,3 | - | - | 10,1 | 0,25 | 1,68 | - | - | - |
Antes de la siembra se aplicó una dosis de herbicida para eliminar la maleza presente en el área de vivero y las bolsas, con el fin de aligerar la siembra de las plantas. Asimismo, se realizó un análisis químico para determinar el estado nutricional del suelo en las bolsas (Cuadro 2) y 2 semanas después se sembraron plántulas de E. guineensis de la variedad Compacta x Gana, que fueron sembradas en Jiffi en la etapa de pre-vivero, donde pasaron 2 meses de establecimiento bajo condiciones controladas.
Cuadro 2 Contenido de nutrimentos de suelo en bolsa utilizado para prueba foliar en etapa de vivero de palma aceitera.
| ID+ Mehlich 3 | pH H2O | cmol(+).l-1 | % SA | m.l-1 | |||||||||
| Acidez (KCl) | Ca | Mg | K | CICE | P | Zn | Cu | Fe | Mn | Si* | |||
| NC | 5,5 | 0,5 | 4,0 | 1,1 | 0,2 | 5,0 | 15 | 1,7 | 0,4 | 10 | 4 | 200 | |
| Suelo inicio | 6,38 | 0,34 | 36,0 | 4,11 | 0,49 | 40,9 | 0,83 | 18,7 | 2,44 | 16,3 | 314 | 35 | 176 |
+Solución extractora Mehlich 3, laboratorio suelos y foliares Palma Tica S.A.; NC = nivel crítico para Inceptisoles según Cabalceta y Molina (2006). CICE = Capacidad de intercambio de Cationes Efectiva = Acidez + Ca + Mg + K. *.Metodología de extracción con ácido acético según Lobo (2013).
Se realizó el mismo manejo agronómico utilizado para viveros, con excepción de la nutrición y el control de enfermedades foliares. La fórmula que se utilizó en vivero corresponde a 15,50 - 9,76 - 15,50 - 4,00 - 3,20(S) - 0,30(B), constituidas por las fuentes de nitrato de amonio (NAM), Microessentials (SZ), cloruro de potasio (KCl), kiesierita y granubor. Esta fórmula se calculó según los requisitos determinados mediante la curva de absorción propuesta por Ramírez y Muñoz (2010). La fertilización se aplicó cada 15 días de forma granular en el área superficial de la bolsa, distanciados del bulbo para no producir pérdida de agua en la planta por difusión.
Posteriormente, se procedió a calcular una dosis estándar dentro del rango de las recomendaciones pre-establecidas para los productos y que fue ajustada al plan de aspersión definido en el vivero de la Compañía Palma Tica S.A. en conjunto con el crecimiento de las plantas. Las aspersiones se realizaron de la siguiente manera: entre los 85 y 135 días después de sembrado (dds) aplicaron 0,6 l.ha-1 de cada producto, de 150 y 200 dds 1,05 l.ha-1 y a partir de los 215 dds hasta terminar la etapa de vivero 1,5 l.ha-1 (Cuadro 3). Estas aplicaciones se realizaron continuamente cada 15 días desde la primera semana de siembra en vivero.
Cuadro 3 Dosis utilizadas de fertilizantes foliares con Si y Ca en vivero de palma aceitera.
| n | Producto comercial | Tratamiento | 85 - 135 dds | 150 - 200 dds | ≥ 215 dds |
| -------------------------- l.ha-1 -------------------------- | |||||
| 1 | Testigo | Test | --- | --- | --- |
| 2 | Cal 56® | Ca56 | 0,6 | 1,05 | 1,5 |
| 3 | Supa Cobre® | SupCu | 0,6 | 1,05 | 1,5 |
| 4 | Polisulfuro de Ca® | PolCal | 0,6 | 1,05 | 1,5 |
| 5 | Calcimax® | Calmax | 0,6 | 1,05 | 1,5 |
| 6 | Sifol Plus® | Sifol | 0,6 | 1,05 | 1,5 |
| 7 | Alexin® | Alexi | 0,6 | 1,05 | 1 |
| 8 | Stan SKH® | Stan | 0,6 | 1,05 | 1,5 |
| 9 | Firmeza® | Firmez | 0,6 | 1,05 | 1,5 |
dds: días después de siembra.
Se realizó la calibración del equipo previo a cada aspersión, de manera que el caldo de aplicación fuera suficiente para humedecer homogéneamente toda la superficie foliar. Se utilizó una bomba de espalda con comprensor de batería modelo “Battery sprayer KB-16E-8”, de 1,8 - 2,2 amperios y 3 bares de presión en trabajo. Para la calibración del equipo, se aplicó un volumen de agua sobre 4 filas bordes y se midió el remanente para obtener la cantidad total de agua de aplicación. Posteriormente, fueron asperjadas las filas con las dosis correspondientes a cada tratamiento.
Variables evaluadas
Se utilizaron profundidades de 0 - 15 cm y de 15 - 30 cm en los suelos en 2 fechas distintas, a los 130 dds y 300 dds, en bolsas para el análisis general del experimento. Se determinaron los contenidos de Acidez intercambiable con KCl y Al intercambiable por retitulación con HCl al 0,01 M, pH, Ca, Mg, K, P, Fe, Zn, Mn y Cu, mediante la solución extractora Mehlich III y Si, a través de la extracción con ácido acético según la metodología de Lobo (2013). Para las hojas lanceoladas y bifurcadas se recolectó el total de la hoja 1 en los muestreos realizados a los 175 y 220 dds. Para la hoja 1 expandidas (con separaciones entre los folios) se recolectaron 2 folios a cada lado según la metodología de Rodríguez y Jiménez (2013), recolectados a los 265 y 300 dds. Las muestras foliares se recolectaron 8 días después de la aspersión foliar, se extrajeron las venas de las hojas y se secaron a 60ºC durante 3 días. Posteriormente, fueron enviadas al laboratorio de Suelos y Foliares de la Compañía Palma Tica S. A., donde se realizaron pruebas de presencia de Si mediante la metodología de (Lobo 2013), N por combustión seca, P, K, Ca, Mg, S, Fe, Zn, Mn, Cu, a través de la digestión húmeda con HNO3 y determinación por espectrometría de Emisión atómica con Plasma (ICP).
Se realizaron mediciones de crecimiento morfológico de la planta según la metodología de Ramírez y Muñoz (2010). Se determinó el largo de raquis en cm a partir de la base de la hoja 1 hasta el meristemo apical. Se midió el diámetro de bulbo que se encuentra en la base de la palma, con un vernier en cm. Por último, se contaron las hojas totales emitidas por las plantas en un periodo de tiempo determinado.
La evaluación del Complejo de Necrosis Foliar (CNF) se realizó mediante una escala visual (medida que se desarrolla con la vista humana, método aclarado en el párrafo) representada por 5 grados de severidad en las plantas. Los grados se fundamentaron de la siguiente manera: 1 = representó el 3% de la hoja o planta dañada, 2 = 7%, 3 = 15%, 4 = 40%, 5 = 75%. Estas se realizaron para la hoja 1 y para la planta total, de manera que esta última cuantificara la severidad en fechas anteriores. Las evaluaciones de CNF se cuantificaron en conjunto con las mediciones morfológicas a los 85, 130, 175, 220, 265 y 300 dds.
Diseño experimental
El experimento fue constituido por 9 tratamientos y 4 repeticiones con un diseño experimental de Bloques Completos al Azar. Los bloques fueron ubicados en un sector céntrico, con historial de enfermedades foliares y sin problemas de topografía. Se prepararon 4 bloques, cada bloque fue representado por 870 plantas con un tamaño de 1096 m2, cada repetición tenía un total de 30 plantas.
Para el análisis de los datos morfológicos se realizaron índices de áreas bajo la curva (abc), para reunir la información de las variables en el tiempo según la metodología de Garbanzo et al. (2018). Posteriormente, los datos fueron sometidos a un análisis de varianza, se calcularon las diferencias estadísticas mediante pruebas de Dunnett test (α = 0,05) para los datos morfológicos, Kruskal Wallis (α = 0,05) para las variables no paramétricas y para los análisis químicos LSD (α = 0,05). Los cálculos fueron realizados por medio del programa estadístico Rstudio versión 0.98.1102.
Resultados
Las aplicaciones de fuentes de Ca y Si foliar no mostraron un efecto significativo en la tolerancia al Complejo de Necrosis Foliar (CNF) a través del tiempo (Cuadro 4). Al analizar el índice de área bajo la curva, el Supcu mostró una tolerancia altamente significativa (p<0,001) en la hoja 1 (808,6) en comparación al testigo (1017,3), este mismo comportamiento mostró tendencias en la severidad de las hojas totales, mientras que Alexi (1269,7) y Cal56 (1230,1) mostraron la mayor severidad con significancia en comparación al modelo de referencia. Se encontró un mayor crecimiento significativo (p=0,001) en el largo de raquis en el Sifol (3290,2) en comparación al referente (3018,4). Este mismo tratamiento mostró un mayor diámetro de bulbo (647,9) que el prototipo base (606,8), mientras que los demás fertilizantes foliares no mostraron diferencias. El PolCal mostró un mayor número de hojas totales (1375,1) notable en referencia al testigo (1312,8). Por último, el índice calculado para el largo de la hoja reveló una diferencia relevante cuando se aplicó el Firmez (803,0) en comparación al testigo (763,4).
Cuadro 4 Índice de área bajo la curva en crecimientos morfológico y severidad de Complejo de Necrosis Foliar en plantas de palma aceitera, tratadas con distintas fuentes de Si y Ca foliar en fase de vivero.
| Tratamientos | Severidad Hoja 1 | Severidad Total | Largo raquis | Hojas totales | Diámetro bulbo | Largo Hoja |
|---|---|---|---|---|---|---|
| -------------------------- Índices de áreas bajo la curva-------------------------- | ||||||
| Alexi | 1269,7 | 1854,6 | 2889,4 | 1284,2 | 581,7 | 767,1 |
| Ca56 | 1230,1 | 1979,3 | 2963,8 | 1360,7 | 608,5 | 780,9 |
| Calmax | 1151,6 | 1829,4 | 2975,6 | 1338,7 | 597,8 | 741,3 |
| Firmez | 1141,4 | 1803,6 | 2987,5 | 1294,6 | 606,0 | 803,4 |
| PolCal | 1176,9 | 1821,8 | 2950,6 | 1375,1 | 613,5 | 761,7 |
| Sifol | 1125,9 | 1776,2 | 3290,2 | 1359,1 | 647,9 | 780,9 |
| Stan | 1204,6 | 1921,7 | 2984,2 | 1332,0 | 596,2 | 792,1 |
| SupCu | 808,6 | 1633,5 | 3033,1 | 1333,3 | 605,2 | 760,8 |
| Test | 1017,3 | 1818,2 | 3018,4 | 1312,8 | 606,8 | 763,4 |
| Comparaciones | ------------------------------ Dunnett test Pr(>|t|) --------------------------- | |||||
| Alexi - test | <0,001 | 1,00 | 0,180 | 0,411 | 0,026 | 1,00 |
| Ca56 - test | <0,001 | 0,07 | 0,932 | 0,032 | 1,00 | 1,00 |
| Calmax - test | 0,066 | 1,00 | 0,982 | 0,521 | 0,869 | 0,449 |
| Firmez - test | 0,078 | 1,00 | 0,998 | 0,848 | 1,000 | 0,022 |
| PolCal - test | 0,014 | 1,00 | 0,819 | 0,001 | 0,969 | 1,00 |
| Sifol - test | 0,410 | 0,989 | <0,001 | 0,041 | <0,001 | 0,698 |
| Stan - test | 0,002 | 0,673 | 0,996 | 0,814 | 0,756 | 0,185 |
| SupCu - test | <0,001 | 0,07 | 1,00 | 0,750 | 1,00 | 1,00 |
n = 36288; Variables morfológicas y severidad evaluados a los 85, 127, 176, 219, 261, 304 días después de siembra. Probabilidades por debajo de 5% (Pr (>|t|) <0,05) representan diferencias significativas de tratamientos en comparación al testigo.
Las fuentes de Si y Ca foliar mostraron tolerancia significativa en la severidad de CNF de la hoja 1 hasta los 220 dds (Figura 1). Al evaluar el comportamiento del porcentaje de severidad en la hoja 1, el SupCu mostró tolerancia importante (α<0,05) a CNF y mantiene un efecto desde los 220 dds hasta los 304 dds. Sin embargo, en el Calcimax a los 219 no se diferencia del SupCu y los demás fertilizantes foliares. Al analizar la severidad del CNF a los 304 dds al igual que el SupCu, el Firmez mostraron mayor tolerancia a enfermedades foliares y difieren estadísticamente del resto de los tratamientos.
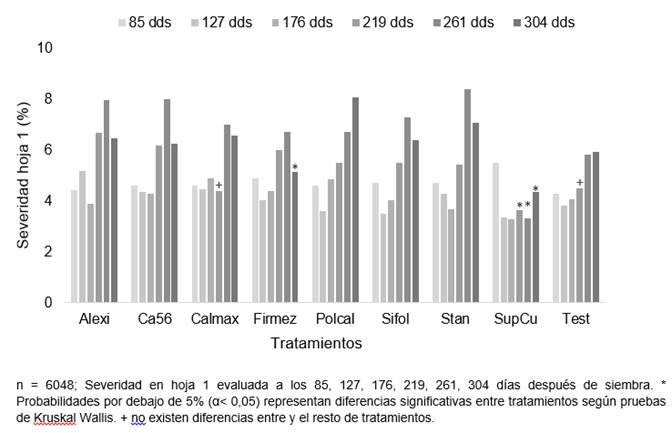
Figura 1 Severidad del Complejo de Necrosis Foliar en la hoja 1 en plantas de palma aceitera entre los 85 y 304 dds, tratadas con distintas fuentes de Si y Ca foliar en fase de vivero.
Al evaluar la severidad de CNF en las hojas totales se encontró un aumento en la tolerancia a los 261 dds (Figura 2). Las plantas lograron una tolerancia significativa en el SupCu a los 261 dds y con diferencias representativas con respecto al resto de los tratamientos. Este efecto se mantuvo en el SupCu hasta los 304 dds, sin embargo, no varió estadísticamente de Sifol y Firmez. Los demás fertilizantes foliares no mostraron diferencias notables en relación con el testigo en las distintas fechas de evaluación.
Las plantas mostraron un mayor crecimiento en el diámetro de bulbo cuando se aplicaron fuentes de Si y Ca foliar a partir de los 127 dds (Figura 3). El efecto solo se logró de forma destacada en el Sifol a partir de los 127 dds y se mantuvo hasta los 261 dds. Sin embargo, el PolCal no se diferenció estadísticamente del Sifol a los 127 dds y de Firmez y SupCu a los 176 dds. Los demás tratamientos no mostraron diferencias mínimas significativas entre ellos y las fechas de evaluación.
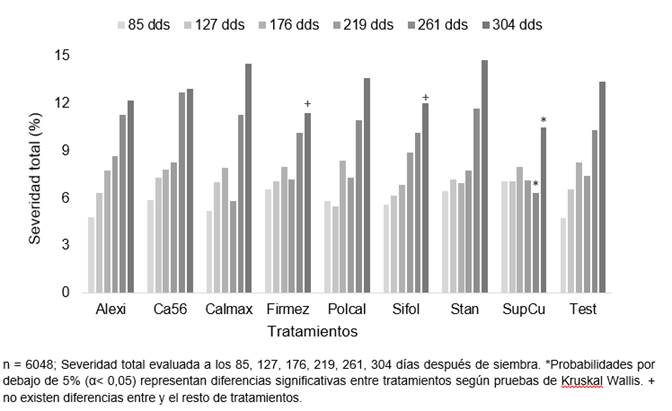
Figura 2 Severidad de Complejo de Necrosis Foliar en las hojas totales en plantas de palma aceitera entre los 85 y 304 dds, tratadas con distintas fuentes de Si y Ca foliar en fase de vivero.
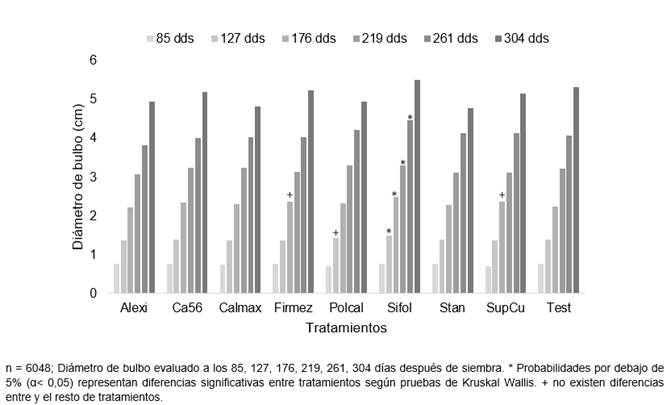
Figura 3 Diámetro de bulbo en plantas de palma aceitera entre los 85 y 304 dds, tratadas con distintas fuentes de Si y Ca foliar en fase de vivero.
No hubo diferencias significativas en la concentración de macronutrimentos en la hoja 1 de las plántulas con la aplicación de fertilizantes foliares (Cuadro 5). Para N, varió entre 3,25 % y 3,92% a los 175 y 310 dds y no mostró diferencia estadística (α< 0,05) entre los tratamientos. El P varió entre 0,20 % y 0,26% en todas las fechas de muestreo. Para K en plantas, no mostró diferencias significativas entre los fertilizantes foliares, con una variación entre 1,23 y 1,65%. El contenido de Ca no mostró diferencias estadísticas, sin embargo, el SupCu mostró una tendencia de mayor concentración en la última fecha. El Ca en las plantas de vivero varió entre un 0,79 y 1,06% en la hoja 1. El Mg en la planta fue mayor a los 175 dds, no obstante, después de los 265 dds, la concentración de Mg no mostró diferencia, por lo que osciló entre 0,25 y 0,35%. La concentración de S se encontró entre 0,23 y 0,31%, donde no mostró diferencias estadísticamente significativas a los 175 y 265 dds, sin embargo, a los 310 dds mostró tendencia de mayor concentración en SupCU (0,31), por lo que se encontraron diferencias estadísticas en comparación al Calmax (0,27%).
Cuadro 5 Efecto de las fuentes de Si y Ca foliar en la concentración de N, P, K, Ca, Mg y S en hoja 1 de palma aceitera.
| Tratamientos | N | P | K | Ca | Mg | S |
|---|---|---|---|---|---|---|
| --------------------------------------- % --------------------------------------------- | ||||||
| -------------------------------------- 175 dds -------------------------------------- | ||||||
| Alexi | 3,49 a* | 0,25 a | 1,59 a | 1,06 a | 0,33 ab | 0,31 a |
| Ca56 | 3,49 a | 0,25 a | 1,57 a | 0,97 a | 0,31 b | 0,28 a |
| Calmax | 3,41 a | 0,26 a | 1,55 a | 1,03 a | 0,31 b | 0,29 a |
| Firmez | 3,25 a | 0,25 a | 1,54 a | 0,98 a | 0,31 b | 0,28 a |
| PolCal | 3,45 a | 0,25 a | 1,56 a | 1,00 a | 0,31 b | 0,27 a |
| Sifol | 3,48 a | 0,25 a | 1,54 a | 1,01 a | 0,32 b | 0,28 a |
| Stan | 3,28 a | 0,25 a | 1,65 a | 1,00 a | 0,32 b | 0,30 a |
| SupCu | 3,49 a | 0,26 a | 1,63 a | 1,00 a | 0,32 b | 0,29 a |
| Test | 3,35 a | 0,24 a | 1,45 a | 1,00 a | 0,35 a | 0,29 a |
| Adj r 2 | 0,48 | 0,38 | 0,40 | 0,28 | 0,64 | 0,42 |
| -------------------------------------- 220 dds -------------------------------------- | ||||||
| Alexi | 3,84 a | 0,20 c | 1,30 a | 0,91 abc | 0,26 ab | 0,27 ab |
| Ca56 | 3,75 a | 0,20 bc | 1,23 a | 0,87 bc | 0,25 b | 0,23 ab |
| Calmax | 3,92 a | 0,20 c | 1,27 a | 0,90 abc | 0,25 ab | 0,27 ab |
| Firmez | 3,82 a | 0,22 a | 1,29 a | 0,89 abc | 0,26 ab | 0,29 a |
| PolCal | 3,81 a | 0,21 bc | 1,31 a | 0,84 c | 0,25 b | 0,25 bc |
| Sifol | 3,82 a | 0,19 c | 1,25 a | 0,98 a | 0,27 ab | 0,28 ab |
| Stan | 3,64 a | 0,19 c | 1,37 a | 0,88 abc | 0,26 ab | 0,27 ab |
| SupCu | 3,73 a | 0,20 bc | 1,36 a | 0,97 ab | 0,28 a | 0,25 bc |
| Test | 3,60 a | 0,22 ab | 1,31 a | 0,94 abc | 0,27 ab | 0,29 a |
| Adj r 2 | 0,60 | 0,78 | 0,71 | 0,75 | 0,74 | 0,01 |
| -------------------------------------- 265 dds -------------------------------------- | ||||||
| Alexi | 3,36 a | 0,22 a | 1,58 a | 0,86 a | 0,25 a | 0,26 a |
| Ca56 | 3,49 a | 0,23 a | 1,57 a | 0,93 a | 0,27 a | 0,28 a |
| Calmax | 3,26 a | 0,22 a | 1,58 a | 0,90 a | 0,26 a | 0,27 a |
| Firmez | 3,38 a | 0,22 a | 1,48 a | 0,91 a | 0,26 a | 0,27 a |
| PolCal | 3,33 a | 0,23 a | 1,62 a | 0,85 a | 0,25 a | 0,27 a |
| Sifol | 3,29 a | 0,23 a | 1,63 a | 0,87 a | 0,25 a | 0,27 a |
| Stan | 3,42 a | 0,22 a | 1,58 a | 0,87 a | 0,25 a | 0,25 a |
| SupCu | 3,54 a | 0,22 a | 1,54 a | 0,90 a | 0,26 a | 0,27 a |
| Test | 3,50 a | 0,22 a | 1,59 a | 0,84 a | 0,25 a | 0,27 a |
| Adj r 2 | 0,47 | 0,42 | 0,28 | 0,24 | 0,33 | 0,45 |
| -------------------------------------- 310 dds -------------------------------------- | ||||||
| Alexi | 3,62 a | 0,21 a | 1,46 a | 0,91 a | 0,27 a | 0,29 ab |
| Ca56 | 3,43 a | 0,22 a | 1,62 a | 0,79 a | 0,25 a | 0,28 ab |
| Calmax | 3,41 a | 0,21 a | 1,53 a | 0,79 a | 0,25 a | 0,27 b |
| Firmez | 3,48 a | 0,22 a | 1,62 a | 0,83 a | 0,27 a | 0,30 ab |
| PolCal | 3,46 a | 0,22 a | 1,60 a | 0,79 a | 0,24 a | 0,28 ab |
| Sifol | 3,39 a | 0,21 a | 1,53 a | 0,80 a | 0,25 a | 0,27 ab |
| Stan | 3,42 a | 0,21 a | 1,51 a | 0,83 a | 0,25 a | 0,29 ab |
| SupCu | 3,67 a | 0,22 a | 1,49 a | 0,92 a | 0,29 a | 0,31 a |
| Test | 3,37 a | 0,21 a | 1,56 a | 0,85 a | 0,27 a | 0,30 ab |
| Adj r 2 | 0,47 | 0,50 | 0,36 | 0,36 | 0,48 | 0,64 |
n = 864; Severidad en hoja 1 evaluada a los 85, 127, 176, 219, 261, 304 días después de siembra. * Letras distintas denotan diferencia significativa de acuerdo con prueba LSD Test (p.adj= bonferroni, α<0,05) del modelo lineal (LM).
El contenido foliar de Si en la hoja 1 en las palmas, no aumentó con las aplicaciones foliares sin embargo, aumentó el contenido de Cu y B en algunas fuentes (Cuadro 6). Al evaluar la concentración de Si foliar a los 175, 220, 265 y 310 dds no se encontró una diferencia significativa (α<0,05) entre los tratamientos, pero mostró tendencias de mayor acumulación en Alexi (0,94 mg.kg-1) y SupCu (1 mg.kg-1) a los 310 dds. Las concentraciones de Cu en las plantas mostraron diferencias mínimas significativas en todas las fechas de muestreo; se encontró más contenido en SupCu (32,1 - 52,9 mg.kg-1) y Sifol (16,3 - 26,1 mg.kg-1) en comparación con el resto de los fertilizantes foliares (8,9 - 12,7 mg.kg-1).
Cuadro 6 Efecto de la aplicación foliar de fuentes de Si y Ca en la concentración de Si, Al, Fe, Cu, Zn, Mn y B en hoja 1 de palma aceitera.
| Tratamientos | Si | Al | Fe | Cu | Zn | Mn | B |
| % | ---------------------------------- mg.kg-1 ------------------------------------- | ||||||
| ----------------------------------------- 175 dds ----------------------------------------- | |||||||
| Alexi | 1,13 a | 180,36 a | 213,59 a | 11,44 c | 16,71 a | 126,61 a | 19,93 b |
| Ca56 | 0,90 a | 219,63 a | 230,26 a | 11,94 c | 18,83 a | 109,29 a | 17,31 ab |
| Calmax | 0,96 a | 164,84 a | 193,22 a | 11,50 c | 17,47 a | 117,88 a | 16,69 ab |
| Firmez | 1,17 a | 248,72 a | 252,03 a | 12,75 c | 17,33 a | 101,37 a | 15,92 ab |
| PolCal | 1,00 a | 150,63 a | 177,79 a | 12,15 c | 17,07 a | 108,11 a | 14,80 ab |
| Sifol | 0,96 a | 175,96 a | 213,10 a | 26,07 b | 16,72 a | 111,33 a | 17,46 ab |
| Stan | 1,04 a | 251,98 a | 261,21 a | 12,28 c | 16,67 a | 114,49 a | 19,94 b |
| SupCu | 0,94 a | 181,01 a | 190,89 a | 51,71 a | 19,02 a | 105,12 a | 18,09 ab |
| Test | 1,22 a | 191,99 a | 227,78 a | 9,38 c | 15,84 a | 132,40 a | 13,28 a |
| Adj r 2 | 0,57 | 0,49 | 0,53 | 0,99 | 0,52 | 0,59 | 0,56 |
| -------------------------------------- 220 dds -------------------------------------- | |||||||
| Alexi | 0,97 b | 31,97 a | 92,75 a | 9,82 c | 14,80 bc | 112,56 a | 24,48 b |
| Ca56 | 1,03 ab | 35,05 a | 95,83 a | 10,52 c | 16,88 abc | 111,32 a | 22,31 b |
| Calmax | 1,05 ab | 52,01 a | 109,78 a | 9,90 c | 15,34 bc | 115,05 a | 23,76 b |
| Firmez | 1,13 ab | 43,16 a | 105,74 a | 11,07 c | 18,53 a | 109,15 a | 24,25 b |
| PolCal | 1,00 b | 27,42 a | 87,44 a | 10,65 c | 15,73 abc | 107,25 a | 22,21 b |
| Sifol | 1,15 ab | 47,51 a | 108,83 a | 22,41 b | 15,26 bc | 135,86 a | 26,70 ab |
| Stan | 1,04 ab | 39,34 a | 94,66 a | 10,06 c | 14,32 c | 112,97 a | 21,84 b |
| SupCu | 1,07 ab | 30,95 a | 97,81 a | 52,90 a | 16,76 abc | 118,35 a | 26,22 ab |
| Test | 1,26 a | 33,08 a | 98,92 a | 10,16 c | 17,40 ab | 129,89 a | 30,84 a |
| Adj r 2 | 0,54 | 0,55 | 0,90 | 0,80 | 0,44 | 0,64 | 0,59 |
| -------------------------------------- 265 dds -------------------------------------- | |||||||
| Alexi | 0,76 a | 22,26 a | 75,80 a | 10,38 b | 16,35 a | 99,63 a | 25,22 b |
| Ca56 | 0,81 a | 24,63 a | 72,87 a | 11,01 b | 16,85 a | 109,68 a | 27,09 b |
| Calmax | 0,82 a | 22,80 a | 70,68 a | 10,86 b | 17,16 a | 103,92 a | 26,51 b |
| Firmez | 0,83 a | 25,48 a | 76,84 a | 10,98 b | 17,48 a | 99,18 a | 24,50 b |
| PolCal | 0,76 a | 19,48 a | 66,69 a | 11,42 b | 17,90 a | 96,42 a | 23,83 b |
| Sifol | 0,80 a | 28,97 a | 77,92 a | 16,28 b | 16,97 a | 106,33 a | 24,94 b |
| Stan | 0,85 a | 23,46 a | 72,72 a | 10,97 b | 16,33 a | 104,20 a | 25,93 b |
| SupCu | 0,82 a | 29,85 a | 79,12 a | 50,54 a | 18,40 a | 113,54 a | 27,90 b |
| Test | 0,80 a | 19,94 a | 70,80 a | 10,88 b | 17,01 a | 106,85 a | 40,78 a |
| Adj r 2 | 0,13 | 0,30 | 0,37 | 0,91 | 0,30 | 0,26 | 0,69 |
| -------------------------------------- 310 dds -------------------------------------- | |||||||
| Alexi | 0,94 a | 43,67 a | 99,01 a | 8,92 a | 18,59 a | 125,94 a | 47,17 ab |
| Ca56 | 0,79 a | 38,05 a | 86,05 a | 9,55 a | 17,11 a | 106,09 a | 36,51 b |
| Calmax | 0,77 a | 36,66 a | 84,49 a | 8,98 a | 16,98 a | 102,85 a | 38,38 ab |
| Firmez | 0,82 a | 31,78 a | 87,12 a | 9,72 a | 16,94 a | 102,41 a | 37,45 ab |
| PolCal | 0,75 a | 41,11 a | 104,80 a | 9,55 a | 15,65 a | 100,91 a | 33,53 b |
| Sifol | 0,73 a | 34,93 a | 89,62 a | 22,08 b | 17,19 a | 105,47 a | 38,25 ab |
| Stan | 0,87 a | 33,60 a | 86,48 a | 9,35 a | 16,17 a | 108,70 a | 42,67 ab |
| SupCu | 1,00 a | 40,73 a | 95,65 a | 32,06 b | 18,95 a | 138,39 a | 50,50 ab |
| Test | 0,83 a | 42,89 a | 93,34 a | 9,16 a | 17,59 a | 116,44 a | 55,89 a |
| Adj r 2 | 0,37 | 0,53 | 0,42 | 0,82 | 0,56 | 0,48 | 0,61 |
n = 1008; Severidad en hoja 1 evaluada a los 85, 127, 176, 219, 261, 304 días después de siembra. *Letras distintas denotan diferencia significativa de acuerdo con prueba LSD Test (p.adj= bonferroni, α <0,05) del modelo lineal (LM).
Discusión
Las aplicaciones de Ca y Si foliar en palma aceitera no tuvieron efecto con la incidencia del Complejo de Necrosis Foliar en plantas de palma aceitera en vivero. Al analizar que el SupCu solo mostró una mayor tolerancia significativa en la hoja 1. La aplicación de estos nutrimentos en las hojas presentó poca penetración en la cutícula, comportamiento que concuerda con Fregoni (1986), Malavolta (1986), Trinidad y Aguilar (1999), quienes encontraron que aplicaciones de fuentes de Ca foliar penetraron solo un 50% en la cutícula después de 96 horas, la cual es muy baja en comparación a N, K, Zn, Na y Cl. Además, se sumaría el efecto de la forma de absorción de los nutrimentos, en particular de Si, el cual se absorbe como ácido ortosílisico en forma pasiva (Ma 2015, Datnoff et al. 2007, Marschner y Marschner 2012, Pilon et al. 2014), mientras que las fuentes foliares se mostraron en forma de óxidos de silicio soluble. Por otro lado, es probable que el efecto de las constantes precipitaciones en la zona lavó el producto, sobre todo en épocas lluviosas (agosto - diciembre) y también en verano (diciembre - abril) por el riego por aspersión que se utilizó en el vivero.
La concentración de Ca y Si en el suelo fue alta y probablemente afectó los resultados del análisis foliar para ambos nutrimentos. Debido al alto contenido de Ca y Si en el suelo, la planta tendría cantidades significativas disponibles, ya que muchos se absorben en su mayoría por el flujo de masas e intercepción desde el suelo y ambos son elementos no móviles (Lambers et al. 1998, Sposito 2008, Marafon y Endres 2013, Pilon et al. 2014, Ma 2015). Es probable que parte del Si disponible para las plantas a través del tiempo, (Zapata 2004, Quero 2008, Czeschlik 2005), haya sido liberado de las estructuras que poseen las arcillas (Alvarado 1985, Klein y Hurlbut 2003, Lizcano et al. 2006, Jaramillo 2011, Alvarado et al. 2014). Se presume que el Si y Ca se absorbiera muy poco, debido a su inmovilidad y que la hoja 1 presentó importante actividad fisiológica, lo cual le permitiría la acumulación del Si en particular por la corriente transpiratoria (Yoshida 1965, Ma y Yamaji 2006), lo que explicaría que la absorción de Si foliar no es significativa en relación con la absorción por las raíces.
Al analizar las concentraciones de los nutrimentos en las hojas, solo el Cu mostró relación con la severidad del CNF. Se identificó una relación inversamente proporcional, es decir, a mayor concentración de Cu, menor severidad de CNF en la hoja 1 y una tendencia de menor severidad en las hojas totales. Al igual que el SupCu, el Sifol también mostró una mayor acumulación de Cu en la lámina foliar. Esto se debe probablemente a que ambos productos presentan Cu en la solución, el SupCu tiene 5,6% (p v-1) de Cu, mientras que el Sifol posee un 1,3%. Las demás plantas no presentaron contenidos altos en las hojas, debido a que fueron obtenidos de los suelos de vivero (16,3 mg.l-1). Por su parte, el efecto del cobre sobre el control de las enfermedades está bien demostrado en otros cultivos (Albrigo y Timmer 1997, Datnoff et al. 2007, Behlay et al. 2009).
En relación con el crecimiento, el tratamiento Sifol mostró el mayor vigor de planta, cuando se analizó el diámetro de bulbo y largo de raquis al compararlo con el testigo. A diferencia del testigo y los demás fertilizantes foliares, este producto posee K y P, este último en forma de fosfitos, lo cual es muy probable que mejorara los balances nutricionales de la planta y en consecuencia mayor crecimiento, más aún cuando este nutrimento se encuentra involucrado en múltiples procesos fisiológicos y de energía en las plantas (Marschner y Marschner 2012, Marafon y Endres 2013, Salim et al. 2014). Es probable que al haber concentraciones altas de Cu, se optimizaran los balances nutricionales en la planta, lo cual mejora su crecimiento. Efectos similares encontraron Sidhu et al. (2001), donde aplicaciones de Cu foliar ayudaron en el crecimiento y vigor del vivero sembrado con suelo del orden Espodozol, aspecto que además coincide con el SupCu en algunas fechas durante la medición del diámetro de bulbo en comparación al Sifol. Es importante destacar que las concentraciones de muchos nutrimentos en la hoja 1 no mostraron diferencias significativas, sin embargo, al tener un vigor superior a los demás tratamientos, es muy probable que la acumulación de la mayoría de nutrimentos sea superior en Sifol y SupCu al resto de los fertilizantes foliares.
Conclusiones
La concentración de Si y Ca en la hoja 1 en vivero de palma aceitera no varió con la aplicación de las fuentes foliares y no presentaron ningún efecto en el control del Complejo de Necrosis Foliar. La aplicación de productos altos en Cu mostraron un aumento significativo en la tolerancia de CNF en vivero de palma aceitera. Las aplicaciones de productos de K y P en forma de fosfitos aumentaron el vigor de la planta en vivero, pero no tuvo efecto en la tolerancia a CNF.














