Introducción
El oomycete Phytophthora capsici Leonian vive como saprófito en el suelo y se considera un patógeno importante de muchos cultivos. Tiene una distribución mundial y es el agente causal de la enfermedad conocida como pudrición basal del tallo o maya en el chile dulce (Capsicum annuum L.) (Solís 1989, Corrales et ál. 1990, Hausbeck y Lamour 2004, Silvar et ál. 2005, Kim et ál. 2008, Perveen et ál. 2010, Zhang et ál. 2010).
La enfermedad se caracteriza por un marchitamiento repentino de la planta como consecuencia de la pudrición de las raíces y la base del tallo. El patógeno puede infectar la raíz, corona y partes foliares de muchos hospederos ya sea por efecto del salpique o la irrigación. Los síntomas se desarrollan rápidamente durante períodos de alta humedad del suelo, asociados con lluvias prolongadas o irrigación frecuente (Kim et ál. 1997, Hausbeck y Lamour 2004, Kim et ál. 2008, Yang et ál. 2012).
Los métodos de control no han sido del todo efectivos debido a la persistencia en el suelo de las oosporas de P. capcisi que son resistentes a la desecación, temperaturas frías y otras condiciones extremas, por lo que pueden sobrevivir por muchos años en la ausencia del hospedero (Hausbeck y Lamour 2004, Kim et ál. 2009, Yang et ál. 2012). Por otro lado, las opciones de control de la enfermedad por medio de agroquímicos pueden causar resistencia, fitotoxicidad y contaminación del ambiente por lo que es necesario desarrollar estrategias ambientalmente sostenibles para el control de la marchitez (Sang et ál. 2008, Ko et ál. 2009, Zhang et ál. 2010, Yang et ál. 2012).
Las rizobacterias promotoras de crecimiento (RPC) se han utilizado para promover el crecimiento y sanidad de cultivos como el chile, maíz, tomate, leguminosas y gramíneas. Las RPC habitan la rizósfera de las plantas y la integran un grupo variado de géneros como Pseudomonas, Burkholderia, Bacillus, Rhizobium, Azospirillum, Herbaspirillum, Enterobacter, Azotobacter, Lysobacter entre otros (Podile y Kishore 2006, Ko et ál. 2009, Kaymak 2011), estas bacterias pueden ser utilizadas como biofertilizantes y biocontroladores (Khalid et ál. 2004, Reyes et ál. 2008).
Las RPC contribuyen a la protección de la planta contra patógenos radicales y foliares por medio de antibiosis, competencia por espacio y nutrientes e inducción de resistencia sistémica. Algunas enzimas que degradan la pared celular están involucradas en la actividad antagonista contra fitopatógenos, así mismo la producción de sustancias como fitohormonas, antibióticos, compuestos orgánicos volátiles, fitoalexinas y sideróforos; otros mecanismos bacterianos señalados que contribuyen al biocontrol son la interferencia de señales de quorum sensing (QS), la inhibición en la formación de biopelículas y producción de toxinas por el patógeno (Howell y Stipanovic 1980, Shanahan et ál. 1992, Podile y Kishore 2006, Kim 2009, Ko et ál. 2009, Kaymak 2011, Bhattacharyya y Jha 2012, Singh y Singh 2013).
A su vez, estas bacterias pueden favorecer el crecimiento de la planta por medio de la fijación de nitrógeno, producción de sustancias reguladoras del crecimiento, solubilización de nutrientes, producción de sideróforos e incremento en el desarrollo de la raíz (Amorim y Melo 2002, Hernández et ál. 2004, Khalid et ál. 2004; Kloepper et ál. 2004, Podile y Kishore 2006, Reyes et ál. 2008, Bhattacharyya y Jha 2012, Singh y Singh 2013).
Una gran diversidad de microorganismos rizosféricos se han descrito, caracterizado y en muchos casos evaluado por su actividad para el control biológico contra patógenos del suelo (Sang et ál. 2008, Kim et ál. 2009, Ko et ál. 2009). Para el control de P. capcisi en chile, se han evaluado con éxito cepas de Pseudomonas sp. (Lee et ál. 2003, Rajkumar et ál. 2005, Sharma et ál. 2007, Sang y Kim 2012), Chryseobacterium sp. (Sang y Kim 2012, Yang et ál. 2012), Bacillus cereus (Yang et ál. 2012), Lysobacter antibioticus (Ko et ál. 2009), Paenibacillus polymyxa (Kim et ál. 2009) y Burkholderia cepacia (Ezziyyani et ál. 2004).
Sang y Kim (2012) encontraron que la inoculación con RPC afectó la actividad y estructura microbiana de la rizosfera de chile, efecto que pudo contribuir a la supresión de la marchitez observada con la inoculación de estas bacterias. Por su parte Yang et ál. (2012) reportaron que a partir de 1487 aislamientos bacterianos obtenidos de la rizosfera, filosfera, endorriza y endosfera de plantas de chile, 232 (15,6%) desplegaron actividad antagónica contra P. capcisi in vitro, de los cuáles, 92 aislamientos expresaron actividad proteolítica, 100 actividad celulolítica, 84 produjeron sideróforos y 4 mostraron actividad quitinolítica. De 16 bacterias elegidas por los autores, fueron eficaces 3 aislamientos (B. cereus B1301, B. cereus PX35 y Chryseobacterium sp. R98) que exhibieron la mayor capacidad para reducir la severidad de la enfermedad en un 83,5%, 83,5% y 92,3% respectivamente. Estos trabajos indican que existe potencial para la utilización de RPC en el control de esta enfermedad.
En Costa Rica no se ha estudiado el uso de estas bacterias en el control biológico de P. capcisi. El objetivo de este trabajo fue evaluar el antagonismo de Rizobacterias Promotoras de Crecimiento sobre P. capsici y su capacidad de reducción del marchitamiento en plantas de chile.
Materiales y métodos
Cepas bacterianas y aislamiento de P. capcisi
Se utilizaron 4 cepas bacterianas de la colección del Laboratorio de Microbiología Agrícola del Centro de Investigaciones Agronómicas previamente aisladas a partir de la rizósfera de caña y arroz. Las bacterias estuvieron almacenadas a -80°C en viales que contenían caldo nutritivo con glicerol al 20%.
Cada cepa bacteriana fue inoculada en placas de Petri con medio agar nutritivo y cultivada a 25°C durante 24 horas. Posteriormente colonias de cada bacteria se resuspendieron en un tubo con solución salina estéril al 0,85% hasta alcanzar una turbiedad igual al estándar 0,5 McFarland. Se determinó mediante recuento en plato la cantidad de bacterias presentes en la suspensión de cada una de las cepas utilizadas en los diferentes ensayos.
Se utilizó el oomycete Phytophthora capcisi de la colección del Laboratorio de Microbiología Agrícola del Centro de Investigaciones Agronómicas previamente aislado a partir de plantas de chile con síntomas de marchitez (Uribe et ál. 2014), la cepa se conservó en refrigeración y se cultivó en agar papa dextrosa (PDA por sus siglas en inglés).
Para los experimentos en invernadero se preparó una suspensión de 1x108 zoosporas.ml-1 en la forma descrita en Uribe et ál. (2014).
Identificación de las cepas promotoras de crecimiento
Para la identificación de las cepas se extrajo ADN a partir de cultivos en agar nutritivo de 24 horas de crecimiento de las cepas PC4, PC9, PC11 y PCJ2, a través del procedimiento utilizado por Fontecha (2003). Un fragmento del gen ARNr 16S se amplificó mediante PCR (amplificación en cadena de la polimerasa) por medio de los imprimadores P1F 5' GAA GAG TTT GAT CAT GGC TC 3' y P2R 5' AAG GAG GTG ATC CAG CCG CA 3' (Brunel et ál. 1996). La mezcla de 50 μL de reacción de amplificación estuvo compuesta por tampón Taq ADN polimerasa con KCl y sin MgCl2 a concentración final de 1X, 1,25 mM de MgCl2, 0,4 mM de cada imprimador, 200 μM de cada desoxirribonucleosido trifosfato (Thermo Scientific(tm)), 1 U de Taq polimerasa (Thermo Scientific(tm)). El programa utilizado incluyó una desnaturalización a 94oC 4 min, seguida de 30 ciclos de desnaturalización a dicha temperatura por 30 s, hibridización a 55oC por 30 s y extensión a 72oC por 90 s, y por último, una extensión a 72oC por 10 min. Los productos de la amplificación se visualizaron por electroforesis en gel de agarosa al 1%, se purificaron y se secuenciaron en un ABI PRISM 3130 por medio de BigDye(r) Terminator v3.1 Cycle Sequencing RR-100 (Applied BioSystems, Foster City, California, Estados Unidos).
Las secuencias parciales del gen ARNr 16S fueron editadas con el empleo de Bioedit v 7.0.5.2 (Hall 1999) y comparadas individualmente con el software BLAST 2.2 (Altschul et ál. 1997), para encontrar similitudes con secuencias depositadas en el GenBank (http://www.ncbi.nlm.nih.gov). Las secuencias fueron alineadas con el programa Clustal X (Thompson et ál. 1997) y el análisis de la matriz de datos de secuencias de ADN fue realizado mediante el método del vecino más cercano asistido por el programa MEGA 6 (Tamura et ál. 2013).
Prueba de inhibición de P. capsici in vitro
En el centro de una placa de PDA de 4 mm de grosor, se colocó una sección de 5 mm de diámetro de agar que contenía micelio de P. capsici. Alrededor de la sección de agar se ubicaron 4 discos de papel de 0,5 cm de diámetro, distribuidos simétricamente. La unidad experimental consistió en el plato de PDA con los 4 discos. A partir de las cepas PC4, PC9, PC11 y PC2J, se prepararon suspensiones bacterianas en la forma previamente descrita. En cada disco se vertió 7 μL de una de las suspensiones. Para cada tratamiento se empleó 5 repeticiones. Se utilizó como control positivo el producto Acrobat MZ 69 WP el cual es un fungicida químico con acción sobre P. capsici y que tiene como principio activo dimetomorf; y como testigo se empleó solución salina estéril al 0,85%. Las placas con filtros fueron incubadas durante 7 días a 25°C y se determinó el radio de crecimiento de P. capsici. El antagonismo fue determinado en la forma descrita por Ko et ál. (2009) como porcentaje de actividad inhibitoria, igual a[(A - B)/A]* 100; donde A es el radio de crecimiento del micelio del oomycete, y B es el crecimiento de P. capcisi en presencia de la bacteria.
El diseño experimental fue irrestricto al azar, los datos de crecimiento se analizaron con el programa INFOSTAT y se realizó un análisis de varianza (ANDEVA), para la separación de medias se utilizó LSD Fisher (p≤0,05).
Determinación de la concentración óptima para la inoculación de P. capsici en plantas de chile
Se utilizó suelo proveniente de Chachagua, San Carlos (Cuadro 1); el suelo se trató con vapor a 96oC por 24 horas y se mezcló con vermicompost al 50%. La adición de este abono favoreció el desarrollo de la enfermedad en plantas de chile dulce en trabajos previamente realizados en el Laboratorio de Microbiología Agrícola (Uribe et ál. 2014).
Se emplearon plantas de chile Capsicum annuum var. Natalie, de aproximadamente 21 días de edad. Las mismas se trasplantaron a macetas de 8 x 8 cm que contenían 250 gramos de suelo. La unidad experimental consistió en 2 plantas de chile colocadas en recipientes de mayor tamaño. Se utilizaron 10 repeticiones por tratamiento.
Cuadro 1: Análisis químico del suelo, Chachagua, San Carlos, Alajuela, Costa Rica. 2012.

Los valores debajo de cada elemento corresponden con los Niveles Críticos generales para la solución extractora usada.
Se evaluó la inoculación de diferentes concentraciones de zoosporas de P. capsici, a saber, 0, 10, 50, 100, 500, 1000, 5000, 10000 zoosporas. ml-1. Se inoculó 1 ml de cada suspensión cerca de la base de la plántula al día 21 (Primer brote apical lateral). El riego se aplicó por medio de una lámina de 4 cm de agua en el recipiente en el que se colocó la maceta. Treinta días después se cosechó el experimento y se evaluó la severidad con el apoyo de la escala de síntomas presentada en las Figura 1 y Figura 2. En cada una de las plantas con síntomas de la enfermedad se corroboró la presencia de P. capsici, tras el aislamiento del patógeno después de colocar secciones de la lesión en medio PDA durante 10 días a temperatura ambiente. A cada unidad experimental se le asignó un valor, de acuerdo con la escala de síntomas, de 0 a 3 en el caso de la parte aérea, y de 0 a 4 en la parte radical. Los datos de severidad correspondientes a las repeticiones de las concentraciones evaluadas se analizaron con el programa INFOSTAT, mediante un análisis de varianza (ANDEVA) con un arreglo irrestricto al azar. Para la separación de medias se utilizó la prueba LSD Fisher (p≤0,05).

Figura 1: Escala de severidad de la parte aérea de las plantas de chile Capsicum annuum var. Natalie. [A]: Planta sana (0). [B]:Planta con hojas amarillas (1). [C]: Plantas con presencia de hojas marchitas (2). [D]: Planta muerta (3).

Figura 2: Escala de severidad de las lesiones de raíz de las plantas de chile Capsicum annuum var. Natalie. [A]: Raíz sana (0). [B]: Raíz que presenta una lesión superficial de 2-4 mm (1). [C]: Raíz que presenta una lesión de 2-9mm (2). [D]: Raíz con una lesión profunda, necrosada mayor a 10mm (3). [E]: Raíz con lesión necrosada alrededor de parte radical basal (4).
Evaluación del efecto de cuatro cepas bacterianas en la protección de plantas de chile inoculadas con P. capsici
Las plantas de chile se sembraron en macetas con el suelo tratado con vapor a 96ºC por 24 horas y mezclado con vermicompost al 50%. La unidad experimental consistió en 2 plantas de chile de 21 días de edad colocadas en un mismo recipiente. Se evaluóla inoculación con 3 cepas que presentaron antagonismo in vitro y una cepa que no presentó inhibición, para lo cual se establecieron los siguientes tratamientos: P. capcisi, P. capcisi + P. fluorescens PC4, P. capcisi + S. rhizophila PC9, P. capcisi + P. fragi PC11, P. capcisi + A. lipoferum PCJ2 y testigo, como testigo se usó solución salina estéril (SSE). Todas las plantas con excepción del testigo, fueron inoculadas con 1 ml de una suspensión de 100 zoosporas de P. capcisi al día 21 (Primer brote apical lateral). Se utilizó un diseño irrestricto al azar con 10 repeticiones por cada tratamiento. Posteriormente cada planta fue inoculada en la zona basal con 1 ml de la cepa bacteriana correspondiente ajustada a una concentración de 1 x 108 bacterias.ml-1. El riego se aplicó con una lámina de 4 cm de agua en el recipiente en el que se colocó la maceta. Se realizaron 3 aplicaciones de las rizobacterias, a los días 28, 35 y 42 días, en la etapa fenológica de formación de brotes laterales, con el objetivo de mantener una población adecuada de rizobacterias durante el crecimiento de la planta hasta la aparición de los síntomas de la enfermedad.
Se evaluó la severidad de la enfermedad a los 51 días, en la fase de aparición del órgano floral. Se determinó el peso fresco y seco aéreo, así como el peso fresco y seco radical. Los datos se analizaron con el programa INFOSTAT, mediante un análisis de varianza (ANDEVA) con un arreglo irrestricto al azar. Para la separación de medias se utilizó LSD Fisher (p≤0,05).
Resultados y discusión
Identificación de las RPC
Las cepas bacterianas utilizadas en el estudio fueron identificadas como Pseudomonas fluorescens PC4, Stenotrophomonas rhizophila PC9,Psudomonas fragi PC11 y Azospirillum lipoferum PCJ2 (Cuadro 2). Las cepas PC4, PC9 y PC11 fueron aisladas de la rizosfera de caña y la PCJ2 de la rizosfera de arroz. Cepas de P. fluorescens (Khalid et ál. 2004, Podile y Kishore 2006, Bhattacharyya y Jha 2012, Kaymak 2011), P. fragi (Selvakumar et ál. 2009, Bashan et ál. 2014), S. rhizophila (Hayward et ál. 2010, Schmidt et ál. 2012) y A lipoferum (Shah et ál. 1992, Mehnaz y Lazarovits 2006, Hungria et ál. 2010, Veresoglou y Menexes 2010, Kaymak 2011, Bashirzadeh et ál. 2012, Bashan y de-Bashan 2010, Bashan et ál. 2014) han sido previamente reportadas como promotoras de crecimiento.
Prueba de inhibición de P. capsici in vitro
Las cepas P. fluorescens PC4, S. rhizophila PC9 y A. lipoferum PCJ2, lograron inhibir a nivel in vitro el crecimiento del oomycete en un 54%, 30% y 50% respectivamente (Cuadro 3, Figura 3). El radio de crecimiento de P. capcisi en contacto con las cepas PC4 y PCJ2 fue significativamente menor que el observado en el control positivo. Oh et ál. (2011) encontraron que de 11 RPC evaluadas in vitro, 9 inhibieron el crecimiento de P. capcisi mientras que Kim et ál. (2009) reportaron al estudiar 25 cepas de P. polymyxa,15 cepas con actividad fuerte, 5 con actividad débil y 5 sin actividad antimicrobiana.
Cuadro 3: Diámetro de crecimiento de Phytophthora capsici enfrentado a diferentes cepas de rizobacterias. Montes de Oca, 2012.
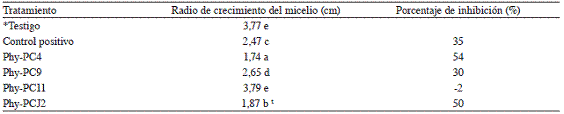
t Cada cifra representa el promedio de 5 repeticiones.
*Testigo (P. capcisi -SSE al 0,85%), Control positivo (P. capcisi-Acrobat MZ 69 WP), Phy-PC4 (P. capcisi -P. fluorescens), Phy-PC9 (P. capcisi + S. rhizophila), Phy-PC11 (P. capcisi -P. fragi), Phy-PCJ2 (P. capcisi -A. lipoferum).
Valores con letras distintas son significativamente diferentes de acuerdo con la prueba LSD Fisher, p<0,05.
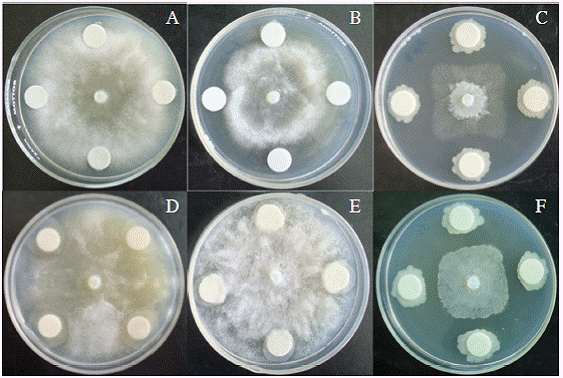
Figura 3: Crecimiento del micelio de P. capsici en contacto con [A]: SSE 0,85 % (testigo), [B]: Acrobat MZ 69 WP (control positivo) [C]: PC4, [D]: PC9, [E]: PC11 y [F]: PCJ2.
El efecto inhibitorio in vitro puede deberse a la producción de antibióticos, sideróforos o enzimas por parte de las cepas. Ko et ál. (2009) indican que L. antibioticus HS124 produce enzimas líticas como quitinasa y b-1,3-glucanasas, lipasas, proteasas y antibióticos que pueden ser responsables de la inhibición mostrada por esta bacteria en ensayos in vitro contra P. capsici. Los autores identificaron el compuesto antibiótico como ácido 4-hidroxifenilacético. Oh et ál. (2011) identificaron los compuestos antifúngicos surfactinas, iturinas y fengicinas producidos por la cepa de Bacillus SB10 antagonista a P. capcisi. Se ha observado que cepas de S. rhizophila aisladas de la rizosfera, producen antibióticos activos contra hongos y bacterias (Hayward et ál. 2010, Schmidt et ál. 2012). En el caso de Azospirillum spp. Bashan y de-Bashan (2010) indican que se ha reportado actividad antagónica causada por la producción de sideróforos, HCN, bacteriocinas y ácido fenilacético por bacterias de este género, específicamente algunas cepas de A. lipoferum producen bacteriocinas (Oliveira 1987) y sideróforos con actividad antimicrobiana (Shah et ál. 1992).
En estudios realizados por Paul y Sarma (2006) cepas de P. fluorescens inhibieron el crecimiento micelial de P. capsici in vitro, mientras que metabolitos producidos por la bacteria afectaron la producción de esporangios y la liberación y germinación de zoosporas. Los autores identificaron el compuesto volátil HCN y los antibióticos pioluteorina y pirrolnitrina. En otro estudio, Lee et ál. (2003) purificaron y evaluaron el sideróforo pioverdina producido por la cepa 2112 de P. fluorescens que mostró acción antagónica contra P. capcisi in vitro y en plantas de chile dulce.
Determinación de la concentración óptima para la inoculación de P. capsici en plantas de chile
Si bien se observaron síntomas en la parte aérea de algunas de las plantas de chile con la inoculación de las concentraciones 100, 500 y 1000 zoosporas.ml-1 (plantas con hojas amarillas, plantas con hojas marchitas y planta muerta), no hubo diferencias significativas entre tratamientos (Cuadro 4).
Cuadro 4: Índice de severidad en plantas de chile Capsicum annuum var. Natalie expuestas a diferentes concentraciones de zoosporas de Phytophthora capsici. Montes de Oca, 2012.
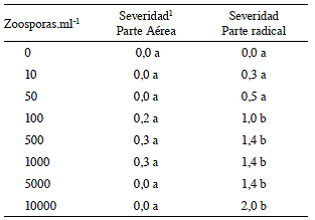
1 La severidad corresponde al valor promedio de las 10 repeticiones de cada tratamiento según el valor asignado en la escala de síntomas de las Figuras 1 y 2.
Se observó un rápido incremento en la severidad en la parte radical al aumentarse el número de esporas inoculadas hasta el nivel de 500 zoosporas.ml-1, las plantas de los tratamientos a los que se les adicionó más de 100 zoosporas.ml-1 presentaron una severidad significativamente mayor que aquellas que fueron expuestas a 0, 10 y 50 zoosporas.ml-1 (Cuadro 4), lo que indica que una mayor concentración de zoosporas asegura mayor contacto con las raíces, sin embargo, a partir de 100 zoosporas. ml-1, no se observó un aumento significativo en la severidad. Al respecto Tuset et ál. (2001), en estudios realizados con zoosporas de P. cinnamomi en plantas de Quercus sp., indican que si las zoosporas enquistadas se acumulan masivamente en zonas puntuales de la corteza radical, se puede impedir que los tubos germinativos alcancen los tejidos superficiales de la planta. Se eligió usar la dosis de 100 zoosporas.ml-1 por tratarse de la concentración por encima de la cual ya no se observa un aumento significativo en la severidad de los síntomas.
Evaluación del efecto de cuatro rizobacterias sobre la supresión de P. capsici en plantas de chile C. annuum var. Natalie
Como se observa en el Cuadro 5 el peso fresco y seco de la parte aérea en el tratamiento inoculado con el patógeno (Phy) no se diferenció significativamente del testigo, mientras que las plantas inoculadas con la cepa PC9 presentaron un peso fresco de la parte aérea significativamente mayor que los tratamientos Phy, testigo y Phy-PC4. No hubo diferencias significativas en la variable peso seco entre los tratamientos inoculados con las bacterias y los tratamientos testigo y Phy. Sin embargo, el tratamiento inoculado con la cepa PC9 fue significativamente mayor que el tratamiento Phy-PC4.
Cuadro 5: Peso fresco y seco e índice de severidad de raíces y parte aérea causados por Phytophthora capsici en plantas de chile Capsicum annuum var. Natalie tratadas con 4 cepas bacterianas promotoras de crecimiento. Montes de Oca, 2012.
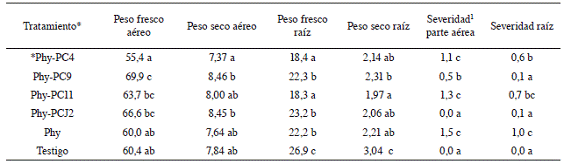
* Phy-PC4 (P. capcisi + P. fluorescens), Phy-PC9 (P. capcisi + S. rhizophila), Phy-PC11 (P. capcisi + P. fragi), Phy-PCJ2 (P.capcisi + A. lipoferum), Phy (P. capcisi), Testigo (SSE al 0,85%).
1 La severidad corresponde al valor promedio de las 10 repeticiones de cada tratamiento según el valor asignado en la escala de síntomas de las Figuras 1 y 2.
Con respecto al peso radical, en todos los tratamientos en los que se inoculó P. capcisi se observó un menor peso fresco y seco que en el tratamiento testigo, aunque el tratamiento Phy-PC11 fue el que presentó menor peso. La inoculación del oomycete causó en la mayoría de los tratamientos, síntomas en la parte aérea y/o en la raíz de la planta, Mendoza y Pinto (1985) mencionan que lesiones en la parte terminal de la raíz principal afectan la absorción de agua y nutrientes hacia el resto de la planta, y por consiguiente causan marchitez en el tallo y hojas de las mismas. En los tratamientos en los que se inocularon las cepas PC9 y PCJ2 se observó una menor severidad en la parte aérea y radical que en el tratamiento inoculado con el patógeno, mientras que las plantas inoculadas con la cepa PC4, presentaron una severidad de la infección en la raíz significativamente menor que las inoculadas con P. capcisi, sin embargo, la aplicación de esta cepa no redujo la severidad de los síntomas en la parte aérea. La cepa PC11 no logró reducir la severidad de la infección en las plantas.
Aunque los resultados obtenidos para la cepa PC11 en medio de cultivo y en planta coincidieron, la mayor actividad in vitro presentada por la cepa PC4 no correspondió con lo observado a nivel de invernadero. Los resultados discrepantes entre la actividad antagonista en pruebas "in vitro" e "in vivo" pueden deberse a los procedimientos utilizados en los ensayos y al tiempo para evaluar la actividad contra el oomycete; la técnica en placa excluye además, mecanismos como la colonización de la raíz, la competencia y parasitismo a nivel de rizosfera, o la modulación por parte de las bacterias de actividades realizadas por la planta (Sharma et ál. 2007, Kim et ál. 2008). No obstante, Kim et ál. (2008) consideran que el método de cultivo dual aún es útil para el tamizaje de cepas antagonistas. Por el contrario, Rajkumar et ál. (2005) proponen ensayos con plántulas de chile como una técnica rápida y precisa para la selección de agentes de biocontrol promisorios.
En este trabajo se observaron diferencias entre cepas en su efectividad para la protección del cultivo; así, de las cepas evaluadas S. rhizophila PC9 y A. lipoferum PCJ2, presentaron potencial para la protección de plantas de chile al reducir significativamente la severidad de la enfermedad lo que podría brindar una alternativa al uso de agroquímicos para el control de este patógeno. Kim et ál. (2009) también observaron una reducción en la severidad de la enfermedad a nivel de invernadero con P. polymyxa GBR-462, mientras que Ezziyyani et ál. (2004) demostraron actividad antagónica de B. cepacia en estudios in vitro, a nivel de invernadero y de campo. Resultados exitosos fueron también obtenidos por Lee et ál. (2003) quienes atribuyen la acción antagónica a sideróforos producidos por P. fluorescens cepa 2112.
Cabe destacar que la cepa S. rhizophila PC9 aumentó el peso fresco de la planta en un 14%; Schmidt et ál. (2012) también observaron promoción de crecimiento en plantas de chile dulce y algodón utilizando la cepa S. rhizophila DSM14405T, los autores sugieren un efecto indirecto vía eliminación de microorganismos patógenos. Según Singh y Singh (2013), S. rhizophila tiene una gran potencial para la aplicación en biotecnología y control biológico debido a su capacidad para promover el crecimiento y proteger la planta de stress biótico y abiótico.
Asímismo, Ko et ál. (2009) indicaron que a nivel de invernadero plantas inoculadas con L. antibioticus HS124 presentaron un mayor crecimiento, resultado de un efecto protector contra P. capcisi. Sang et ál. (2008) en estudios en campo y Park et ál. (2013) utilizando Bacillus vallismortis encontraron cepas que además de reducir la marchitez, aumentaron la producción de frutos. Un efecto similar fue observado por Oh et ál. (2011) quienes señalaron que la cepa de Bacillus SB10 redujo la marchitez y aumentó el vigor de C. annuum.
Si bien el tratamiento de las plantas con cepas bacterianas promotoras de crecimiento ha llevado en algunos casos al control biológico como una alternativa efectiva contra patógenos presentes en el suelo (Guo et ál. 2004), debe considerarse que la supresión de enfermedades a través de agentes protectores y antagónicos depende de la interacción entre la planta, el patógeno, el agente usado como biocontrol y el ambiente por lo que es necesario continuar con estudios a nivel químico y molecular para profundizar en los mecanismos de acción empleados por las RPC, así como estudiar si estas características se mantienen en diferentes genotipos y en condiciones de campo.















