Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Costarricense de Ciencias Médicas
Print version ISSN 0253-2948
Rev. costarric. cienc. méd vol.27 n.1-2 San José Jan. 2006
Detección de anticuerpos contra los virus linfotrópicos de células T tipo I/ II (HTLV I/ II) como medida de seguridad sanguínea en donantes de sangre en Costa Rica, mayo del 2002 a diciembre del 2004
Zaida García1* , Ximena Cortés2,4, Lorena Torres1, Patricia Araúz2, Emelson Pacheco3, Lizeth Taylor2
1* Correspondencia. Dirección General de Gestión Regional de Servicios de Salud. CCSS, Departamento de regulación y Sistematización de servicios de Salud Área Laboratorios Clínicos
2. CMRT. Facultad de Microbiología. San José, Costa Rica.
3. Comisión Epidemiología, Hospital Grecia, CCSS, Costa Rica.
4. INISA, Instituto de Investigaciones en Salud, Universidad de Costa Rica, San José.
Resumen
Los Virus Linfotrópicos Humanos tipo I y II (HTLV I/II) fueron los primeros retrovirus descritos y aislados en 1980. Tienen distribución mundial y son endémicos en el sur de Japón, el Caribe, algunos países del Sur y Centro América, África occidental y algunas otras poblaciones. Aunque la mayoría de infectados permanecen asintomáticos por largos periodos, el HTLV I es el agente causal de la leucemia/linfoma de células T del adulto (LTA) y de la Paraparesia Espástica Tropical (PET) o Mielopatía asociada (MAH).El HTLV II se identificó inicialmente en un paciente con leucemia peluda de células T, pero se requieren más estudios para establecer la relación entre ambos.
Dos de las principales vías de transmisión son la transfusión sanguínea o por compartir agujas de individuos infectados en drogadicción. Para controlar la transmisión de la infección en Costa Rica, se inició en el año 2002 un proyecto de la Sección de Laboratorios Clínicos de la CCSS, para la tamización de anticuerpos contra estos retrovirus a todos los donantes de sangre, fecha histórica para nuestro país por ser el primero en tener una cobertura del 100% de los donantes en América Latina.
Se analizaron 106.958 donantes, 582 (0,54%) fueron reactivos iniciales por tamizaje por un primer ELISA, 272 (46,7%) de ellas dieron repetidamente reactivas por duplicado (RR) con el mismo ELISA; un 0.25% de la población inicial analizada. A todas ellas se les realizó un segundo ELISA con diferente fuente antigénica y a 232 un WB (40 sueros insuficientes).El 0.03%(27) confirmaron positivas y un 0.13 (136) fueron indeterminadas. De las 27 positivas, 13 en donde hubo suero disponible, se procesaron por el WB comercial HTLV Blot 2.4 (ABBOTT) y se obtuvieron:7 positivas para HTLV II, 5 para HTLV I y un indeterminado. Además, de 14 segundas muestras recibidas (positivas e indeterminadas) que se analizaron por PCR, 10 fueron negativas, 3 positivas por HTLV 1 y una fue positiva por HTLV 2.
La mayor prevalencia se presentó en la región Huetar Atlántica con un 0,09% y la Brunca y Central Sur un 0,05%.. Las regiones Pacífico Central,Chorotega y el área Metropolitana un 0,02%.. No se detectó ningún caso en las regiones Huetar Norte y Central Norte.
Con este estudio, se documentó una seropositividad general para el HTLV I / II de 0.22% y una prevalencia nacional de 0.033% en los donantes de sangre. Lo que indica la relevancia del tamizaje obligatorio como medida de seguridad sanguínea y de Salud Pública para impedir la transmisión de estos agentes a través de sangre o sus hemoderivados a pacientes y población general.
Palabras claves: Retrovirus, infección, HTLV I / HTLV II, Western Blot, transfusión sanguínea.
Abstract
During 1980, Human T lymphotropic virus (HTLV-I /II) were the first retrovirus identified and isolated.The geographic distribution of the virus is global, with endemic regions like south Japan, the Caribbean islands, western Africa, some South and Central America countries and other specific populations.
Most infected patients remain without symptoms for long periods of time but association with human disease has been demonstrated. HTLV-II has been linked to adult T-cell leukemia/lymphoma (ATL/ATLL) and is also the causative agent of a neurological disorder termed HTLV-II associated Myelopathy/ttropical Spastic Parapesis.HTLV-II was first identified in a patient with hairy-cell leukemia, however better studies are needed to establish the relation between both.
HTLV can be transmitted by blood transfusion and sharing of needles and syringes. During 2002, Costa Rica became the first Latin American country with 100% coverage of blood donors. In this year, the Sección de Laboratorios Clínicos de la CCSS began as a project the screening for antibodies against HTLV in order to avoid transmission through this route.
Of 106958 blood donors, 582 (0,54%) were initially reactive by enzyme-immunolinked assay (EELISA), 272 (46,7%) were reactive in duplicated with the same ELISA and they were analyzed by a second ELISA and 232 were confirmed with an "in-house "Western Blot (WB).. Those represent the 0.25% of the initial population. Twenty seven samples (0.03%)confirmed positives and 136 (0.13%) were indeterminate. A commercial WB was performed with 13 of these positive samples, 7 were HTLV-II, 5 were HTLV-III and 1 was an indeterminate pattern.
PCR samples were received for 14 patients (positives and indeterminates), 10 were negative, 3 were positive for HTLV-II and 1 was positive or HTLV-II.
The higher prevalences were found in the Huetar Atlántica region with 0,09% and Brunca and Central Sur regions with 0,05%.The Pacífico Central,Chorotega and Metropolitan area showed a prevalence of 0,02%.. No positive serum samples were detected in Huetar Norte or Central Norte regions.
This study demonstrates a general seropositivity of 0,22% and a national prevalence of 0,033% in blood donors. The present work highlight the relevance of the HTLV I/II mandatory screening as a measure for safe blood and public health.
Key words: retrovirus, infection, HTLV I/ HTLV II, Western Blot, Blood Transfusion.
Introducción
Los Virus Linfotrópicos Humanos tipo I y II (HHTLV I/II del inglés Human T-Lymphotropic type I/II) fueron los primeros retrovirus aislados, identificados y descritos en el año 1980. (1, 2)
Aunque casi todos los individuos infectados permanecen asintomáticos, el impacto de la infección viral en áreas endémicas es significativo porque el HTLV I puede ocasionar dos tipos diferentes de patologías: la Leucemia/linfoma de células T del adulto (LTA) (ATL del inglés adult T-cell leukemia) (3) y la Paraparesia Espástica Tropical (PET) (TSP del inglés tropical spastic paraparesis) o Mielopatía asociada con el HTLV-II (MAH) (HAM del inglés HTLV-II associated myelopathy).. También se ha asociado con aumento del riesgo de dermatitis infecciosas, uveítis, polimiositis y artropatías. (4,5)
El HTLV II se asoció a la leucemia peluda de células T, además con cuadros neurodegenerativos crónicos y con un aumento de incidencia de neumonía, bronquitis e infección de tracto urinario. (6) Sin embargo actualmente su papel en estos cuadros esta siendo cuestionado por la baja incidencia en los mismos. (5) Estos retrovirus están distribuidos a nivel mundial y las infecciones por HTLV-II son endémicas en el sur de Japón, el Caribe, en algunos países de Sur y Centro América, en África Occidental, Melanesia, Australia y algunas poblaciones aisladas. (7) En Japón donde se ha estudiado bastante, existe una prevalencia según regiones hasta del 35%, luego el Caribe con 2 al 5% de seropositivos. El HTLV-III es endémico entre los amerindios de Norte, Centro y Suramérica, y en las tribus de África Central. (8 - 10) En EE.UUU. y Europa, también se ha descrito que este virus está asociado a usuarios de drogas endovenosas y grupos de homosexuales. (13,14)
En Costa Rica en el año 1995 se documentaron prevalencias hasta de 10% para el HTLV-II en indígenas. (11,12)
Las fuentes de transmisión son de madre a hijo, transplacentaria o por leche materna; no obstante, una de las fuentes de transmisión importante es por sangre en los procesos de transfusión o drogadicción por compartir agujas o jeringas de individuos infectados. (13,14)
Para evitar que se transmita la infección por estos retrovirus, la tamización de la donación sanguínea ha sido obligatoria en algunos países, como en Japón en 1986, en Estados Unidos y en la Islas Caribeñas Francesas en 1989, en Canadá y Francia en 1990, en los Países Bajos del Continente Europeo en 1993, Suecia, Dinamarca e Irán en 1994, y más recientemente en Portugal y Grecia. (14, 15) En Costa Rica, en el 2002, la Sección de Laboratorios Clínicos inició el proyecto de tamización de la presencia de anticuerpos contra estos retrovirus a todos los donantes de sangre (DS) de la Caja Costarricense del Seguro Social (CCSS), fecha histórica para nuestro país y de gran interés para la Salud Pública, al controlar y así eliminar una posible fuente de transmisión, datos que serán proporcionados por esta investigación. Actualmente, en ninguno de los países del área centroamericana y en la mayoría de los de América del Sur aún no se realiza el control permanente de la presencia de HTLV-I/II en la sangre y sus derivados en un cien por ciento. Esto, según varios autores (16), podría deberse a varios factores: falta de recurso económico y fuentes de colaboración externa para llevar a cabo la detección de anticuerpos; por considerarse que los HTLV-I/II son agentes poco comunes o por creer que está limitado a áreas endémicas; por despreciar su potencialidad de efectos adversos en el receptor de sangre homóloga; o lo que es peor, por considerar que estos virus no son importantes y que tienen consecuencias menores en la transfusión. Por tanto, la infección por HTLV sigue sin que se explore su presencia en la mayoría de los donantes de sangre de Centro y Sur América .
Es importante y necesario conocer la prevalencia de infección del HTLV I /II en todos los donantes del territorio nacional, como un indicador de la circulación de estos virus en una población de bajo riesgo de infección.
La infección se puede prevenir cuando exista interés y evidencia sobre la importancia de la transfusión como factor de riesgo. Por las razones que anteceden, a partir de mayo del 2002, se inició la cobertura total de los donantes que asisten a los Bancos de Sangre de la CCSS, en Costa Rica, para brindar sangre cien por ciento segura, libre de agentes infecciosos transmisibles por este fluido a todos los pobladores costarricenses que necesitan transfusiones. Este hecho además, permitió conocer la prevalencia de la infección por HTLV en el país. En la CCSS se realiza más del 98% de las donaciones y transfusiones sanguíneas.
Materiales y métodos
La CCSS cuenta con una red de 96 Laboratorios, 29 poseen un Banco de Sangre, 23 de los cuales están trabajando con captación y transfusión, cinco transfunden sin recibir donantes y uno se dedica sólo a captación.
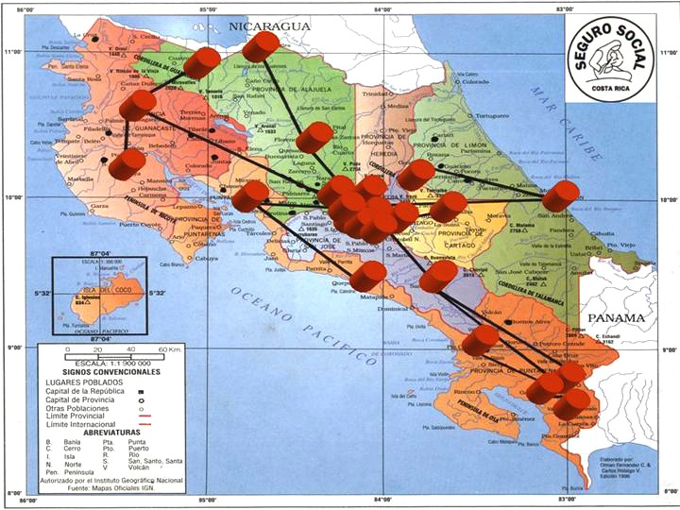
Para presentar la distribución de los donantes tamizados por bancos de sangre y la ubicación geográfica de las muestras analizadas por Western Blot, se utilizó la división por regiones de la CCSS, distribuidas de la siguiente forma:
- Central Norte (gran área metropolitana):incluye Hospital San Vicente de Paúl en la provincia de Heredia; Hospital San Rafael, Hospital Dr. Carlos Luis Valverde Vega, Hospital San Francisco de Asís, estos tres en la provincia de Alajuela.
- Central Sur (gran área metropolitana): incluye Hospital William Allen y Hospital Dr. Maximiliano Peralta, ambos en la provincia de Cartago.
- Ubicación Metropolitana (San José): Donde se encuentran los Hospitales Nacionales y el Banco Nacional de Sangre. En los Hospitales se incluyen el Hospital de las Mujeres, Hospital Nacional de Niños, Hospital Dr. Rafael Ángel Calderón Guardia, Hospital México Hospital San Juan de Dios.
- Región Chorotega (zona noreste en la provincia de Guanacaste): incluye Hospital La Anexión, Hospital de Upala y Hospital Dr. Enrique Baltodano Briceño, en Liberia.
- Región Huetar Norte (zona norte): Hospital de San Carlos y Hospital de los Chiles.
- Región Brunca(zona sur):Hospital de Golfito,Hospital Tomás Casas Casajús, Hospital de Ciudad Neilly y Hospital Dr. Escalante Pradilla.
- Región Huetar Atlántica (provincia de Limón):Hospital Tony Facio y Hospital de Guápiles.
- Región Pacífico Central (provincia de Puntarenas): incluye el Hospital Monseñor Sanabria.
Población de estudio
Ciento seis mil novecientos cincuenta y ocho (1106.958) muestras de suero de donantes de todo el territorio nacional, que asistieron a los Bancos de Sangre de la CCSS, recolectadas de mayo del 2002 a diciembre del 2004, las cuales fueron analizadas en diferentes pruebas para detectar agentes infecciosos transmitidos por transfusión sanguínea, para Virus Hepatitis C (VHC), Virus Hepatitis B (VHB),Virus Inmunodeficiencia Humana (VVIH), contra el Trypanosoma cruzi (enfermedad de Chagas) y el Treponema pallidum (Sífilis),lo que lleva a este estudio de anticuerpos tipo IgG contra los virus HTLV I/II. En Costa Rica por ley está prohibida la venta o compra de sangre y sus hemoderivados y la tamización es del 100% en toda la Red de Bancos de Sangre de la CCSS. El estudio realizado fue de tipo exploratorio descriptivo, de corte transversal.
Tipo de donantes
En Costa Rica se identifican tres tipos de donantes: el altruista, reposición y el autologo. En el segundo caso, si bien los hospitales piden una cuota de donadores, el paciente puede o no reponer la sangre que recibe. Un porcentaje menor al 2% es donante autologo.
La población de donantes esta constituida por un 70% de hombres y un 30% de mujeres, la edad más frecuente se encuentra dentro del rango de 36 a 45 años con un 36% y la menos frecuente es de 45 a 65 años con un 10%.
Es importante resaltar que antes del año 2004 el porcentaje de donadores por reposición fue de un 50 a 52% y el de voluntarios altruistas inferior. No obstante, en el 2004 el 57% correspondió a donantes voluntarios altruistas y el 43% a donantes por reposición, fruto del trabajo de concienciación de los profesionales de la Red de Bancos de Sangre en la población general.
Tipo de muestra
Las muestras de sangre fueron enviadas desde los respectivos bancos de sangre hasta las instalaciones del Centro Internacional de Investigación y Adiestramiento Médico, conocido por sus siglas en inglés como ICMRT, ubicado en la facultad de Microbiología de la Universidad de Costa Rica.
Ensayo Inmunoenzimático (EIA)
Las muestras se analizaron inicialmente con el ensayo inmunoenzimático (EIA), Vironostika ® HTLV I / II Microelisa system (E8V20, Biomerieux), siguiendo las respectivas recomendaciones del fabricante. A 28 muestras no se les realizó el EIA Vironostika ®, pero fueron analizadas por el EIA Murex HTLV I/II Abbott. Las muestras repetidamente reactivas se analizaron por un segundo ensayo, Detect-HTLVTM (Adaltis), siguiendo las recomendaciones del fabricante.
Western lot (WB)
Como prueba confirmatoria se realizó un Western Blot (17,18), utilizando como antígeno un lisado comercial del virus HTLV-1 (HTLV-1 MT-2 Purified Viral Lysate, Advanced Biotechnologies Incorporated)..
Brevemente, cada tira de nitrocelulosa se colocó en 2 ml de solución amortiguadora de trabajo (Tris-Albúmina bovina 0.5%- leche descremada 2%). Se agregaron 50 µl de muestra o control para una dilución final de 1/40.Para cada corrida de WB se utilizó 1 control positivo y 1 control negativo.
Se incubó 2 horas a temperatura ambiente (TA) o toda la noche en agitación constante y posteriormente, se realizaron tres lavados con un amortiguador de fosfatos salino (AFS) con 0.1% de Tween 20.
Se agregó 2 ml de conjugado marcado con fosfatasa alcalina (Anti IgG Humano, Sigma A 9544) diluido 1/40000 en la solución amortiguadora de trabajo y se incubó 2 horas a TA en agitación constante. Se repitieron los lavados y se agregó 2 ml de sustrato BCIP/NNBT (5-bromo-4-chloro-33-indolyl phosphate/NitroBlue Tetrazolium, Sigma B1911). Finalmente se incubó por 15 minutos o hasta que las bandas se volvieron suficientemente fuertes para interpretación. Las tiras se lavaron dos veces con agua estilada.
Según criterio del Centro de Control de Enfermedades de Atlanta de Estados Unidos (10) una muestra es negativa si no presenta bandas, positiva si reacciona contra la proteína 24 del gen GAG (p24) y con una o más proteínas del gen de la envoltura (EENV) gp 46 y/o gp 61/668; si no se cumple el criterio anterior, se considera una muestra indeterminada.
Western Blot Comercial
Aquellas muestras positivas de las cuales se tenía suficiente suero, se procesaron por el sistema HTLV Blot 2.4, de Genelabs ® Diagnostics, siguiendo las especificaciones de la casa comercial.
Reacción en cadena de la polimerasa (PCR por sus siglas en inglés)
Para esta prueba se solicitó una muestra de sangre total anticoagulada con EDTA. La extracción de leucocitos se realizó utilizando el siguiente protocolo: se mezclaron 2 ml de sangre total con 7 ml AFS estéril, en un tubo cónico estéril se agregaron 5 mL de Ficoll-Histopaque ®-1077 (Sigma 10771) y luego se depositaron por la pared del tubo los 9 mL de sangre diluida; se centrifugó a 2000 rpm por 30 min. Posteriormente, se descartó la capa superior de suero con una pipeta Pasteur, se recolectó la capa de leucocitos (máximo de 0.5 mL de Ficoll)y se transfirió a un tubo cónico estéril. En el tubo se llevó a un volumen final de 12 mL con AFS estéril, se centrifugó a 2500 rpm por 15 minutos y se descartó el sobrenadante. El precipitado se resuspendió en 4 mL de PBS estéril y se colocó esta suspensión en 2 viales estériles de 2mL. Finalmente se centrifugó a 5000 rpm por 10 min. y se descartó el sobrenadanante, se procedió a realizar la extracción de ADN o se guardó el botón de células a - 70 ºC.
Después de la separación de los leucocitos, se procedió a extraer el ADN siguiendo las especificaciones del fabricante QIAgen (QIAmp Viral DNA Mini Kit, 51306).
Se realizó un primer PCR (PCR I) que utilizó iniciadores degenerados, los cuales permitieron amplificar HTLV I y II. Las secuencias de estos iniciadores son:
SK 110: CCMTACAAYCCMACCAGCTCAG
y
SK111: GTGGTGRSKYTGCCATCGGGTTT.
A partir del primer PCR, se realizó un segundo PCR (PCR II) con iniciadores específicos para detectar HTLV I y otro PCR II con iniciadores específicos para detectar HTLV II. Las secuencias de los iniciadores son para HTLVI:
Pol 1.1 TTGTAGAACGCTCTAATGGCATTC
y
Pol 3.1: TGGCAGTTGGTTAACACATTCAGG
Para el HTLV II:
Pol 1.2 CCTGGTCGAGAGAACCAATGGTG
y
Pol 3.2 CCACTGGGTTCATGACATTTAGC (19).
Las condiciones de PCR para todas las reacciones fueron las siguientes:
94 ºC3 min seguidos por 30 ciclos de 94 ºC 30 seg; 55 ºC 30 seg; 72 ºC 30 seg; y una extensión final de 72 ºC 7 min;y 4 ºC indefinido.Se utilizó un termociclador Perkin Elmer 2700.
La banda presente del producto amplificado es de 135 pares de bases (bp) para el HTLV I y 137 bp para el HTLV II.
En la figura N º1 se describe el algoritmo que se siguió para el análisis y reporte de las muestras en estudio.
Fig. 1
Resultados
En el cuadro Nº 1, se observa la distribución de donantes tamizados por Bancos de Sangre (BS), según las regiones de salud de la CCSS y en la figura N º2 se observa la ubicación de los BS distribuidos en todo el territorio nacional. Nótese como el Área Metropolitana es la que capta el mayor número de donantes.
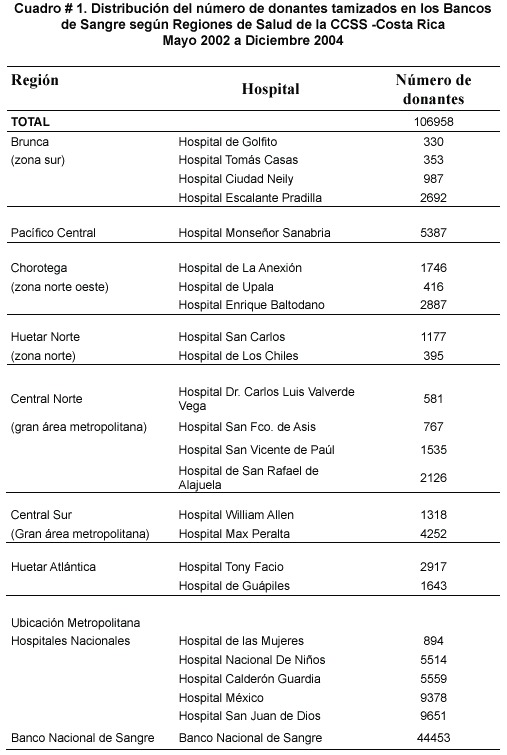
El 100% de los donantes fueron analizados (1106.958), de los cuales 582 (0,54%) fueron reactivos iniciales por tamizaje (RT) por el primer EIA de Vironostika, de estos al repetirse por duplicado con el mismo EIA, 310 (53,3%) fueron negativos. Las 272 (46,7%) muestras restantes fueron positivas por duplicado (repetidamente reactivos RR), lo que corresponde a un 0.25% de la población total analizada, a quienes se les realizó un segundo EIA (Adaltis). La distribución de seropositividad según BS, se visualiza en la figura N º3.Obsérvese que hay un mayor número de muestras con reacciones (EIA) iniciales positivas que muestras confirmadas,por lo tanto,la proporción de bolsas de sangre retenidas por cuarentena, esto es mientras se estudia el donante por pruebas de EIA y pruebas confirmatorias,es de 0,54%y el porcentaje de reacciones inespecíficas o falsas positivas de 0,39% (310 muestras negativas por un segundo y tercer EIA, 69 WB negativos, 40 WB pendientes por muestra de suero insuficiente),sobre el total de la población analizada; para las unidades de sangre descartadas es un 0,25% de donantes positivos por EIA RR.
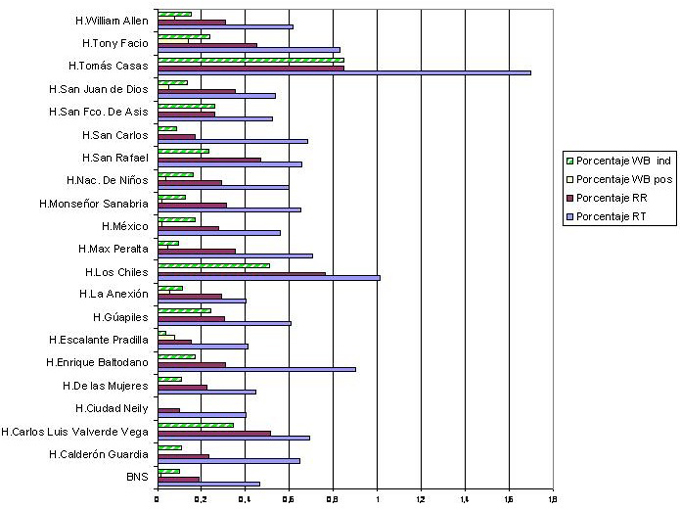
Independientemente del resultado del segundo EIA, las muestras se analizaron por WB, incluyendo muestras que por duplicado presentaron lecturas cercanas al corte y se obtuvo 27 (0,03%) positivos, 136 (0,13%) indeterminados y 69 (0,06%) negativos (Cuadro Nº 2). En el periodo de estudio quedaron 40 muestras pendientes de confirmar por WB.
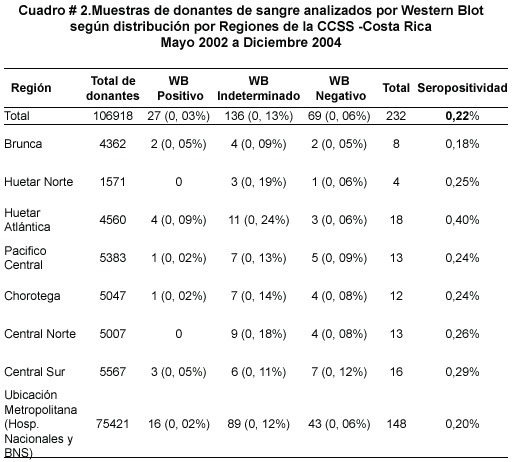
La mayor prevalencia se encontró en la región Huetar Atlántica con un 0,09% y la región Brunca y Central Sur con un 0,05%.Las regiones Pacífico Central, Chorotega y el área Metropolitana obtuvieron un 0,02%.. Durante el periodo de estudio no se detectó ningún caso en las regiones Huetar Norte y Central Norte. Se observó que el mayor porcentaje de WB indeterminados (0.13%) nuevamente correspondió a la región Huetar Atlántica (Cuadro Nº 2).
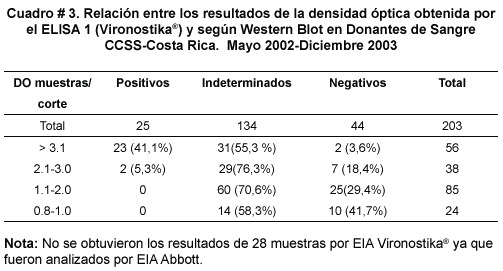
En el Cuadro Nº 3 se observa la relación entre las densidades ópticas (DO) del EIA y el resultado del WB. Los resultados de WB positivos se asocian principalmente a valores de EIA mayores a 3,1 de DO, sin embargo, los WB indeterminados se distribuyen en todos los niveles de DO. Para los resultados por WB positivos se solicitó una muestra inmediata de sangre total anticoagulada con EDTA,con el fin de realizar la prueba de PCR y para los resultados de muestras indeterminadas, se solicitó una segunda muestra con una diferencia de tres meses con respecto a la primera (Ver Algoritmo figura N º1). Para ilustrar la interpretación de los WB, en la figura N º4 se muestra la distribución de las bandas de acuerdo al peso molecular y se presenta la reactividad en diferentes muestras positivas e indeterminadas. Para efectos de este estudio los WB con bandas muy débiles se consideraron indeterminados. Los resultados individuales de las bandas proteicas virales en el WB indeterminado más comunes fueron contra la región GAG, la banda p19 en 25 muestras y la p24 en 2 muestras.
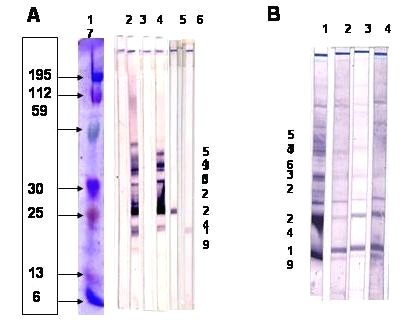
Figura # 4: Western Blot HTLV. A Línea 1: Marcadores de Peso Molecular (Kda) Línea 2: control negativo. Línea 3: control positivo. Línea 4: muestra negativa. Línea 5: muestra positiva. Línea 6: indeterminado (24) Línea 7: indeterminado (19) B Línea 1: control positivo. Línea 3: indeterminado con baneo múltiple. Línea 2 y 4: muestras positivas con bandeo débil.
De las muestras con WB indeterminado (66%) solamente se obtuvo segunda muestra de trece (19,7%); de estas 12 repitieron el resultado de indeterminado y 1 presentó WB negativo. De las primeras 12 se obtuvo tercera muestra para 3, de las cuales 2 presentaron un resultado indeterminado y la restante uno negativo.
Para las muestras con WB positivo, se obtuvieron cinco segundas muestras, las cuales fueron positivas. Solamente se obtuvo una tercera muestra que se mantuvo positiva. Debido al bajo número de segundas y terceras muestras obtenidas, no se analizaron los resultados de seguimiento.
Para informar si es una infección por HTLV I y II se realiza una prueba de PCR. A 14 muestras se les aplicó el PCR en el período de estudio, dando como resultado 10 negativas, 3 positivas por HTLV I y una por HTLV II. En la figura N º 5 se observa el producto amplificado de muestras positivas para HTLV I y HTLV II, controles positivos y ningún producto amplificado en muestras y controles negativos.
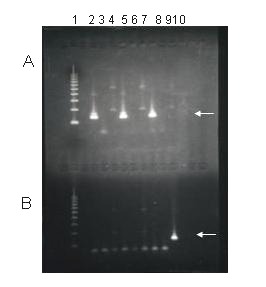
Figura #5: PCR HTLV y PCR HTLV II A) PCR II con iniciadores para la detección de HTLV 1. B) PCR II con iniciadores para la detección de HTLV II. Línea 1: Marcadores de peso molecular. Línea 2 y 5: control positivo HTLV I (banda 135 Pb). Línea 3, 6 y 9: control de reactivos. Línea 4 y 7: muestras negativa por HTLV I y negativa por HTLV II. Línea 8: muestra positiva por HTLV I y negativa por HTLV II. Línea 10: muestra negativa por HTLV I y positiva por HTLV II (banda 137 Pb)
De las 27 muestras positivas por el WB inicial, 13 se procesaron por el WB comercial HTLV Blot 2.4 (ABBOTT) y se obtuvieron: 7 patrones correspondientes a HTLV II, 5 a HTLV I y un patrón indeterminado. De las 14 muestras positivas restantes, no se contó con suficiente muestra de suero para realizar el WB.
Discusión
La detección de anticuerpos contra los virus HTLV I/II en donantes de sangre es de gran importancia desde el punto de vista de Salud Pública, ya que se debe impedir la transmisión de estos agentes a través de sangre o sus hemoderivados a pacientes y población general. Con la aplicación de diferentes pruebas de laboratorio se elaboró un algoritmo de seguimiento (figura N º1) para todas las muestras de los donantes, lo que permitió uniformar el análisis de los resultados de la investigación. Según los resultados del estudio se presentó un 0.54% (582 DS) reactivos iniciales por tamización, de los cuales 272 fueron repetidamente reactivos representando un 0,25% de la población total analizada. En las pruebas confirmatorias se presentó un 0.03% de positivos, 0,06% de negativos y 0,13% de indeterminados, documentándose por este trabajo una seropositividad general para el HTLV I /II de 0.22% y una prevalencia nacional de 0.033% en los donantes de sangre. La distribución del mayor número de los donantes de sangre está en la gran área metropolitana, la cual corresponde a las zonas más urbanizadas y por ende el mayor número de población y de hospitales (figura N º1).No obstante, la mayor seropositividad para el HTLV I/II está en la Región Atlántica con un 0,40% y una prevalencia de 0,09%, seguidamente la Región Brunca y la Central Sur, ambas ubicadas en la zona sureste del país, con una prevalencia de 0.05% (Cuadro Nº 2). Es importante considerar que en estas regiones (Brunca y Región central Sur) hay una mayor afluencia de población de origen amerindio y en las zonas costeras individuos de raza negra, lo que se podría relacionar con las mayores prevalencias de HTLV encontradas en estos lugares. Un estudio de marcadores genéticos clásicos (20) señaló que en la parte sur del país se detecta una mayor influencia de origen amerindio, mientras que en las regiones de las costas se ha detectado una mayor contribución de genes africanos, lo que confirma el resultado de este estudio.
Además estos hallazgos correlacionan con una prevalencia mayor encontrada en los amerindios de Costa Rica (11) La infección por estos retrovirus también se confirmó en amerindios de otros países de América Latina. (16,21) Existe un documento que contiene la investigación de pruebas serologicas de tamizaje y confirmación por Western Blot en una pequeña muestra de donantes de sangre y politransfundidos de Centro América, donde se detectó 1.3%, 0.6%, 0.7% en Nicaragua, Salvador y en donantes de Costa Rica, con infecciones de HTLVI/II positivas por prueba confirmatoria, pero en Nicaragua predominó la del HTLV II, en Honduras y Guatemala no se detectó ninguna positiva en el grupo de muestras analizadas y en los politransfundidos se documenta 1.3% de Western Blot indeterminados or HTLV I/II. (22)
La infección por HTLV-II después de una transfusión puede producir MAH/PET en menos de 4 años. El riesgo de ALT y MAH está alrededor del 5% para individuos seropositivos, pero las formas menos severas tienen un riesgo que oscila entre 3% y 5%. (16)
El HTLV-II es endémico en la población amerindia, en Costa Rica también se ha documentado su presencia en nueve diferentes localidades indígenas y mestizas, encontrándose 1.2% para el HTLV I y un 1.4% para el HTLV II por Western Blot como prueba confirmatoria. Por tribu o grupo amerindio individual perteneciente se presentaron en los grupos con mayor prevalencia para HTLV I un 0.9% y 6.8%, en los Kuna y Bribri-Cabecar y 4,2% - 10% para HTLV II en los Bribri- Cabecar y un grupo en Limón. (11) Según diversos trabajos en Colombia, el HTLV infecta de 0.2% a 10% de individuos en los mestizos, negros e indígenas de la costa sur del Pacífico y las tasas de seropositividad oscilan entre 0.2% y 0.8% para los donantes en los bancos de sangre de la costa pacífica.(16)
En los Estados Unidos la seroprevalencia de HTLV I/I en donantes voluntarios de sangre es de un promedio de 0.016%. Aproximadamente la mitad de los donadores de sangre son infectados por el HTLV I, los cuales refieren una historia de nacimiento en países endémicos o contacto sexual con personas del Caribe o Japón y un pequeño porcentaje por el uso de drogas inyectadas o transfusión de sangre. Según reportes, algunos grupos son de negros del sureste y de inmigrantes de áreas endémicas. El HTLV-II es prevalente en abusadores de drogas intravenosas y en personas que tuvieron contacto sexual con ellos, más del 80% de la infección de HTLVII es por el uso de esta práctica. (14)
En Costa Rica se transfundieron en el año 2002: 100.062 unidades de hemoderivados, en el 2003:1124.552 unidades de productos sanguíneos y en el 2004: 70.630 en todo el territorio nacional. (23) Por lo cual es importante continuar con la tamización de este y otros agentes transmisibles por sangre como medida de seguridad sanguínea. En la Red Nacional de Bancos de Sangre se presentó una retención o cuarentena del 0,54% de las bolsas de sangre donadas, por ser inicialmente reactivas por EIA y un 0,26% se descartaron por mantenerse RR o resultar positivas, negativas o indeterminadas por WB y ser potencialmente una amenaza para los pacientes a transfundir, lo cual es un costo beneficio que se asume para la prevención y control de la infección.
A pesar del número de bolsas de sangre en retención o descartadas, es importante continuar con la tamización de este y otros agentes transmisibles por sangre, para eliminar al máximo la posibilidad de transmisión a los pacientes receptores de sangre.
Los resultados serológicos indeterminados mostrados en la figura Nº 3 y Cuadro Nº 3 son comúnmente encontrados en estos retrovirus al igual que con el VIH, en especial en poblaciones estudiadas de bajo riesgo. No obstante, es bien entendido que las reacciones de muestras indeterminadas deben ser rechazadas para uso en el Banco de Sangre, el manejo del
donante de sangre con un resultado indeterminado es complicado tanto para él mismo, como para el personal que da la consejería, debido a que amerita un seguimiento prolongado que
provoca angustia mientras se conoce su verdadera situación. Esto no es un problema aislado observado, las causas de estas reacciones son varias y aún quedan pendientes de investigar, algunos autores describen reacciones cruzadas con antígenos no virales de las células donde se replican estos retrovirus y con otros agentes virales como lentivirus y el VIH. (24,25)
En el presente estudio no se encontró ninguna correlación en las lecturas de densidad óptica de los EIA realizados y el criterio de Western Blot indeterminado, ya que se presentó una distribución
homogénea, donde hubo lecturas bajas, medias y altas con criterio de indeterminado. Por otro lado, analizando las bandas del Western Blot en este estudio, los patrones individuales más comunes de los WB indeterminados fueron contra la región proteica del GAG, la banda proteica p19 (25 muestras) y la p24 (12 muestras). En las regiones tropicales endémicas, se ha reportado
un perfil indeterminado de proteínas grupo específicas (gen gag;HGIP,Gag indeterminate profile pattern) donde se observan las bandas p19, p26, p28, p32 y p53, sin la presencia de la banda p24 o alguna de las bandas que corresponden a glicoproteínas del gen de la envoltura (gp 46, gp 61/68). (26,27)
Se ha sugerido que en estas áreas este patrón no corresponde a infección por HTLV-1, sino que podría estar asociado a otros factores ambientales. (28)
Para los resultados obtenidos en el período de estudio, no se observó una alta frecuencia de este patrón, por el contrario se obtuvo una mayor cantidad de patrones indeterminados con bandas múltiples, que presentaron la banda 24 y/o alguna banda del gen de la envoltura.
No se encontró ninguna asociación entre una banda específica o grupos de bandas que oriente hacia un resultado de un falso negativo, esto resalta la necesidad de realizarse el Western Blot pero es indispensable dar un seguimiento a través del PCR para resolver los casos de indeterminados en un corto plazo. La relación del Western Blot comercial HTLV Blot 2.4 de ABBOTT y el PCR en las pocas muestras positivas enviadas para confirmación si es HTLV I o HTLV II, por esta última metodología fue de un cien por ciento de correlación.
Aún falta concienciar al personal responsable de Banco de Sangre sobre la importancia del envió de una segunda o tercera muestra para el seguimiento y control, lo que permitiría caracterizar acertadamente a cada donante. Este problema impidió la clasificación en un grupo de muestras bastante significativas y no se pudo establecer en su totalidad si la infección es mayor por HTLV I o HTLV II en el país, a pesar de que el HTLV II se presentó en 7 muestras de 13 analizadas con suero suficiente de las 27 en total positivas y 5 HTLV. No obstante, este estudio nos ha indicado la gran relevancia del tamizaje obligatorio de estos retrovirus Linfotrópicos como una medida de seguridad sanguínea impidiendo una importante fuente de infección, lo cual se podría reforzar con la implementación y uso de filtros leucoreductores obligatorio en las unidades de Bancos de Sangre, ya que algunos investigadores documentan que potencialmente contribuyen a disminuir la carga de provirus, pero que por si solo el uso de filtros leucoreductores no provee completa protección de la infección (29,30), sino que en conjunto es una medida más que coopera en reducir estos y otros virus.
A su vez, aporta la primera evidencia de circulación de estos agentes en una población de bajo riesgo de todo el territorio costarricense. Quedan aún pendientes estudios por realizar en diferentes grupos poblacionales.
Agradecimiento
Los autores agradecen al Dr. José Luis Salas Oviedo, de la Dirección Desarrollo de Servicios de Salud, Departamento de Regulación y Sistematización Servicios de Laboratorios de los Servicios de Laboratorios Clínicos - Bancos de Sangre de la CCSS y a todos los funcionarios que conforman la Red de los Laboratorios Clínicos y Bancos de Sangre, por la información suministrada. Al Dr. Cesar Vega de la O de ABBOTT Healthcare por la colaboración brindada.
Referencias
1. Kalyanaraman, V. S., Sarngadharan, M. G., Poiesz, B., Ruscetti, F. W. y Gallo, R. C. 1981. Immunological properties of a type C retrovirus isolated from cultured human T-lymphoma cells and comparison to other mammalian retroviruses . J. Virol . 38:906-915. [ Links ]
2. Poiesz, B. J., Ruscetti, F. W., Gazdar, A. F., Bunn, P. A., Minna, J. D. y Gallo, R. C. 1980. Detection and isolation of type c retrovirus particles from fresh and cultured lymphocytes of a patient with cutaneous T-cell lymphoma. Proc. Natl. Acad.Sci . SA 77:7415-7419). [ Links ]
3. Blattner, W. A., Takatsuki, K. y Gallo, R. C.. 1983. Human T-cell leukemia-lymphoma virus and adult T-cell leukemia. JAMA 250:1074-1080. [ Links ]
4. Gessain, A., Barin, F ., Vernant, J. C., Gout, O., Maurs, L., Calender, A., et al. 1985. Antibodies to human T-lymphotropic virus type-1 in patients with tropical spastic paraparesis. Lancet ii: 407-410. [ Links ]
5. Green, P.LL. y Chen, I.Y. 2001. Human T-Cell Leukemia Virus types 1 and 2. En Knipe DM, Peter MH, et al. eds. Fields Virology. 4 ta Ed. Vol 2. Cap 58: 1941-1969. Philadelphia. USA. Lippincott William & Wilkins Publishers. [ Links ]
6. Glynn, S. A., Murphy, E. L., Wrigth, D. J., Sacher, R.A., et al. Laboratory abnormalities in former blood donors seropositive for Human T Lymphtropic Virus Types 1 y 2. A Prospective Analysis. Med 2000; 124-3: 550-55. [ Links ]
7. Meytes, D., Schochat, B., Lee, H., et al. Serological and molecular survey for HTLV-I infection in a high-risk Middle Eastern group. Lancet 1990; 336: 1533-35. [ Links ]
8. Zaninovic, V.,, Tajima, K., Hayami, M., et al. Epidemiología del HTLV-I en indígenas de Colombia. Med 1992; 23: 94-9. [ Links ]
9. Egea, E., Martínez, M., Durango, A., Garavito, G., Angel, L. y Valverde, C. Estudio de prevalencia de enfermedades infecciosas VHA-VHB-VIH-HTL V en una comunidad Afrocolombiana del Litoral Caribe-Isla Barú. UNINORTE 1999;14(1):3- [ Links ]
10. Heneine, W.,, Kaplan, J.E., Gracia, F., et al. HTLV-II endemicity among Guaymi Indians in Panama. Med 991; 324:565 (letter). [ Links ]
11. García, Z.M., Barrantes, R. y Visoná, K.A. 1995. Estudio preliminar sobre la prevalencia de HTLVI/II en amerindios de Costa Rica. Resumen X Congreso Centroamericano de Microbiología, X Congreso Nacional de Microbiología, 22 al 23 de Noviembre. [ Links ]
12. Levine, P.H., Jacobson, S., Elliott, R., et al. HTLV-II infection in Florida Indians. Retroviruses 1993; 9:123-7. [ Links ]
13. DeThe, G. y Bomford, R. An HTLV-I vaccine: Why, how and for whom? Retrovirol 1993; 9: 81-86. [ Links ]
14. CDC. Recommendations for Counseling Persons Infected with HumanT-Lymphotrophic Virus, Types I and II. USA; 1993.MMWR 1993; 42/RR-9:1-13. [ Links ]
15. Hjelle, B., R. Mills, G. Mertz, S. Swenson. 1990. Transmission of HTLV-1 via blood transfusion. Sang . 59:119-122. [ Links ]
16. Cortés, A., Buelvas, M.D, Beltrán, M., Gallego, G.A. e Isaza, L.M. Estudio prospectivo seroepidemiológico de infección por el virus linfotrópico humano I y II (HTLV-I/II) en donantes de sangre de áreas colombianas endémicas y no endémicas. Med 1999; 30:19-25. [ Links ]
17. Laemmli, U.K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature 1970; 227, 680–685. [ Links ]
18. Towbin, H., Staehelin, T. y Gordon, J. Electrophoretic transfer of proteins from polyacrylamide gels to nitrocellulose sheets: procedure and some applications. Sci 1979; 76: 350–4354. [ Links ]
19. Heneine, W., Khabbaz, R.F., Lal, R.B.y Kaplan, J. E. Sensitive and specific polymerase chain reaction assays for diagnosis of human T-ccell lymphotropic virus type I (HTLV-I) and HTLV-II infections in HTLV-I/II-seropositive individuals. Microbiol. 1992 Jun; 30(6):1605-7. [ Links ]
20. Morera, B., Barrantes, R. y Marín-Rojas, R. Gene admixture in the Costa Rican population. Genet . 2003 Jan; 7(Pt ): 71-80. [ Links ]
21. De Freitas, A.B., Proietti, C., Catalan, B., Proietti, F.A. and Interdisciplinary HTLV I/II Research Group. Human T Cell Lymphotropic Viruses (HTLVI/II) in South America: Should it be a Public Health Concern? Sci 2000; 9: 587-595. [ Links ]
22. García, Z.M., Del Valle, L., Vinelli, G., Ayerdis, E., Cáceres, J. y Visoná, K.A. 1995. Seroprevalencia de HTLV I/II en donantes de sangre y en pacientes politransfundidos de Centroamérica. Resumen X Congreso Centroamericano de Microbiología, X Congreso Nacional de Microbiología, 22 al 23 de Noviembre. [ Links ]
23. Caja Costarricense del Seguro Social, Dirección Técnica Servicios de Salud -Sección de Laboratorios. Informe de Bancos de Sangre año 2002, 2003, 2004 y 2005. Serie de Informes Técnicos: 2000-22005. San José, Costa Rica, 2005. [ Links ]
24. Gastaldello, R., Gallego, S., Isa, M.B., Maturano,E.,et al.Immunofluorescence assay reactivity patterns of serum samples presenting indeterminate Western Blot results for antibodies to HIV 1 and HTLV I/II en Cordoba, Argentina. Trop.S Paulo. 2001 September-October; 43(4):277-282. [ Links ]
25. Teixeira, T.,, De Castro, C.M., Goubau, P., Vandamme, A.M. et al. Western Blot Seroindeterminate individuals for Human T Lymphotropic Virus 1 / 2 in Fortaleza (Brazil): A serological and Molecular diagnostic and epidemiological Approach. Diseases (BJID) 2003; 7(3): 202-209. [ Links ]
26. Mauclere, P., Le Hesran. J.Y.,, Mahieux. R., Salla, R., et al. Demographic, ethnic, and geographic differences between human T cell lymphotropic virus (HTLV) type I-seropositive carriers and persons with HTLV-I Gag-indeterminate Western blots in Central Africa. Dis . 1997 Aug;176 (2): 505-9. [ Links ]
27. Rouet, F., Meertens, L., Courouble, G., Rouet, F., Hermann – Storck, C., et al. Serological, epidemiological, and molecular differences between human T-cell lymphotropic virus Type 1 (HTLV-1)- seropositive healthy carriers and persons with HTLV-I Gag indeterminate Western blot patterns from the Caribbean. J Clin Microbiol. 2001 Apr 39 (4): 1247-53. [ Links ]
28. Mahieux, R., Horal, P., Mauclere, P., Mercereau-Puijalon, O., et al. A Human T-cell lymphotropic virus type 1 gag indeterminate western blot patterns in Central Africa: relationship to Plasmodium falciparum infection. J Clin Microbiol. 2000 Nov; 38(11):4049-57. [ Links ]
29. Pennington, Taylor, G.P, Sutherland, J., Davis, R.E., et al. Persistence of HTLV-I in blood components after leukocyte depletion. Blood.2002 July 15; 100(2): 677-681. [ Links ]
30. Cesaire, R., Kerob – Bauchet, B., Bourdonne, O.,Maier, H., et al. Evaluation of HTLV-I removal by filtration of blood cell components in a routine setting. Transfusion . 2004 Jan; 44(1): 42-8. [ Links ]













