Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Costarricense de Ciencias Médicas
Print version ISSN 0253-2948
Rev. costarric. cienc. méd vol.26 n.3-4 San José Jun. 2005
Impacto de la revolución genómica en la salud de los países latinoamericanos
Isabel Castro Volio*
Resumen
El objetivo de este trabajo es analizar un tema de actualidad y de interés para los profesionales de la salud, relacionados con la "nueva genética". Se tocan aspectos como el proyecto del genoma humano, el nacimiento de la medicina genómica, su potencial en el campo de la salud y sus implicaciones éticas, legales y sociales.
Abstract
This is an overview on the "new genetics" for health professionals. It approaches several current interesting topics such as the human genome project, the birth of genomic medicine, it 's impact in the sanitary field and it 's legal, ethical and social implications.
Palabras clave: medicina genómica, proyecto genoma humano, implicaciones éticas, legales y sociales.
Key words: human genome project, genomic medicine, ethical, social and legal implications.
Introduccion
Las características de todos los organismos vivos refl ejan las complejas interacciones entre su patrimonio genético y el ambiente en que se desarrollan. Las funciones biológicas que son consecuencia de esta íntima relación, se explican en términos de mecanismos bioquímicos, los que a su vez, reflejan la actividad de los genes que los regulan. De ahí el énfasis creciente de la investigación médica, en el análisis de los mecanismos patológicos al nivel de las células y moléculas en general y de genes en particular.
La "vieja genética" se ocupa fundamentalmente de las enfermedades en las cuales la responsabilidad del material hereditario es fundamental, tales como las enfermedades causadas por mutaciones en un gen, llamadas monogénicas o mendelianas, o por alteraciones en el número o la estructura de los cromosomas. Ejemplos de las primeras son la fibrosis quística del páncreas, el síndrome del cromosoma X frágil, la fenilcetonuria, la drepanocitosis y unas cinco mil enfermedades más. Ejemplos de las segundas son los síndromes de Down, de Turner, de Klinefelter, las translocaciones, deleciones, inversiones y otras alteraciones que pueden afectar cualquiera de los 24 cromosomas humanos.
Estas enfermedades tienen mucha importancia para las personas y las familias que las padecen, pero aún todas sumadas, son relativamente raras, no atañen a la mayoría de la gente, de manera que han jugado un papel menor en el ámbito sanitario y social, con excepción de los hospitales pediátricos de atención terciaria. Estas enfermedades suelen ser tan raras que se reservan para los genetistas clínicos y los consejeros genéticos, el resto de los médicos y salubristas han tenido muy poco que ver con ellas.
Por otro lado, vemos componentes genéticos muy importantes entre los primeros grandes grupos de causas de mortalidad en Costa Rica, a saber, enfermedades del aparato circulatorio (tasa 12,4 por 10 000 habitantes en el año 2000), el segundo grupo corresponde a los tumores con una tasa de 8,1; el tercero a causas externas con 4,3; el cuarto lugar a las enfermedades respiratorias con 3,9 y el quinto lugar enfermedades del aparato digestivo con una tasa de 2,7 por 10 000. La tasa de mortalidad infantil fue de 10,8 por 1 000 nacimientos en el cuatrienio 98-2000, las muertes infantiles son predominantemente neonatales, con una tasa en el 2001 de 7,4 por mil. La mortalidad materna fue de 3,6 por mil nacidos vivos en el año 2000 (1). La mayoría de las malformaciones congénitas y de las enfermedades comunes del adulto asociadas a este perfi l de mortalidad, obedecen a herencia multifactorial, es decir, a la interacción de una constelación de genes con el ambiente en el que se desenvuelve el individuo. Estas patologías sí que conciernen a los médicos especialistas y generales y por lo tanto, la "nueva genética" se integra a la atención de la salud desde el nivel primario.
Método
Se ha hecho una revisión de la literatura indexada de amplio acceso para tratar de esclarecer cuales han sido las bases científicas de la genómica para una potencial revolución sanitaria en Latinoamérica.
El Proyecto Genoma Humano (PGH):
El PGH es el primer gran esfuerzo coordinado internacionalmente en la historia de la Biología. En 1990 fue su lanzamiento oficial y a 15 años plazo y con un costo en ese momento calculado en tres billones de dólares, se proponía conocer con precisión las secuencias completas del genoma, o sea, del conjunto total de las 24 moléculas diferentes de ADN nuclear, ya que la única secuencia humana que se conocía era la del ADN mitocondrial (2). En realidad este objetivo se alcanzó antes de lo previsto y a un costo mucho menor, gracias a los adelantos tecnológicos concomitantes y a la "carrera" que desató la competencia con una compañía privada. La razón para querer conocer la secuencia del genoma es en última instancia, para conocer el rol de los genes en la salud y en la enfermedad (http://www.genome.gov).
Del microscopio de luz al secuenciador:
Recordemos que la información genética se transfi ere de una generación a la siguiente mediante unas estructuras llamadas cromosomas. Son 46 y vienen en pares, el óvulo tiene un miembro de cada par y el espermatozoide tiene al otro miembro, de manera que la célula una vez fecundada tiene 22 pares de cromosomas no sexuales o autosomas y el par sexual, que puede ser una pareja de cromosomas X y que por lo tanto se desarrollará en una niña o un par sexual X y Y que dirigirá el desarrollo hacia el fenotipo masculino.
Los cromosomas consisten en una molécula de ácido desoxirribonucleico o ADN estrechamente empaquetada y de varias proteínas que determinan su estructura y nivel de actividad. El ADN es un par de largas hebras de bases nucleotídicas enroscadas en ellas mismas. Las bases son cuatro y se llaman adenina, timina, citosina y guanina. Los genes son tramos específi cos de la molécula, que codifi can la información para hacer productos funcionales, como proteínas o moléculas de ácido ribonucleico o ARN.
El genoma humano contiene alrededor de tres billones de pares de bases químicas, si se imprimieran se llenaría 150 000 páginas de directorio telefónico. A menudo la enfermedad es causada por un cambio en una de esas tres billones de parejas de bases, o un error en una letra de todo ese enorme libro. Para los genetistas humanos es muy importante aislar los genes de las enfermedades, pero para lograrlo necesitan buenos mapas del genoma.
Los mapas pueden ser de tres tipos: citológico o citogenético, que se basa en la localización de marcadores dentro de rasgos citológicos como los patrones de bandeo; mapa genético o de ligamiento que se basa en la frecuencia de recombinación entre marcadores, siendo un marcador de ADN como un pueblo en un mapa de carreteras, y mapa físico de los cromosomas que se determina por las distancias moleculares que separan los marcadores, es decir, un sitio de otro de la molécula de ADN. Los tres tipos de mapas se integran en mapas de alta densidad de marcadores. Los marcadores que se mapean tanto física como genéticamente correlacionan ambos mapas entre sí y se llaman marcadores de anclaje.
Además de generar mapas, cada vez de mayor resolución, el PGH alcanzó la meta final de conocer la secuencia exacta o el orden en que se encuentran los pares de bases a lo largo de la molécula de ADN. El análisis de la secuencia sugiere que el genoma humano cuenta con 30- 35000 genes, pero aún no se ha terminado el análisis pues hay varias dificultades para establecer el número preciso de genes humanos. Los análisis de la variación de la secuencia genómica son importantes para la investigación antropológica y médica.
La estrategia para secuenciar el genoma nuclear básicamente fue primero construir un mapa genético de alta resolución para usarlo a modo de armazón para luego construir mapas físicos también con muy alta resolución hasta obtener la secuencia completa. Al mismo tiempo había que desarrollar proyectos auxiliares para el desarrollo de tecnologías y herramientas apropiadas y más baratas, secuenciar el genoma de otros cinco organismos modelo (E. coli, levadura, el gusano C. elegans, la mosca drosófila y el ratón) y dedicar recursos y trabajo a las implicaciones éticas, sociales y legales (ELSI) del PGH (3).
Los genomas de otros organismos
Además se secuenció ya el genoma de muchos organismos modelo, y aún más importante por sus aplicaciones médicas, el de muchos patógenos humanos, tales como Haemophilus influenzae, Mycobacterium tuberculosis, Campylobacter jejuni, Vibrio cholerae, Neisseria meningitides, Salmonella typhi, Plasmodium falciparum, Trypanosoma cruzi, Leishmania major y otros. Se ha hecho lo mismo con el genoma de vectores de enfermedades como el del mosquito transmisor de la malaria. El proyecto del genoma del ratón ha sido fundamental para comprender el funcionamiento de genes humanos, pues se sabe desde hace ya algún tiempo que largos segmentos de cromosomas muestran el mismo orden de los genes entre humanos y ratones. Estos animales son herramientas muy valiosas en la investigación genética por muchas razones, comparten con nosotros muchas similitudes anatómicas y fisiológicas, para muchas enfermedades humanas hay una contraparte murina y además es relativamente fácil producir mutaciones y desactivar genes del ratón para su estudio. La genómica de plantas es otra área de interés médico pues además de los efectos nutriciona les, la modifi cación genética de plantas puede ofrecer posibilidades muy importantes para dispensar a la población vacunas o agentes terapéuticos para el control de las enfermedades.
El fin de la era pre-genómica
Para abril del año 2003 las secuencias humanas y de los organismos modelo iniciales y de otros que se fueron agregando con el correr del tiempo, se encontraban en la Internet. Ese mismo mes, pero cincuenta años atrás, se publicó en la revista Nature artículos que cambiarían profundamente nuestra historia científica. Como preámbulo de estos artículos figuraba un título en mayúsculas de los editores: Estructura molecular de los ácidos nucleicos. Los periódicos de la época difundieron la noticia como el "descubrimiento del secreto de la vida".
Al descubrimiento de la estructura del ADN le siguió un periodo relativamente largo de silencio científico, no exento de observaciones críticas, pero sin aplicaciones clínicas directas. La falta de un desarrollo tecnológico paralelo al progreso de la ciencia básica suele producir este tipo de retraso. Hasta mediados de los años 70 no se estableció el método de secuenciación manual del ADN. Este proceso no sólo era lento sino que, además, tenía limitaciones técnicas importantes. El primer genoma de 5.000 bases de un virus se decodificó en 12 meses. Hoy, secuenciadores automáticos pueden desentrañar hasta un millón y medio de bases en 24 horas. Después llegó el método de amplificación del ADN mediante la llamada reacción en cadena de la enzima polimerasa (PCR), que permite multiplicar por un millón o más los fragmentos del genoma, de manera que pequeñas muestras sean accesibles a su estudio. Ha nacido la época genómica con sus aplicaciones e implicaciones médicas y forenses, legales y éticas.
El nacimiento de la medicina genómica
La era genómica nace el 14 de abril de 2003 cuando el PGH cerró la era pre-genómica al anunciar que se había alcanzado la última meta: la secuenciación completa del genoma humano, justamente 50 años después de la descripción de la doble hélice por Watson y Crick (4-6). El reto ahora es extraer sentido a la enorme cantidad de información de la secuencia del ADN, una herramienta de enorme utilidad para conseguir esto es el nuevo campo de la ciencia que comprende muchas disciplinas llamado bioinformática.
La información obtenida por el PGH es de uso limitado sin la anotación funcional, es decir ahora hay que hacer un catálogo de genes y averiguar cuál es su significado biológico. Las funciones de genes individuales se pueden describir a tres niveles, bioquímico, celular y en el organismo completo. Las relaciones funcionales entre los genes se deben estudiar a dos niveles, del trasnscriptoma y del proteoma. El primero es la colección completa de los ARN mensajero en una célula en particular, el segundo es la totalidad de las proteínas en la misma. Genómica funcional es el análisis global de la función de los genes. La genómica comparada es otro gran campo de estudio que se abre gracias a los logros en la secuenciación del genoma de organismos tales como el ratón, pues el genoma de los organismos modelo sirve para extraer información comparativa esencial para entender cómo funciona el genoma humano (7,8).
El potencial de la genómica en el campo de la salud
El PGH ha disminuido cien veces el costo de clonar un gen, los recursos bioinformáticos han sido fundamentales para facilitar la identificación de genes, además de los mapas y secuencias, el proyecto ha puesto a la disposición de la comunidad cientíca programas y servicios de mapeo y secuenciación que han convertido procesos tediosos y caros en baratos y más fáciles. La acumulación de la secuencia de los llamados organismos modelo ha contribuido enormemente al conocimiento de los genes y sus funciones biológicas, la genética humana se ha unido a la de todos los otros organismos del planeta y las comparaciones de secuencias entre especies son de gran ayuda para identificar los genes que intervienen en las enfermedades no mendelianas (9).
Enfermedades mendelianas (10)
La genética y la patología molecular están ya influyendo en la práctica clínica mediante la mejora de la clasificación de las enfermedades humanas. Estas disciplinas se basan en el reconocimiento de mutaciones genéticas y alteraciones de patrones de expresión de los productos codificados por los genes, es decir, las proteínas. Este enfoque ha permitido realizar diagnósticos más precisos, proporcionar datos de valor pronóstico y diseñar tratamientos individualizados para cada paciente. La identificación de más genes asociados a enfermedades monogénicas, amplía los alcances del diagnóstico prenatal y presintomático de las mismas. En el caso del síndrome de Kallman, hipogonadismo hipogonadotrófico con anosmia o hiposmia, enfermedad mendeliana de herencia ligada al cromosoma X, el mapeo por ligamiento ubicó el gen en Xp22.3, luego se hicieron mapas físicos con ADN clonado de esa región y comparando con el de otros mamíferos y pollos, se aisló el gen KALIG-1 (11).
El conocer cómo funcionan y se regulan los genes implicados y qué proteína o parte de proteína codifican nos permite discernir las bases moleculares y fisiológicas del fenotipo patológico y diseñar mejores estrategias de prevención y tratamiento, el tamizaje de mutaciones y el cálculo del riesgo individual (medicina personalizada), es un elemento fundamental para prevenir y tratar la enfermedad genética (12). Un ejemplo de cómo la medicina genómica puede contribuir al mejor abordaje de condiciones médicas comunes es el de Carmen, una embarazada de 34 años que va a su primera cita de control prenatal. Ella refiere el antecedente de trombosis venosa cinco años atrás cuando estaba tomando la píldora anticonceptiva y que la madre también tuvo trombosis venosa profunda cuando estaba embarazada de Carmen. El médico sospecha que la mujer padece una trombofilia hereditaria y en efecto, las pruebas genéticas realizadas en una muestra de sangre demuestran que es heterocigota para una mutación en el factor V Leiden que incrementa el riesgo de eventos trombóticos. En vista de este hecho y de su antecedente de tromboembolismo posiblemente asociado a estrógenos, Carmen es tratada durante su embarazo con heparina subcutánea profiláctica. Ella permanece asintomática y trae al mundo a un bebé sano de término. La medicina personalizada no parece alcanzable a corto plazo, el camino para llegar a ella no está exento de dificultades, por un lado conocer la secuencia de aminoácidos no siempre permite predecir la estructura de la proteína, por ejemplo, a pesar de que conocemos su secuencia desde hace décadas, aún no sabemos el mecanismo de regulación del gen de la globina. Por otro lado, las enfermedades mendelianas son un blanco relativamente fácil pero individualmente suelen ser muy raras. Las más frecuentes son las multifactoriales, pero presentan grandes desafíos y los científicos aún no se ponen de acuerdo en cuanto a cuál es la mejor estrategia para identificar genes de enfermedades de herencia compleja, la basada en mapas y desequilibrio de ligamiento o la basada en secuencias (9). Es por esto que las aplicaciones médicas más importantes pueden tardar bastante en desarrollarse.
Enfermedades transmisibles
Un claro ejemplo del potencial del conocimiento genómico para resolver problemas sanitarios de los países en desarrollo es el de la droga antimalaria fosmidomicina (13). El acceso público a la base de datos generada por el proyecto del genoma de la malaria permitió que científicos alemanes se percataran de que el parásito utiliza una vía enzimática crucial para su supervivencia llamada DOXP que está ausente en humanos. Esta misma vía es el blanco de la fosmidomicina, una droga desarrollada en Japón en los años 1970 pero que nunca se comercializó pues aunque demostró ser muy bien tolerada, incluso a dosis altas, resultó ineficaz para tratar sepsis urinarias recurrentes, para la cual se desarrolló. Los alemanes probaron esta droga en modelos murinos de malaria con resultados sorprendentes y los estudios clínicos en Tailandia y Gabón son muy promisorios.
El conocimiento de los patrones particulares de la expresión génica en patógenos y la definición de genes de virulencia también ha impulsado el desarrollo de vacunas contra la meningitis bacteriana, la tuberculosis, la malaria, entre otros. También se está progresando en el control de vectores, por ejemplo modificando el genoma del mosquito para reducir su habilidad de transmitir la malaria. Otra aplicación de la genómica es para conocer mejor la variabilidad del huésped en respuesta al agente infeccioso. Por ejemplo, una mutación en el gen CCR5 que codifica un receptor que utiliza el virus HIV para introducirse en las células se asocia con una resistencia muy marcada a la infección en las personas que son homocigotas. Las personas heterocigotas tienen períodos muy prolongados desde la infección hasta la manifestación de la enfermedad.
Otro avance en medicina genómica se refiere a la rápida identificación de nuevos patógenos como por ejemplo el causante de síndrome respiratorio agudo severo o SARS. Los primeros casos surgieron en China a finales del año 2002 y de allí el coronavirus se diseminó a Hong Kong y a Canadá. Una vez aislado el virus en un paciente canadiense se secuenció su genoma en nueve días y al día siguiente esta información estaba depositada en los bancos de datos públicos de la Internet (14). La epidemia mundial está ahora bajo control y se tiene un conocimiento mucho más amplio de la enfermedad gracias a la información contenida en el genoma viral.
Para muchos países latinoamericanos posiblemente es más importante, antes que volcar la mirada hacia la genómica, la aplicación de tecnologías diagnósticas basadas en ADN y ya bien establecidas, para el abordaje de las enfermedades transmisibles. El trabajo de Eva Harris y sus colegas del SSI (Instituto de Ciencias Sustentables) en la región ha demostrado que el diagnóstico de dengue y de leishmaniasis ha mejorado enormemente con el uso de la reacción en cadena de la polimerasa (PCR). Esta tecnología es más rápida, sensible y versátil, y lo más importante, más barata, que los métodos tradicionales de detección de una gran cantidad de patógenos. Con ella se descartó que un brote de fiebre hemorrágica en el norte de Nicaragua en 1995 fuera ocasionado por dengue y se identificó la culpabilidad de la leptospirosis. De igual manera se pudo contener un brote de dengue en Asunción, la capital de Paraguay, en 2001 (15).
Cáncer
En este campo se han desarrollado las aplicaciones más espectaculares de la biología celular y molecular. Conocemos cientos de genes relacionados con el cáncer como los oncogenes, los genes oncosupresores y los de reparación del ADN. Actualmente la tecnología de microarrays ha revolucionado aún más esta área (16). Los microarrays son cientos, miles o hasta decenas de miles de ensayos miniatura de biomoléculas como ADN, ARN y proteínas. Los perfiles de expresión génica que se obtienen con esta herramienta se utilizan para determinar el pronóstico y guiar la terapia del cáncer de mama, de próstata, de células renales, leucemias y linfomas, por ejemplo (17).
La sinergia de esfuerzos para desarrollar programas de investigación en cáncer llevada a cabo por el Proyecto Genoma del Cáncer Humano de Brasil, el Proyecto Anatomía del Genoma del Cáncer de E.U.A. y el Proyecto Genoma del Cáncer, del Reino Unido, ha permitido construir bases de datos integrales y totalmente accesibles a la comunidad científica para permitir la investigación básica y aplicada en cáncer (18).
Muchas formas de cáncer parecen resultar del daño adquirido en conjuntos específicos de genes, usualmente como consecuencia de agresores ambientales. Es probable que la investigación creciente en genes que confieren susceptibilidad a enfermar nos ayudará a entender los mecanismos de estas enfermedades y permitirá enfoques terapéuticos más focalizados para su prevención y tratamiento. En particular, deberá conducir al descubrimiento de moléculas específicas hacia las cuales dirigir la terapia. Por ejemplo, en el 70% de los melanomas malignos se encuentran mutaciones en el gen BRAF, y ya se están diseñando medicamentos con la proteína como diana y otros abordajes más modernos (19).
Envejecimiento
Los genomas de los organismos modelo han arrojado luz sobre un gen llamado DAF2 o "geromodulador" y gracias a las herramientas de estudio con que se cuenta actualmente, se buscan más genes de este tipo para estudiar la variación en su función y su relación con algunos de los cambios estructurales y la fisiopatología asociada al envejecimiento (21).
Farmacogenética y farmacogenómica
Las primeras observaciones clínicas de diferencias hereditarias en la respuesta medicamentosa se documentaron en la década de 1950, lo cual originó el campo de la farmacogenética y luego de la farmacogenómica (21). Estos campos se dedican al estudio de la variación genética o genómica en la respuesta a los medicamentos y se espera que este conocimiento mejore la seguridad y la eficacia de los mismos (22). Otra disciplina emergente que combina las herramientas de la genómica y de la química es la quimiogenómica, que se define como el estudio de la respuesta genómica y proteómica de un sistema biológico intacto, desde células aisladas hasta un organismo entero, ante compuestos químicos, o el estudio de la habilidad de interacción de dianas moleculares aisladas con esos compuestos (23). La esperanza es que esta nueva ciencia identifique y valide dianas terapéuticas y detecte medica mentos candidatos para generar rápida y efectivamente nuevos tratamientos para muchas enfermedades humanas.
Terapia génica (24)
Este término abarca una variedad de abordajes para el tratamiento de enfermedades mediante la alteración del componente genético de células u órganos. Aunque se ha investigado mucho en la terapia génica somática, hasta la fecha ha habido poco éxito en este campo. El reto mayor ha sido poder conseguir transferir ADN a un número sufi ciente de células para obtener respuesta terapéutica sostenida en el tiempo. Los resultados más promisorios obtenidos hasta ahora han sido para las enfermedades genéticas en las cuales el gen insertado no necesita ni estar estrechamente regulado ni altos niveles de expresión.
Genómica de plantas y salud humana
Se proyecta que los requerimientos alimenticios de los países en desarrollo se duplicarán para el año 2025. Se espera además que las semillas genéticamente modificadas provean a esta población de sufi cientes cosechas de alimentos de valor nutritivo incrementado y resistentes a las plagas. Otra aplicación sanitaria fundamental es la de las vacunas comestibles. Un ejemplo promisorio es la producción de antígeno de superficie de hepatitis B en plantas transgénicas (25). Actualmente se investiga en producción de vacunas contra cólera, sarampión y virus papiloma humano. Si se tiene éxito, todas estas iniciativas tendrán un impacto muy importante para los países en desarrollo.
Medicina forense (26)
La genómica está causando ya un fuerte impacto en la medicina forense. Puesto que nuestro ADN contiene muchas regiones que son sumamente variables en su estructura, no hay dos personas iguales, excepto los gemelos idénticos, con respecto al patrón que se produce cuando el ADN es enzimáticamente cortado en pequeños fragmentos. Estas huellas genéticas se obtienen de muchos fluidos y tejidos, aún después de muchos años, pues el ADN es relativamente estable.
La medicina genómica y el futuro de la atención de la salud
La relevancia clínica de la variación genómica
La variación genómica entre los individuos y que nos hace únicos, con excepción de los gemelos idénticos, es de 0.1% del genoma, es decir, somos diferentes en alrededor de 3 millones de bases. Esta variación es la base de la medicina personalizada y de la farmacogenómica (4,5).
Los polimorfismos de un solo nucleótido (SNPs) son variaciones comunes de una sola base que ocurren en el ADN humano con una frecuencia de aproximadamente una de cada mil bases. Estas variaciones se pueden emplear para rastrear patrones de herencia familiar. Los haplotipos son colecciones de SNPs que se heredan en bloque. El PGH ha facilitado enormemente el descubrimiento y la catalogación de los SNPs.
El estudio de los SNPs podría permitir la predicción de la susceptibilidad hacia una enfermedad y el pronóstico de la misma. La susceptibilidad a la cardiopatía por ejemplo, ha sido relacionada con numerosos genes, incluyendo APOE, cuyas variantes elevan o disminuyen los niveles séricos de lipoproteínas de baja densidad pero solamente tienen un impacto significativo en el riesgo individual de enfermedad cardiovascular cuando la persona fuma. El tabaquismo triplica el riesgo entre los portadores de la variante 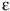
La identificación de SNPs también puede ayudar a individualizar la terapia medicamentosa, potenciando su eficacia y minimizando su toxicidad. Se han identificado más de 20 SNPs en el sistema del citocromo (CYP) p450, una familia de enzimas hepáticas que metabolizan la mayoría de los medicamentos usados en la práctica clínica. Algunos SNPs disminuyen la actividad de estas enzimas, lo que incrementa la toxicidad, mientras que otros la aumentan, con lo que no se alcanzan concentraciones terapéuticas. En pacientes anticoagulados con warfarina, la variación en un único gen CYPP2C9 puede hacer a una persona cinco veces más sensible a la droga y susceptibles a hemorragias internas severas por sobredosis (28).
Las implicaciones éticas, legales y sociales de la medicina genómica (29)
El uso apropiado del nuevo conocimiento y de las nuevas capacidades en materia de genómica, su potencial abuso o mal uso, lo mismo que las medidas para evitar esto último, dependen en gran medida del contexto social, legal, político, económico y cultural de cada pueblo. Las preocupaciones de los norteamericanos, quienes aseguran su salud a través de compañías privadas, probablemente no son las mismas que las de los países con servicios solidarios de atención de la salud. Sin embargo, hay temas clave que deben ser considerados por todos los países, ricos y pobres, desarrollados o no y son:
Consentimiento informado, obtenido en estricto apego a todas las normas bioéticas, para todos los casos de investigación, programas de tamizaje genético, pruebas genéticas, las que deben incluir asesoramiento pre y post ensayo, establecimiento de bancos de ADN y cualquier otra intervención. En materia de genética, la gente debe tener el derecho a no saber y a no actuar, con excepción del tamizaje neonatal. En este caso, el diagnóstico precoz y el tratamiento adecuado previenen las complicaciones y secuelas de la enfermedad genética que padece el recién nacido y por lo tanto es obligatorio, ya que el Estado tiene el derecho y el deber de proteger la salud de los niños.
Confidencialidad de la información genética para prevenir la discriminación y la estigmatización, la única razón para que el médico rompa el contrato de confidencialidad con su paciente es en el caso de posible daño serio a familiares del mismo y cuando el paciente se niega a revelar información genética vital para la atención de la salud de sus familiares. Los países deben asegurar la igualdad de derechos de todos los hombres sin importar su perfil genético, sobre todo en el campo de los seguros y el empleo.
Asuntos de género, en las sociedades en las que los derechos de las mujeres son irrespetados, la información genética puede ser que no se les ofrezca o que se use de manera muy perjudicial para ellas. Podrían ser obligadas a someterse o a abstenerse de hacerse una prueba genética, no tener libertad reproductora, evitar el nacimiento de bebés del sexo femenino y otras injusticias.
Eugenesia, se deben evitar los errores morales históricos de los movimientos eugenésicos tales como prejuicios de raza, clase social y nacionalidad, irrespeto a los derechos reproductores, intolerancia a las diferentes interpretaciones de lo que es un individuo valioso, una vida y sociedad buenas, abuso e inequidades del poder, sacrificio de los intereses y derechos individuales en aras del supuesto mayor bien común y otros. Sin embargo, se debe también tener cuidado de no satanizar acciones de salud en materia de genética tachándolas de prácticas eugenésicas. Se puede abusar de la ambigüedad del término para condenar acciones que algunos grupos sociales desaprueban por razones religiosas, por ejemplo.
Intervenciones no terapéuticas, serían las dirigidas a mejorar características naturales y ofrecer ventajas a sus poseedores. Lo más probable es que solamente los padres adinerados puedan costear estas intervenciones a sus hijos, para que tengan mejor sistema inmunológico, más inteligencia, mejor memoria Si esto llegara a ser posible, habrá que dedicarse a evaluar las consideraciones éticas pertinentes.
Terapia génica, tratándose de células somáticas no parece haber problemas, pero la terapia génica de células germinales conlleva la posibilidad de alterar la constitución genética de las futuras generaciones, a las cuales no se les ha solicitado consentimiento para ello, de manera que está prohibida en la mayoría de los países. La terapia con células madre hace entrar en conflicto los intereses terapéuticos y los derechos del embrión humano, lo mismo que la clonación humana con fines terapéuticos, que no es lo mismo que la clonación reproductora. La diferencia entre ambas es muy clara y la clonación reproductora se puede prohibir sin que se afecte la clonación terapéutica.
Acceso a los servicios genéticos, lamentablemente en muchos países está restringido a las clases sociales con capacidad económica alta. Esto genera una situación de injusticia que debe ser remediada. Por ejemplo en Costa Rica, como en muchos otros países latinoamericanos, las mujeres que se benefician del tamizaje prenatal y del diagnóstico fetal para prevenir el nacimiento de hijos afectados por trisomía y otros defectos cromosómicos son las que cuentan con medios económicos que les permiten acceder al aborto selectivo más allá de nuestras fronteras. La gran mayoría de mujeres, se tiene que resignar a esperar el momento en que el feto muera, ya sea en su vientre o después de nacer, o en los casos compatibles con la vida extrauterina, se tendrán que conformar con prepararse para criar a un hijo que tendrá retraso mental y posiblemente malformaciones congénitas asociadas (30).
Conclusiones
Muchas de las aplicaciones sanitarias de la investigación genómica serán muy valiosas pero probablemente muy caras, sobre todo al principio. A esto se podría sumar gastos excesivos por concepto de propiedad intelectual y patentamiento de la información genómica básica. Existe el riesgo de que esto aumente la disparidad en atención de la salud que existe no sólo entre países sino también dentro de los países.
Muchas de las susceptibilidades individuales a enfermar que podría descubrir la medicina genómica se deberán abordar a través de la modificación del ambiente, el cual es mucho más fácil de modificar que los genes. La pregunta es si estará la gente preparada o dispuesta para hacer los cambios necesarios en sus vidas o preferirán sucumbir ante el determinismo genético.
Los países más pobres deberán hacer esfuerzos para desarrollar la biotecnología necesaria para obtener los beneficios más importantes de la genómica pues lo más probable es que las transnacionales biocientíficas y farmacéuticas no se interesen en estos mercados ni en enfermedades propias de países menos desarrollados.
Los países deben establecer marcos reguladores para evitar el mal uso y el abuso de las nuevas tecnologías generadas por el PGH.
La sociedad latinoamericana debe prepararse adecuadamente para la era de la genómica y sus consecuencias, la información y la educación científica y genética básicas deben mejorar y extenderse al grueso de la población.
Durante los siguientes diez o quince años estaremos recogiendo y analizando la información obtenida por los proyectos genoma y las aportaciones terapéuticas serán moderadas.
A pesar de que los nuevos descubrimientos sobre los genes ofrecen oportunidades crecientes para la investigación médica, también se requiere de investigación en el campo de la salud pública para traducir esos descubrimientos genéticos en acciones personales y de salud pública que mejoren la salud y prevengan las enfermedades. Los estudios de epidemiología, políticas y ciencias de la comunicación, así como la investigación sobre los servicios de salud, son cruciales para permitir que la medicina genómica sea una realidad en el siglo 21 (31).
Referencias
1. Anónimo. República de Costa Rica. Política Nacional de Salud. 2002-2006. San José, Marzo 2003. [ Links ]
2. Guyer MS, Collins FS. The Human Genome Project and the future of medicine. AJDC 1993; 147:1145-52. [ Links ]
3. Jordan E. Invited editorial: the human genome project: where did it come from, where is it going?. Am J Hum Genet 1992; 51:1-6. [ Links ]
4. Guttmacher AE, Collins FS. Welcome to the genomic era. N Eng J Med 2003; 349:996-98. [ Links ]
5. Collins FS, Green ED, Guttmacher A E, Guyer MS. A vision for the future of genomics research. A blueprint for the genomic era. Nature 2003; 422:835-47. [ Links ]
6. Carpenter AE, Sabatini DM. Systematic genomewide screens of gene function. Nat Rev Genet 2004; 5:11-22. [ Links ]
7. Steinmetz LM, Davis RW. Maximizing the potential of functional genomics. Nat Rev Genet 2004; 5:190-201. [ Links ]
8. Botstein D, Risch N. Discovering genotypes underlying human phenotypes: past successes for mendelian disease, future approaches for complex disease. Nat Genet suppl 2003; 33:228-36. [ Links ]
9. Burke W. Genomics as a probe for disease biology. N Engl J Med 2003; 349:969-74. [ Links ]
10. Hardelin JP. Kallman syndrome: towards molecular pathogenesis. Mol Cell Endocrinol 2001; 179:75-81. [ Links ]
11. Sander C. Genomic medicine and the future of health care. Science 2000; 287:1977-78. [ Links ]
13. Jomaa H, Wiesner J, Sanderbrand S, Altincicek B, Weidemeyer C, Hintz M et al. Inhibitors of the nonmevalonate pathway of isoprenoid biosynthesis as antimalarial drugs. Science 1999; 285:1573-76. [ Links ]
14. Marra MA, Jones SJM, Astell CR, Holt RA, Brooks-Wilson A, Butterfield Y SN, et al. The genome sequence of the SARS-associated coronavirus. Science 2003; 300:1399-404. [ Links ]
15. World Health Organization. Genomics and World Health. Report of the advisory committee on health research. Geneva 2002. [ Links ]
16. Shergill IS, Shergill NK, Arya M, Patel HRH. Tissue microarrays: a current medical research tool. Curr Med Res Opin 2004; 20:707-12. [ Links ]
17. Macoska JA. The progressing clinical utility of DNA microarrays. CA 2002; 52:50-9. [ Links ]
18. Strausberg RL, Simpson AJG, Wooster R. Sequence-based cancer genomics: progress, lessons and opportunities. Nat Rev Gen 2003; 4:409-18. [ Links ]
19. Sumimoto H, Miyagishi M, Miyoshi H, Yamagata S, Shimizu A, Taira K et al. Inhibition of growth and invasive ability of melanoma by inactivation of mutated BRAF with lentivirus-mediated RNA interference. Oncogene 2004; publicación electrónica. [ Links ]
20. Yu H, Larsen PL. DAF-16-dependent and independent expression targets of DAF-2 insulin receptor-like pathway in Caenorhabditis elegans include FKBPs. J Mol Biol 2001; 314:1017-28. [ Links ]
21. Evans WE, McLeod HL. Pharmacogenomics – drug disposition, drug targets, and side effects. N Engl J Med 2003; 348:538-48. [ Links ]
22. Weinshilboum R. Inheritance and drug response. N Engl J Med 2003; 348:529-37. [ Links ]
23. Bredel M, Jacoby E. Chemogenomics: an emerging strategy for rapid target and drug discovery. Nat Rev Genet 2004; 5:262-75. [ Links ]
24. Kimmelman J. Recent developments in gene transfer: risk and ethics. BMJ 2005;330:79-82. [ Links ]
25. Ma JKC, Drake PMW, Christou P. The production of recombinant pharmaceutical proteins in plants. Rev Nat Genet 2003; 4:794-805. [ Links ]
26. Butler JM. Genetics and genomics of core short tandem repeat loci used in human identity testing. J Forensic Sci. 2006; 51:253-65. [ Links ]
27. Guttmacher AE, Collins FS. Genomic medicine - a primer. N Eng J Med 2002; 347:1512-20. [ Links ]
28. Kansagra S, List J. The clinical relevance of genomic variation. JAMA 2004; 291:1641. [ Links ]
29. Clayton EW. Ethical, legal, and social implications of genomic medicine. N Engl J Med 2003; 349:562-9. [ Links ]
30. Castro Volio I. El diagnóstico prenatal de defectos cromosómicos en Costa Rica. Rev Biol Trop 2004; 52: 545-49. [ Links ]
31. Khoury MJ. Human genome epidemiology: translating advances in human genetics into population-based data for medicine and public health. Genetics in Medicine 1999;1:71-4. [ Links ]
* Sección de Genética Humana, Instituto de Investigaciones en Salud, Ciudad de la Investigación de la Universidad de Costa Rica, San Pedro 2060, San José, Costa Rica.
Correo electrónico icastro@cariari.ucr.ac.cr













