Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Costarricense de Ciencias Médicas
Print version ISSN 0253-2948
Rev. costarric. cienc. méd vol.24 n.1-2 San José Jan. 2003
Resumen
Se analizaron 420 muestras diarreicas de pacientes admitidos en el Hospital San Vito, Puntarenas; Costa Rica durante enero del 2001 a enero del 2002 y se determinó el porcentaje de resistencia de Shigella sp a 8 antibióticos de primera línea. El 65,1% de las cepas se aislaron durante los meses de octubre a diciembre de12001. Se aislaron 142 cepas de Shigella flexneri y 6 de Shigella sonnei. El 70% mostraron resistencia a TrimetoprinSulfametoxazole, tetraciclina y ampicilina, siendo todas las cepas sensibles a la gentamicina, cefotaxima y ciprofloxacina.
El estudio mostró que la mayoría de las cepas aisladas presentaron una alta resistencia a los antibióticos comúnmente utilizados en el tratamiento de las enfermedades diarreicas. Por lo tanto, se recomienda un monitoreo continuo de los patrones de resistencia para un subsecuente tratamiento. (Rev Costarric Cienc Med 2003; 24:55-60).
Palabras clave: Shigella, diarrea, resistencia.
Abstract
Among 420 diarrheic simples from patients from the San Vito Hospital, Puntarenas, Costa Rica, were essayed from 2001, January to 2002, January.
The percentage of resistance of Shigella sp; to eight of the first line antibiotics, was determined.
The 65.1 % of the strains were isolated between October and December of 2001. One hundred and forty two of the strains isolated were Shigella flexneri and six were Shigella sonnei. The 70% of the strains shown resistance to Trimethoprim / Sulfametoxazole, tetracycline and ampicillin. AII of the strains were susceptibles to gentamicin, cefotaxime and ciprofloxacin.
The case studies determined that most of the strains isolated, have an higher resistant rate to the most used antibiotics in treatment against diarrheic illness. For hence, it is important the continual monitoring of the resistance patterns for a subsequentt reatment.
Key words: Shigella, diarrheic, resistance.
Introducción
Las enfermedades diarreicas representan una causa significativa de morbilidad y mortalidad en todo el mundo, especialmente en los países en desarrollo (1 ). La etiología infecciosa de estas enfermedades es muy variada, incluyendo desde agentes virales, protozoarios y bacterias; estas últimas global mente representan aproximadamente un 80% de los casos (2 ) , excluyendo los periodos epidémicos debidos a agentes particulares, como ocurre anualmente con rota virus (3 ). Uno de los agentes bacterianos más importantes por la severidad de los cuadros inducidos es Shigella . Se estima que anualmente provoca unos 164,7 millones de casos y el 99% de ellos ocurre en países en desarrollo y la mayoría de las muertes ocasionadas ocurren en niños menores de 5 años. En el 60% de los aislamientos se identifica a Shigella fIexneri y un 15% corresponde a Shigella sonnei ( 4 ).
En Costa Rica la mayoría de los estudios sobre etiología de las enfermedades diarréicas se ha centrado en población infantil, sin embargo hay estudios relacionados efectuados por Achí y colaboradores. En el Cantón de Coto Brus, Provincia de Puntarenas durante el año 2000 se informó de un total de 3 019 casos de enfermedad diarreica, de los cuales solamente 14 fueron atribuidos a Shigella sp. (5 ). Sin embargo, en el año 2001 se presentó un aumento en el número de aislamientos de Shigella llegando a 135, manteniéndose un comportamiento similar a la presentada el año anterior, ya que se diagnosticaron 3.078 casos. Además de Shigella, se buscó Salmonella y Vibrio; agentes que no se aislaron durante ese período. El tratamiento habitual según las normas de atención utilizados desde la década de los noventas por los médicos del Hospital San Vito, ha sido Trimetoprim-sulfa y Ampicilina, aunque en numerosos estudios se ha demostrado una alta resistencia de esta bacteria hacia estas drogas comúnmente prescritas en diferentes partes del mundo ( 6-10 ). El objetivo de este estudio es conocer el patrón de resistencia a los antibióticos de las cepas aisladas en el Laboratorio Clínico del Hospital San Vito durante el año 2001.
Materiales y métodos
Muestras clínicas. Se analizaron 420 muestras de heces de pacientes que fueron atendidos en el Servicio de Urgencias, en el EBAIS u hospitalizados entre enero del 2001 y enero del 2002. Se descartaron las muestras repetitivas de pacientes incluidos en el estudio.
Medio de cultivo. De cada muestra se inoculó un plato de Agar Salmonella-Shigella (MERCK), y un plato de Agar TiosuIfato-citrato-biIis -sacarosa (DIFCO). Sin embargo, durante los meses de octubre, noviembre y diciembre la cantidad de coprocultivos procesados aumentó y dado que las características clínicas, epidemiológicas y de que se estaba aislando fundamentalmente Shigella sp; se procedió a inocular únicamente en platos de Agar Salmonella-Shigella.
Identificación. Los microorganismos lactosa negativas que por morfología colonial sugieren ser una posible cepa de Shigella, se identificaron por medio de serología, empleando antisueros específicos para especies de Shigella (DIFCO).
Sensibilidad a los antimicrobianos. A todas las cepas aisladas de Shigella se les determinó la sensibilidad a los antibióticos mediante la técnica de difusión en agar, siguiendo el método estándarizado de Kirby-Bauer ( 11 ), utilizando Agar Müeller-Hinton (MERCK). Se utilizaron sensidiscos de ampicilina (10 µg), cefotaxime (30 µg), cloranfenicol (30 µg), ciprofloxacina (30 µg), gentamicina (30 µg), eritromicina (30 µg), y trimetoprimsulfametoxazole (1,25/23,75 µg) todos de la compañía (BBL).
Resultados
De las 420 muestra procesadas, en 148 (35,2%) se obtuvo cepas de Shigella, de las cuales 142 (96%) correspondieron a S. fIexneri y 6 (4%) a S. sonnei. Esas cepas fueron aisladas de 81 (54,7%) mujeres y 67 (45,3%) hombres. No hubo diferencias importantes en la distribución por sexo, de acuerdo al número total de casos. Ladistribución mensual se expresa en el Gráfico 1 , que permite ver la presencia de un brote de diarrea, ocurrido entre los meses de octubre, noviembre y diciembre de 2001 y enero de 2002. El pico máximo ocurrió durante diciembre, cuando se presentaron 47 (32%) casos del total presentado durante los 13 meses de estudio.
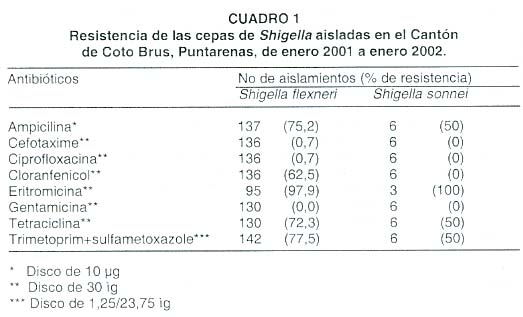
El análisis de los patrones de sensibilidad a los antibióticos de cepas de S. fIexneri mostró un patrón alto de resistencia, pues el 77,5% eran resistentes a trimetoprim + sulfametoxazol, 72,3% a tetraciclina, el 73,7% a ampicilina y el 17,6% y el 13,7% fueron resistentes a cloranfenicol y eritromicina, respectivamente. Sin embargo, el perfil de sensibilidad de estos dos últimos antibióticos es igualmente bajo que el mostrado con los otros antibióticos evaluados, pues solo el 2,1% de las cepas fueron sensibles a eritromicina, ya que el 84,2% de las cepas fueron catalogadas como de sensibilidad intermedia; para el cloranfenicol ese porcentaje fue del 44,9, lo que relega las cepas sensibles solo al 37,5%.
Todas las cepas evaluadas fueron sensibles a la gentamicina y el 99,3% fueron sensibles a cefotaxima y ciprofloxacina. En el cuadro 1 se muestra los patrones de sensibilidad a los antibióticos evaluados. Las seis cepas de S. sonnei aisladas siguen un patrón similar, resaltando la resistencia hacia trimetoprim-sulfametoxazol, tetraciclina, eritromicina y ampicilina.
En cuanto a la distribución por edad en el brote de octubre del 2001 a enero del 2002, el grupo de edad más afectado es el de 20 a 59 años, en el cual se presentaron 37 casos, siguiéndole en frecuencia, con 22 casos en el grupo de 1 a 4 años y con 19 casos en el grupo de 60 o más años.
En relación con la prevalencia de enfermedades diarreicas por mes durante el período estudiado se encontró que durante 11 de los 13 meses estudiados las diarreas excedieron los 200 casos mensuales yen los meses de octubre, noviembre y diciembre el número de casos de diarrea excedió los 300 mensuales. Esto demuestra una alta frecuencia de aislamiento de Shigella durante esos meses, como se demuestra en la figura 1 .
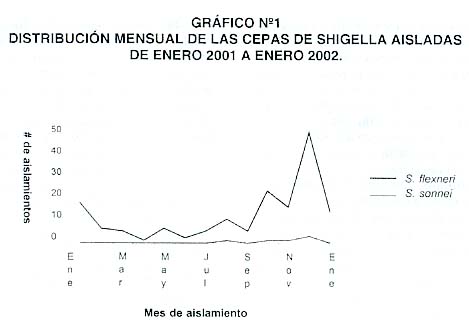
Discusión
En este estudio Shigella fIexneri representó el 96% de los aislamientos de las muestras de heces de pacientes con diarrea durante el año 2001; aunque la mayoría de esos aislamientos se hicieron entre los meses de octubre a diciembre, que correspondieron al 61,5% del total de las cepas de Shigella aisladas durante el período estudiado. No se encontró una diferencia importante en la distribución por sexo, similar a lo informado por otros autores (7 ).
Los datos sobre el patrón de sensibilidad a los antibióticos obtenidos en este estudio, corroboran el problema que se presenta prácticamente en todo el mundo, especialmente asociado a las cepas bacterianas aisladas a partir de casos de diarrea ( 12 ). Más del 70% de las cepas evaluadas era resistente a trimetoprim+suIfametoxazole, tetraciclina y ampicilina, lo que concuerda con datos de otras investigaciones en diversos países (7 , 9 , 11 ). También, en el caso del cloranfenicol se obtuvo una baja sensibilidad tala como se ha publicado en otras latitudes (6 ,13 ,14 ). Con respecto a la sensibilidad a gentamicina, ciprofloxacina y cefotaxime nuestros hallazgos mostraron que más del 95% de las cepas aisladas fueron sensibles a estos antimicrobianos, lo cual es acorde con datos de otros países (9 , 10 ,15 ).
El patrón de resistencia tan exacerbado contra la mayoría de los antibióticos evaluados podría ser explicado por el uso indiscriminado de antibióticos que han llevado a seleccionar cepas altamente resistentes. Tales hallazgos permiten concluir que los antibióticos de primera línea tales como ampicilina, trimetoprim+suIfametoxazole, tetraciclina y cloranfenicol muestran un alarmante porcentaje de resistencia, lo que también se ha informado como un problema mundial (16-18 ). Ello nos lleva a pensar que su efectividad como tratamiento habitual no es la respuesta que se espera (2 ), por lo que se hace necesario realizar una evaluación para desarrollar un nuevo protocolo de tratamiento, siempre y cuando el uso de los antibióticos sea necesario (17 ,19 ).
En nuestro estudio se determinó, que los antibióticos a administrar en caso necesario son: gentamicina, cefotaxime y ciprofloxacina, con la limitación de que los dos primeros requieren hospitalización, lo que aumenta el costo del tratamiento; en tanto, la ciprofloxacina se puede utilizar ambulatoriamente, pero aparte de su alto costo en Costa Rica, la Comisión Nacional de Farmacoterapia restringió su uso en niños menores de dos años y mujeres embarazadas.
El curso de la enfermedad diarreica por Shigella es autolimitada y más del 50% de los casos se resuelve en periodo menor de tres días (20 ); el aIto costo de los antibióticos y aún peor el problema de la resistencia a patógenos entéricos nos obliga a evitar el uso rutinario de éstos en forma empírica. En casos de pacientes diabéticos, con cirrosis o inmunosuprimidos se debe considerar el uso de antibióticos efectivos, así como a aquellos niños y personas de edad avanzada que presenten complicaciones. Lo que se recomienda es un manejo adecuado de rehidratación, monitoreo de electrolitos y nutrición adecuada. Además, es importante enfatizar las medidas preventivas primarias, como la adecuada disposición de las heces, el lavado de manos, control de las poblaciones de moscas y en general, todas las normas de higiene que eviten la transmisión de los agentes patógenos relacionados con las diarreas.
Referencias
1. Bern C, Martines J, deZoysa I, Glass RI. Magnitude of the global problem of diarrheal disease: a ten-year update. Bull World Health Organ 1992;70:705-14. [ Links ]
2. Adachi JA, Ostrosky-Zeichner L, DuPont HL; Ericsson CD . Empirical antimicrobial therapy for traveler"s diarrhea. Glin Infect Dis 2000; 31: 1079-1083. [ Links ]
3. González P, Sánchez A, Rivera P, Jiménez C, Hernández F. Rotavirus and corona virus outbreak: etiology of annual diarrea in Costa Rican children. Rev Biol Trop 1997,45:989-991. [ Links ]
4. Kotloff KL, Winickoff JP, Ivanoff B, Clemens JD, Swedlow DL, Sansonetti PJ, Adak GK, Levine MM. Global burden of Shigella infections: Implications for vaccine development and implementation of control strategies. Bull World Health Organ 1999;77:651-666. [ Links ]
5. Hospital San Vito. Diarreas reportadas. REDES, Boletín Estadístico Mensual Hospital San Vito. Diciembre 2001.Pág 49. [ Links ]
6. Wasfy MO, Oyofo BA, David JC, Ismail TF, el-Gendy AM, Mohran ZS, Sultan Y, Peruski LF Jr. Isolation and antibiotic susceptibility of Salmonella, Shigella and Gampylobacter from acute enteric infections en Egypt. J Health Popul Nutr 2000; 18 (1):338. [ Links ]
7. Replogle ML, Fleming DW, Cieslak PRo Emergence of antimicrobial resistant Shigellosis in Oregon. Glin Infect Dis 2000;30:515-9 [ Links ]
8. Hoge CW, Gambel JM, Srijan A, Pitarangsi C, Echeverria P. Trends in antibiotic resistance among diarrheal pathogens isolated in Thailand over 15 years. Clin Infect Ois 1998;26:341-5.
9. Niyogi SK, Mitra U, Dutta P. Changing patterns of serotypes and antimicrobial susceptibilities of Shigella species isolated from children in Calcutta, India. Jpn J Infect Dis 2001; 54:121-122. [ Links ]
10. Lee JC, Kim KS, Jeong YW, Cho JW, Park JC, Seol SY, Cho DT. Antimicrobial resistance of Shigella sonnei in Korea during the last two decades. APMIS 2001; 109 (3):228-34.
11. Bauer AW, Kirby WM, Sherris JC, Turck M, Antibioitic susceptibility testing by standardized single disk method. Am J Clin Pathol 1966; 45: 493-96 [ Links ]
12. Tenvor FC, Hughes JM, The challenges of emerging infectious diseases: development and spread of multiply-resistant bacterial pathogens. JAMA 1996; 275(4):300-4. [ Links ]
13. Shapiro RL, Kumar L, PhillipsHoward P, Wells JG, Adock P, Brooks J, Ackers ML, Ochieng JB, Mintz E, Wahlquist S, Waiyaki P, Slutsker L. Antimicrobial-resistant bacterial diarrheal in rural western Kenya. J Infect Dis 2001; 183: 1701-4. [ Links ]
14. Ahmed AA, Osman H, Mansour AM, Musa HA, Ahmed AB, Oarrar Z, Hassan HS. Antimicrobial agent resistance in bacterial isolates from patients with diarrhea and urinary tract infections in the Sudan. Am J Trop Hyg 2000;63(5,6):259-63. [ Links ]
15. Legros D, Ochola D, Lwanga N, Guma G. antibiotic sensibility or endemic Shigella in Mbarara, Ufanda. East Afr Med J 1998: 75(3):160-1 [ Links ]
16. Kiliç D, Tulek, Tuncer G, Dogancy L, Willke A. Antimicrobial susceptibilities and ESBL production rates of Salmonella Kand K Shigella strains in Turkey. Eur J Clin Microbiol lnfect Dis 2001; 7(6):341-42. [ Links ]
17. Oldfield 3rd EC, Wallace MR. The role of antibiotics in the treatment of infectious diarrhea. Gastro-enterol Clin North Am 2001;30(3):817-36. [ Links ]
18. Sack RB, Rahman M, Yunus M, Khan EH. Antimicrobial resistance in organisms causing diarrheal disease. Clin Infect Dis 1997; 24(Suppl 1 ):S102-5. [ Links ]
19. Nataro James P. Treatment of bacterial enteritis. Pediatr Infect Dis J 1998;17(5):420-1 [ Links ]
20. Goodman L, Segreti J. Infectious diarrhea. Dis Mon 1999;45:265. [ Links ]
1 . Laboratorio Clínico, Hospital de San Vito, CCSS, Puntarenas, Costa Rica.
* Correspondencia.













