Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Costarricense de Ciencias Médicas
Print version ISSN 0253-2948
Rev. costarric. cienc. méd vol.23 n.3-4 San José Dec. 2002
Resumen
Las flotaciones algales nocivas son fenómenos que están bien caracterizados en algunas partes del mundo, debido al impacto que pueden provocar en los ecosistemas, los efectos adversos que estos fenómenos pueden ocasionar en la salud humana y los problemas económicos y sociales asociados a la reducción de ingresos por parte de los pobladores de las regiones afectadas. Costa Rica no es una excepción a estos eventos algales. Desde la década pasada se ha observado un aumento en frecuencia y duración de los microorganismos capaces de originar FAN. Se tiene poco conocimiento sobre la dinámica de estos eventos en nuestro país. En este estudio se recolectaron muestras de agua en diversos sectores del Golfo de Nicoya (long. 85ºW y lat. 10ºN) sobre la superficie y a 5 metros de profundidad. Se encontraron 33 especies de microalgas: 24 especies de dinoflagelados, 8 diatomeas y 1 cianobacteria las cuales fueron analizadas morfológicamente mediante microscopio óptica y microscopio electrónica comparándolas con bases de datos y fuentes bibliográficas describiendo además la probable potencialidad toxica o dañina de cada una de ellas.
Palabras clave
flotaciones algales nocivas, fitoplancton, toxinas marinas, dinofiagelados, microalgas, cianobacterias.
Abstract
The harmful algae blooms are very weil known and characterized phenomena in some parts of the worid, due to the negative impact that they cause in the ecosystems, the adverse effects in the human health together with economic and social problems associated to the decrease in the revenues of the residents of the affected regions. Costa Rica is not an exception to these algae events. From last decade an increase in frequency, and duration of the microorganisms able to originate HAB has been observed. The dynamics and causative factors of these events are not weil known in our country. In this study we collected samples of the water in diverse sectors of the Gulf of Nicoya (long. 85ºW and lat. 10ºN) on the surface and 5 meters deep. We found 33 microalgae species: 24 dinoflagellates species, 8 diatoms and 1 cyanobacteria. They were analyzed, characterized and describes by light microscopy and scanning electron microscopy comparing them with public databases and bibliographical sources. We also describes the possible toxic or harmf u¡ potential of each specie.
Key Words
Harmful algae blooms, phytoplankton, marine toxins, dinofiagellates, microalgae, cyanobacteria.
Introducción
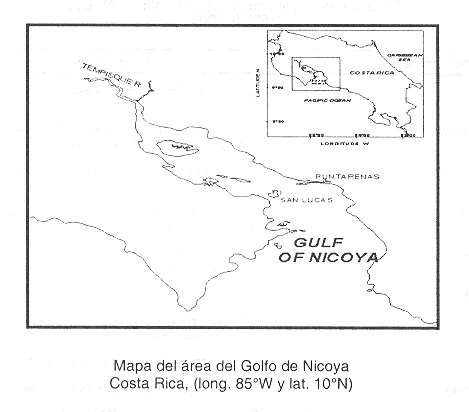
Las flotaciones algales son discoloraciones del agua debidas a proliferaciones de microorganismos planctónicos pigmentados que pueden ser microalgas, ciliados y bacterias, que alcanzan concentraciones del orden de 106 cel x L-1 ( 1 ). El término FAN (Floraciones Algales Nocivas) lo designó la Comisión Oceanográfica Intergubernamental de la UNESCO (2) para distinguir a un grupo heterogéneo de microorganismos que son percibidos como dañinos para el hombre por sus efectos adversos en la salud humana, en la acuicultura, turismo y en las poblaciones naturales de organismos marinos en las zonas costeras (1 ). Especialmente en los últimos años, las flotaciones algales en la costa Pacífica de nuestro país, han aumentado en frecuencia, duración y cantidad de microorganismos capaces de producirlas. Se tiene poco conocimiento sobre la dinámica de estos eventos en nuestro país, y especialmente sobre las especies de microalgas que los producen y el daño que estas puedan causar a nuestros ecosistemascosteros. Por este motivo hemos escogido una zona costera bien caracterizada y conocida por los problemas socio-económicos de sus habitantes y el interés turístico y cercanía a plantas de acuacultura.
Materiales y métodos
Las muestras fueron colectadas en el área del Golfo de Nicoya (long. 85ºW y lat. 10ºN) Fig. 1 , en diferentes localidades, entre ellas la cercanía a Isla Chira, Punta Morales, Isla San Lucas, Paquera, muelle y Estero de Puntarenas, Mata de Limón, Caldera y Quepos, en el periodo comprendido entre el año 1997 y 2002. La recolección fue hecha sobre la superficie y a 5 metros de profundidad de dos maneras, las primeras con una botella de Niskin de 1L de capacidad. Parte de estas muestras se transportaron frescas al laboratorio para posteriormente aislar microalgas y mantenerlas en cultivos unialgales. El resto de las muestras (500 mL) se fijaron con solución de Lugol. En el laboratorio se pusieron a sedimentar en probetas de 250mL durante 1 día, luego cada día se pasaban a probetas más pequeñas (100ML, 50mL, 25mL, 10mL y 5mL) con la finalidad de prepararlas para realizarles el conteo celular en 500mL de agua de mar y así determinar la biomasa algal. Otras muestras fueron colectadas mediante el lanzamiento a la superficie del agua de una red para fitoplancton de 20 p m de grosor de poro, con la finalidad de concentrar el fitoplancton que se encontraba en el lugar. Estas muestras se fijaron con una mezcla de aldehídos (3 ) amortiguada en cacodilato de sodio al 0.1 M, el pH de la solución final fue de 7.4. Posteriormente se procesaron tanto para microscopio electrónica como para microscopio de luz. El procedimiento para microscopio electrónica consistió en realizar varios lavados de las muestras fijadas con la solución amortiguadora de cacodilato de sodio al 0.1M durante 15 min. Posteriormente las muestras se posfijaron con tetraóxido de osmio al 1% en amortiguador durante 1 h, luego se lavaron 4 veces durante 15 min cada vez en agua. Se deshidrataron utilizando un gradiente ascendente de alcohol etílico (30º, 50º, 70º, 80º, 90º, 95º, 100º, 100º) 10 min cada paso. Posteriormente se realizaron cambios de 10 min en acetato de amilo para su posterior secado en punto crítico. Luego se montaron sobre bases de aluminio que tenían cinta doble cara y se recubrieron con una capa de platino de 30nm (nanómetros) de grosor en un cobertor iónico marca Hitachi, modelo IB-5. Las muestras se observaron con un microscopio electrónico de barrido (MEB) Hitachi S-2360 N, a voltajes de aceleración de 15KV y se fotografiaron con película Kodak Verichrome Pan Asa 120. Los negativos se positivaron en papel blanco y negro Kodak Glossy de contraste medio.
Para microscopio de luz se lavó varias gotas de las muestras concentradas con solución amortiguadora, posteriormente se colocó una gota de muestra sobre un portaobjeto y se dejaron secar al aire. Una vez secos los portaobjetos, se les colocó una gota de medio de montaje de baja viscosidad Cytoseal 60 (Stephens Scientífic) y se pusieron a secar a temperatura ambiente. Todas las láminas se etiquetaron y se coleccionaron para su posterior observación con el microscopio de luz. Las láminas se observaron y se fotografiaron con película a color AGFA ISO 200, además se hicieron medidas morfométricas de los especimenes para su posterior identificación. Algunas especies que se mantuvieron en cultivos unialgales fueron procesadas para la toma de fotografías con el MEB, como se describió anteriormente.
Resultados
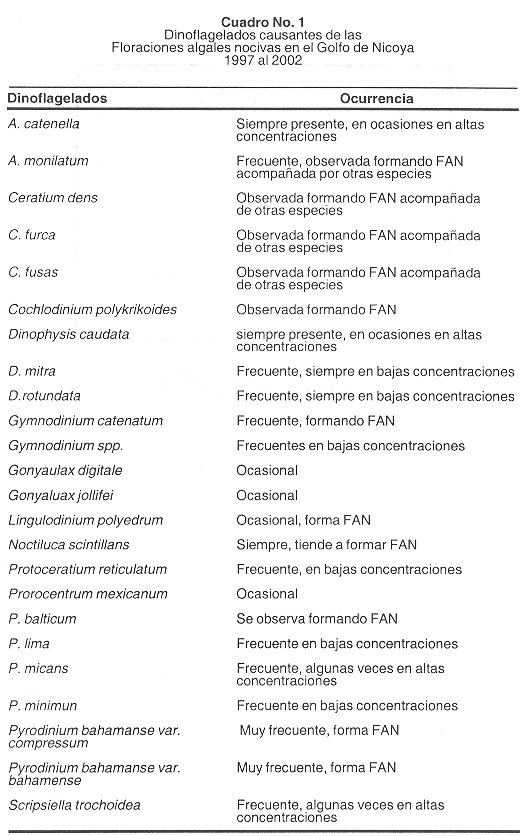
La lista de dinoflagelados y diatomeas identificadas en el Golfo de Nicoya es extensa, abarca más de 250 especies, por lo que hemos decidido presentar solo las microalgas que hemos observado produciendo FAN o que en algún momento han manifestado un aumento en el número de microorganismos en el agua, que de ser estas especies tóxicas, sería importante considerarlas para tomar las medidas de precaución pertinentes en la salud pública. En el Cuadro 1 se anotan 24 dinoflagelados colectados en muestras desde 1996, y a los cuáles se les han visto formando flotaciones algales nocivas o han manifestado en algunos lugares un aumento en el número celular en al agua. Las microalgas más dañinas observadas en la costa Pacífica de Costa Rica son las siguientes:
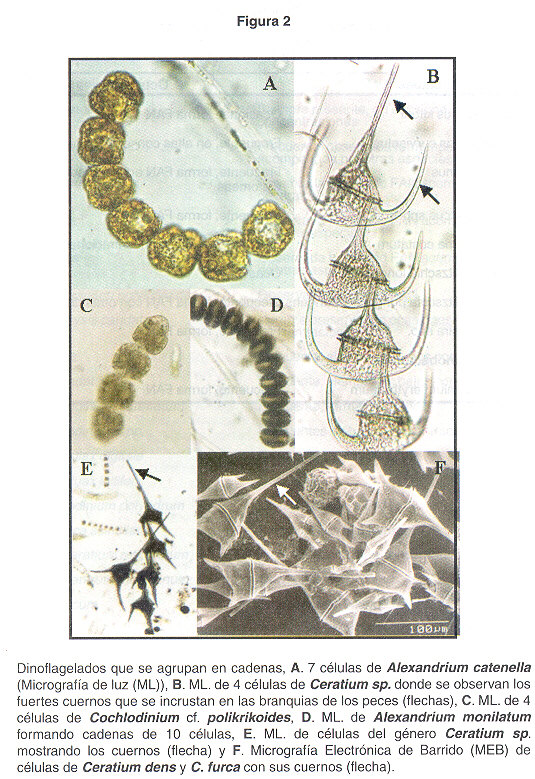
Alexandrium catenella (descrito por: Whedon & Kofoid, Balech 1985). Este tipo de microalga constituye la principal amenaza por FAN a la salud pública en América Latina, se distribuye principalmente en el Pacífico Sudamericano y en el Atlántico (1 , 4 ). Además produce el tipo de intoxicación por consumo de mariscos que se ha presentado en la costa Pacífica costarricense desde hace más de 20 años (5 , 6 ). Esta especie ha sido observada en nuestras muestras a lo largo del Golfo de Nicoya. (Fig. 2A ). A él se le atribuye la producción de saxitoxinas y neosaxitoxinas, además se cree que es tóxico para organismos marinos ( 7 ). Las toxinas que conforman la intoxicación paralizante por mariscos están básicamente constituidas por un núcleo tetrahidropurínico, siendo todas ellas análogas a la saxitoxina (2 ). Actualmente existen más de 26 derivados de la saxitoxina ( 1 , 2 , 8 ). Producen cuadros neurotóxicos en los primeros 15 min de haber ingerido la toxina debido a alteración en el transporte del sodio en el canal de sodio (4 , 9 , 10 ). El grado de intoxicación varía dependiendo de la cantidad de toxina ingerida. Las primeras manifestaciones son: parestesia bucal, o sensación de hormigueo alrededor de la boca, transmitiéndose luego a manos y pies. Luego aparecen la cefalea y náuseas seguidos por incoordinación al hablar, alteración del pulso y dificultad respiratoria. En casos graves ocurre una parálisis muscular flácida, insuficiencia respiratoria y posteriormente paro cardiorespiratorio ( 1 ,7 ,9 ).
Alexandrium monilatum (descrito por: (Howell) Balech 1995). Frecuentemente en las muestras de agua se encuentra a este microorganismo formando cadenas largas de más de 16 células (Fig. 2D ). Siempre está presente en el agua, acompañado por otros dinoflagelados, pero hasta el momento no se ha descrito la presencia de toxinas producidas por él en nuestro país, sin embargo, se ha señalado en el pasado como productor de potentes ictiotoxinas resultando en efectos paralizantes, y aumentasen el número de células de esta especie han producido la muerte en moluscos bivalvos. En el pasado se reportó la presencia de saxitoxina y gonyatoxinas, hecho que no se ha podido confirmar en este momento. Muertes masivas de peces se han reportado en el Golfo de México y la costa este de Florida (7 ).
Ceratium dens (descrito por: Ostenfeld & Schmid), C. turca (descrito por: (Ehrenberg) Ciaparéde & Lachmann 1859) y C. fusus (descrito por: (Ehrenberg) Dujardin 1841). Las especies de Ceratium son muy comunes en el Golfo de Nicoya (Figs.2 B, E y F ). A estos organismos se les ha observado formando FAN de color café oscuro. A pesar de no habérseles encontrado algún tipo de toxina, se cree que son ictiotóxicos y dañinos para los peces e invertebrados (7 , 11 ), ya que, además de producir un mucus en el agua, pueden disminuir el oxígeno disuelto y además ocasionar severos sangrados en las branquias de los peces.
Cochlodinium cf. polykrikoides (descrito por: Margalef, 1961). A pesar de que esta especie ha sido observada en muestras anteriores, a principios del año 2002 se observó una floración que producía un olor fétido cerca de Caldera (Puntarenas) que se extendió hasta Quepos. Se observó gran producción de mucus cerca de la costa, además se reportaron casos de intoxicación por medio de la briza marina y se observó cientos de peces muertos en la playa. A este organismo ( Fig. 2C ) se le atribuyen múltiples toxinas (neosaxitoxinas) y se ha comprobado que es una especie productora de ictiotoxinas y además es dañino para moluscos (7 ,12 ).
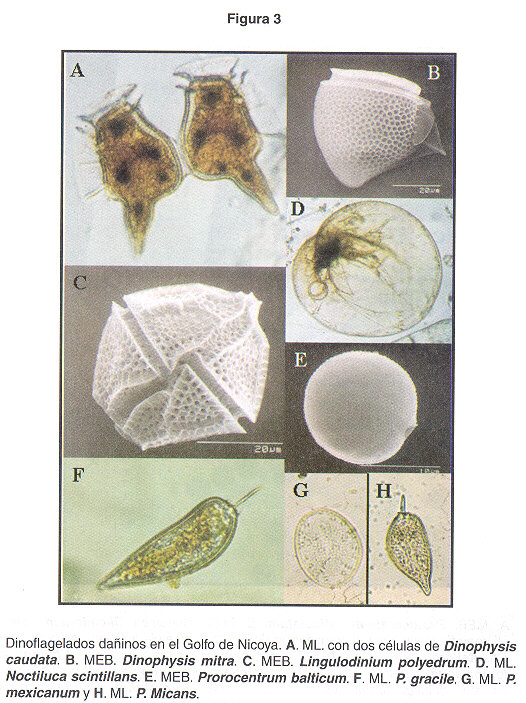
Dinophysis caudata (descrito por: Saville-Kent, 1881). El género Dinophysis ha sido observado durante la década pasada, sin embargo, desde principios del año 2000 se detectó un aumento en el número de células en muestras colectadas en diferentes partes del Golfo de Nicoya. A finales de 2002 se observó un aumento de células de Dinophysis caudata (Fig. 3A ), dinoflagelado que se encontraba dominando la muestra colectada. A este género se le atribuye la producción de toxinas diarréicas de tipo ácido okadaico y toxina dinophysis, que por la ingestión de mariscos, que sirven de vectores, producen gastroenteritis aguda. Estas toxinas del tipo diarréico son poliéteres (1 , 4 , 13 , 14 ), tienen alto peso molecular y son liposolubles (15 ). Tienen la capacidad de disminuir el grado de fosforilación de proteínas que controlan la permeabilidad del epitelio intestinal produciendo náusea, vómito, dolor abdominal y una diarrea secretoria que los lleva rápidamente a la deshidratación. Este dinoflagelado es común encontrarlo en muestras superficiales, algunas veces en altas concentraciones y hemos logrado mantenerlo vivo en el laboratorio durante 3 semanas. También se ha demostrado que es dañino para los peces(1 ,7 ).
D. mitra (descrito por: (Schütt) Abe, 1967). Este dinoflagelado siempre se encuentra presente en las muestras tomadas en la parte central del Golfo de Nicoya y cerca de la costa (Fig. 3B ). Produce ácido okadaico, causando intoxicación diarréica por mariscos, similar al cólera (7 ).
D. rotundota (descrito por: Ciaparède & Lachmann 1859). Siempre presente en el Pacífico de nuestro país, pero en bajas concentraciones, Se le atribuye la producción de toxinas diarreicas según Según Sar et al. (2002).
Gymnodinium cotenatum (descrito por: Graham, 1943). Desde 1980 es el dinofiagelado responsable de la producción de FAN en el Pacífico de Costa Rica. Se han reportado casos de intoxicación paralítica por el consumo de mariscos contaminados con la microalga. Este microorganismo se encuentra siempre formando cadenas de mas de 32 células, y las manchas producidas en el agua son de color rojizo-amarillento. Es un productor muy potente de saxitoxinas en muchas partes del mundo, incluyendo Australia, Japón y España. Su veneno neurotóxico causa parálisis muscular (7 ,16 ).
Lingulodinium polyedrum (descrito por: (Stein) Dodge 1989). Frecuentemente se observa a esta microalga en las muestras de agua tomadas cerca de la costa ( Fig. 3C ). Recientemente, Morales et al. encontraron una floración alga¡ originada por esta especie en Bahía Culebra (Golfo de Papagayo, Pacífico Norte). A él se le atribuyen toxinas del tipo de las yesotoxinas, además se cree que puede ser dañino y tóxico para algunos organismos marinos (7 ).
Noctiluca scintillans (descrito por: (Macartney) Kofoid & Swezy 1921). Esta especie es el dinoflagelado de mayor tamaño que hemos observado en las muestras colectadas (Fig. 3D ). Frecuentemente produce flotaciones bioluminiscentes a todo lo largo de la costa Pacífica ocasionando intensas discoloraciones en el agua. A pesar de que en Japón se ha observado a la variedad verde de este microorgan ismo (17 ), en Costa Rica solamente hemos observado la variedad incolora. Se sabe que flotaciones densas de este microorganismo disminuyen la calidad del agua con gran impacto ambiental. Según Sar et al. (2002), acumula grandes cantidades de amonio en sus vacuoias por lo que puede resultar tóxico para los peces.
Prorocentrum balticum (descrito por: (Lohmann) Loeblich lII, 1970). Este microorganismo lo hemos observado principalmente en muestras de estanques utilizados para la acuacultura, cerca del golfo. Allí aumenta su abundancia en millones de células/mL. No se le conoce producción de toxina, sin embargo se ha encontrado que puede ser dañino para los peces (7 ,18 ) (Fig. 3E ).
Prorocentrum lima (descrito por: (Ehrenberg) Dodge 1975) Es muy común encontrarlo en muestras de agua a nivel superficial, especialmente cerca de la costa en Puntarenas. A este microorganismo se le atribuye la producción de ácido okadaico, toxinas diarreicas y ciguatoxinas, las cuales producen problemas gastrointestinales (7 , 19 ).
Prorocentrum micans (descrito por: Ehrenberg 1833). En el pacífico de Costa Rica se encuentra formando flotaciones en algunos sectores (Fig. 3H ). En nuestros cultivos de laboratorio ha mostrado un crecimiento más rápido que otras especies de dinoflagelados, además soporta cambios bruscos de temperatura y no necesita de aditivos en sus medios de cultivo, por lo que consideramos que es una especie adaptada a diversas condiciones. Según Sar et al. 2002, es muy probable que algunos de estos taxones de dinoflagelados sean tóxicos en algunos lugares según las condiciones del medio.
Prorocentrum mexicanum (descrito por: Tafali, 1942). Este organismo cuya taxonomía puede confundirse con P. rhathymum, ha sido observado en el Golfo de Nicoya en muestras desde 1996 (Fig. 3G ). Se le atribuyen toxinas no caracterizadas, además de la producción de ácido okadaico y posiblemente ciguatera, sin embargo, esto aún no está confirmado (7 , 20 ).
Prorocentrum minimun (descrito por: (Pavillard) Schiller 1933). Es un dinoflagelado que se ha observado cerca de la costa frente a Puntarenas, Isla San Lucas, Isla Chira y cerca de Punta Morales en el Golfo de Nicoya. A este microorganismo se le atribuyen toxinas de baja toxicidad, sin embargo, en Japón se le responsabiliza de varios centenares de intoxicaciones humanas, inclusive con casos fatales (1 ).
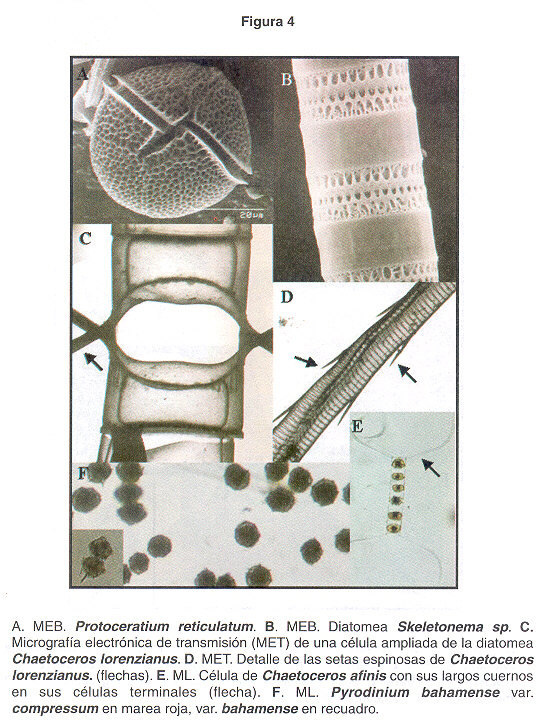
Protoceratium reticulatum (descrito por: (Claparède & Lachmann) Bütschli 1885). Esta especie conocida por su nombre anterior como Gonyaulax grindleyi ha sido la causante de la producción de yesotoxinas en Noruega ( 21 ) y Japón (22 ). Por medio de métodos químicos se ha demostrado niveles muy altos de esta toxina en ostras para consumo humano. En el Golfo de Nicoya a este dinoflagelado se le ha encontrado generalmente en la parte media entre Isla San Lucas e Isla Tortuga, cerca de Paquera e Isla San Lucas ( Fig. 4A ).
Pyrodinium bahomanse var. compressum (descrito por: (Böhm) Steidinger, Tester & Taylor 1980). En 1990 Mata y colaboradores reportaron el primer caso en Costa Rica de la intoxicación de un grupo de personas con toxinas paralizantes producidas por este dinoflagelado. Después de este hecho, a este microorganismo no se le había observado en muestras de agua hasta finales de 1999 cuando se produjo una floración que abarcó toda la costa Pacífica de nuestro país, produciendo severos daños a la salud de muchas personas y a la economía del sector pesquero del país. Las flotaciones de este dinofiagelado (Fig. 4F ) son café oscuro, algunas veces fétidas. Actualmente, mantenemos cultivos de estas especies para determinar el perfil de toxinas que producen las cepas costarricenses, que comparativamente parecen ser más tóxicas que en otros lugares por los datos que se han recopilado de las concentraciones en la carne de moluscos (datos aun no publicados).
Pyrodinium bahamanse var. bahamense (descrito por: Plate 1906). Hasta el año 2002, este microorganismo no se observada en muestras de agua de la costa Pacífica de nuestro país, sin embargo, en la floración de finales de 1999 frente al muelle de Puntarenas, se identificó a esta variedad (Fig. 4F , recuadro), la cuál se creía pertenecía solo al Atlántico. Las flotaciones algales producidas por este género en Costa Rica, se encuentran mezcladas con ambas variedades, y se está trabajando en la determinación de una posible toxicidad en esta variedad por medio de cultivos unialgales obtenidos de nuestras aguas.
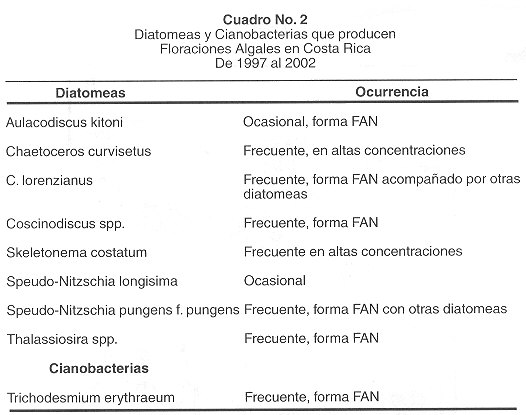
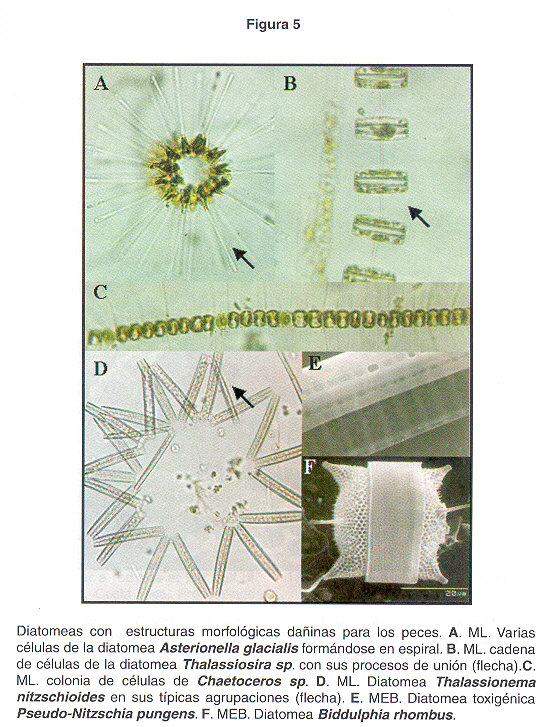
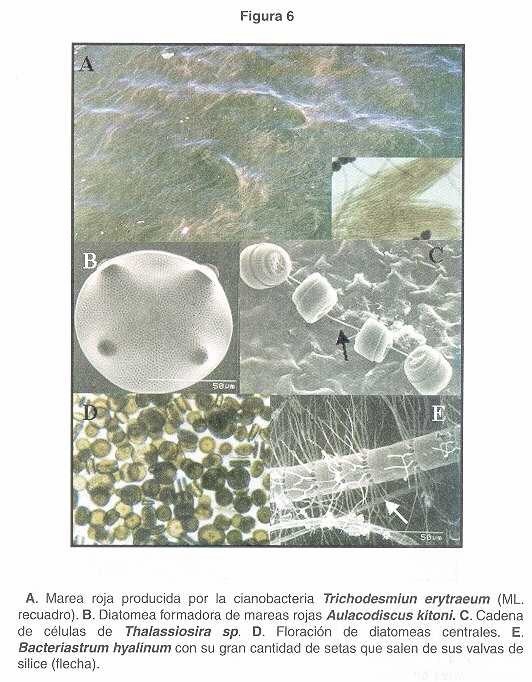
Floraciones Algales Nocivas causadas por diatomeas y cianobacterias. Las diatomeas son taxones muy importantes en el Golfo de Nicoya, siempre están presentes en el agua, y debido a su gran diversidad son capaces de alimentar a la gran variedad y cantidad de organismos microscópicos que a su vez sirven de alimento a otras especies mayores. Sin embargo, en algunas ocasiones se les ha observado formando extensas manchas superficiales, principalmente, en la parte interna del Golfo de Nicoya, generalmente durante de la época seca. Según los reportes en los últimos años, se ha observado un aumento de FAN producidas por diatomeas toxigénicas, especialmente las productoras de ácido domóico y veneno amnésico. En el Cuadro 2 se describen a 8 diatomeas y 1 cianobacteria observadas en nuestras aguas del Pacífico, a las cuáles en algunos muestreos se le ha observado en cantidades importantes. Generalmente las flotaciones causadas por estas especies no producen mal olor, y los buzos han asociado bajas temperaturas del agua. Dependiendo de la hora del día, es difícil observar una discoloración del agua, aunque en algunas ocasiones, como en el caso de flotaciones producidas por las diatomeas del género Pseudo-Nitzschia (Fig. 5E) se observan colocaciones rojizas. Muchas especies de mariscos con concha provenientes del fondo, contienen toxinas del tipo amnésicas como las producidas por diatomeas del género Pseudo-Nitzschia. Según Sar et al 2002, una posibilidad es que los bivalvos del fondo adquieran la toxicidad por ingestión de paquetes fecales de copépodos u otros organismos filtradores que predaron una floración de Pseudo-Nitzschia spp. También, debido a la, forma que presentan algunas diatomeas como las pertenecientes al género Chaetoceros (Figs.4C, D y E , Fig.5C ), y otros géneros, pueden provocar serios daños a las branquias de los peces, debido a la gran cantidad de cuernos y espinas en su estructura silícea (Fig.4B , Fig.5A, B, C, D y F , Fig.6C y E ).
Las flotaciones de cianobacterias son poco comunes en el Golfo de Nicoya, sin embargo, a principios del 2002 se le observó a Trichodesmium erythraeum (descrito por: Ehrenberg 1830) formando una floración rojiza frente al muelle de Puntarenas (Fig. 6A ). Las agregaciones de esta cianobacteria mantienen un hábitat sumamente importante para una diversa comunidad de organismos micro heterotróficos. Algunos investigadores basados en pruebas de laboratorio creen que T. Erythraeum está asociada a padecimientos parecidos a ciguatera en Australia (23 ), también asociadas con mortalidades en pólipos de corales (24 ). En India, un evento de mortalidad que involucro numerosas especies de animales, fue causado por una floración de T. erythraeum asociado al deterioro en la calidad del agua. También ha sido asociada a problemas de irritación respiratoria en humanos.
Discusión
Los programas de seguimiento de microalgas tóxicas en el resto del mundo, responden a un esfuerzo inicial de sentido común para diseñar un programa que responda a las demandas sociales de la región en estudio y que sea realizable con los medios materiales y recursos humanos disponibles (1 ). Los objetivos de estos programas son él de proteger la salud pública mediante el establecimiento de un sistema de control de ficotoxinas en productos destinados al consumo humano y proteger los cultivos de peces y el mercado de los productos marisqueros mediante una alerta temprana de episodios nocivos. Debido al gran impacto ambiental, económico, social y en la salud pública, consideramos necesario colaborar en alguna medida con un programa de monitoreo de mareas rojas para definir los agentes causases de las mismas y la posible existencia de estacionalidad en las principales costas pesqueras de nuestro país. La Universidad de Costa Rica por medio del Centro de Investigación en Estructuras Microscópicas (CIEMIC), el Centro de Investigaciones en Ciencias del Mar y Limnología (CIMAR), el Laboratorio de Ensayos Biológicos (LEBi) y el Centro de Investigación en Contaminación Ambiental (CICA), han estado involucrados en una serie de propuestas de proyectos para investigación, cuya finalidad, es la de establecer un plan de monitoreo de todas los factores relacionados a estos eventos y que contribuyan al conocimiento de estos fenómenos. Estas propuestas de investigación a instituciones gubernamentales y no gubernamentales han tenido poco impacto debido a la falta de interés político.
Consideramos que urge debe definir y caracterizar todas las especies de microalgas tóxicas, la bioquímica y fisiopatología de las toxinas que afectan nuestras áreas costeras para poder realizar un diagnóstico preciso y rápido en caso de intoxicación y poder ofrecer un mejor tratamiento en los casos que lo ameriten. Existen pocos estudios sobre las microalgas nocivas en nuestras costas, las que, han ido aumentando tanto en número de especies como en frecuencia de episodios nocivos. Estos fenómenos que se producen por diversas razones, entre las que se encuentran el clima, la contaminación de las áreas costeras, el transporte marítimo y acarreo de especies nuevas por medio de sus aguas de lastre, además de factores como aumento en las poblaciones humanas cerca de la costa con su consecuente impacto sobre las zonas silvestres (9 ). A pesar de que son difíciles los estudios dinámicos de superficie y profundidad no debemos esperar a que este tipo de evento "natural" ocurra sino estudiarlo multidisciplinariamente y proponer responsablemente a tiempo las medidas para asegurar la salud pública.
Agradecimientos
Referencias
1. Sar E, Ferrario ME, Reguera B. Floraciones Nocivas en el Cono Sur Americano, Vigo España: Instituto Español de Oceanografía, 2002. pp. 311. [ Links ]
2. Hallegraeff GM, Anderson DM, Cembella AD. Manual of Harmful Marine Microalgae, N.33, París Francia: lntergovernmental Oceanographic Commission (UNESCO), 1995. pp. 551. [ Links ]
3. Karnovsky M.J. A formaldehydeglutaraldehyde fixative of high osmolarity for use in electrón microscopy. Jour of Cell Biol 1965; 27:137A. [ Links ]
4. Suárez B, Guzmán L. Mareas Rojas y Toxinas Marinas, Floraciones de algas nocivas. Santiago de Chile: 1999. pp. 77. [ Links ]
5. Mata L, Abarca G, Marranghello L et al. Intoxicación paralítica por mariscos (IPM) por Spondylus calcifer contaminado con Pyrodinium bahamense, Costa Rica 1989-1990. Rev Biol Trop. 1990; 38:129-136. [ Links ]
6. Vargas-Montero M, Freer E. First Report of Pyrodinium bahamense var. compressum and bahamense (Dynophyta: Peridinae) forming togheter a red tide at the Gulf of Nicoya, Costa Rica. Proccedings of the "4th Internacional Conference on Molluscan Shellfish Safety, Santiago de Compostela España: 2002. [ Links ]
7. Landsberg J. The Effects of Harmful Algae Blooms on Aquatic Organisms. En: Stickney R. Reviews in Fisheries Science. New York: Fisheries Science; 2002. 10:113-390. [ Links ]
8. Cortés-Altamirano R. Las Mareas Rojas, México D.F., 1998. pp.161. [ Links ]
9. Anderson DM, Andersen P, Bricelj VM, et al. Monitoring and Management Strategies for Harmful Algal Blooms in Coastal Waters, No. 59, Paris: lnterguvernamental Oceanographyc Commission Technical Series, 2001. pp.268. [ Links ]
10. Herderson R, Ritchie JM, Strichartz GR. The binding of labelled saxitoxin to the Sodium Channel in nerve membranas. J Physiol 1973; 235:783-804. [ Links ]
11. Mijares AJ, Sevcik C, Barboza A et al. lchthyotoxism by a paralytic toxin produced by marine dinofiagellates of the genus Ceratium: relationship to fraction a isolate from the sponge Tedania ignis. Toxicon 1985; 23:221-233. [ Links ]
12. Ho MS, Zubkoff PL. The effects of a Cochlodinium heterolobatum bloom on the survival and calcium uptake by larvae of the American oyster, Crassostrea virginica. En: Taylor DL, Seliger HH, eds. Toxic Dinofiagellate Blooms, New York: Elsevier; 1979.pp.409-412. [ Links ]
13. Murata M, Kumagai JS, Lee JS et al. lsolation and structure of yessotoxin, a novel polyether compound implicated in diarrhetic shellfish poisoning. Tetrahedron 1987;28:5869-5872. [ Links ]
14. Yasumoto T, Murata M, Oshima Y. et al. Diarrhetic shellfish toxins. Tetrahedron 1985; 41:1019-1025. [ Links ]
15. Yasumoto T, Murata M, Lee LS, et al. Polyether toxins produced by dinoflagellates. En: Natori S, Hashimoto K, Ueno Y eds. Mycotoxins and Phycotoxins. Elsevier, Amsterdam: 1989; 375-382. [ Links ]
16. Oshima Y, Yasumoto T, Hallegraeff G, et al. Paralytic shellfish toxins and causative organisms in the tropical Pacific and Tasmanian waters. En: Gopalakrishnakone O, Tan CK. eds. Progress in Venom and Toxin Research, Singapore; 1987; pp.423-428. [ Links ]
17. Fukuyo Y, Takano H, Chihara M. et al. Red Tide Organisms in Japan. Uchida, Japan, 1990. pp.405. [ Links ]
18. ICES (internacional Council for the Exploration of the Sea). Report of the ICES/IOC working group on harmful algae bloom dynamics (WGHABD-Portugal, 1998), Copenhagen, Denmark, 1998, 4: 1-76. [ Links ]
19. Holmes MJ, Lee FC, Khoo HW. Productionof 7-deoxy-okadaic acid By a New Caledonian strain of Prorocentrum lima (Dinophyceae). J Phycol 2001; 37:280-288. [ Links ]
20. Tindall DR, Dickey RW, Carlson RD, et al.Ciguatoxigenic dinofiagellates from the Caribbean Sea. En: Ragelis EP. ed. Seafood Toxins, American Chemical Society Symposium Series, Washington; 1984. pp.225-340. [ Links ]
21. Miles CO, Aasen J, Dahl E, et al. Yessotoxin in Norwegian blue mussels caused by Protoceratium reticulatum. En: Proccedings of the "4th Internacional Conference on Molluscan Shellfish Safety", Santiago de Compostela, España; 2002. [ Links ]
22. Masayuki S, Eiki K, Oshima Y, et al Yessotoxin production by Protoceratium reticulatum in Japan and structures of it's new analogs. En: Proccedings of the "X" International Conference on Harmful Algae", St. Pete Beach, Florida; 2002. [ Links ]
23. Hahn ST, Capra MF. The cianobacterium Oscillatoria erythraea, a potencial source of toxin in the ciguatera food chain. Food Addit Contam 1992; 9:351-355. [ Links ]
24. Endean R. Destruction and recovery of coral reef communities. En: Biology and Geology of Coral Reefs. Academic Press, New York, 1977. Pp.215-254. [ Links ]
1 Centro de Investigación en Estructuras Microscópicas, CIEMic, Universidad de Costa Rica.
* Dirigir correspondencia: CIEMic, Ciudad de la Investigación, Universidad de Costa Rica, CP 2060, Costa Rica. Fax: 207 3182. E-mail: vmontero@cariari.ucr.ac.cr













