Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Costarricense de Ciencias Médicas
Print version ISSN 0253-2948
Rev. costarric. cienc. méd vol.22 n.1-2 San José Jun. 2001
electrónica de cortes histológicos en parafina
Francisco Hernández-Chavarría1,2* Maribel Vargas-Montero1 Patricia Rivera3 Alfonso Carranza3
Resumen
Se describe un método simple y rápido para el re-procesamiento de tejidos incluidos en parafina usados en microscopia de luz para poder ser observados con microscopia electrónica de transmisión (MET) y de rastreo (MER). Los tejidos incluidos en parafina se seccionaron, desparafinaron en tolueno y se expusieron a vapores de osmio mediante irradiación con microondas en un horno de microondas doméstico. Los tejidos fueron embebidos en resina epóxica, polimerizados y seccionados. El método de procesamiento requirió un tiempo relativamente corto (aproximadamente 30 minutos para MET y 15 para MER) y rinde una calidad razonable de la ultraestructura para propósitos diagnósticos.(Rev Cost Cienc Med 2001; 22(1,2):51-56)
Palabras clave
Tejidos embebidos en parafina, microscopia electrónica de transmisión, microscopia electrónica de rastreo,
Abstract
A simple and rapid method is described for re-processing of light microscopy paraffin sections to observe they under transmission electron microscopy (TEM) and scanning electron microscopy (SEM). The paraffin-embedded tissue is sectioned and deparaffinized in toluene; then exposed to osmium vapor under microwave irradiation using a domestic microwave oven. The tissues were embedded in epoxy resin, polymerized and ultrathin sectioned. The method requires a relatively short time (about 30 minutes for TEM and 15 for SEM), and produces a reasonable quality of the ultrastructure for diagnostic purposes.
key words
Paraffin embedded tissues, scanning electron microscopy, transmission electron microscopy,.
Introducción
Uno de los artículos publicados en memoria del quincuagésimo aniversario de la microscopia electrónica (ME) en 1984 (1), señalaba que esta metodología se había incorporado a la rutina del trabajo en histopatología, desde la década de 1950, cuando la microscopia electrónica tenía unos 30 años de existencia. Ya que los primeros equipos de ME se utilizaron para el análisis de materiales inanimados (2).
El principal escollo que enfrentaba el estudio de muestras biológicas al MET era el procesamiento de las muestras; pues estas debían soportar condiciones muy drásticas dentro de la columna del microscopio, como lo es un vació de al menos 1x10-4 torr; deben ser irradiadas por un haz de electrones acelerados a un voltaje mínimo de 75 KV, que calienta y puede evaporar parte de la muestra si no se protege adecuadamente; y aparte de esto, las secciones de la muestra deben tener un espesor máximo de unos 100 nm, esto es unas 50 veces más delgadas que las secciones para el microscopio de luz (3). Por estas razones, las primeras aplicaciones biológicas de la ME fueron el análisis de estructuras virales, de viriones sombreados con platino evaporado a alto vacío, un proceso similar al que se empleaba para el estudio de películas delgadas de metales; o sea, que al principio las muestras biológicas se procesaron siguiendo la metodología utilizada en estudios de materiales (2).
Posteriormente, se siguió una metodología adaptada de aquella utilizada en histología para microscopia de luz; que hoy, con ciertas modificaciones, se sigue empleando (4). Brevemente, esa metodología consiste en fijar químicamente los tejidos, deshidratarlos y luego embeberlos en un soporte que permita su seccionamiento fino. La fijación química inicialmente se hizo con osmio y luego en la década de 1960 se empleó glutaraldehido o bien una mezcla de éste y paraformaldehido (5). Actualmente, se sigue una rutina de doble fijación, primero con aldehidos (1 a 2 horas a 4°C), seguida por una posfijación con OsO4(1 hora) y luego deshidratación en una gradiente de etanol (30 a 100%), dejando el tejido en cada alcohol entre 10 y 15 minutos y finalmente hay un proceso de embebido en resina, que tarda varias horas e incluso en algunos casos debe dejarse de un día para otro; luego la resina debe polimerizarse unas 48 a 72 horas a una temperatura mínima de 60°C. Entre las resinas más populares actualmente figuran las epóxicas; sin embargo, hay otras resinas parcialmente hidrosolubles como las LR White® y la Lowicril®, esta última polimeriza a temperaturas inferiores a –40°C bajo luz ultravioleta, lo que es ideal para evitar pérdida o inactivación de antígenos (6). El tejido incluido en la resina tiene la suficiente resistencia como para soportar el golpe de la navaja (de vidrio o de diamante) y permitir el seccionamiento a los espesores requeridos en ME.
El procesamiento descrito anteriormente tarda de 3 a 5 días, lo cual es un obstáculo, cuando se requiere hacer un análisis rápido, como podría ser ante la necesidad de un diagnóstico histopatológico. Sin embargo, se ha descrito una serie de procesos rápidos; aunque, la calidad del tejido se puede alterar al acortar los periodos de procesamiento. No obstante, la aplicación de la irradiación con microondas (IMO) ha permitido acelerar esos procesos sin detrimento en la calidad del detalle ultraestructural (7). Nosotros hemos adaptado esas metodologías, logrando una buena preservación de la morfología, irradiando en un horno doméstico de microondas (8). Incluso, los procesos de tinción electrodensa se aceleran con esta metodología, sin someter la muestra a calentamiento (9).
Otro inconveniente que se sigue presentando en un servicio de patología es el daño post morten. Desde el propio momento de la muerte se inicia la autólisis, lo cual afecta fundamentalmente los análisis hechos a partir de muestras obtenidas de autopsia (10). La muestra ideal para un estudio histológico al MET debería ser obtenida luego de una fijación por perfusión, lo cual solo se logra en el laboratorio con animales de experimentación. Una segunda opción son las muestras obtenidas luego del sacrificio del animal y fijación inmediata por inmersión de los tejidos en la mezcla fijadora, lo que también queda relegado a laboratorios de experimentación, y lo más cercano a esto en un laboratorio de patología sería la fijación de biopsias (11). En tercer lugar se encuentra lo que representa la rutina y es la obtención de especímenes durante una autopsia, que obviamente han enfrentado un proceso más o menos largo de autólisis.
A veces en un estudio histopatológico, de una biopsia o de un tejido de autopsia, se encuentran estructuras similares a microorganismos, que requerirían un estudio a mayor resolución para complementar el diagnóstico. Desafortunadamente, en muchas ocasiones ya no hay más tejidos que los incluidos en parafina o bien, solo queda el tejido incluido en la lámina teñida. Sin embargo, es posible reprocesar ese tejido para ME (12-13). Obviamente, las características ultraestructurales de esos tejidos estarán alteradas debido a los daños post mortem; no obstante, algunas características microbianas pueden mantenerse y servir de ayuda diagnóstica. El objetivo de este trabajo es mostrar un método simple y rápido de reprocesamiento de tejidos embebidos en parafina, para utilizarlos en el análisis ultraestructural tanto al MET como al MER.
Material y Métodos
Se analizaron cuatro muestras de miocardio de un caso de endocarditis estafilococcica (14). Los tejidos estaban incluidos en tacos de parafina, que habían sido procesados para microscopia de luz. Se obtuvieron secciones histológicas de 10 µm de espesor, que se recogieron sobre portaobjetos y se desparafinaron con tolueno. Esos tejidos se reprocesaron para ME de acuerdo a la siguiente metodología: los tejidos se osmificaron sin hidratarlos, para ello los portaobjetos se colocaron en porta-láminas plásticos, con 0,1 ml de OsO4 al 4% en el fondo, de manera que el líquido no tocara el tejido y se irradió en un horno doméstico de microondas a 100 KW de potencia, durante dos periodos de 5 minutos cada uno, con un periodo intermedio de reposo de 2 minutos, colocando el porta-láminas en un baño de hielo para evitar el calentamiento de las muestras (9). Los tejidos osmificados por los vapores de osmio adquirieron un color pardo.
Para el análisis con microscopia electrónica de rastreo (MER) se cortaron fragmentos de esas láminas de aproximadamente 1 cm2 y se montaron sobre bases de aluminio para MER y se recubrieron con 10 nm de oro en un cobertor iónico (Eiko IB-3) y se analizaron en un microscopio de rastreo (Hitachi S-570) a un voltaje de aceleración de 15 KV, con una inclinación de 45° y a una distancia de trabajo de 12 mm. Para microscopia electrónica de transmisión los tejidos osmificados se recubrieron con etanol absoluto y se irradiaron con microondas por 2 minutos, evitando el calentamiento excesivo de la muestra colocando un Beaker con 300 ml de agua en una esquina del horno. Luego, se repitió el procedimiento con mezclas de etanol-resina en proporciones de 3:1, 1:1 y 1:3 empleando la irradiación durante 2, 4 y 5 minutos respectivamente. Finalmente la lámina se cubre con resina pura, y se irradia durante dos periodos de 5 minutos cada uno, separados por un tiempo de reposo de 2 minutos. Durante la irradiación el tejido se embebe en la resina, que está lista para polimerizar; entonces se coloca un taco de resina previamente polimerizado sobre el área de interés del tejido, se irradió por microondas durante 10 minutos y se transfiere a una incubadora a 60°C. La resina irradiada polimeriza en aproximadamente dos horas. La lámina con los tacos polimerizados se coloca en un congelador a –20°C por unos 15 minutos para que se desprenda el taco con la sección del tejido requerida, que estará lista para cortarla en un ultramicrótomo. Las secciones ultrafinas obtenidas se recogen sobre rejillas de cobre y se tiñen con acetato de uranilo y citrato de plomo, acelerando el proceso mediante IMO, lo cual se logra en un tiempo total de unos 5 minutos, según el método descrito previamente (9).
Resultados
Las figuras 1 y 2 corresponden a una sección de tejido fotografiada al microscopio de luz. La panorámica a bajo aumento muestra una zona del tejido con una fuerte reacción inflamatoria y destrucción tisular con un acúmulo de un material basófilo (que aparece negro en la fotografía). A 1000X (lente de inmersión) esa preparación muestra la presencia de bacterias cocoides, que fueron cultivadas y luego identificadas como Staphylococcus aureus (14). Sin embargo, histológicamente esas bacterias aparecen solo como cuerpos basófilos esferoides, sin mayor detalle; más aún, es difícil enfocar la preparación para fotografiarla, pues las bacterias aparecen en diversos planos de la sección, cuyo espesor es de aproximadamente 6 µm y la bacteria mide poco menos de 1 µm de diámetro.
El análisis de ese tejido con MER permite observar claramente que se trata de bacterias cocoides en acúmulos numerosos, localizados especialmente en las áreas con mayor destrucción tisular (Figs. 3 y 4). Al MET se observan detalles ultraestructurales de la pared de esas bacterias, que confirman efectivamente que se trata de cocos con una pared estructuralmente tipo Gram positiva (Figs. 5 y 6).
Discusión
La mayoría de los métodos de reprocesamiento de cortes histológicos en parafina inician con la rehidratación del tejido, para llevarlo hasta amortiguador a fin de fijarlo en osmio y luego debe ser deshidratado, lo cual es un procedimiento que consume mucho tiempo (15). El objetivo de esa osmificación; además, de la fijación per se, es aumentar la electrodensidad de las membranas celulares donde se deposita el osmio. Sin embargo, algunas de las versiones más rápidas de reprocesamiento omiten la osmificación para acortar el tiempo (16,17), sacrificando la electrodensidad.
En la versión descrita aquí se impregnan los tejidos con vapores de osmio, por lo que no es necesario rehidratar la muestra; además, al utilizar la IMO se aceleran los procesos, de manera que cada paso tarda entre 2 y 5 minutos. El tiempo total de reprocesamiento para MET hasta incubar la muestra para polimerizar la resina requiere un tiempo ligeramente mayor de media hora; en tanto, otros métodos descritos como rápidos, se requiere un mínimo de 3 horas (17). Además, la IMO acelera el proceso de polimerización, que se completa en otras dos horas.
La metodología descrita aquí es aplicable al MER lo que brinda información complementaria, que permite comprender mejor las características ultraestructurales o las alteraciones inducidas por microorganismos.
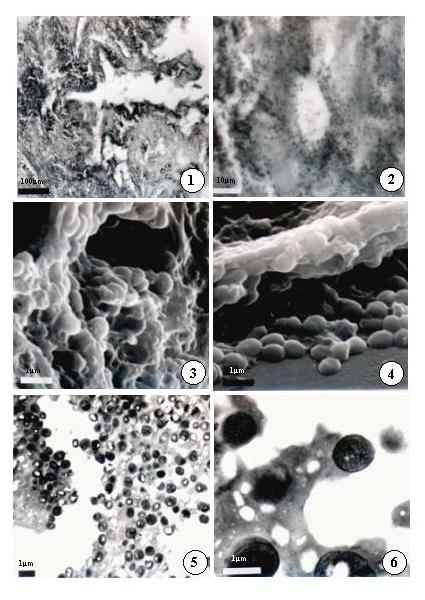
Leyenda de las figuras
Figuras 1 y 2. Micrografías de luz de una "vegetación" en una válvula cardiaca de un caso de endocarditis estafilococcica. La figura 1 muestra una vista panorámica a bajo aumento, en la que se aprecia la destrucción tisular, y a alta magnificación (1000X) se observan bacterias cocoides.
Figuras 3 y 4. Micrografías electrónicas de rastreo de una lámina reprocesada. Se aprecian los acúmulos de bacterias cocoides, algunas de las cuales aparecen en división.
Figuras 5 y 6: Micrografías electrónicas de transmisión. A bajo aumento se aprecian los acúmulos de bacterias cocoides, cuya morfología típica se aprecia en la figura 6.
Referencias
1) Afzelius BA. Half a century of electron microscopy: The early years. Ultrastr Pathol 1981; 2: 309-311. [ Links ]
2) Hawkes PW. The beginnings of electron microscopy. Academic Press Inc. Orlando, 1985. Pp. 633. [ Links ]
3)Crang RFE, Lkomparens KL. Artifacts in biological electron microscopy. Plenum Press, New York. 1988. pp 231. [ Links ]
4) Bozzola JJ, Russell LD. Electron microscopy. Principles and techniques for biologist. Jones and Bartlett Publishers, Boston. 1992. pp 542. [ Links ]
5) Bowers B, Maser M. Artifacts in fixation for transmission electron microscopy. P. 13-42. En: Artifacts in biological electron microscopy. Plenum Press, New York. 1988. [ Links ]
6) Newman GR. Resin microscopy and on-section immuno-cytochemistry. Springer-Verlag, Berlin. 1993. pp 221. [ Links ]
7) Kok LP, Boon ME. Microwave cookbook for microscopists. Art and science of visualization. 3ª ed. Coulomb Press. Leiden 1992. pp 432. [ Links ]
8) Hernández-Chavarría F, Guillén R. Microwave process for scanning electron microscopy. Europ J Morphol 2000; 38: 109-111. [ Links ]
9) Hernández-Chavarría F, Vargas-Montero M. Rapid staining of ultrathin sections using microwave irradiation with heat dissipation. J Microsc 2001; 202: 1-5. [ Links ]
10) Hernández F, Kozuka Y. Cambios post mortem en mucosa intestinal y tejido pulmonar de Mus musculus, observados al microscopio electrónico de barrido. Rev Biol Trop 1981; 29: 265 - 272. [ Links ]
11) Robinson DG, Ehlers U, Herken R, Hermann B, Mayer F, Schürmann FW. Methods of preparation for electron microscopy. An introduction for the biomedical sciences. Spring-Verlag Berlin 1987. Pp 190. [ Links ]
12) Ngai HK, Chan KW, Or SB, Yau WL. A rapid method for reprocessing paraffin sections for diagnostic electron microscopy. J Pathol 1985; 145: 59-62. [ Links ]
13) Mitin KS, Pigolkin II. A method for the re-embedding of tissues from paraffin blocks into epoxi resins for the study of stained semithinn sectiosn by electron microscopy. Sud Med Ekspert 1997; 40: 37-39. [ Links ]
14) Carranza A, Rivera P, Gutiérrez R, Hernández-Chavarría F. Endocarditis aguda estafilococcica fatal con periodontitis severa. Rev Cost Cienc Med 2000; 21 (3,4). En prensa. [ Links ]
15) Mather J, Stanbridge CM, Butler EB. Method for the removal of selected cells from cytological smear preparations for transmission electron microscopy. J Clin Pathol 1981; 34: 1355-1357. [ Links ]
16) Bretscheider A, Burns W, Morrison A. "Pop-off" technic. The ultrastructure of paraffin embedded sections. Amer J Clin Pathol 1981; 76: 450-453. [ Links ]
17) Widehn S, Kindblom LG. A rapid and simple method for electron microscopy of paraffin-embedded tissue. Ultrastruct Pathol 1988; 12: 131-136. [ Links ]
1Unidad de Microscopia Electrónica, Universidad de Costa Rica, San José, Costa Rica.
2Facultad de Microbiología, Universidad de Costa Rica, San José, Costa Rica.
3Hospital Nacional de Niños, CCSS, San José, Costa Rica.
*Correspondencia: E-mail: hchavarr@cariari.ucr.ac.cr













