Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Costarricense de Ciencias Médicas
Print version ISSN 0253-2948
Rev. costarric. cienc. méd vol.22 n.1-2 San José Jun. 2001
y aumenta la permeabilidad de membrana
de macrófagos alveolares de rata.
Jorge García *
Resumen
El ozono es un gas generado por procesos fotoquímicos en áreas urbanas o industriales con niveles altos de contaminación, y su inhalación causa inflamación en vías respiratorias. Para estudiar el daño causado por el gas, macrófagos alveolares fueron obtenidos por medio de lavado pulmonar de ratas Sprague-Dawley, y expuestos a ozono (0,594 ppm) por un máximo de 60 minutos. Los efectos de la exposición se manifestaron como disminución de la adherencia celular a un sustrato de poliestireno, y un incremento en la permeabilidad de la membrana plasmática, manifiesto como aumento en la liberación específica de 51Cr, y como aumento en el calcio citoplásmico, evidenciado por medición espectrofluorométrica. Los resultados obtenidos apoyan la idea de que la membrana celular es el blanco principal de la acción del ozono. La elevación en el calcio citoplásmico podría mediar otras respuestas de los macrófagos al ozono, incluyendo la producción de eicosanoides y óxido nítrico, que acarrean una reducción concomitante en la capacidad fagocítica y la producción de superóxido.(Rev Cost Cienc Med 2001; 22(1,2): 33-44).
Palabras clave
ozono, macrófagos alveolares, permeabilidad de membrana.
Abstract
Ozone gas is generated photochemically in areas with high levels of automotive or industrial emissions, and causes irritation and inflammation of the airways if inhaled. Rat alveolar macrophages were obtained by lung lavage from male Sprague Dawley rats and used as a model to assess ozone induced cell damage (0,594 ppm for up to 60 minutes). Ozone exposure caused loss of cell adherence to a polystyrene substrate and increased membrane permeability, as noted by increases in specific 51Cr release and citoplasmic calcium levels. The results indicate that the cell membrane is a target for ozone damage. Elevations of cytoplasmic calcium could mediate other macrophage responses to ozone, including eicosanoid and nitric oxide production, with concomitant decreases in phagocytic ability and superoxide production.
Key words
ozone, alveolar macrophages, membrane permeability.
Introducción
El ozono (O3) es un gas incoloro, de olor característico, generado tanto en la estratosfera, donde juega un papel fundamental en el bloqueo de la radiación ultravioleta solar, como en la superficie del planeta, donde constituye un problema serio de salud pública (1). Ello se debe a que el ozono es altamente oxidante, y su inhalación puede causar problemas respiratorios, especialmente en pacientes con patologías subyacentes, como los asmáticos (2).
En las capas medias de la estratosfera, la radiación ultravioleta rompe el oxígeno molecular (O2) de manera que la reacción de los átomos de oxígeno (O) resultantes con otras moléculas de oxígeno causa la formación de O3; este proceso forma parte de un ciclo de formación y descomposición de ozono causada por la misma radiación ultravioleta (2).
En zonas con niveles altos de contaminación por emisiones automotrices o industriales, el dióxido de nitrógeno (NO2) y moléculas orgánicas volátiles, contenidos en las mismas, participan, junto con oxígeno del aire y la luz solar, en una serie de reacciones que generan ozono (3,4). La radiación solar convierte al dióxido de nitrógeno en monóxido de nitrógeno (NO) y oxígeno atómico (O). Este último reacciona con oxígeno molecular para formar ozono. Aunque el monóxido de nitrógeno puede reaccionar con ozono, descomponiéndolo (NO + O3 ____ > NO2 + O2), las moléculas orgánicas volátiles, tales como aldehídos e hidrocarburos, pueden oxidar NO hasta NO2 por medio de la formación de radicales (peróxidos y peroxilos de alquilo), de manera directa y sin la participación de ozono, lo que posibilita la acumulación de este. En zonas urbanas altamente contaminadas, como en las ciudades de México o Los Angeles, los niveles de ozono se mantienen por sobre el mínimo establecido de 0,1 partes por millón (ppm) casi todo el año, y pueden llegar hasta 0,5 ppm durante los meses de verano (2). La exposición prolongada a niveles elevados de ozono causa inflamación en vías respiratorias, con bronconstricción, y a pesar de que el daño disminuye distalmente, puede afectar los alveolos proximales si la dosis de ozono y el período de exposición son suficientes (5). Puede ocurrir desprendimiento de células ciliadas, así como daño a neumocitos de tipo I, y acumulación de leucocitos en las cercanías de los bronquíolos terminales (2,6,7); el daño tisular puede intensificarse debido a la liberación de radicales y enzimas líticas por parte de los mismos leucocitos (8).
Se ha propuesto, y la evidencia reciente así lo confirma, que la membrana plasmática y las membranas de organelas son el blanco principal del ozono (9). Este no es un radical, pero tiene la capacidad de oxidar directamente grupos funcionales en moléculas biológicas y de formar complejos de adición a enlaces dobles, especialmente en fosfolípidos de membrana. Estos compuestos de adición pueden dar lugar a la formación de radicales peroxilo, y de peróxidos e hidroperóxidos, que en conjunto afectan negativamente la función de la membrana (2). Tomando en cuenta lo anterior, esta investigación se efectuó con el fin de evaluar los efectos de ozono en la integridad de la membrana plasmática de macrófagos alveolares de rata. Estos se obtienen con facilidad, y su localización alveolar los convierte en blancos de la acción oxidante del ozono. Además, son un elemento clave en el fenómeno inflamatorio, por su capacidad de liberar no sólo radicales y enzimas líticas, sino también mediadores inflamatorios de tipo prostanoide y citoquinas.
Materiales y Métodos
Aislamiento de macrófagos alveolares.
Los macrófagos alveolares se obtuvieron de ratas macho de la cepa Sprague-Dawley, las que se sacrificaron mediante inyección intra peritoneal de pentobarbital sódico (65 mg/ kg). Se efectuó de inmediato canulación traqueal, seguida por lavado pulmonar con 8 alícuotas de 10 ml. de solución salina fría amortigüada con fosfatos (0,1 M), sin calcio ni magnesio, y con un pH de 7,4. Las células se concentraron por medio de centrifugación a 550 x g durante 10 minutos a 4° C (centrífuga Sorvall RC 3, Sorvall Instruments, Newtown, CT), y se lavaron usando amortiguador de HEPES sin calcio (HEPES 10 mM, glucosa 5 mM, KCl 5 mM, NaCl 145 mM, pH 7,4), resuspendiéndose luego en 1 ml de amortiguador de HEPES con calcio (igual al anterior pero con CaCl2 1 mM). El conteo de macrófagos en la suspensión se efectuó utilizando un contador electrónico (Coulter Counter, modelo ZBI, con canalizador 256, Coulter Instruments, Hialeah , FL). El porcentaje de macrófagos obtenidos en las suspensiones final fue de 87,8 + 2,9 %, y el porcentaje de células viables, estimado mediante exclusión de azul tripán, fue de 86,8 + 3,0 % (porcentajes + 1 desviación standard).
Exposición de macrófagos alveolares a ozono.
Los macrófagos alveolares (3–4 x 106), se colocaron en botellas modificadas de poliestireno para cultivo de tejidos (GIBCO, 25 cm2), junto con 4 mL de medio mínimo esencial (Eagle, sin indicadores de pH ), conteniendo suero fetal bovino (10%). Cada botella se incubó a 37° C en presencia de una atmósfera con 5% de CO2 , durante 50-60 minutos, para permitir la adherencia de los macrófagos al fondo del recipiente. Luego de la incubación, las monocapas celulares se lavaron tres veces con amortigüador HC para descartar las células no adherentes, y se añadieron 3 ml del mismo amortigüador antes de proceder a la exposición a ozono.
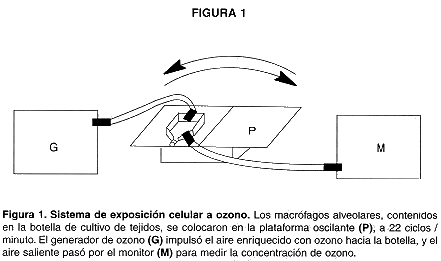
Las botellas de poliestireno se modificaron previo a los experimentos mediante 2 perforaciones, una en la pared lateral cerca del cuello, para salida de ozono, y otra en la pared posterior, para entrada de ozono. A las perforaciones se pegaron acoples de polietileno usando pegamento epóxico, para posibilitar el empate de mangueras de teflón por las que fluyeron las mezcla gaseosas de entrada y salida. El sistema de exposición se ilustra en la Fig.1. El acople de entrada en la botella de poliestireno conteniendo las células se conectó a un generador de ozono (Modelo 1000, McMillan Electronics Corp., Houston, TX), mientras que el acople de salida se conectó a un detector de ozono (Modelo 1003-AH. Dasibi Environmental Corp., Glendale, CA). La botella que contenía las células se colocó sobre una plataforma Buchler con mecanismo de inclinación alterna a 22 cambios por minuto. Al tiempo que el generador impulsó una corriente de aire enriquecido con ozono hacia el interior de la botella, la inclinación alterna permitió el contacto intermitente de la monocapa de macrófagos con la atmósfera en el interior de la botella. La mezcla gaseosa se analizó a su salida por medio del monitor, estableciendo así la concentración de ozono a que fueron sometidas las células ( 0,594 + 0,005 ppm durante una hora, a temperatura ambiente). En cada experimento, monocapas celulares colocadas en botellas sobre la misma plataforma, con entradas y salidas expuestas al aire ambiental sirvieron como controles no expuestos a ozono. Para las mediciones de calcio intracelular, los macrófagos resuspendidos en amortiguador HC conteniendo el fluorocromo fura 2-AM se colocaron sobre cubreobjetos, los cuales se pusieron dentro de una placa de Petri humedecida y se incubaron a temperatura ambiente durante 50 minutos para que las células formaran una monocapa sobre el vidrio. Luego de la incubación, los cubreobjetos se trasladaron a botellas de cultivo de tejidos, como las descritas previamente, pero modificadas mediante la confección de una ventana sellable en la parte superior, a través de la cual se introdujo el cubreobjetos al interior, y se fijó a un anillo de hule pegado sobre el fondo de la botella. La exposición a ozono se hizo entonces de acuerdo al mismo esquema descrito con anterioridad, luego de agregar amortigüador HC (4 ml) y sellar herméticamente con grasa de vacío la cubierta de la ventana a través de la cual se introdujo el cubreobjetos con las células.
Medición de la adherencia de macrófagos expuestos a ozono.
La medición de la adherencia de macrófagos expuestos a ozono se efectuó mediante conteos electrónicos. Luego de colocar un número conocido de macrófagos en las botellas de cultivo de tejidos e incubar para permitir la adherencia celular, se enjuagaron las monocapas con amortigüador HC para recolectar las células no adherentes, las que se contaron de inmediato. El canalizador incorporado al contador electrónico permitió discriminar las células de acuerdo a su volumen, de manera que se registraron sólo los macrófagos no adherentes, y se obtuvo por diferencia el número de macrófagos en la monocapa. Las botellas se examinaron microscópicamente previo a la exposición a ozono para comprobar la integridad de la monocapa celular y la ausencia de células no adherentes en el amortigüador que las cubría.
Las monocapas se expusieron luego a ozono durante 60 minutos, luego de lo cual se enjuagó la monocapa celular tres veces con amortigüador HNC para recoger las células no adherentes, que se contaron y cuyo total se usó para calcular su porcentaje con respecto al número total de macrófagos en la monocapa original. Las monocapas lavadas se examinaron nuevamente bajo el microscopio para comprobar la ausencia de células no adherentes en el sobrenadante.
Evaluación de la permeabilidad de membrana.
Los cambios en la permeabilidad de la membrana de los macrófagos se estudiaron mediante medición de 51Cr liberado al sobrenadante por células precargadas con el isótopo y expuestas a ozono. Luego del lavado pulmonar, los macrófagos se resuspendieron en medio mínimo con 10% suero fetal bovino y 100-250 µL de solución de Na251CrO4 (New England Nuclear,100
uCi / 107 macrófagos) hasta un volumen final de 1 mL, en un tubo de ensayo cónico de polietileno. Se incubó a continuación a 37° C durante 50 minutos en una atmósfera con 5% de CO2, con agitación suave cada 10 minutos, para permitir la incorporación del isótopo por parte de las células, las que se lavaron luego tres veces con amortigüador HC (1 mL) a fin de descartar el isótopo en el sobrenadante, y se colocaron las células en las botellas para permitir su adherencia. Se procedió luego a la exposición a ozono, según se describió previamente. Durante el período de exposición, se tomaron alícuotas de 100 uL del amortigüador que cubría los macrófagos para conteo de radioactividad (cpm, o cuentas por minuto) a 0, 20, 40, y 60 minutos, usando un contador de centelleo (Modelo LS 6500, Beckman Instruments, Fullerton, CA). Cada experimento incluyó cuatro botellas; una sirvió de control expuesto únicamente a la atmósfera ambiental; otras dos se expusieron a ozono, cuyos conteos se promediaron, y otra sirvió para la estimación del 100% de liberación de isótopo. En ésta última, se decantó el amortigüador a tiempo 0 minutos y se añadió un volumen de 3 mL de solución de Triton al 1% en agua, para lisar las células, y se tomó una alícuota de 100 uL a tiempo 60 minutos; el conteo de radioactividad en este caso representó un 100% de liberación de isótopo. El porcentaje de liberación específica de 51Cr para cada uno de los tiempos de lectura se calculó mediante la fórmula
% liberación específica = promedio cpm (expuestos a O3) – cpm (no expuestos)
cpm ( 100% de liberación)
en la cual los valores promedio de cpm en todas las botellas a tiempo 0 minutos se restaron a los de cpm en expuestos y no expuestos en todos los puntos de lectura. Los conteos de controles expuestos a la atmósfera ambiental no presentaron variación cuando se midieron nuevamente al final del período experimental de 60 minutos.
Medición de la variación del calcio intracelular en macrófagos alveolares expuestos a ozono.
Las variaciones en los niveles de calcio citoplásmico se estimaron mediante espectrofluorometría, en células cargadas con el fluorocromo fura 2-AM ( Molecular Probes, Eugene, OR). Los macrófagos alveolares se aislaron según se describió con anterioridad, y fueron resuspendidos en amortigüador HNC conteniendo fura-2 a una concentración de 4 uM, previo a la colocación de los mismos sobre cubreobjetos de vidrio. Esta incubación posibilitó la adherencia de los macrófagos al cubreobjetos y también permitió la entrada del fluorocromo a las células. Varios cubreobjetos se colocaron en las botellas de cultivo de tejidos y se procedió a la exposición a ozono, en presencia de amortigüador HC. A diferentes intervalos, se tomaron cubreobjetos de las botellas, interrumpiendo momentáneamente la exposición, para el análisis de cambios en la fluorescencia de fura 2, los que se midieron utilizando un sistema de medición catiónica (Spex Inc., Edison, N.J.) capaz de evaluarlos en unas cuantas células mediante microscopía de fluorescencia. Incrementos en la fluorescencia de fura 2 reflejaron aumentos en la concentración del calcio citoplásmico, y se detectaron al aumentar la razón de emisiones a 510nm (excitación a 340 nm)/ emisiones a 510nm (excitación a 380 nm). Los valores control se restaron de los valores de células expuestas a ozono en cada lectura.
Resultados
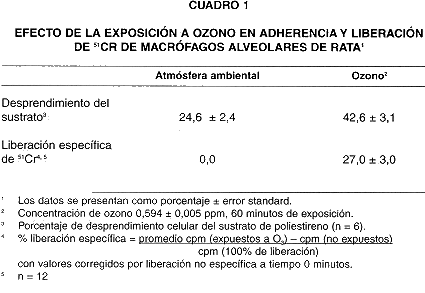
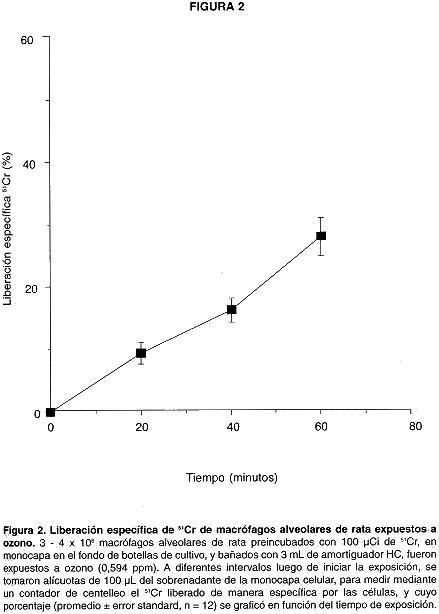
La exposición a ozono causó cambios en la permeabilidad de la membrana de macrófagos alveolares. La membrana intacta permite de manera muy lenta la entrada y salida de 51Cr; sin embargo, como puede apreciarse en el cuadro 1, la exposición de las células a ozono durante 60 minutos causó un aumento de 27 + 3,0 % en la liberación específica del isótopo por parte de las mismas en comparación con el control, indicando un incremento en la permeabilidad de la membrana. El daño a la membrana aumenta progresivamente en forma lineal a lo largo de la exposición, tal y como puede apreciarse en la Fig. 2.
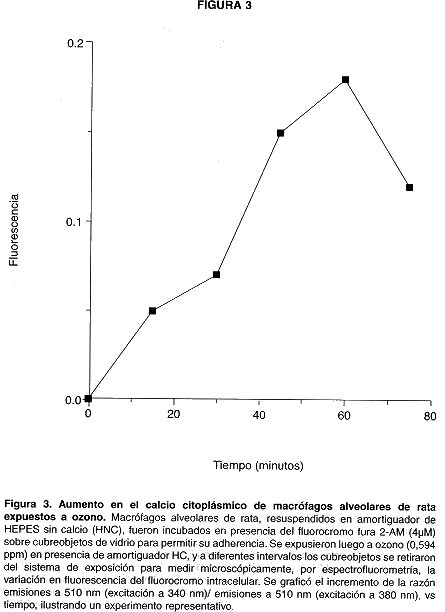
La alteración en la permeabilidad de membrana también causó un incremento en el calcio citoplásmico de los macrófagos alveolares, lo que se reflejó como aumento relativo de la fluorescencia debida al complejo citoplásmico Ca+2 – fura 2, como se ilustra en la Fig. 3. La fluorescencia aumentó de manera lineal hasta los 25 minutos de exposición, y luego aumentó de manera más pronunciada hasta los 60 minutos, para decaer a los 80 minutos. No se cuantificó la magnitud del aumento en términos de concentración de calcio citoplásmico.
La exposición de macrófagos alveolares a ozono durante 60 minutos causó el desprendimiento de un 42,6 + 3,1 % de células en la monocapa, comparado con un 24,6 + 2,4 % de desprendimiento en las botellas control expuestas a la atmósfera ambiental
(Cuadro 1).
Discusión
La exposición a ozono causa inflamación en las vías respiratorias, que puede conducir a hiperplasia si la exposición es crónica (2). La inflamación se caracteriza por la presencia de proteínas plasmáticas y células inflamatorias en fluido de lavado broncoalveolar, en el cual se detectan también eicosanoides tales como prostaglandinas, tromboxanos y HETE (ácido hidroxieicosatetraenoico) (2,10). En asmáticos, la respuesta inflamatoria es aún más pronunciada (11). Los cambios inflamatorios se acompañan de daño al epitelio respiratorio, con pérdida celular y apoptosis (12). Este es un hallazgo interesante, ya que el daño a la membrana causado por el ozono podría, por medio de la entrada de calcio externo, constituirse en una señal que dispare el proceso apoptótico.
Los macrófagos alveolares son un modelo en los cuales se han estudiado muchos de los efectos del ozono (2). Aún así, esos efectos no están del todo definidos (12). Existe consenso en la literatura en cuanto a que la membrana celular es el sitio fundamental de acción del ozono (9,13). Los datos obtenidos en esta investigación son congruentes con esa proposición, en la medida en que la permeabilidad de la membrana aumenta a los pocos minutos de exposición, detectada como aumento en la liberación de 51Cr a los 20 minutos de exposición y aumento en la concentración citoplásmica de Ca+2 a los 15 minutos. En ambos casos el efecto del ozono causa respuestas crecientes hasta los 60 minutos de exposición, lo que sugiere que el daño a la membrana aumenta progresivamente con el paso del tiempo. La señal fluorescente indicadora de aumento en el calcio citoplásmico disminuyó a los 80 minutos, probablemente debido al escape del fluorocromo a través lesiones en la membrana. Al efectuar la exposición a ozono con células bañadas con amortigüador HNC adicionado con 0,05 mM EDTA ( para quelar el calcio externo), la fluorescencia disminuyó abruptamente a los 45 minutos (datos no ilustrados). Ello podría explicarse asumiendo que el aumento inicial del calcio citoplásmico se debe a la entrada del calcio externo, lo que ocasionaría que, al eliminar éste, la señal fluorescente disminuya. Otra explicación sería proponer que la disminución del calcio externo vuelve a la membrana más susceptible al daño causado por el ozono, de manera que las lesiones alcanzan más tempranamente la magnitud necesaria para permitir el escape del fluorocromo, lo que concuerda con el papel protector del calcio sobre las membranas reportado con anterioridad (14).
Resultados previos señalan que el ozono puede adicionarse directamente a enlaces dobles en fosfolípidos (2), lo que conduce a la formación de radicales libres, con reorganización y ruptura de moléculas, alterando la permeabilidad selectiva de la membrana.
Aunque en esta investigación no se definió el efecto de la alteración de membrana en la viabilidad de los macrófagos, otros autores han reportado que macrófagos alveolares, tanto humanos como de cobayo, sometidos a ozono por períodos similares y a concentraciones semejantes, no muestran cambios en su contenido de ATP ni liberan enzimas como deshidrogenasa láctica durante el período experimental (60 minutos), indicando que las células se mantienen viables, al tiempo que se activan y liberan interleuquinas 1, 6 y 8 (15). Sin embargo, aumentos en el calcio intracelular como los reportados aquí pueden conducir posteriormente a apoptosis, y es posible que la exposición a ozono por períodos más prolongados dañe la membrana lo suficiente como para causar citotoxicidad.
El aumento en el calcio citoplásmico, reportado aquí como resultado original, también es consistente con una serie de observaciones previas, que tienen como denominador común el papel disparador del calcio como señal intracelular. Se cuentan entre ellas la formación de protrusiones de membrana en macrófagos expuestos a ozono (16), efecto característico del ionóforo de calcio A23187, y dependiente por lo tanto de aumentos en calcio intracelular. Asimismo, la liberación de eicosanoides, incluyendo leucotrienos, prostaglandinas y tromboxanos, también pueden ser estimuladas por ionóforos de calcio (17) y son elementos clave en la hiperreactividad bronquial observada luego de exposiciones a ozono. La producción de prostaglandina E2, además, parece mediar defectos en fagocitosis en macrófagos en respuesta al ozono (18) .
La liberación de óxido nítrico por parte de macrófagos en respuesta al ozono (19) es probablemente mediada, en parte, por incrementos en calcio intracelular. Dado que el óxido nítrico reacciona con el anión superóxido para generar peroxinitrito (20), ello podría contribuir a la disminución de producción de superóxido observada en macrófagos luego de tratamiento con ozono (21). Como la producción de superóxido es clave para la acción bactericida de los macrófagos, su producción disminuida podría originar la susceptibilidad aumentada a infecciones en animales expuestos a ozono.
La organización del citoesqueleto depende de la homeostasis de calcio intracelular. En la medida en que el ozono cause aumentos del calcio citoplásmico, la adherencia de los macrófagos pueden alterarse, lo que daría cuenta de la adherencia celular disminuida observada en este estudio. Otros autores (22) han reportado una disminución de moléculas de adhesión (integrinas CD18) como efecto del ozono en macrófagos, aunque los mecanismos causantes no han sido establecidos.
Los datos aquí presentados, por lo tanto, corroboran a la membrana celular como blanco de acción de ozono, y los aumentos observados en el calcio citoplásmico contribuyen a explicar hallazgos previos relacionados con la activación de los macrófagos y la alteración de sus características como por efecto del ozono.
Referencias
1) National Academy of Sciences. Ozone and other photochemical oxidants. Committee on Medical and Biologic Effects of Environmental Pollutants. Subcommittee on Ozone and Other Photochemical Oxidants. National Academy of Sciences, Washington, D.C. Vol. 19, 1977. [ Links ]
2) Mustafa, M.G. Biochemical basis of ozone toxicity. Free Radical Biol Med 1990; 9: 245-265. [ Links ]
3) Haagen-Smith, A.J. Chemistry and Physiology of Los Angeles smog. Ind Eng Chem 1952; 44: 1342-1346 [ Links ]
4) Haagen-Smith, A.J. Photochemistry and smog. J Air Pollut Control Assoc 1963; 13: 446-454. [ Links ]
5) Koren, H.S., Devlin, R.B., Graham, D.E., Mann, R., McGee, M.P., Horstman, D.H., Kozumbo, W.J., Becker, S., House, D.E., McDonnell, W.F., Bromberg, P.A. Ozone-induced inflammation in the lower airways of human subjects. Amer Rev Respir Dis 1989; 139: 407-415. [ Links ]
6) Stephens, R.J., Sloan, M.F., Evans, M.J., Freeman, G. Early response of lung to low levels of ozone. Am J Pathol 1974; 73: 711-726. [ Links ]
7) Barry, B.E., Miller, F.J., Crapo, J.D. Alveolar epithelial injury caused by inhalation of 0.25 ppm ozone. En Lee. S.D., Mustafa, M.G., Mehlman (eds.) International Symposium on the biomedical effects of ozone and related photochemical oxidants. Princeton Scientific Publishers, Princeton; N.J. 1983; p 299-309. [ Links ]
8) Brain, J.D. Macrophage damage in relation to the pathogenesis of lung diseases. Environ Health Perspect 1980; 35:21-28. [ Links ]
9) Becker, S., Madden, M.C., Newman, S.L., Devlin, R.B., Koren, H.S. Modulation of human macrophage properties by ozone exposure in vitro. Toxicol Appl Pharmacol 1991; 110: 403-415. [ Links ]
10) Coffey, M.J., Wheeler, C.S., Gross, K.B., Eschenbacher, W.L., Sporn, P.H., Peters-Golden, M. Increased 5-lipoxygenase metabolism in the lungs of human subjects exposed to ozone. Toxicology 1996; 114: 187-197. [ Links ]
11) Scannell, C., Chen, L., Aris, R.M., Tager, I., Christina, D., Ferrando, R., Welch, B., Kelly, T., Balmes, J.R. Greater ozone-induced inflammatory responses in subjects with asthma. Am J Resp Crit Care Med 1996; 154: 24-29. [ Links ]
12) Hamilton, R.F. Jr., Li, L., Eschenbacher, W.L., Szweda, L., Holian, A. Potential involvement of 4-hydroxynonenal in the response of human lung cells to ozone. Am J Physiol 1998; 274: L8-L16. [ Links ]
13) Banks, M.A., Porter, D.W., Martin, W.G., Castranova, V. Effects of in vitro ozone exposure on peroxidative damage, membrane leakage, and taurine content of rat alveolar macrophages. Toxicol Appl Pharmacol 1990; 105: 55-65. [ Links ]
14) Pasternak, C.A. A novel role of Ca+2 and Zn+2: protection of cells against membrane damage. Bioscience Reports 1988; 6: 579-583. [ Links ]
15) Arsalane, K., Gosset, P., Vanhee, D., Voisin, C., Hamid, Q., Tonnel, A.B., Wallaert, B. Ozone stimulates synthesis of inflammatory cytoquines by alveolar macrophages in vitro. Am. J Respir Cell Mol Biol 1995; 13: 60-68. [ Links ]
16) Dormans, J.A., Rombout, P.J., van Loveren, H. Surface morphology and morphometry of rat alveolar macrophages after ozone exposure. J Toxicol Environ Health 1990; 31: 53-70. [ Links ]
17) Palmer, R.M.J., Salmon, J.A. Release of leukotriene B4 from human neutrophils and its relationship to degranulation induced by N-formyl-methionyl-leucyl-phenylalanine, serum-treated zymosan and the ionophore A23187. Immunology 1983; 50:65-73. [ Links ]
18) Canning, B.J., Hmieleski, R.R., Spannhake, E.W., Jakab, G.J. Ozone reduces murine alveolar and peritoneal macrophage phagocytosis: the role of prostanoids. Am J Physiol 1991; 261: L277-L282. [ Links ]
19) Laskin, D.L., Pendino, K.J., Punjabi, C.J., Rodríguez del Valle, M., Laskin, J.D. Pulmonary and hepatic effects of inhaled ozone in rats. Environ Health Perspect 1994; 102 (Suppl 10): 61-64. [ Links ]
20) Radi, R,. Cosgrove, T.P., Beckman, J.S., Freeman, B.A. Peroxynitrite-induced luminol chemiluminescence. Biochem J 1993; 290: 51-57
21) Ryer-Powder, J.E., Amoruso, M.A., Czerniecki, B., Witz, G., Goldstein, B.D. Inhalation of ozone produces a decrease in superoxide anion radical production in mouse alveolar macrophages. Amer Rev Resp Dis 1988; 138: 1129-1133. [ Links ]
22) Hoffer, E., Baum, Y., Tabak, A., Frevert, C. Adhesion molecules of blood polymorphonuclear leukocytes and alveolar macrophages in rats: modulation by exposure to ozone. Hum Exp Toxicol 1999; 18: 547-551. [ Links ]
* Departamento de Bioquímica
Escuela de Medicina, Universidad de Costa Rica