Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Costarricense de Ciencias Médicas
Print version ISSN 0253-2948
Rev. costarric. cienc. méd vol.22 n.1-2 San José Jun. 2001
Efecto del dimetilsulfóxido en la respuesta quimioluminiscente y el consumo de oxígeno de neutrófilos humanos activados.
Jorge García*
Resumen
El dimetil sulfóxido es un secuestrador inactivante del radical hidroxilo (.OH), e inhibe, de manera proporcional a la dosis, la quimioluminiscencia (QL) de luminol (QLU) y de lucigenina (QLC) en leucocitos polimorfonucleares neutrófilos (PMN) activados con estimulantes solubles y partículas de zimosán opsonizado (ZO). Los resultados indican que la inhibición de la QLU en respuesta al ionóforo de calcio A23187 puede deberse al secuestro de .OH por DMSO, mientras que la inhibición de la QLC sugiere que el DMSO afecta negativamente a la oxidasa de membrana de PMN. Ello se confirmó al observar que el DMSO inhibió el consumo de O2 en PMN activados con FMLP y ZO. Cuando el DMSO se añadió luego de la estimulación con FMLP y ZO, no hubo inhibición de la QLU, pero sí de la inducida por A23187. El lavado de PMN expuestos a DMSO causó un incremento en la QLU en respuesta a la estimulación con FMLP y ZO. Ello es congruente con la hipótesis de que el DMSO interfiere con la activación de las subunidades de membrana de la oxidasa por las unidades reguladoras citoplasmáticas. Estos resultados implican que el DMSO puede inhibir la QL en fagocitos tanto mediante secuestro de .OH como por interferencia con la producción de superóxido por la oxidasa de membrana. (Rev Cost Cienc Med 2001; 22(1,2):17-32).
Palabras claves
Dimetil sulfóxido, quimioluniniscencia, luminol, lucigenina, neutrófilos.
Abstract
Dimethylsulfoxide (DMSO), a hydroxyl radical scavenger, exerted a dose dependent inhibition on the luminol and lucigenin-enhanced chemiluminiscent responses of human neutrophils activated with soluble and particulate stimulants. DMSO inhibition of the luminol chemiluminescence induced by calcium ionophore A23187 was probably due to .OH scavenging, whereas inhibition of the lucigenin chemiluminiscence suggested DMSO negatively affects the NADPH-dependent membrane oxidase of neutrophils. In agreement with this, DMSO moderately inhibited O2 consumption in PMN suspensions stimulated with chemotactic peptide and opsonized zymosan. DMSO inhibition of chemotactic peptide and opsonized zymosan-induced luminol chemiluminescence was observed only when added before or in conjunction with stimulants, whereas A23187-induced chemiluminescence was inhibited by DMSO regardless of time of addition. Washing of DMSO-treated PMN resulted in increased luminol enhanced chemiluminescence in response to chemotactic peptide and opsonized zymosan. This is consistent with the idea that DMSO may be interfering with activation of the membrane subunits of the oxidase by translocation and docking of the cytoplasmic, regulatory subunits. These data imply that DMSO inhibits neutrophil chemiluminescence both by .OH scavenging and interfering with oxidase activation.
Key words
Dimethylsulfoxide, chemiluminiscent, luminol, lucigenin, neutrophils.
Introducción
El dimetilsulfóxido (DMSO, CH3SOCH3) se obtiene como subproducto durante el procesamiento de pulpa de madera para fabricación de papel, y es líquido a temperatura y presión ambientes. Descubierto por Saytzeff en 1866, se usó como solvente orgánico a partir de la década de 1940, y como criopreservante a partir de 1961 (1). Es aprótico y altamente dipolar, en razón de la separación de cargas entre el oxígeno y el azufre, y, por ello, es miscible tanto con el agua como con solventes orgánicos. Puede formar complejos en sistemas biológicos con cationes metálicos, biomoléculas (hormonas, enzimas, eicosanoides) y drogas, al asociarse con pares de electrones no compartidos en aminas, alcoholes, ésteres y ácidos (2). Atraviesa rápidamente la epidermis y las membranas celulares sin dañarlas, por lo que sirve como acarreador de drogas a través de dichas barreras (3).
El DMSO se introdujo en la práctica clínica para el tratamiento tópico de quemaduras, lesiones hipotérmicas en extremidades, y artritis (4). Posteriormente, numerosos reportes en la literatura documentaron su posible uso como antiinflamatorio (1), efectivo para disminuir el daño tisular causado por isquemia cerebral (5). Sin embargo, no se llegó a la etapa de estudios clínicos controlados. Más recientemente, se ha usado, junto con heparina, en el tratamiento de inhalación de humo en modelos animales (6), se ha administrado a pacientes con cáncer gástrico (7) y de colon (8), en los cuales aparentemente incrementa la longevidad, y se usa como tratamiento tópico en aplicaciones veterinarias (9).
El DMSO puede transferir .H de sus grupos metilo al radical hidroxilo (.OH) de manera específica, comportándose como un secuestrante inactivador del mismo (1), y generando formaldehído (10), metano (11) y metano sulfinato (12) como productos de la reacción. Esta característica, junto con su alta capacidad penetrante, explican la mayor parte de la actividades biológicas del DMSO. Paradójicamente, al tiempo que las posibilidades de uso clínico desaparecían, su utilización como herramienta experimental en el estudio de radicales libres aumentó. El DMSO se usa en fecuentemente para establecer la participación del radical (.OH) en procesos biológicos e inorgánicos (11), o prevenir el daño que pueda causar en sistemas biológicos experimentales (2). Asimismo, su uso como criopreservante de células en cultivo está ampliamente difundido (13).
El efecto del DMSO en leucocitos polimorfonucleares neutrófilos (PMN) ha sido objeto de varias investigaciones. Aunque todavía es motivo de controversia, la evidencia señala que los PMN activados producen .OH, y el metano resultante de su reacción con DMSO se detecta en células fagocitantes (11), en los cuales la actividad bactericida disminuye (14). En modelos de animal entero, sin embargo, no se presenta susceptibilidad aumentada a infecciones como resultado del tratamiento con DMSO, ya que la capacidad microbicida es multifactorial, y no depende solamente de la generación de .OH (15).
Algunos estudios indican que el DMSO afecta la oxidasa de membrana en PMN (enzima que reduce O2 hasta superóxido, u O2-), con lo que disminuye tanto la producción de O2-, como la de otros oxidantes derivados del mismo, como peróxido de hidrógeno (H2O2), hipoclorito (OCl -), e .OH (16,17). Estos resultados sugieren que el efecto depresor del DMSO en la producción de radicales y la actividad bactericida de PMN no se debe necesariamente al secuestro de .OH. Los resultados de nuestra investigación clarifican esta aparente discrepancia.
La producción de radicales por parte de fagocitos y otras células se acompaña de una emisión extremadamente débil de luz, llamada quimioluminiscencia (QL), la cual es debida a la reacción de radicales con moléculas blanco o entre ellos mismos, y que puede detectarse con fotómetros altamente sensibles, como los usados en contadores de centelleo, o en luminómetros (18). La QL puede amplificarse añadiendo al sistema compuestos como luminol o lucigenina, que sufren oxidación al reaccionar con radicales y emiten fotones con mayor rendimiento cuántico (18). El luminol puede ingresar a la célula, y detecta radicales intra y extracelulares; es oxidado por diferentes radicales, aunque con mayor efectividad por H2O2 y el OCl- (19), los que cooxidan al luminol para dar una quimioluminiscencia (QLU) hasta 100 veces mayor que la obtenida por la oxidación de aquel por otros radicales. La lucigenina, por el contrario, permanece en el compartimiento extracelular, y es oxidada preferencialmente por el O2- (20). Sin embargo, la especificidad de esa oxidación ha sido puesta en duda, y debe comprobarse usando superóxido dismutasa, que al convertir al O2- en H2O2, disminuye la quimioluminiscencia de lucigenina (QLC) (21).
La quimioluminiscencia no amplificada emitida por PMN durante la fagocitosis de bacterias disminuye por efecto del DMSO, lo que indica que el .OH contribuye a la señal lumínica (22). La evidencia obtenida en presencia de luminol en sistemas generadores de radicales in vitro es congruente con esa propuesta, ya que la QLU en respuesta al .OH en estos sistemas también disminuye en presencia de DMSO (23).
En esta investigación hemos estudiado, en primera instancia, el efecto del DMSO en PMN activados con estimulantes que afectan diferentes mecanismos metabólicos, midiendo la QLU y QLC resultantes para estimar el efecto del DMSO en la producción de radicales. El aceto-miristato de forbol (PMA) es un activador directo de la proteína quinasa C (PKC), y estimula la producción de anión superóxido (O2-) y de óxido nítrico (NO.); el péptido quimiotáctico N-formil leucil metionil fenilalanina (FMLP), al activar receptores de membrana, promueve la producción de O2- y de NO., así como la degranulación (que, al liberar mieloperoxidasa, conduce a la formación de OCl- si el O2- está presente ); el zimosán opsonizado (ZO) es un estimulante particulado que también activa receptores de membrana y causa fagocitosis y degranulación, con formación de diferentes radicales (O2-, H2O2, OCl-, .OH y NO.) (24,25); el ionóforo de calcio A23187 se inserta en la interfase entre lípidos y proteínas de la membrana (26) y causa entrada de calcio al citoplasma, activando fosfolipasas, ciclooxigenasa y lipooxigenasa, promoviendo la síntesis de eicosanoides a partir de ácido araquidónico (27), lo que es acompañado por producción de .OH (28). También activa la formación de NO. (24).
Se evaluó, además, el consumo de oxígeno en PMN activados con los diferentes estimulantes en presencia de DMSO, para establecer posibles efectos inhibitorios de éste en la actividad de la oxidasa de membrana.
Materiales y Métodos
Obtención de leucocitos polimorfonucleares neutrófilos.
Los neutrófilos para el ensayo de quimioluminiscencia de luminol (QLU) en PMN estimulados con ZO, FMLP, y A23187 (todos de Sigma Chemical Co.), se obtuvieron de sangre periférica mediante sedimentación con dextrán. En este método, 10 partes de sangre venosa, anticoagulada con EDTA, se mezclaron con 3 partes de Dextrán (T 300, Aldrich Chemicals) al 6% en PBS sin calcio (NaCl 140 mM, KCl 5 mM, Na2HPO4 9.35 mM, NaH2PO4. H2O 1.9 mM, pH 7.4, reactivos de Sigma Chemical Co.), y la mezcla se incubó a 37 C durante 45 minutos para permitir la sedimentación de eritrocitos. El plasma rico en PMN se recolectó y se centrifugó para separar las células, las cuales se lavaron a continuación con PBS sin calcio. Las células se resuspendieron en 1 ml de amortigüador de HEPES ( HEPES 10 mM, NaCl 144 mM, KCl 5 mM, CaCl20.2 mM, Glucosa 5.5 mM, pH 7.4, reactivos de Sigma Chemical Co.) para su conteo. La concentración de PMN en los viales de reacción fue de 1 x 10 6 células, las que fueron añadidas en 1 ml de amortigüador de HEPES 1 mM en Ca+2.
Para los ensayos de QLU con PMA (Sigma Chemical Co.) como estimulante, para los de quimioluminiscencia de lucigenina (QLC), y para los de consumo de oxígeno, los PMN se aislaron de sangre periférica usando medio MonoPoly (ICN-Flow). Se usó sangre venosa heparinizada, la cual se estratificó en tubos de ensayo sobre medio Mono Poly, y se centrifugó de acuerdo a las instrucciones del fabricante. Se recogió la banda de PMN y éstos se lavaron con 20 ml de amortigüador HEPES sin calcio. Los PMN se resuspendieron luego en 10 ml de solución de NH4Cl (0.83% en HEPES 10 mM, pH 7.4) durante 7 minutos a 37 C, para lisar eritrocitos contaminantes. Los PMN se lavaron una vez más con amortigüador HEPES sin calcio y se resuspendieron en 1 ml de amortigüador de HEPES 0.2 mM en Ca+2.
Estimulantes
Se prepararon soluciones de PMA (3.2 x 10 –5 M), FMLP (4 x 10 –5 M) y A23187 (1 x 10-4 M) en amortigüador de HEPES sin calcio, de las cuales se agregó la cantidad apuntada a los viales de reacción. Aunque los estimulantes se solubilizan inicialmente en DMSO, la concentración del mismo contribuida por las soluciones a las suspensiones de trabajo con PMN fue menos de 100 veces de la requerida para causar efectos observables.
El zimosán se opsonizó mezclando 6 mg con 1 ml de plasma autólogo y 5 ml de amortigüador de HEPES sin calcio. Se incubó a 37 C durante 15 minutos y se lavó por centrifugación, resuspendiéndose luego en HEPES sin calcio (6 ml) a una concentración de
1 mg/ml. Se sonicó luego durante 5 minutos para homogenizar la suspensión.
Medición de quimioluminiscencia.
La QLU de PMN estimulados con FMLP, ZO y A23187 se midió usando un contador de centelleo Beckman LS8100, en modalidad fuera de coincidencia (con un solo fotomultiplicador). La mezcla de trabajo, contenida en viales plásticos de centelleo, consistió en 3 ml de amortigüador de HEPES con Ca+2 (1 mM), 1 ml de suspensión celular (1 x 10 6células) y 100 µL de solución de luminol (concentración final 10 -8M).
La mezcla se incubó a 37° C durante 10 minutos previo al inicio de la reacción, la que inició al agregar 1 ml de solución del estimulante, luego de obtener la lectura de QLU basal durante 5 min. Las lecturas se efectuaron en secuencias de 0.2 minutos, con una duración total de 10 - 30 minutos, según el estimulante, hasta que la señal decayó. Los valores obtenidos se expresaron como valores máximos o integrales ( área bajo las curvas), según se apunta en la sección de resultados.
Las mediciones de QLU en PMN estimulados con PMA, y las de QLC, se efectuaron en un luminómetro de seis canales (Berthold LB 9505C, Berthold Instruments, Wildbad, Alemania) asistido por computadora, y con programas suministrados por el fabricante.
El volumen de reacción en las cubetas del luminómetro fue de 500 µL, conteniendo amortiguador de HEPES con Ca+2 (1 mM), 50-100 µL de suspensión celular (0.5-1 x 10 6 PMN /mL) y 10 µL de solución de luminol (concentración final 10 -8 M). La suspensión celular se mezcló primero con el luminol, y se leyó el nivel basal de QL durante 5-10 min. La reacción se inició con la adición de los estimulantes (2 – 20 µL) y la quimioluminiscencia se midió durante 10-30 minutos hasta que la señal decayó.
Los valores se expresaron como máximos o integrales.
La adición de DMSO a los viales de reacción se efectuó a diferentes tiempos, según se indica en la sección de resultados, a saber: a) antes de iniciar la reacción, en cuyo caso se preincubó junto con las células previo a la adición del estimulante b) al mismo tiempo que se añadió el estimulante para iniciar la reacción y c) a diferentes períodos luego de la adición de los estimulantes.
Consumo de oxígeno de PMN en suspensión.
El consumo de oxígeno se midió usando un oxígrafo Wilson K-IC con un electrodo Clark (Wilson Medical Electronics, Middleton, WI) 5 x 10 6 células, en 100 µL de amortigüador de HEPES con 0.2 mM Ca+2, se transfirieron a la cámara de reacción del oxígrafo junto con 1.5 ml de amortigüador de HEPES con 1 mM de Ca+2. El consumo basal de oxígeno se midió durante 10 minutos, a 37° C y con agitación controlada, en presencia o ausencia de DMSO. Luego se añadieron 50-100 µL de solución del estimulante, y se midió el consumo de oxígeno post estimulación.
Viabilidad de PMN expuestos a DMSO
Para determinar si la exposición a DMSO afectó negativamente la viabilidad de PMN, 8.5 x 105 células, resuspendidas en 200 µL de amortigüador de HEPES sin calcio, se mezclaron con 800 µL de amortigüador de HEPES con 1 mM Ca+2 y DMSO a concentraciones finales de 274 y 660 mM. Los viales conteniendo la mezcla se incubaron a 37° C y se tomaron muestras a los 0, 30, 45 minutos, procediéndose a efectuar conteos de células no viables en presencia de azul de tripán.
Resultados
La viabilidad de PMN expuestos a DMSO de analizó mediante el método de azul de tripán según se detalló anteriormente. No se observó ningún incremento por sobre el número basal de células no viables (2%) a lo largo de los 45 minutos de incubación, a ninguna de las concentraciones de DMSO (datos no ilustrados).
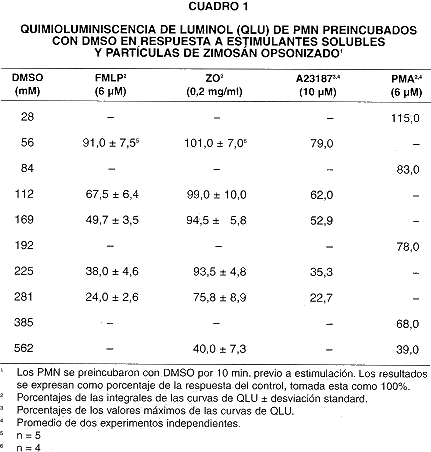
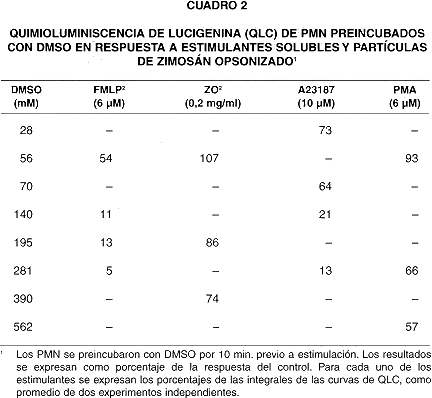
Cuando los PMN se incubaron con DMSO previo a su estimulación, tanto la QLU como la QLC se inhibieron progresivamente conforme aumentó la concentración del DMSO (cuadros 1 y 2). La inhibición se manifiestó claramente cuando la concentración de DMSO sobrepasó 112 mM. La QLU y QLC de los PMN en respuesta a FMLP y A23187 se inhibieron de manera más pronunciada (a menos de 25% de la respuesta control) que las respuestas a ZO y PMA.
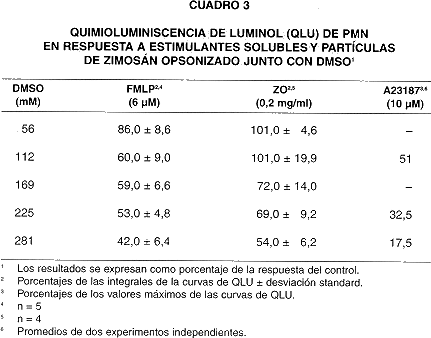
La QLU de PMN estimulados a los que se añadió DMSO junto con los estimulantes también fue suprimida según aumentó la dosis de DMSO (cuadro 3). En este caso, las señales de QLU en respuesta a FMLP y A23187 fueron también inhibidas de manera más pronunciada que las respuestas a ZO y PMA.
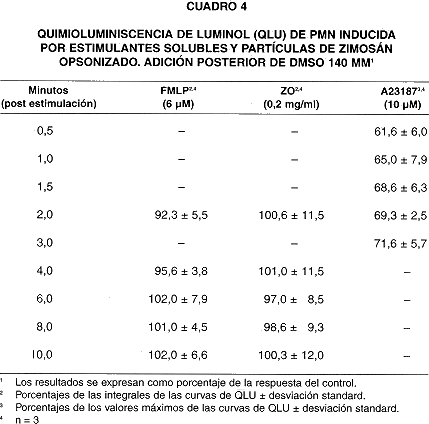
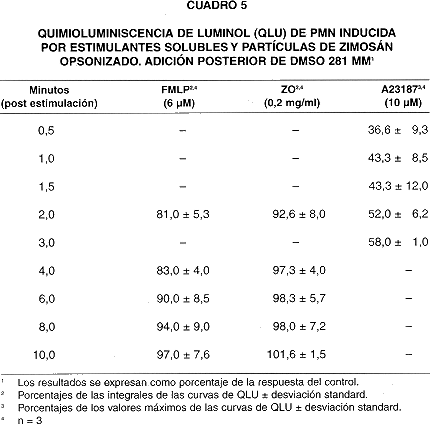
Cuando el DMSO (140 y 281 mM) se añadió a los PMN luego de la adición de estimulantes (cuadros 4 y 5) la respuesta de QLU en respuesta al A23187 todavía mostró inhibición importante. Sin embargo, la QLU en respuesta a FMLP y ZO no sufrió inhibición cuando el DMSO se adicionó a partir de los 2 minutos post-estimulación.
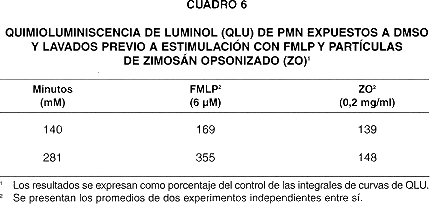
Cuando se lavaron los PMN preincubados con DMSO, la QLU en respuesta a la estimulación con FMLP y ZO mostró un incremento (hasta de 355% por sobre control en PMN activados con FMLP), que fue mayor en PMN expuestos a concentraciones más altas de DMSO ( 281 mM, cuadro 6).
En contraste con lo anterior, la preincubación de PMN con DMSO a dosis relativamente altas (281 y 561 mM) causó una disminución de 20 a 35 % en el consumo de oxígeno luego de estimulación con FMLP, PMA y ZO (cuadro 7).
Mientras que la QLU en PMN estimulados con FMLP en presencia de 281 mM DMSO decae a 24% del control (cuadro 1), el consumo de oxígeno es de 71% del control (cuadro 7). De la misma manera, la QLC decae a 5% del control (cuadro 2), al tiempo que el consumo de oxígeno es de un 82% del control (cuadro 7).
Discusión
Investigaciones previas han demostrado que el DMSO es un secuestrador inactivante específico del radical .OH (2), y que la quimioluminiscencia de luminol (QLU), inducida por sistemas generadores de .OH, es inhibida en presencia de DMSO (23), ya que la inactivación del .OH previene la oxidación del luminol, y por ende, la emisión de luz.
A pesar de ser todavía objeto de debate, aceptamos la proposición de Repine et al. de que los fagocitos activados producen .OH, el cual, al reaccionar en su sistema experimental con DMSO, da metano como producto (11). La producción de hidroxilo en fagocitos también recibe apoyo indirecto por los experimentos de van Dyke et al. (29), quienes encontraron que los inhibidores del metabolismo de araquidonato (inhibidores de fosfolipasa A2 y ciclooxigenasa) inhiben la QLU emitida en respuesta al ionóforo de calcio A23187; esto indica que la QLU proviene mayoritariamente de la producción de .OH asociada al metabolismo de araquidonato (28). Estudios posteriores muestran que una parte (ca.20%) de esa respuesta puede ser eliminada por superóxido dismutasa (SOD), señalando entonces al O2- como participante minoritario (30); el origen del O2- no está claro, porque la oxidasa de membrana no es activada por el A23187 (29).
En esta investigación hemos evaluado el efecto del DMSO en QLU, QLC, y consumo de oxígeno en PMN sujetos a estimulantes solubles y particulados del metabolismo oxidativo. Los antecedentes en la literatura permitían anticipar una posible inhibición de la QLU, gracias al efecto secuestrante de .OH por parte de DMSO (2). Sin embargo, de acuerdo al reporte de Beilke et al. (17), era necesario considerar también una posible inhibición de la oxidasa de membrana por parte del DMSO. Nuestros resultados son congruentes con ambas proposiciones, a saber, que el DMSO puede disminuir la QL emitida por fagocitos activados en razón de su capacidad de reaccionar con .OH, y que también ejerce un efecto negativo, aunque no muy pronunciado, sobre la actividad de la oxidasa de membrana.
Como la QLU de PMN activados con el ionóforo de Ca+2 A23187 puede deberse en su mayor parte a la producción de .OH (29,31), su inhibición por parte del DMSO, observada en este estudio (cuadros 1, 3, 4 y 5) , es probablemente el resultado de su efecto secuestrador de .OH; concuerda con esto el que la inhibición sea independiente del momento de adición del DMSO. Aunque el A23187 también estimula la producción de NO. (25)y de una pequeña cantidad de O2- en PMN (30), éstos no parecieran ser suficientes para generar peroxinitrito (ONOO -), que también oxida al luminol y produce QL (32), ya que, como se dijo antes, la QLU inducida por A23187 es debida al .OH (29,31).
Sin embargo, el DMSO inhibe la QLC de PMN estimulados (cuadro 2), la cual es básicamente resultado de la generación de O2- por la oxidasa de membrana. Esto sugiere que el DMSO está inhibiendo directamente la producción de O2-, lo que se confirmó al constatar que el DMSO inhibió el consumo de oxígeno (precursor directo de O2-) en PMN activados con PMA, FMLP y ZO (cuadro7). La inhibición del consumo de O2 no es pronunciada, y aún a una concentración de DMSO de 562 mM, alcanza solo un 35% en PMN estimulados con ZO (cuadro 7). Como era de esperar, el ionóforo de calcio no estimuló el consumo de O2 en suspensiones de PMN (datos no ilustrados).
La oxidasa es una enzima multimérica, dependiente de NADPH, que consta de subunidades de membrana (flavocitocromo b,
p22 phox, gp91 phox y p21rac), que reducen O2 hasta O2-, usando electrones donados por NADPH, cuando son activadas por interacción con un complejo trimérico de proteínas citoplásmicas (p40phox, p47phox, y p60phox), que se transloca a la membrana en fagocitos activados(33). Los datos ilustrados en los cuadros 5 y 6 indican que la QLU de PMN estimulados se inhibe solo si el DMSO se adiciona previamente o en conjunto a los estimulantes, y no después. Ello sugiere que el DMSO podría interferir con la interacción de las unidades reguladoras citoplásmicas con las subunidades catalíticas situadas en la membrana. Sin embargo, los datos disponibles no permiten discernir si el efecto del DMSO se ejerce directamente sobre la enzima, las unidades reguladoras, o sobre la topología de la membrana plasmática, en la que se localizan las unidades catalíticas.
Si los PMN expuestos a DMSO se lavan para eliminar este antes de la estimulación, la actividad de la enzima aumenta, como se observa en el cuadro 6. Ello implica que el efecto del DMSO sobre la actividad de oxidasa es reversible, y parecería consistente con la hipótesis de que el DMSO altera la topología de la unidad catalítica de la oxidasa en la membrana.
No es posible explicar, sobre la base de los datos obtenidos, la inhibición más pronunciada de la QLU en respuesta a ZO cuando el DMSO se añade simultáneamente (cuadros 1 y 3). La QLU y QLC inducida por FMLP son más susceptibles de inhibición por DMSO, en un porcentaje mucho mayor que el justificable por la disminución en el consumo de oxígeno (cuadros 1, 2, 3 y 7). Como el FMLP causa liberación de mieloperoxidasa, con formación de OCl- (30), la disminución en QLU podría indicar,además, interferencia del DMSO en la cooxidación del luminol por OCl- y H2O2, por reacción secundaria del DMSO con OCl- (17). Un fenómeno análogo, pero no definido, podría explicar la disminución en QLC.
Reconocimientos
El autor desea dejar constancia de que las mediciones de QLU en el contador de centelleo Beckman LS8100 se efectuaron gracias a fondos de investigación otorgados por el Instituto Costarricense de Investigación y Enseñanza en Nutrición y Salud (INCIENSA, proyecto H2-8404), y asimismo, de la participación de la Dra. María Cecilia Matamoros en las mismas.
Referencia.
1) Dujovny, M., Rozario, R., Kossovsky, N., Diaz, F.G., Segal, R. Antiplatelet effect of dimethyl sulfoxide, barbiturates, and methyl prednisolone. Ann NY Acad Sci 1983; 411: 234-244. [ Links ]
2) Kharasch, N., Thyagarajan, B.S. Structural basis for the biological activities of dimethyl sulfoxide. Ann NY Acad Sci 1983; 411:391-402 [ Links ]
3) Spruance, S.L., McKeough, M.B., Cardinal, J.L. Dimethysulfoxide as a vehicle for topical antiviral chemotherapy. Ann NY Acad Sci 1983; 411: 28-33. [ Links ]
4) Wood, D.C., Wood, J. Pharmacological and biochemical consideration of dimethylsulfoxide. Ann NY Acad Sci 1975; 243: 7-19. [ Links ]
5) de la Torre, J.C. Role of dimethylsulfoxide in prostaglandin-thromboxane and platelet systems after cerebral ischemia. Ann NY Acad Sci 1983; 411: 293-308. [ Links ]
6) Brown, M., Desai, M., Traber, L.D., Herndon, D.N., Traber, D.L. Dimethylsulfoxide with heparin in the treatment of smoke inhalation injury. J Burn Care Rehab 1988; 9: 22-25. [ Links ]
7) Salim. A.S. Oxygen-derived free radical scavengers prolong survival in gastric cancer. Chemotherapy 1992; 38: 135-144. [ Links ]
8) Salim, A.S. Scavengers of oxygen-derived free radicals prolong survival in advanced colonic cancer. A new approach Tumour Biol 1993; 14: 9-17. [ Links ]
9) Smith, G., Bertone, A.L., Kaeding, C., Simmons, E.J., Apostoles, S. Anti-inflammatory effectos of topically applied dimethyl sulfoxide gel on endotoxin-induced synovitis in horses. Am J Vet Res 1998; 59: 1149-1152. [ Links ]
10) Klein, S.M., Cohen, G., Cederbaum, A.I. The interaction of hydroxyl radicals with dimethylsulfoxide produces formaldehyde. FEBS Lett 1980; 116: 220-222. [ Links ]
11) Repine, J.E., Eaton. J.W., Anders, M.W., Hoidal, J.R., Fox, R.B. Generation of hydroxyl radical by enzymes, chemicals and human phagocytes in vitro. Detection with the anti-inflammatory agent, dimethylsulfoxide. J Clin Invest 1979; 64: 1642-1651. [ Links ]
12) Babbs, C.F., Griffin, D.W. Scatchard analysis of methane sulfinic acid production from dimethylsulfoxide: a method to quantify hydroxyl radical formation in physiologic systems. Free Rad Biol Med 1989; 6: 493-503. [ Links ]
13) Jacob, S.W., Herschler, R. Introductory remarks: dimethylsulfoxide after twenty years. Ann NY Acad Sci 1983; 411: xiii- xvii. [ Links ]
14) Repine, J.E., Fox, R.B., Berger, E. Effect of dimethylsulfoxide on the bactericidal function of polymorphonuclear leukocytes. Ann NY Acad Sci 1983; 411: 11-13. [ Links ]
15) Czuprynski, C.J., Henson, P.M., Campbell, P.A. Effect of dimethylsulfoxide on the in vitro and in vivo bactericidal activity of human and mouse neutrophils and mononuclear phagocytes. Inflammation 1984; 8 181-191. [ Links ]
16) Auer, D.E., Ng., J.C., Seawright, A.A. Superoxide production by stimulated equine polymorphonuclear leukocytes - inhibition by anti-inflammatory drugs. J Vet Pharmacol Ther 1990; 13: 59-66. [ Links ]
17) Beilke, M.A., Collins-Lech, C., Sohnle, P.G. Effects of dimethylsulfoxide on the oxidative function of human neutrophils. J Lab Clin Med 1987; 110: 91-96. [ Links ]
18) Allen, R.C. Phagocytic leukocyte oxygenation activities and chemiluminescence: a kinetic approach to analysis. Meth Enzymol 1986; 133: 449-493. [ Links ]
19) Brestel. E.P. Co-oxidation of luminol by hypochlorite and hydrogen peroxide: implications for neutrophil chemiluminescence. Biochem Biophys Res Comm 1985; 126: 482-488. [ Links ]
20) Dahlgren, C., Aniansson, H., Magnusson, K.E. Pattern of Formylmethionyl-leucyl-phenylalanine-induced luminol and lucigenin-dependent chemiluminescence in human neutrophils. Infect Immun 1985; 47: 326-328. [ Links ]
21) Barber, D.A., Do, N.H., Tackett, R.L., Capomacchia, A.C. Nonsuperoxide lucigenin-enhanced chemiluminescence from phospholipid and human saphenous veins. Free Radic Biol Med 1995; 18: 565-569. [ Links ]
22) Repine, J.E., Staer-Johansen, K., Berger, E. Hydroxyl radical scavengers produce similar decreases in the chemiluminescence responses and bactericidal activities of neutrophils. Infect Immun 1984; 43: 435-437. [ Links ]
23) Rao, P.S., Luber, Jr., J.M., Millinowicz, J., Lalezari, P., Mueller, H.S. Specificity of oxygen radical scavengers and assessment of free radical scavenger specificity efficiency using luminol enhanced chemiluminescence. Biochem. Biophys. Res Comm 1988; 150: 39-44. [ Links ]
24) Sadler, K.L., Badwey, J.A. Second messengers involved in superoxide production by neutrophils: function and metabolism. Hematology/Oncology Clinics of North America 1988; 2: 185-200. [ Links ]
25) Larfars G., Gyllenhammar, H. Stimulus-dependent transduction mechanisms for nitric oxide release in human polymorphonuclear neutrophil leukocytes. J Lab Clin Med 1998; 132: 54-60. [ Links ]
26) Klausner, R.D., Fishman, M.C., Karnovsky, M.J. Ionophore A23187 disrupts membrane stucture by modifying protein-lipid interactions. Nature 1979; 281: 82-83. [ Links ]
27) Borgeat, P., Samuelsson, B. Arachidonic acid metabolism in polymorphonuclear leukocytes: effect of ionophore A 23187. Proc Nat Acad Sci (USA) 1979; 76: 2148-2152. [ Links ]
28) Singh, D., Greenwald, J.E., Bianchine, J., Metz, E.N., Sagone, Jr. A.L. Evidence for the generation of hydroxyl radical during arachidonic acid metabolism by human platelets. Amer J Hematol 1981; 11: 233-240. [ Links ]
29) Van Dyke, K., Matamoros, M.C., Van Dyke, C.J., Castranova, V. Calcium ionophore stimulated chemiluminescence from human granulocytes: evidence that A23187 induced chemiluminescence originates from arachidonic acid metabolism. Microchem J 1983;
28: 568-579.
30) García, J. La alfa hemolisina de Escherichia coli potencia el metabolismo oxidativo de neutrófilos humanos en respuesta al péptido quimiotáctico FMLP: comparación con el ionóforo de calcio A23187. Rev Cost Cienc Med 2000; 21: En prensa. [ Links ]
31) OBrien, P.J., Hulett, L.G. Hydroxyl radical involvement in the luminol chemiluminescence from the reaction of arachidonic acid with sheep vesicular gland microsomes. Prostaglandins 1980; 19: 683-690. [ Links ]
32) Radi, R., Cosgrove, T.P.Beckman, J.S., Freeman, B.A. Peroxynitrite-induced luminol chemiluminescence. Biochem J 1993; 290: 51-57. [ Links ]
33) Segal, A.W., Shatwell, K.P. The NADPH oxidase of phagocytic leukocytes. Ann NY Acad Sci 1997; 832: 215-222. [ Links ]
*Departamento de Bioquímica, Escuela de Medicina
Universidad de Costa Rica.