Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Costarricense de Ciencias Médicas
Print version ISSN 0253-2948
Rev. costarric. cienc. méd vol.21 n.3-4 San José Dec. 2000
Resumen
La viabilidad de leucocitos polimorfonucleares neutrófilos (PMN) expuestos a alfa hemolisina ( Hly A) de E. coli se evaluó detectando, por citometría de flujo, la fluorescencia que células permeabilizadas al propidio manifiestan con éste último intercalado en el ADN celular. El sobrenadante hemolítico causó fluorescencia en PMN de manera directamente proporcional a la dosis hemolítica, no así los sobrenadantes control no hemolíticos. A dosis menores a 0,5 HU50/ml las células excluyeron propidio manteniendo viabilidad, aunque aumentaron de manera leve y temporal su tamaño, y volvieron al nivel basal en término de 1 hora, sugiriendo que existe daño en membrana sin entrada de propidio, y que se presenta recuperación celular de dichas lesiones, al menos a corto plazo. La fluorescencia de PMN disminuyó luego de 15 minutos de exposición, fenómeno que se previno mediante la quelación de Ca+2extracelular con N,N,N´,N´- tetraacetato ( EGTA ); ello indica que es la entrada de calcio a la célula la causante de la pérdida de señal. La disminución o quelación de Ca+2 extracelular incrementó la fluorescencia, pero solo la quelación simultánea de Ca+2 externo e interno la mantuvo inalterada. Se concluye que la entrada de Ca+2 a la célula activa mecanismos que disminuyen la fluorescencia inicial; que niveles bajos o quelación de Ca+2 extracelular facilitan la entrada de propidio, lo que incrementa la fluorescencia, y que la disminución de la señal se evita solo si el Ca+2 intracelular y el extracelular se encuentran quelados. Los hallazgos de este estudio, en conjunto con datos de otros autores, se toman como base para formular una cadena hipotética de acontecimientos que explica las observaciones citométricas en PMN expuestos a Hly A, con énfasis en el significado del aumento en tamaño celular en ausencia de entrada de propidio a la célula. (Rev Cost Cienc Med 2000; 21(3-4):127-139)
Palabras Claves
Leucocito polimorfonuclear, alfa hemolisina, citometría de flujo, fluorescencia.
Abstract
Cell viability of Hly A - exposed polymorphonuclear neutrophils (PMN) was assessed by propidium uptake, measured by flow cytometry. Hemolytic supernatant, but not the non hemolytic controls, caused a dose-dependent fluorescence signal in PMN. Cells exposed to low hemolytic activities (below 0,5 HU50/ml) did not fluoresce, although cell size, estimated by Forward Scatter (FSC), increased slightly, and then returned to normal within 30-60 minutes, suggesting both membrane damage in absence of propidium uptake and short term cell recovery from the effects of Hly A. The fluorescent signal from permeated PMN decreased 15 minutes after exposure to Hly A, a decrease which was prevented by chelation of extracellular Ca+2 with EGTA. Whereas Ca+2 entry into the cell is responsible for triggering mechanisms leading to loss of fluorescence, low or chelated extracellular Ca+2 facilitate propidium uptake, but the fluorescent signal does not decrease only when both intracellular and extracellular Ca+2are chelated. The findings of this study, together with data from other authors, are taken as the basis to formulate a hypothethical sequence of events to explain the cytometric data obtained from Hly A exposed PMN, including the significance of increases in cell size without propidium uptake.
Key Words
Polymorphonuclear leukocytes, alpha hemolysin, flow cytometry, fluorescent.
Introducción
La capacidad de producir y secretar alfa hemolisina (Hly A) caracteriza a casi la mitad de las cepas de E. coli causantes de infección extraintestinal (1,2), y se encuentra hasta en un 78% de las cepas uropatogénicas (3), tanto en infecciones sintomáticas como asintomáticas (4). Hly A es un factor de virulencia, como ha sido demostrado repetidamente con mutantes no hemolíticos derivados de cepas virulentas, que pierden su virulencia (5), o mediante cepas hemolíticas isogénicas obtenidas por transformación de E. coli no virulentas, que adquieren virulencia luego de la transformación (6-8). La utilización de técnicas de genética molecular ha contribuido enormemente a la definición de la estructura y función de Hly A, incluyendo su estructura primaria (9), caracterización de su operón (10,11), y el papel de los diferentes dominios de la molécula en su mecanismo de acción en células blanco (12-14).
Aunque los estudios iniciales de Hly A se centraron en su capacidad hemolítica (15,16), pronto se reconoció que su actividad citotóxica era más amplia, y que afectaba diferentes tipos de células (17). Hly A es una citotoxina que depende de calcio extracelular para su activación (18), y que ataca la membrana de la célula blanco, insertándose en la misma y formando poros hidrofílicos (19). Estos poros han sido estudiados en detalle (20); su efecto sobre la membrana, y las consecuencias de tales lesiones sobre la fisiología de la célula blanco, explica la actividad citotóxica de Hly A, incluyendo disfunción fagocítica, producción de mediadores inflamatorios (21,22), y estimulación de consumo de oxígeno en neutrófilos (PMN) que acompaña la producción de radicales libres (21). La evidencia obtenida revela que, aunque la toxina sufre inactivación si se preincuba con proteínas plasmáticas, mantiene su efecto contra PMN si se añade simultáneamente con aquellas; se propone entonces que Hly A es una citotoxina que tiene efecto selectivo contra PMN (23), por cuanto las proteínas plasmáticas no parecen inactivarla antes de que actúe sobre aquellos. Esto concuerda con la propuesta de que Hly A es un factor de virulencia, si se tiene en cuenta que su acción anti fagocítica puede facilitar el establecimiento y diseminación de la bacteria en tejidos. Otras células blanco incluyen células de epitelio tubular renal (24), las cuales no encuentran un medio proteico en el lumen tubular que ofrezca a sus membranas protección contra HlyA. En ésta situación, la citotoxicidad de Hly A puede contribuir a formar micro abscesos que faciliten la entrada de la bacteria al parénquima renal.
La citotoxicidad de Hly A en leucocitos se ha evaluado haciendo uso de microscopía de luz (25), exclusión de azul tripán (25,26), microscopía electrónica de transmisión (27) y liberación de 51Cr de células blanco (28). Bhakdi et al (23) usaron exclusión de propidio, medida con citometría de flujo, como marcador de integridad de membrana en células expuestas a Hly A, y propusieron que es el indicador más sensible de daño a la membrana de neutrófilos (29). Sin embargo, los estudios publicados no proporcionan datos comparativos del daño causado por Hly A en células blanco usando diferentes técnicas para estimar la integridad de la membrana.
La citometría de flujo para estimar exclusión de propidio es una técnica objetiva, eficiente y altamente reproducible para la medición de daño a membranas celulares. Agentes con actividad sobre membranas pueden ocasionar lesiones que permiten al propidio ingresar a la célula, e intercalarse en el ADN. La excitación del propidio intercalado con un haz láser causa emisión de fluorescencia, la cual es detectada por el citómetro (30). En este estudio se usó citometría de flujo para establecer la curva de dosis respuesta en PMN expuestos a Hly A, se midió la exclusión de propidio en función del tiempo de exposición y el efecto que sobre la misma tiene el calcio intra y extracelular.
Materiales y Métodos
Cepas de Escherichia coli
Las cepas usadas en esta investigación se obtuvieron del laboratorio del Dr. R.A. Welch (U. of Wisconsin, Madison, WI), y son derivadas de Escherichia coli DH1. La cepa hemolítica WAM 589 se transformó con el plásmido pWAM04, (plásmido pUC 19 en el cual se subclonaron los genes de hemolisina, contenidos en el operon hly CABD proveniente del plásmido pSF4000). La cepa control WAM 675 no es hemolítica y fue transformada con el plásmido pUC 19 desprovisto de genes de hemolisina. La cepa control WAM 783 es la DH1 transformada con un derivado del plásmido pWAM04, el cual porta una deleción en el gen hlyC. Este gen es responsable de la acilación de la pro HlyA (31). En consecuencia, WAM 783 secreta una hemolisina no acilada, incapaz de insertarse en membranas de la célula blanco.
Sobrenadantes de cultivos bacterianos
Se usaron sobrenadantes crudos de cultivos de la cepa WAM 589 como fuente de hemolisina y crudos de las cepas WAM 675 y 783 como controles, a diluciones elevadas con respecto a los volúmenes de reacción (más de 1: 200).
Las cepas de Escherichia coli se cultivaron en caldo Luria-Bertani (LB), con ampicilina (100 µg/ml) para seleccionar las cepas WAM 589 y 675, y cloramfenicol (20 µg/ml) para seleccionar la cepa WAM 783. Volúmenes de 100 ml de caldo LB se inocularon con 1-3 ml de un cultivo estacionario de la cepa correspondiente (incubado a 37° C durante 12 horas), luego de lo cual se incubaron a 37° C con agitación (200 rpm) en un incubador rotatorio G25 ( New Brunswick, Edison, NJ). Se tomaron muestras de 10-15 ml de los cultivos cuando éstos alcanzaron una densidad óptica (D.O.) de 0,3-0,4 ( 600 nm) y las bacterias se sedimentaron por centrifugación (7 min, 800 xg) en una centrífuga Sorvall SS1 (Dupont Instruments, Wilmington, DE). El sobrenadante se esterilizó por filtración a través de una membrana estéril con porosidad de 0.4 um (Millipore) , y se mantuvo en hielo previo a su utilización. Para experimentos en los que se utilizó EGTA quelante del calcio (ver más adelante), se añadió CaCl2(10 mM) al caldo LB previo al cultivo, para preactivar la hemolisina.
Determinación de actividad hemolítica
A cada ml de diluciones dobles seriadas de sobrenadante bacteriano crudo y estéril en solución salina 0.85% con calcio (10 mM CaCl2) se añadió 1 ml de suspensión al 1% de eritrocitos de carnero suspendidos solución salina, y se incubaron a 37° C durante 1 h. Al finalizar la incubación, se añadió a cada dilución 2 ml de solución salina fría para detener la reacción; se centrifugó a 700 xg por 5 min en una centrífuga Sorvall GLC-2B (Dupont Instruments, Wilmington, DE) y se leyó la D.O. del fluido sobrenadante a 545 nm para estimar la liberación de hemoglobina. Se determinó la dilución de sobrenadante que causó 50% de lisis eritrocitaria mediante interpolación en papel semilogarítmico en el cual se había trazado una curva patrón de hemólisis (por lisis hipotónica, en agua destilada) obtenida independientemente con el mismo lote de eritrocitos. El título hemolítico (HU50/ml) se definió como el inverso de la dilución de sobrenadante de cultivo bacteriano que causó 50% de hemólisis. Dado que los ensayos con células se efectuaron en amortigüador HC (descrito a continuación), se hicieron titulaciones de sobrenadantes hemolíticos en el mismo amortigüador, para descartar variaciones en el título hemolítico debidas al cambio de solución. El título hemolítico no varió con respecto al obtenido en solución salina con calcio. Titulaciones de sobrenadantes preactivados con 10 mM Ca+2, en presencia de solución salina –5mM EGTA, no mostraron variación en título hemolítico, indicando que el quelante no sustrae el calcio de su complejo con Hly A.
Obtención de leucocitos polimorfonucleares neutrófilos (PMN)
Se usó sangre venosa heparinizada obtenida de voluntarios sanos, la cual se estratificó en tubos de ensayo sobre medio Mono Poly (ICN-Flow) y se centrifugó de acuerdo a instrucciones del fabricante. Se recogió la banda de PMN y éstos se lavaron usando 20 ml de amortigüador HEPES sin calcio (HNC: HEPES 10 mM, NaCl 144 mM, KCl 5 mM, Glucosa 5,5 mM , gelatina para cultivo de tejidos 0,5% p/v, pH 7.4). Los PMN se resuspendieron luego en NH4Cl ( 0,83% en HEPES 10 mM, pH 7,4) durante 7 minutos a 37° C, para lisar eritrocitos contaminantes. Los PMN se lavaron una vez más con HNC y se resuspendieron luego en 1 ml de amortigüador (0,8 ml de HNC + 0,2 ml de amortigüador HEPES con calcio, o HC, de composición idéntica a HNC, pero adicionado de 1 mM Ca Cl2 y 0,1% gelatina, pH 7,4). El conteo de células en la suspensión se efectuó usando una cámara para contar glóbulos (Hemacytometer).
Ensayos de citotoxicidad
Los ensayos se efectuaron en viales de vidrio para centelleo, silanizados previamente para impedir adhesión de PMN al vidrio. Se agregó a los viales amortigüador HC estéril con 0,1% de gelatina (2-4 ml), seguido la suspensión celular (hasta 200 µL) para dar una densidad celular de 0,8-1 x 106 /ml. El experimento se inició al añadir sobrenadante hemolítico o sus controles a las suspensiones celulares, y los viales se mantuvieron a 37°C con agitación (100-150 rpm, G76 Gyrotory Bath Shaker) durante el período de exposición. A intervalos definidos, alícuotas de 500 µL se mezclaron con 5 µl de solución de yoduro de propidio (5 µg/ml) para análisis de exclusión en un citómetro (FACSCAN, Beckton-Dickinson). En algunos experimentos, los PMN se incubaron previamente durante 1 hora en amortigüador HNC conteniendo 5 mM Etilenglicol-bis ( beta aminoetil éter ) N,N,N´,N´- tetraacetato
(EGTA, que penetra la membrana ), para quelar tanto el calcio intra como extracelular. Cuando se necesitó quelar solamente el calcio intracelular, los PMN incubados con el amortiguador HNC-EGTA se lavaron dos veces y se resuspendieron en amortigüador HNC antes de iniciar el experimento.
Resultados
La validez del uso sobrenadantes crudos como fuente de hemolisina se justificó mediante experimentos de inactivación térmica, enzimática y con anticuerpos monoclonales anti hemolisina y anti LPS; la descripción detallada de esos experimentos se ha ofrecido previamente (32 ).
PMN expuestos a Hly A mostraron fluorescencia al análisis citométrico, lo que indica que el daño a la membrana celular permitió el ingreso del propidio al interior de la célula; no así los sobrenadantes control, los cuales no causaron fluorescencia celular. Los resultados se ilustran en la figura 1, en la cual se aprecia que al final de una incubación de 15 minutos la exposición a más de 0,5 HU 50/ml causó un aumento en la fluorescencia que fue directamente proporcional a la dosis hemolítica, y que alcanzó un máximo a 5 HU50/ml, con porcentajes promedio de células fluorescentes cercanos al 80%. Dosis hemolíticas inferiores a 0,5 HU50/ml no causaron fluorescencia celular durante los 60 minutos de duración del experimento. Las lecturas se reportaron a los 15 minutos por cuanto la fluorescencia de PMN expuestos a dosis hemolíticas de 2 HU50/ml y superiores disminuyó a partir de los 15 minutos de incubación, según se ilustra en la figura 2. Esta disminución es posterior a la lesión original causada por Hly A en la membrana, la cual se inserta en la membrana durante los primeros minutos de exposición (33).
Para estudiar el origen de la pérdida de fluorescencia, se efectuaron experimentos disminuyendo las concentraciones de calcio intra y extracelular. PMN conteniendo EGTA para quelar calcio intracelular, y resuspendidos en HNC (sin calcio agregado, con concentración de Ca+2 externa de 10–5 M) dieron una respuesta fluorescente más pronunciada que la de PMN sin EGTA, del orden de 45% en células expuestas a 0,5 HU50/ml; sin embargo, la fluorescencia también tiende a disminuir a los 30 minutos (datos no ilustrados).
PMN conteniendo EGTA y resuspendidos en amortiguador HNC - EGTA durante su exposición a Hly A manifestaron la respuesta fluorescente más intensa (más de 90% a partir de 1 HU50/ml, Fig.3), que no disminuyó durante el período de incubación.
Discusión
Los resultados de este estudio corroboran hallazgos previos (23) señalando que PMN expuestos a Hly A sufren daño de membrana que causa permeabilización de la misma y permite la entrada de propidio a la célula, lo que se detecta como una señal fluorescente en el citómetro. La curva de dosis respuesta ilustrada en la figura 1 define además un rango sublítico de concentraciones de Hly A (<0,5 HU50/ml), que no causan fluorescencia durante el período experimental de 60 minutos.
La disminución en la fluorescencia de PMN que se observó a partir de los 30 minutos de incubación no ha sido reportada previamente. Como la señal fluorescente proviene del propidio intercalado en ADN, podría explicarse asumiendo la salida del propidio a través de las lesiones de la membrana. Sin embargo, ello requeriría desplazamiento del propidio del ADN , y no se conoce un mecanismo que explique tal disociación. Otra explicación consiste en atribuir la disminución de la señal fluorescente a una posible activación de endonucleasas, debida a la entrada de calcio externo a través de las lesiones de membrana. La activación de endonucleasas causaría degradación de ADN, y explicaría la disociación del propidio del ADN degradado, con disminución de la fluorescencia. La evidencia experimental obtenida en este estudio apoya esa idea, ya que la quelación del calcio externo con EGTA previene su entrada a la célula, y es suficiente para evitar la disminución de la fluorescencia. Sin embargo, la prueba definitiva de tal mecanismo sería la demostración directa de degradación de ADN en PMN expuestos a Hly A.
PMN preincubados con EGTA y suspendidos en HNC muestran mayor fluorescencia; la señal tiende a disminuir a los 30 minutos, aunque no de manera notoria, como se observó en PMN suspendidos en HC, con 1 mM de Ca+2. Este resultado también es congruente con la idea de que es el calcio externo el responsable de la pérdida de fluorescencia, ya que era de esperar que la disminución (sin quelación) de Ca+2 externo retrasara la pérdida de señal, teniendo en cuenta que la quelación la evita por completo. Sin embargo, plantea una interrogante respecto del aumento inicial en fluorescencia, el que pareciera estar relacionado con concentraciones bajas de Ca+2 extracelular.
La respuesta fluorescente de PMN con EGTA interno y resuspendidos en HNC-EGTA es la más intensa (Fig 3). Se ha demostrado previamente que la quelación del calcio extracelular aumenta la probabilidad de que los poros formados por Hly A se encuentren en su configuración abierta (33). Al permanecer el poro abierto por más tiempo, se facilita la entrada del propidio al interior de la célula, y la intercalación al ADN es mayor, lo que se refleja a su vez como un mayor porcentaje de células fluorescentes (Fig 3). Esta observación concuerda con datos reportados con anterioridad (32), con los que se demuestra que el aumento en volumen celular medio de PMN en respuesta a Hly A es mayor cuando la concentración de calcio extracelular es baja. La apertura incrementada de los poros acelera la redistribución catiónica y la célula alcanza equilibrio tipo Donnan con mayor celeridad, lo que a su vez causa movimiento más rápido de agua hacia el interior de la célula.
Se desprende de lo anterior que la formación de poros en la membrana de PMN por parte de Hly A es independiente de calcio, exceptuando el que se necesita para su activación. Se ha propuesto con anterioridad que Hly A causa sus efectos hemolíticos porque se comporta como un ionóforo de calcio (34, 35). Los resultados de este estudio rebaten tal conclusión, y confirman los de Bhakdi ( 19 ), quien reportó experimentos mostrando que la hemólisis no se afectó al usar Hly A pre activada con calcio pero en presencia de 5 mM EDTA. La evidencia presentada en este trabajo amplía la observación de Bhakdi al demostrar que la formación de poros ocurre a pesar de que se haya quelado también el calcio intracelular.
Bhakdi (23) ha propuesto que la exclusión de propidio en PMN expuestos a Hly A es el método más sensible para la detección de poros en membrana, y que una célula que no muestre fluorescencia no los manifiesta. Si bien la citometría es objetiva, rápida, y altamente reproducible, la evidencia obtenida en esta investigación, así como datos publicados con anterioridad (32), y otros en preparación, indican, por el contrario, que la exclusión de propidio no es la medida más exacta de los poros formados por Hly A. En este estudio, PMN expuestos a actividades hemolíticas de 0,5 HU50/ml o menores no mostraron fluorescencia durante 1 hora de incubación. Sin embargo, como se ha mostrado previamente, el volumen celular medio de PMN expuestos a 0,1 y 0,5 HU50/ml (sublíticas de acuerdo a citometría) aumenta significativamente a los 15 minutos de incubación. Se concluye que a esas dosis hemolíticas sí ocurre la formación de poros que permiten la redistribución de cationes a través de la membrana, y que tiene como consecuencia entrada de agua a la célula. Más aún, gráficos de contorno (SSC vs FSC) de la población de PMN expuestos a Hly A, obtenidos de la misma citometría de flujo en esta investigación y que no se ilustran, muestran aumentos leves en el tamaño celular (FSC), el cual vuelve a niveles basales 60 minutos después de exposición a 5 HU50/ml, y 30 minutos después de exposición a 0,1 HU50/ml. Otros datos por publicarse muestran entrada de calcio a células blanco a 0,1 HU50/ml, lo que constituye evidencia adicional de formación de poros de membrana a dosis que no causan fluorescencia. La citometría define, por lo tanto, actividades sublíticas de Hly A, que deben interpretarse como concentraciones que forman poros en la membrana, pero que no permiten la entrada de propidio durante los 60 minutos de incubación reportados en este estudio.
El poro que aparece luego de la inserción de Hly A en la membrana tiene un diámetro funcional de 2-3 nm. La definición de su apertura se hizo mediante pruebas de protección osmótica en eritrocitos (23), las cuales mostraron que el Dextran 4 (PM 4000, 3 nm de diámetro) no penetró la membrana por los poros de Hly A y previno la lisis eritrocitaria, lo que no se logró con la inulina ( PM 5000, 2,8 nm de diámetro), que penetró muy lentamente, ni con la sacarosa (PM 342, diámetro 0,9 nm), que penetró más rápido. Estos resultados, sin embargo, no establecieron si el poro causado por Hly A mantiene el mismo diámetro funcional conforme el eritrocito aumenta su volumen y se aproxima a la ruptura.
Los hallazgos ilustrados en este estudio y algunos de los experimentos publicados previamente (19, 29) son congruentes con la hipótesis que se formula. A dosis hemolíticas bajas ( 0,5 HU50/ml y menores en este estudio) los poros formados, no son tan numerosos, y la redistribución iónica resultante conduce a aumentos leves en volumen celular medio y en tamaño celular (FSC), aumentos de los que los PMN parecieran recuperarse en término de 15-60 minutos, y que no causan entrada de propidio a la célula. Sin embargo, es posible que las células se vean afectadas posteriormente como consecuencia de la entrada de calcio, que alteraría su metabolismo, pudiendo sufrir citotoxicidad o cambios apoptósicos horas después del episodio que lesionó la membrana (35,36).
A dosis hemolíticas más elevadas, la cantidad de poros formados por Hly A en la membrana es mayor, y las redistribuciones iónicas señaladas anteriormente se suceden más rápidamente, causando aumentos pronunciados en volumen celular; la entrada de calcio es mucho mayor, y podría conducir rápidamente a la activación de fosfolipasas (37) y proteasas (38), acentuando el daño a la membrana, que se agrava aún más por el aumento en volumen celular. Estos factores, y el stress que causan a la membrana, podrían aumentar el diámetro funcional de los poros, permitiendo que compuestos de peso molecular más elevado, como el propidio (PM 668) ingresen a la célula, y que otros escapen de ella, tal y como se ha demostrado sucede con el ATP (PM 551), (23). Siendo el ATP una molécula aniónica, su escape de la célula sugiere también modificación de la lesión original de membrana, que en ese momento habría perdido su selectividad para cationes. Esta secuencia hipotética de acontecimientos concilia, entonces, observaciones aparentemente dispares, y propone un mecanismo que explica las observaciones citométricas en PMN expuestos a Hly A.
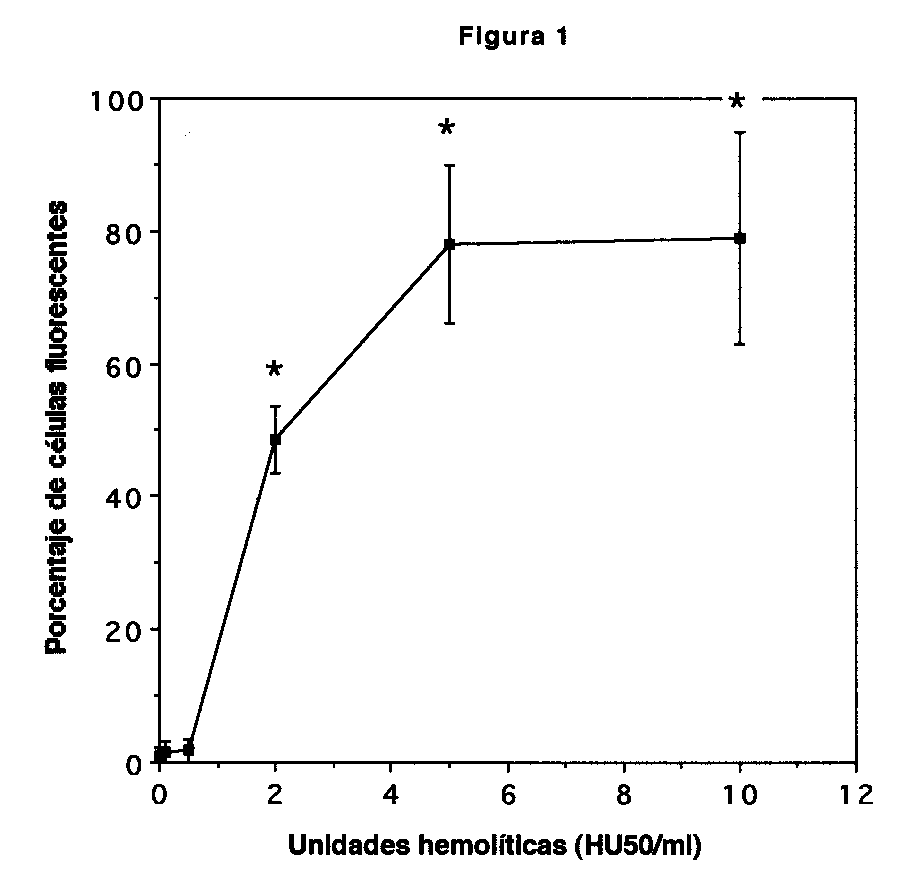
Figura 1. Exclusión de propidio en PMN expuestos a Hly A. PMN (1x106/ml) se expusieron al sobrenadante de E. coli WAM 589. El gráfico muestra porcentaje de células fluorescentes versus dosis hemolítica (HU50/ml) luego de 15 minutos de incubación. Las barras denotan error standard (n = 4). Sobranadantes no hemolíticos no causaron fluorescencia.
p< 0,05 prueba t pareada, comparado con valores
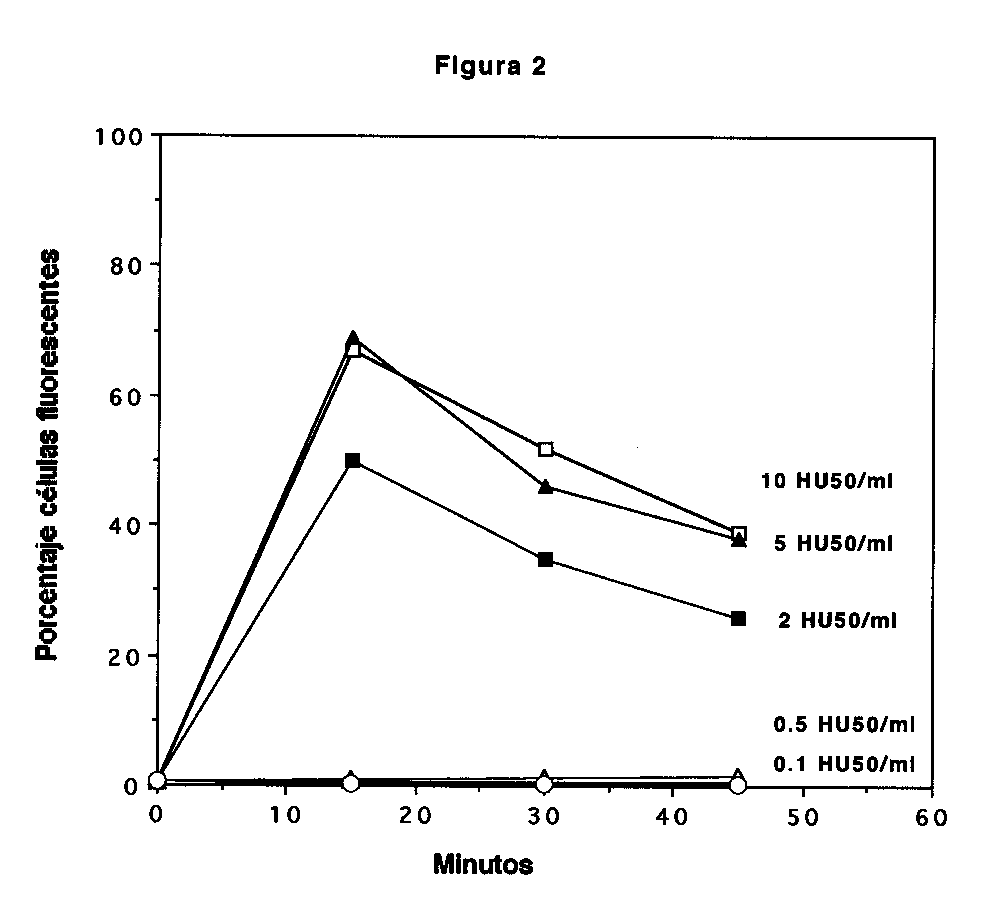
Figura 2. Exclusión de propidio vs. tiempo en PMN expuestos a Hly A. PMN (1x106/ml) se expusieron al sobrenadante de E. coli WAM 589. El gráfico muestra porcentajes de células fluorescentes expuestas a diferentes dosis hemolíticas en función del tiempo de incubación. Se muestra un experimento representativo.
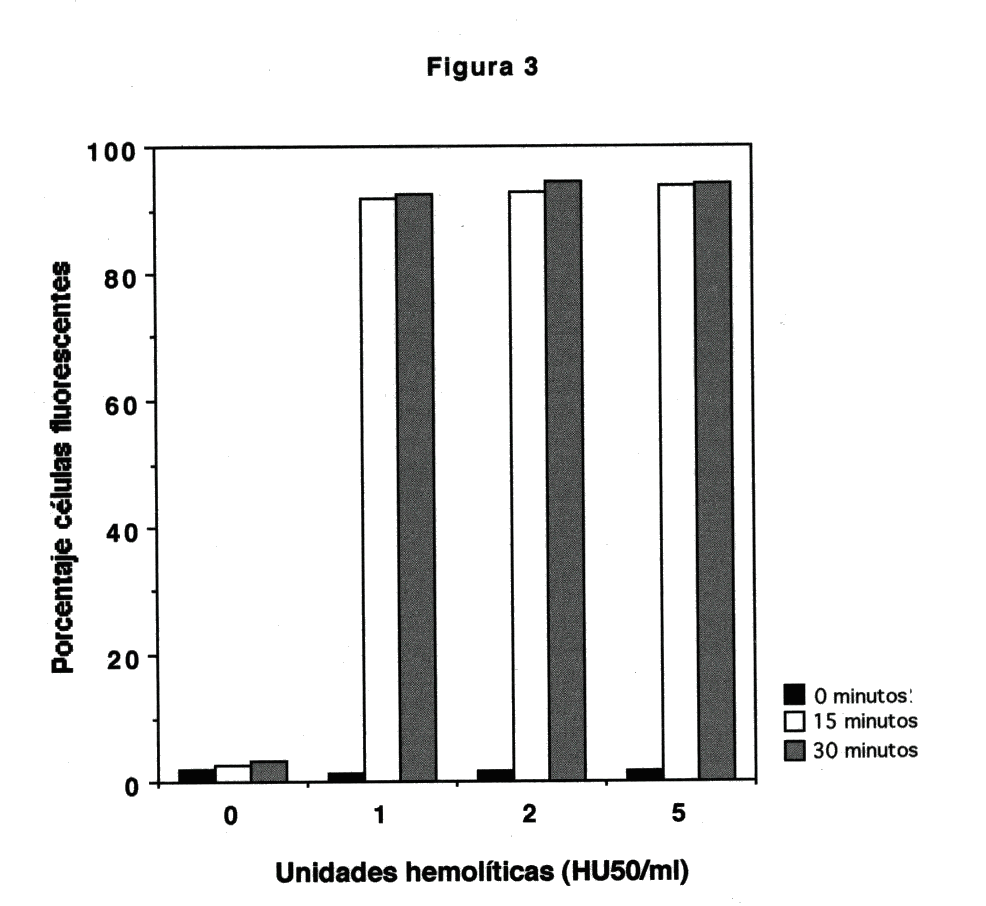
Figura 3. Efecto de la quelación de calcio con EGTA en la exclusión de propidio en PMN expuestos a Hly A. PMN (1x106/ml) se preincubaron con 5mM EGTA y se expusieron a sobrenadante hemolítico de E. coli WAM 589 resuspendidos en amortiguador con 5 mM EGTA. El gráfico presenta porcentajes de células fluorescentes vs dosis hemolítica a diferentes períodos de incubación. El experimento se repitió dos veces con resultados similares.
referencias
1) Cooke, E.M., Ewins, S.P. Properties of strains of Escherichia coli isolated from a variety of sources. J Med Microbiol 1975; 8:107-111. [ Links ]
2) Minshew, B.H., Jorgensen, J., Counts, G.W., Falkow, S. Association of hemolysin production, hemagglutination of human erythrocytes, and virulence for chicken embryos of extraintestinal Escherichia coli isolates. Infect Immun 1978; 20:50-54. [ Links ]
3) O´Hanley, P., Low, D., Romero, I., Lark, D., Vosti, K., Falkow, S., Schoolnik.,G. Gal-gal binding and hemolysin phenotypes associated with uropathogenic Escherichia coli. N Eng J Med 1985; 313:414-417. [ Links ]
4) Hughes, C., Hacker, J., Roberts, A., Goebel, W. Hemolysin production as a virulence marker in symptomatic and asymptomatic urinary tract infections caused by Escherichia coli. Infect. Immun 1983; 39:546-551.
5) Fried, F.A., Vermeulen, C.W., Ginsburg, M.J., Cone, C.M. Etiology of pyelonephritis: further evidence associating the production of experimental pyelonephritis with hemolysis in Escherichia coli. J Urol 1971; 106:351- 354. [ Links ]
6) Welch, R.A., Dellinger, E.P., Minshew, B., Falkow, S. Haemolysin contributes to virulence of extra-intestinal E. coli infections. Nature 1981; 294:665-667. [ Links ]
7) Waalwijk, C.F., Van den Bosch, J.F., Mac Laren, D.M., de Graaff, J. Hemolysin plasmid coding for the virulence of a nephropathogenic Escherichia coli strain. Infect Immun 1982; 35:32-37. [ Links ]
8) Hacker, J., Hughes, C., Hof, H., Goebel, W. Cloned hemolysin genes from Escherichia coli that cause urinary tract infection determine different levels of toxicity in mice. Infect Immun 1983; 42:57-63. [ Links ]
9) Felmlee, T., Pellett, S., Welch, R.A. Nucleotide sequence of an Escherichia coli chromosomal hemolysin. J Bacteriol 1985; 163: 94-105. [ Links ]
10) Welch, R.A., Hull, R., Falkow, S. Molecular cloning and physical characterization of a chromosomal hemolysin from Escherichia coli. Infec Immun 1983; 42: 178-186. [ Links ]
11) Mackman, N., Holland, I.B. Functional characterization of a cloned haemolysin determinant from E. coli of human origin, encoding information for the secretion of a 107 K polypeptide. Mol Gen Genet 1984; 196:123-134. [ Links ]
12) Ludwig, A., García, F., Benz, R., Jarchau, T., Oropeza-Wekerle, R.L., Hoppe, J., Goebel, W. Structures essential formation by Escherichia coli haemolysin. En Bacterial Protein Toxins, Witholt et al (Eds), Zbl Bakt. 1992; Suppl 23: 450- 460. [ Links ]
13) Menestrina, G., Dalla Serra, M., Pederzolli, C., Bregante, M., Gambale, F. Bacterial hemolysins and leukotoxins affect target cells by forming large exogenous pores into their plasma membrane. Escherichia coli hemolysin A as a case example. Bioscience Rep 1995; 15: 543-551. [ Links ]
14) Bauer, M.E., Welch, R.A. Association of RTX toxins with erythrocytes. Infect Immun 1996; 64:4665-4672. [ Links ]
15) Zwadyk, P., Snyder, I.S. Purification and kinetic studies of the hemolysin from Escherichia coli. Can J Microbiol 1971; 17: 741-745. [ Links ]
16) Rennie, R.P., Freer, J.H., Arbuthnot, J.P. The kinetics of erythrocyte lysis by Escherichia coli haemolysin. J Med Microbiol 1974; 7:189-195. [ Links ]
17) Cavalieri, S.J., Bohach,G.A., Snyder, I.S. Escherichia coli alpha hemolysin: characteristics and probable role in pathogenicity. Microbiol Rev 1984; 48: 326-343. [ Links ]
18) Snyder, I.S., Koch, N.A. Production and characteristics of hemolysins of Escherichia coli. J Bacteriol 1966; 91: 763-767. [ Links ]
19) Bhakdi, S., Mackman, N., Nicaud, J.M., Holland, I.B. Escherichia coli hemolysin may damage target cell membranes by generating transmembrane pores. Infect Immun 1986; 52: 63-69. [ Links ]
20) Ropele, M., Menestrina, G. Electrical properties and molecular architecture of the channel formed by Escherichia coli hemolysin in planar lipid membranes. Biochim Biophys Acta 1989; 985:9-18. [ Links ]
21) Cavalieri, S.J., Snyder, I.S. Effect of Escherichia coli alpha hemolysin on human peripheral leukocyte function in vitro. Infect Immun 1982; 37: 966-974. [ Links ]
22) Grimminger, F., Scholz, C., Bhakdi, S., Seeger, W. Sub-hemolytic doses of Escherichia coli hemolysin evoke large quantities of lipoxygenase products un human neutrophils. J Biol Chem 1991; 266: 14262-14269. [ Links ]
23) Bhakdi, S., Greulich, S., Muhly, M., Eberspächer, B., Becker, H., Thiele, A., Hugo, F. Potent leukocidal action of Escherichia coli hemolysin mediated by permeabilization of target cell membranes. J Exp Med 1989; 169: 737-754. [ Links ]
24) Keane, W.F., Welch, R.A., Gekker, G., Peterson, P.K. Mechanism of Escherichia coli alpha hemolysin induced injury to isolated renal tubular cells. Am J Pathol 1987; 126:350-357. [ Links ]
25) Gadeberg, O.V., Orskov, I., Rhodes, J.M. Cytotoxic effect of an alpha hemolytic Escherichia coli strain on human blood monocytes and granulocytes in vitro. Infect Immun 1983; 41: 358-364. [ Links ]
26) Cavalieri, S.J., Snyder, I.S. Effect of Escherichia coli alpha hemolysin on human peripheral leukocyte viability in vitro. Infect Immun 1982; 36: 455-461. [ Links ]
27) Gadeberg, O.V., Blom, J. Morphological study of the in vitro cytotoxic effect of alpha hemolytic E. coli bacteria and culture supernatants on human blood granulocytes and monocytes. Acta Pathol Microbiol Immunol Scand. (Sect.B) 1986; 94: 75-83. [ Links ]
28) Gadeberg. O.V., In vitro activity of alpha hemolytic and non hemolytic Escherichia coli on human blood granulocytes and monocytes. Acta Pathol. Microbiol Immunol Scand. (Sect. B) 1987; 95:219-225. [ Links ]
29) Bhakdi, S., Martin, E. Superoxide generation by human neutrophils induced by low doses of Escherichia coli hemolysin. Infect Immun 1991; 59: 2955-2962. [ Links ]
30) Jacobs, D.A., Pipho, C. Use of propidium iodide staining and flow cytometry to measure antibody-mediated cytotoxicity: resolution of complement-sensitive and resistant target cells. J Immunol Meth 1983; 62:101-108. [ Links ]
31) Issartel, J.P., Koronakis, V., Hughes, C. Activation of Escherichia coli prohaemolysin to the mature toxin by acyl carrier protein-dependent fatty acylation. Nature 1991; 351: 759-761. [ Links ]
32) García, J.D. Medición del aumento en volumen celular inducido por alfa hemolisina de E. coli (Hly A) en leucocitos polimorfonucleares neutrófilos: efecto del calcio extracelular. Rev Cost Cienc Méd 1999; 20: 141-152. [ Links ]
33) Menestrina, G., Bashford, C.L., Pasternak, C.A. Pore-forming toxins: experiments with S. aureus alpha- toxin, C. perfringens- theta toxin and E. coli hemolysin in lipid bilayers, liposomes and intact cells. Toxicon 1990; 28:477- 491. [ Links ]
34) Jorgensen, S.E., Mulcahy, P.F., Wu, G.K. Calcium accumulation in human and sheep erythrocytes that is induced by Escherichia coli hemolysin. Toxicon 1983; 21:717-727. [ Links ]
35) Hameed, A., Olsen, K.J., Lee, M.K., Lichtenheld, M., Podack, E.R. Cytolysis by Ca-permeable transmembrane channels. Pore formation causes extensive DNA degradation and cell lysis. J Exp Med 1989; 169: 765-777. [ Links ]
36) Jonas, D., Walev, I., Berger, T., Liebetrau, M., Palmer, M., Bhakdi, S. Novel path to apoptosis: small transmembrane pores created by staphylococcal alpha- toxin in T lymphocytes evoke internucleosomal DNA degradation. Infect Immun 1994; 62: 1304-1312. [ Links ]
37) Farber, J.L. Biology of disease: membrane injury and calcium homeostasis in the pathogenesis of coagulative necrosis. Lab Invest 1982; 47: 114-123. [ Links ]
38) Nicotera, P., Hartzell, P., Orrenius, S. The formation of plasma membrane blebs in hepatocytes exposed to agents that increase cytosolic Ca+2is mediated by the activation of a no-lysosomal proteolytic system. FEBS Lett. 1986; 209: 139-144. [ Links ]
*Departamento de Bioquímica. Escuela de Medicina
Universidad de Costa Rica













