Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Costarricense de Ciencias Médicas
Print version ISSN 0253-2948
Rev. costarric. cienc. méd vol.20 n.3-4 San José Dec. 1999
Resumen
Leucocitos polimorfonucleares neutrófilos (PMN) sufrieron aumento en su volumen celular medio (VCM) cuando se expusieron a sobrenadantes hemolíticos como fuente de alfa hemolisina (HlyA) de Escherichia coli, una citotoxina que se inserta en la membrana celular y forma poros hidrofílicos, que permiten la redistribución de cationes a través de la membrana y ulterior movimiento de agua hacia el interior de la célula. En este estudio se cuantificó el incremento en VCM causado por Hly A, el cual fue proporcional a la dosis hemolítica, y se estableció que al no adicionar calcio a la suspensión de PMN, el incremento en VCM fue más pronunciado, lo que indica un efecto protector del calcio extracelular ante el efecto de Hly A. Tanto el ionóforo de calcio A23187 como Hly A disminuyeron la granularidad citoplásmica de PMN, lo que sugiere que el flujo de calcio hacia el citosol a través de los poros formados por Hly A puede alterar de manera importante la fisiología de PMN, probablemente interferir con la función fagocitaria y amplificar la respuesta inflamatoria a la bacteria hemolítica.
Palabras clave
Escherichia coli, alfa hemolisina, leucocitos polimortonucleares neutrófilos.
Abstract
Mean cell volume (MCV ) of polymorphonuclear neutrophils exposed to E. coli hemolytic supernatants increased in a dose dependent way. E. coli alpha hemolysin (Hly A) is a membrane active cytotoxin which forms hydrophilic, cation selective pores upon insertion. Cation movement through hemolisin pores result in net water movement into the target cell. lncreases in MCV were more pronounced when no calcium was added to the buffer on the PMN suspension, indicating calcium exerts a protective effect against Hly A induced damage. Both the calcium ionophore A23187 and Hly A decreased cytoplasmic granularity of PMN, suggesting calcium influx through Hly A pores may interfere with PMN function in vivo and could amplify the inflammatory response to hemolytic E. coli.
Key Words
Escherichia coli, alpha hemolysin, Polymorphonuclear neutrophils.
Introducción
Escherichia coli es una bacteria oportunista que causa infecciones tanto en tracto intestinal como en otros tejidos ( 1 ). Entre los factores de virulencia que expresa se encuentra la hemolisina alfa, o Hly A (2), proteína que la bacteria sintetiza como pro-toxina y que activa por acilación antes de secretaria al medio externo como lipoproteína, y cuya actividad depende de la presencia de iones calcio en solución (3-5). El papel de Hly A como factor de virulencia se ha demostrado mediante estudios que indican que las cepas de Escherichia coli a las cuales se transforma con los genes codificantes de HlyA se tornan virulentas en modelos animales (6), y que la eliminación de dichos genes reduce drásticamente su virulencia (4).
HlyA es una citotoxina que ejerce su acción en varios tipos de células, incluyendo eritrocitos (7), fibroblastos (8), leucocitos polimorfonucleares neutrófilos (9, 10), macrófagos (11), monocitos ( 19,12 ) y linfocitos (11, 12 ). La asociación y posterior inserción de Hly A en membranas de células blanco (13) causa la formación de poros (14, 15), lo cual explica la actividad citotóxica. Los poros formados en la membrana se comportan como canales hidrofílicos con selectividad canónica (11). Aunque no son visibles al microscopio electrónico (16), permiten el paso de cationes (17), ATP (18) y probablemente otras moléculas. El daño causado a la membrana eventualmente conduce a muerte celular. La evidencia obtenida por Bhakdi et al (18) muestra que Hly A es una leucocidina muy potente, de acción irreversible, que causa la degranulación de Polimorfonucleares neutrófilos, y según datos obtenidos por medio de citometría de flujo, hace que las células aumenten su volumen.
Este estudio pretende cuantificar el aumento de volumen celular promedio en leucocitos polimorfonucleares neutrófilos expuestos a Hly A y estudiar la posible influencia de los iones calcio del medio extracelular en dicho efecto. Además, se complementó con mediciones utilizando citometría de flujo para corroborar el aumento en volumen celular, y tratar de definir una posible participación del calcio externo en la degranulación causada por HlyA.
Materiales y métodos
Las cepas usadas en esta investigación se obtuvieron del laboratorio del Dr. R.A. Welch (U. of Wisconsin, Madison, Wl) y son todas derivadas de la Escherichia coli DH 1. La cepa hemolítica WAM 589 se transformó con el plásmido pWAM04, (plásmido pUC 19 en el cual se subclonaron los genes de hemolisina, contenidos en el operon hly CABD proveniente del plásmido pSF4000). La cepa control WAM 675 no es hemolítica y fue transformada con el plásmido pUC 19 desprovisto de genes de hemolisina. La cepa control WAM 783 es la DH1 transformada con un derivado del plásmido pWAMO4, el cual porta una deleción en el gen hlyC. Este gen es responsable de la acilación de la pro HlyA (20). En consecuencia, WAM 783 secreta una hemolisina no acilada, incapaz de insertarse en membranas de la célula blanco.
Preparación de sobrenadantes de cultivos bacterianos
Se usaron sobrenadantes crudos de cultivos de la cepa WAM 589 como fuente de hemolisina y sobrenadantes crudos de las cepas WAM 675 y 783 como controles, a diluciones elevadas con respecto a los volúmenes de reacción (más de 1: 500).
Las cepas de Escherichia coli se cultivaron en caldo Luria-Bertani (LB), con ampicilina (100 ug/mi) para seleccionar en cultivo las cepas transformadas WAM 589 y 675, y cloramfenicol (20 µg/mi) para seleccionar la cepa WAM 783. Volúmenes de 100 ml de caldo LB se inocularon con 1-3 ml de un cultivo estacionario de la cepa correspondiente (incubado a 37° C durante 12 horas), luego de lo cual se incubaron a 37° C con agitación (200 rpm) en un incubador rotatorio G25 ( New Brunswick, Edison, NJ). Se tomaron muestras de 10-15 ml de los cultivos cuando éstos alcanzaron una densidad óptica (DO ) de 0,3-0,4 (600 nm) y las bacterias se sedimentaron por centrifugación (7 min, 800xg) en una centrífuga Sorvall SS1 (Dupont lnstruments, Wilmington, DE). El sobrenadante se esterilizó por filtración a través de una membrana estéril con porosidad de 0,4 um (Millipore), y se mantuvo en hielo previo a su utilización.
Determinación de actividad hemolítica
A cada ml de diluciones dobles seriadas de sobrenadante bacteriano crudo y estéril en solución salina 0,85% con calcio (10 mM CaCl2) se añadió 1 ml de suspensión al 1% de eritrocitos de carnero suspendidos solución salina. Se incubaron a 37° C durante 1 h. Al finalizar la incubación, se añadió a cada dilución 2 ml de solución salina fría para detener la reacción; se centrifugó a 700xg por 5 min en una centrífuga Sorvali GLC-2B (Dupont lnstruments, Wilmington, DE) y se leyó la DO del fluido sobrenadante a 545 nm para estimar la liberación de hemoglobina. Se determinó la dilución de sobrenadante que causó 50% de lisis eritrocitaria mediante interpolación en papel semilogarítmico en el cual se había trazado una curva patrón de hemólisis (hipotónica, en agua destilada) obtenida independientemente con el mismo lote de eritrocitos. El título hemolítico (HU50/ml) se definió como el inverso de la dilución de sobrenadante de cultivo bacteriano que causó 50% de hemólisis. Dado que los ensayos con células se efectuaron en buffer HC (1 mM Ca Cl2 y 0,1% gelatina, pH 7,4), se hicieron titulaciones de sobrenadantes hemolíticos en el mismo buffer, para descartar variaciones en el título hemolítico debidas al cambio de solución. El título hemolítico no varió con respecto al obtenido en solución salina con calcio.
Obtención de leucocitos polimorfonucleares neutrófilos (PMN)
Se usó sangre venosa heparinizada obtenida de voluntarios sanos, la cual se colocó en tubos de ensayo sobre medio Mono Poly (ICN-Flow) y se centrifugó de acuerdo con instrucciones del fabricante. Se recogió la banda de PMN y éstos se lavaron usando 20 ml de buffer HEPES sin calcio (HNC: HEPES 10 mM, NaCl 144 mM, KCI 5 mM, Glucosa 5,5 mM, gelatina para cultivo de tejidos 0,5% p/v, pH 7,4). Los PMN se resuspendieron luego en NH4CI (0,83% en HEPES 10 mM, pH 7,4) durante 7 minutos, para lisar eritrocitos contaminantes. Los PMN se lavaron una vez más con HNC y se resuspendieron luego en 1 mi de buffer (0,8 mi de HNC + 0,2 ml de buffer HEPES con calcio, o HC. El conteo de células en la suspensión se efectuó usando una cámara cuenta glóbulos (Hemacytometer).
Medición de volumen celular medio (VCM) y citometría de flujo
Se agregaron volúmenes de 2-4 ml de buffer HC estéril a viales de vidrio siliconizado para uso en contadores de centelleo. Se añadió luego el volumen de suspensión celular necesario para obtener 1 x 106 células/ml. El experimento se inició adicionando el volumen de sobrenadante crudo estéril, sus controles, o reactivos según se indica, a las suspensiones celulares. Los viales se mantuvieron a 370 C, con rotación a 100-150 rpm (G76 Gyrotory Water Bath Shaker, New Brunswick, Edison, NJ). A intervalos definidos, se recogieron alíquotas de 200 ul , las cuales se diluyeron en solución lsoton (Beckton-Dickinson), de acuerdo con instrucciones del fabricante, para conteo total y medición de VCM en un contador Coulter, modelo ZBI, con un canalizador 256 (Coulter lnstruments, Hialeah, FL), conectado a una computadora IBM con programa Accu 256.
Para citometría de flujo, se tomaron alíquotas de 500 ul de los viales y se analizaron en un citómetro FACSCAN (Beckton-Dickinson), con excitación laser de X 488 nm, graficando el contorno de la población de PMN con respecto a "Forward Scatter'y "Side Scatter".
Resultados
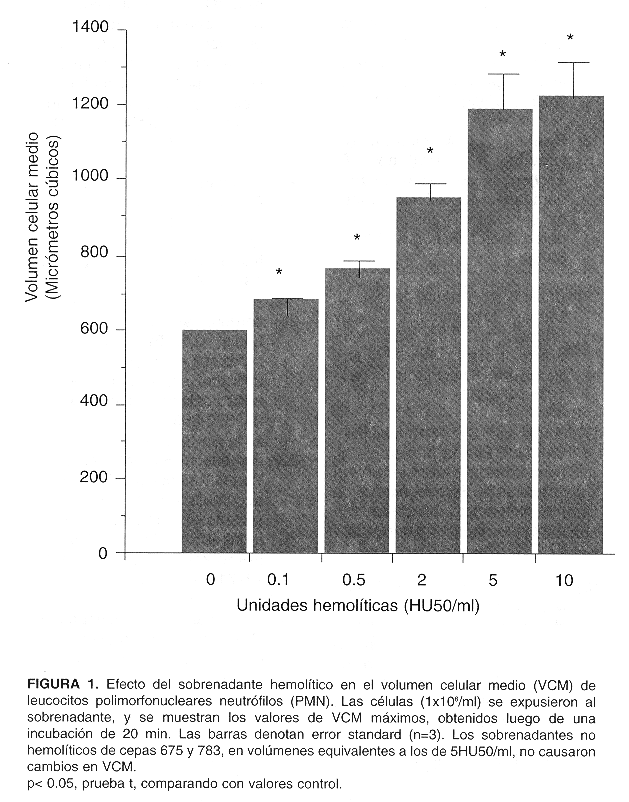
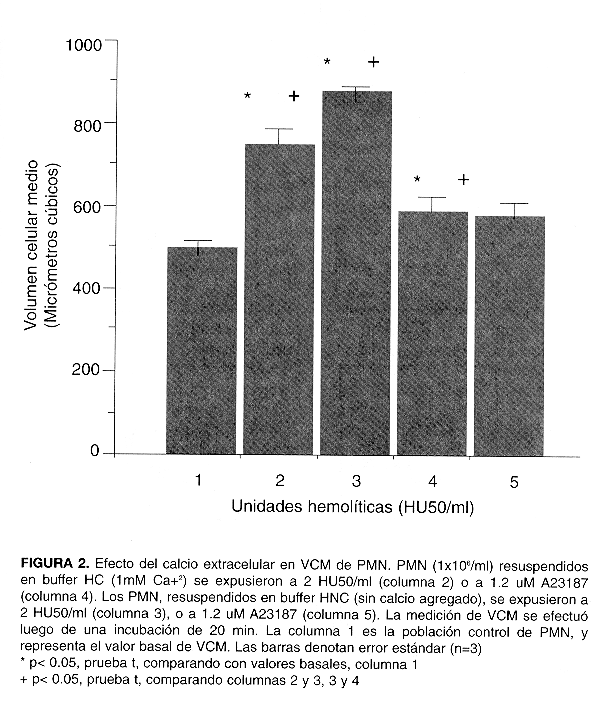
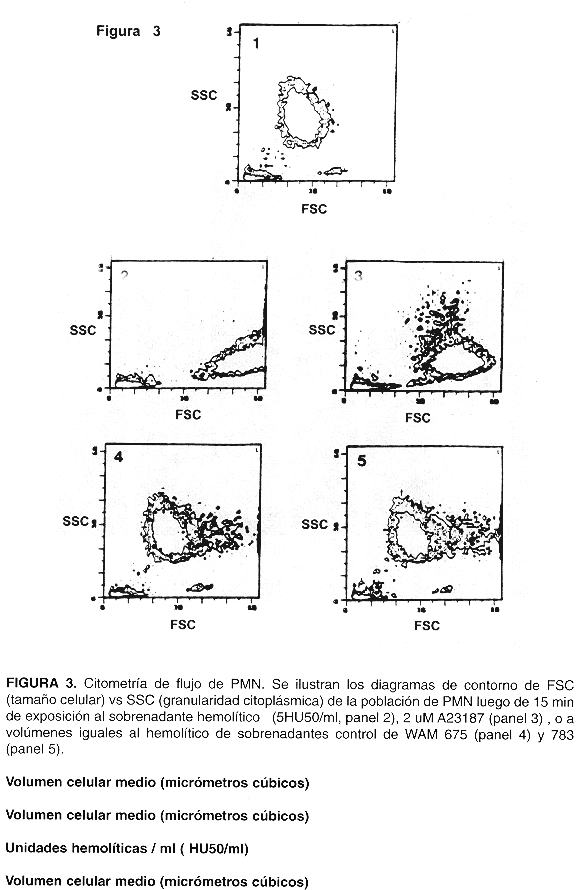
El VCM de PMN expuestos a sobrenadantes hemolíticos aumentó en relación directa a la dosis empleada, alcanzando un máximo de más de 200% por sobre el valor basal en aquellos expuestos a 5 HU50/ml o valores superiores (Fig. 1). El efecto de la hemolisina se detectó a diluciones extremadamente altas de sobrenadante hemolítico. Por ejemplo, éste debió diluirse en razones del orden de 1: 20 000 para dar 0,1 HU50/ml, dosis ante la cual los PMN aumentaron su VCM de manera leve pero significativa. En presencia de sobrenadantes de las cepas control WAM 675 y 783 los PMN no aumentaron su VCM con respecto al valor basal. Para estudiar el efecto del calcio extracelular en el VCM (Fig. 2), alícuotas de PMN suspendidos en HNC (sin calcio agregado) se expusieron a 2 HU50/ml; en este caso, se adicionó previamente CACI2 (5 mM) al sobrenadante bacteriano para asegurar la activación de la hemolisina. Dada la dilución tan elevada del sobrenadante en la suspensión de PMN, la contribución del calcio agregado al sobrenadante al volumen de reacción fue despreciable. Para estudiar el efecto de la transiocación selectiva de calcio hacia el interior de la célula en el VCM, los PMN se expusieron también a 1,2 uM del ionóforo de calcio A23187 estando suspendidos en HC, o en HNC, para controlar con éste último el efecto de A23187 sin calcio externo. Los PMN resuspendidos en HNC y expuestos a 2 HU50/mi mostraron un aumento muy pronunciado en VCM, mucho mayor que el de los expuestos a la misma dosis hemolítica en presencia de HC. Los PMN expuestos al ionóforo A23187 aumentaron leve pero significativamente su VCM con respecto al valor basal sólo en presencia de calcio en solución (suspendidos en HC). Los resultados de la citometría de flujo se presentan en la Fig. 3. El panel 1 ilustra la posición del contorno de los PMN usados como control.
Aquellos expuestos a 5 HU 50/ml (panel 2) mostraron aumento en tamaño celular, evidenciado por el aumento en FSC (Forward Scatter), así como disminución en granularidad citoplásmica, según se desprende de la disminución en SSC (Side Scatter); ambos efectos se notaron también en PMN tratados con 2 uM de ionóforo A23187 (panel 3). Sin embargo, y en concordancia con los hallazgos en las determinaciones de MCV, el tamaño de los PMN expuestos a 2uM A23187 no aumentó tanto como en el caso de los expuestos a 5 HU/mi. Los PMN expuestos a sobrenadantes de la cepa WAM 675 (panel 4) o WAM 783 (panel 5) no mostraron cambios importantes en FSC o SSC, excepto por un porcentaje pequeño de células (5-10%) que aumentan aparentemente en tamaño, debido a cambios en forma celular inducidos por el LPS presente en el sobrenadante de cultivo bacteriano.
Discusión
Los sobrenadantes de cultivos bacterianos son una mezcla compleja de componentes del medio de cultivo y de productos bacterianos. Su uso como fuente de hemolisina se justifica en esta investigación en vista de la complejidad estructural de la alfa hemolisina, la cual no ha podido ser totalmente purificada, ya que forma complejos con el lipopolisacárido ( LPS ) presente en los mismos medios de cultivo (21). Sobrenadantes de las cepas isogénicas WAM 675 y 783 se usaron como controles para asegurar que los efectos observados son atribuibles únicamente a Hly A. Se efectuaron también experimentos de inactivación térmica y enzimática, sometiendo los sobrenadantes hemolíticos en éste último caso a la acción de lipasa, proteinasa K y tripsina. Ambos tratamientos, térmico y enzimático, eliminaron por completo la actividad hemolítica de los sobrenadantes. Además, la actividad hemolítica se bloqueó por completo cuando se les incubó previamente con D12, un anticuerpo monocional anti HlyA, pero no disminuyó cuando se les incubó con el anticuerpo monocional D1, que posee especificidad anti LPS. La obtención de los anticuerpos D1 y D12 ha sido reportada previamente (21). Todo lo anterior demuestra de manera concluyente que el principio activo en el sobrenadante de la cepa WAM 589 es Hly A, y valida su uso en este estudio.
Los PMN aumentaron su MCV en respuesta al sobrenadante hemolítico, aún a diluciones altas, sin verse afectados por los sobrenadantes control. Ello es congruente con el mecanismo de acción propuesto para la alfa hemolisina, a saber, la formación de poros en membrana (11,15). La aparición de tales lesiones permite la redistribución de cationes a través de la membrana de acuerdo a su gradiente de concentración, en particular de sodio, potasio y calcio (22, 23), y hace que la célula afectada entre en equilibrio de Donnan. La presencia de proteínas intracelulares como aniones no difusibles causa entonces un incremento en la concentración de cationes intracelulares, que conduce a movimiento de agua hacia el interior de la célula, y explica el incremento en VCM. Observaciones al microscopio de luz, no documentadas en el presente trabajo, mostraron que las células afectadas aumentan su volumen, pierden su forma, su adherencia al sustrato y eventualmente pierden citoplasma, el cual se proyecta como abultamientos por sobre la membrana celular y se expulsa al exterior.
Los PMN se expusieron también a la hemolisina suspendidos en buffer sin calcio con el fin de explorar el posible efecto del mismo en el VCM. La disminución en calcio externo acentúa el aumento en VCM inducido por Hly A, en concordancia con los resultados de Menestrina et al: concentraciones fisiológicas de calcio aumentan la probabilidad de que el poro formado por la hemolisina se encuentre momentáneamente cerrado, mientras que concentraciones muy bajas lo mantienen abierto con más frecuencia, y la redistribución iónica a través de la membrana se acelera como resultado (14). Otros autores (24) apuntan que tanto el calcio como el zinc contribuyen a la protección de membranas celulares sometidas a la acción de agentes hemolíticos. Tal efecto podría jugar incluso un efecto protector en infecciones. PMN expuestos a ionóforo de calcio aumentan levemente su volumen, ya que el aumento en calcio intracelular induce abultamientos en la membrana de las células, relacionados probablemente con alteraciones en el citoesqueleto, pero es patente que el efecto del incremento en calcio no influencia el VCM como lo hace la hemolisina (Fig. 2).
Los resultados de la citometría de flujo concuerdan con las mediciones de VCM, ya que el incremento de FSC en PMN expuestos a hemolisina indica aumento en tamaño celular. El ionóforo de calcio A23187 produjo una transiocación de calcio al interior de la célula, y causó en consecuencia una disminución en la granularidad citoplásmica (degranulación) de los PMN que es igual a la inducida por la Hly A. Esta degranulación, por lo tanto, es debida al aumento en el calcio citopiásmico inducido por ambos agentes ( Fig. 3). De hecho, experimentos no reportados en este trabajo comprobaron que Hly A causa incrementos en calcio intracelular, y que, en efecto, Hly A induce liberación al medio externo de enzimas contenidas en los gránulos de PMN, de acuerdo con los resultados de Bhakdi et al (18).
Estos hallazgos indican que Hly A puede alterar la fisiología de la célula blanco debido, entre otras causas, al incremento en el calcio intracelular posterior la aparición de poros en la membrana. Como la concentración fisiológica de calcio extracelular oscila en rango milimolar, y la concentración intracelular en rango micromolar o nanomolar, la apertura de poros no fisiológicos permite el paso de calcio al citoplasma. El aumento no fisiológico en el calcio citoplásmico puede activar fosfolipasas y quinasas, trastornando seriamente el metabolismo y función celular. Las observaciones al microscopio de luz que mostraron pérdida de forma y adhesión de PMN al sustrato son consistentes con una posible desorganización del citoesqueleto, cuya función depende de la concentración intracelular de calcio.
Esta investigación amplía reportes previos añadiendo la cuantificación del efecto de Hly A en el VCM de PMN; la evidencia obtenida incluye a HlyA dentro del grupo de agentes cuyo efecto es modulado por el calcio extracelular, y postula que el incremento causado por HlyA en el calcio intracelular contribuye a las alteraciones en la fisiología celular inducidas por la hemolisina. En PMN, tales alteraciones, podrían explicar los defectos en quimiotaxis y fagocitosis reportados por Cavalieri y Snyder (25) y amplificarían la respuesta inflamatoria a las bacterias hemolíticas y el daño tisular al causar liberación de contenidos granulares de PMN.
Referencias
1) Eisenstein, B.I., Jones, G.W. The spectrum of infectious and pathogenic mechanisms of Escheríchia coli Adv lnt Med 1988;33:231-252. [ Links ]
2) Cavalieri, S.J., Bohach, G.A., Snyder, l.S. Escherichia coli alpha hemolysin: characteristics and probable role in pathogenicity. Microbiol Rev 1984; 48: 326-343. [ Links ]
3) Snyder, l.S., Zwadyk, P. Some factors affecting production and assay of Escherichia coli hemolysins. J Gen Microbiol 1969; 55: 139-143. [ Links ]
4) Chakraborty, T, Kathariou, S. Hacker, J., Hof, H., Huhle, B., Wagner, W., Kuhn, M., Goebel, W. Molecular analysis of bacterial cytolisins. Rev Infec Dis 1987; 9 (S5):S456-S466. [ Links ]
5) lssartel, J.P., Koronakis, V., Hughes, C. Activation of Escherichia coli prohaemolysin to the mature toxin by acyl carrier protein-dependent fatty acid acyiation. Nature 1991;
351: 759-761.
6) Welch, R.A., Dellinger, E.P., Minshew, B., Falkow, S. Haemolysin contributes to viruience of extra intestinal E. coli infections. Nature 1981; 294: 665- 667. [ Links ]
7) Snyder, l.S., Koch, N.A. Production and characteristics of hemolysins of Escherichia coli. J Bacteriol 1966; 91: 763-767. [ Links ]
8) Cavalieri, S.J., Snyder, l.S. Cytotoxic activity of partially purified Escherichia coli alpha hemolysin J Med Microbiol 1982; 15: 11-21. [ Links ]
9) Cavalieri, S.J., Snyder, l.S. Effect of Escherichia coll aipha hemolysin on. human peripheral leukocyte viability in vitro. Infect Immun. 1982; 36:455-461.
10) Gadeberg, O., Orskov, I. In vitro cytotoxic effect of aipha hemolytic Escherichia coll on human blood granulocytes. Infect Immun 1984; 45: 255- 260.
11) Menestrina, G., Dalla Serra, M., Pederzoili, C., Bregante, M., Gambale, F. Bacterial hemolysins and leukotoxins affect target cells by forming large exogenous pores into their plasma membrane. Escherichia coli hemolysin A as a case example. Bioscience Reports 1995; 15: 543-551.
12) García, J.D. Efecto citotóxico de la hemolisina de Escherichia coli (parcialmente purificada) en linfocitos y monocitos in vitro. Rev Cost Cienc Med 1984; 5: 170-174. [ Links ]
13) Bauer, M.E., Weich, R.A. Association of RTX toxins with erythrocytes. lnfect lmmun 1996; 64: 4665-4672. [ Links ]
14) Menestrina, G., Bashford, C.L., Pasternak, C.A. Pore-forming toxins: experiments with S. aureus alpha-toxin, C. perfringens theta-toxin and E. coli hemolysin in lipid bilayers, liposomes and intact cells. Toxicon 1990; 28: 477-491. [ Links ]
15) Bhakdi, S., Mackman, N., Nicaud, J.M., Holland, l.B. Escherichia coli hemolysin may damage target cell membranas by generating transmembrane pores. lnfect Immun 1986; 52: 63-69. [ Links ]
16) Bhakdi, S., Tranum-Jensen, J. Damage to mammalian celis by proteins that form transmembrane pores. Rev Physiol Biochem Pharmacol 1987; 107:147-223.
17) Jorgensen, S.E., Hammer, R.F, Wu, G.F. Effects of a single hit from the aipha hemolysin produced by Escherichía colí on the morphology of sheep erythrocytes. lnfect lmmun 1980; 27: 988-994.
18) Bhakdi, S., Greulich, S., MuHly, M., Eberspacher, B., Becker, H., Thiele, A., Hugo, F. Potent lescocidal action of Escherichía coll hemolysin mediated by permeabilization of target cell membranas. J Exp Med 1989;
169: 737-754.
19) Bhakdi, S., Muhly, M., Korom, S., Schmidt, G. Effects of Escherichia coli hemolysin on human monocytes. J Clin lnvest 1990; 85: 1746-1753. [ Links ]
20) Hardie, K.R., lssartel, J.P., Koronakis, E., Hughes, C., Koronakis, V. In vitro activation of Escherichia coli prohaemolysin to the mature membrane-targeted toxin requires HlyC and a low-molecularweight cytosolic poiypeptide. Molecular Mícrobiology 1991; 5: 1669-1679. [ Links ]
21) Bohach, G.A., Snyder, l.S. Chemical and immunologicalanalysis of the complex structure of Escherichia coli alpha hemolysin. J Bacteriol 1985; 164: 1071-1080. [ Links ]
22) Jorgensen, S.E., Mulcahy, P.F., Louis, C.F. Effect of Escherichía colí hemolysin on permeability of erythrocyte membranes to calcium. Toxicon 1986; 24: 559-566.
23) Jorgensen, S.E., Mulcahy, P.F., Wu, G.K., Louis, C.F. Calcium accumulation in human and sheep erythrocytes that is induced by Escherichia coli hemolysin. Toxícon 1983; 21:717-727.
24) Pasternak, C.A. A novel role of Ca+2 and Zn +2: protection of cells against membrane damage. Bioscience Reports 1988; 6: 579-583. [ Links ]
25) Cavalieri, S.J., Snyder, l.S. Effect of Escherichia coli alpha hemolysin on human peripheral leukocyte function in vitro. Infect lmmun 1982; 37: 966974. [ Links ]
* Departamento de Bioquímica, Facultad de Medicina, Universidad de Costa Rica.