Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Costarricense de Ciencias Médicas
Print version ISSN 0253-2948
Rev. costarric. cienc. méd vol.20 n.1-2 San José Jun. 1999
Resumen
Se investiga el uso de un método recientemente descrito para la determinación enzimática de los fosfolípidos que contienen colina (FLC) como un medio de evaluar madurez pulmonar fetal. Se compararon resultados del FLC con los resultados obtenidos por cromatografía de la capa fina, fluorescencia polarizada (TDx-FLM), recuento de cuerpos lamelares y absorbancia a 650 nm. El estudio usó 101 líquidos amnióticos. El análisis de los resultados sugirió que una concentración de FLC ( 7,0 mg/dL es indicativa de madurez pulmonar. Se encontró una alta concordancia del FLC con las otras pruebas para evaluar madurez pulmonar fetal. Se sugiere el empleo de FLC como método alternativo para la evaluación del riesgo de síndrome de insuficiencia respiratoria.
Palabras clave
fosfolípidos, líquido amniótico, madurez pulmonar fetal, síndrome de insuficiencia respiratoria, cuerpos lamelares, fosfatidilglicerol, relación surfactante/albúmina.
Abstract
The use of a method recently describes for the enzymatic determination of phospholipids that contain choline (PCC) as a means of evaluating fetal lung maturity is evaluated. Results of the PCC were compared with those obtained by thin layer chromatography, polarizad f luorescence (TDx-FLM), recount of lamellar bodies and absorbance at 650 nm. The study used 101 amniotic liquids. The analysis of the results suggested that a concentration of 7,0 mg/dL of PPC is indicative of lung maturity. It was a high agreement of the PPC method with the other tests to evaluate fetal lung maturity. It is suggested the employment of PPC test like an alternative method for the evaluation of the risk of respiratory distress syndrome.
Key words
phospholipids * amniotic fluid * fetal lung maturity * respiratory distress syndrome * lamellar bodies * phosphatidylglycerol * surfactant/albumin ratio.
Introducción
El síndrome de insuficiencia respiratoria (SIR) continúa siendo la causa preponderante de mortalidad neonatal de recién nacidos con bajo peso (1). De acuerdo a esto, a fin de evitar el SIR, es importante la confirmación de la madurez pulmonar fetal (MPF), sobre todo en el manejo de embarazos con riesgo de nacimiento prematuro (1, 2). El SIR se presenta cuando el niño nace antes de que los pulmones estén fisiológica y funcionalmente maduros. La madurez pulmonar es reflejada en parte por la cantidad de surfactante pulmonar producido, el cual reduce la tensión superficial a nivel alveolar evitando el colapso de los alvéolos (3). El surfactante pulmonar es una mezcla compleja de lípidos, proteínas y carbohidratos; siendo los fosfolípidos el principal componente lipídico (4). La lecitina (fosfatidilcolina) es el principal fosfolípido del surfactante pulmonar y del líquido amniótico. La concentración de lecitina en el líquido amniótico aumenta marcadamente durante las últimas semanas de gestación y por lo tanto se considera que refleja en forma bastante exacta la edad gestacional y la madurez pulmonar (3-7). El fosfatidilglicerol (FG) y el fosfatidilinositol (FI) a pesar de que se hallan en concentraciones menores revisten gran importancia desde el punto de vista de la madurez, por presentar efecto coadyuvante tensoactivo (2).
Las técnicas más aceptadas para evaluar la madurez pulmonar fetal son la relación lecitina/esfingomielina (UE) (3, 6, 7) y la determinación de FG, ambas se realizan mediante cromatografía en capa fina (CCF) (8-11). Aunque estas técnicas relacionan confiablemente fosfolípidos en líquido amniótico con la madurez pulmonar fetal; son muy laboriosas y para obtener una buena precisión se requiere una considerable experiencia y habilidad (2, 12). Algunos otros métodos para estimar madurez pulmonar fetal incluyen: estabilidad de la espuma (13), determinación de la absorbancia del líquido amniótico a 650 nm (14), fluorescencia polarizada (1, 15), métodos de inmunoaglutinación (16, 17) y enzimáticos (18-20) para medir lecitina, esfingomielina y FG, así como la cuantificación de cuerpos lamelares (21, 22). Estas pruebas difieren en cuanto a su confiabilidad clínica, tiempo requerido para realizarlo y experiencia del personal, así como en costos de equipo e implementos. De acuerdo a esto, la utilidad clínica varía con los diversos procedimientos (1, 2, 12).
En este artículo se compara un método enzimático para determinar la concentración de fosfolípidos que contienen colina (FLC) en líquido amniótico (23) con otras pruebas para evaluar madurez pulmonar (fluorescencia polarizada del TDx-FLM, determinación de cuerpos lamelares, la absorbancia a 650 nm y la presencia de fosfatidilglicerol).
Materiales y métodos
Se analizaron 101 líquidos amnióticos enviados al laboratorio clínico del Hospital Calderón Guardia, Caja Costarricense de Seguro Social, San José, Costa Rica; para análisis de madurez pulmonar fetal. Las muestras fueron obtenidas entre las 28 y 42 semanas de gestación (determinadas mediante ultrasonido) por medio de amniocentesis transabdominal; y ya que fueron obtenidas para propósitos clínicos, no se requirió consentimiento informado. Las muestras fueron procesadas en un periodo no mayor de cuatro horas después de su extracción o congeladas a -20 °C para análisis posteriores.
Los líquidos amnióticos se centrifugaron a 250 g por 5 minutos para remover restos celulares y otros contaminantes. Las muestras contaminadas con sangre o meconio, fueron excluidas de este estudio, a menos que se especifique lo contrario. Por motivo del volumen a las muestras no se les realizaron todas las pruebas. El método de FLC fue descrito recientemente (23), sin embargo, en esta prueba 0,2 mL de líquido amniótico se mezclan con 0,8 mL de reactivo de color que contiene por litro de tris (hidroximetil) aminometano 50 mM, pH 7,8: 1000 UI fosfolipasa D; 5000 UI de colina oxidasa; 800 UI peroxidasa; 1000 mg de fenol; 1420 mg de 4-aminofenazona; 1 mL de Tritón X-1 00 y 400 mg de CaCI2 anhidro. Después de incubar 30 minutos a 37°C se determina la absorbancia a 500 nm, la cual es proporcional a la concentración de FLC.
La presencia de fosfatidilglicerol se determinó mediante CCF. Brevemente, volúmenes iguales de líquido amniático y metanol absoluto se mezclan con Vortex. Los lípidos se extraen con dos volúmenes de cloroformo. Después de centrifugar, se extrae la capa de cloroformo y se evapora. El residuo se disuelve en 20 µL de cloroformo. Las muestras y controles (5 µL) se aplican en placas de sílica gel para cromatografía en capa fina (Merck). Como fase móvil se empleó una mezcla de cloroformo/ metanol/agua (200:75:3). Los fosfolípidos se hacen visibles al exponerlos a vapores de yodo. El FG se determinó cualitativamente como presente o ausente.
Para el análisis de fluorescencia polarizada (TDx-FLM), una porción de cada muestra se filtró en los filtros suministrados por el fabricante del equipo, después se realizó la prueba en el analizador de fluorescencia polarizada (Analizador TDx de la firma Abbott). Se recomienda que los especímenes con >55 mg surfactante por gramo de albúmina (mg/g) se informen como maduros. Por consiguiente, para este estudio, las muestras con valores de TDX-FLM < 55 mg/g se consideraron como inmaduros. El recuento de cuerpos lamelares se realizó en el canal de plaquetas de contadores hematológicos Coulter (Coulter Diagnostics) y CellDin 1500 (Abbott).
La absorbancia de los líquidos amnióticos se determinó a 650 nm en cubetas de un centímetro de paso de luz contra un blanco de agua destilada en un espectrofotómetro (Shimadzu, modelo UV-1601 PC; Shimadzu Corporation, Kyoto Japón). El valor de corte que indica madurez se estableció como > 0.15.
Los datos fueron analizados por regresión simple y las probabilidades de p < 0,05 fueron consideradas significativas.
Para el análisis de los datos se emplearon las siguientes definiciones: prueba negativa = prueba que indica ausencia de SIR (prueba madura); prueba positiva = resultado que indica presencia de SIR (prueba inmadura); Sensibilidad, un indicador positivo del desarrollo de SIR por un resultado inmaduro (habilidad de predecir inmadurez),. Especificidad, un indicador positivo de MPF por un resultado maduro (habilidad de predecir madurez).
Resultados
Se analizaron un total de 101 líquidos amnióticos por el método FLC, de estos únicamente 20 fueron muestras de madres cuyos niños nacieron en el intervalo de 72 horas después de la toma de muestra. No se presentaron casos de SIR, por lo tanto las comparaciones se llevaron a cabo empleando los niveles de corte o decisión de las pruebas ya establecidas.
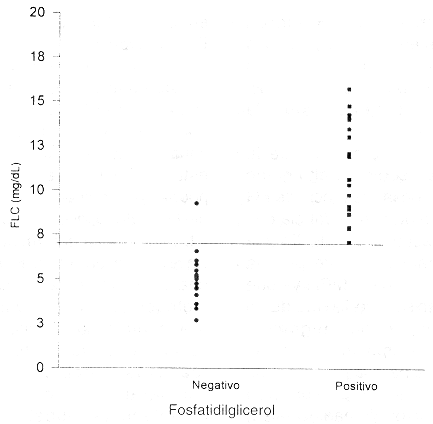
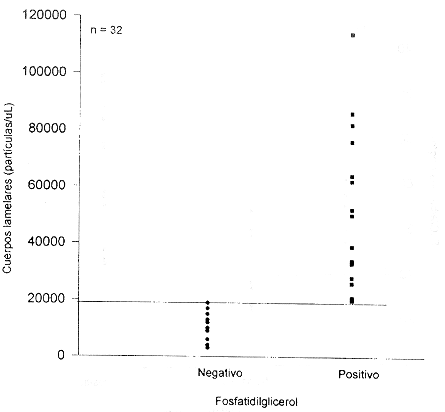
Comparación del método FLC con presencia de Fosfatidilglicerol por CCF
La figura 1 muestra el estudio comparativo de la prueba FLC con la presencia de FG en cromatografía de capa fina. Se analizaron por ambos métodos un total de 32 muestras. Después de evaluar diferentes niveles de decisión se consideró adecuado un nivel > 7,0 mg/dL como índice de madurez. Como puede observarse en la figura, con este valor se presenta la mejor concordancia entre las pruebas. Tomando la presencia de FG como indicadora de madurez pulmonar fetal, el nivel de corte > 7,0 mgldl presenta una sensibilidad de 0,93 y una especificidad de 1,0. Únicamente se presenta un falso negativo (maduro por FLC, inmaduro por FG). Si el nivel de decisión se disminuye a 6,5 mg/dl, se observa un aumento en valores falsos negativos (sensibilidad 0,87); aunque no cambia la especificidad (1,0). Si el nivel de corte se establece en 7,5; se aumentan los falsos positivos (especificidad 0,94), aunque no aumentan los falsos negativos. Con el nivel elegido (7,0 mg/dL) se obtiene un adecuado compromiso entre sensibilidad y especificidad.
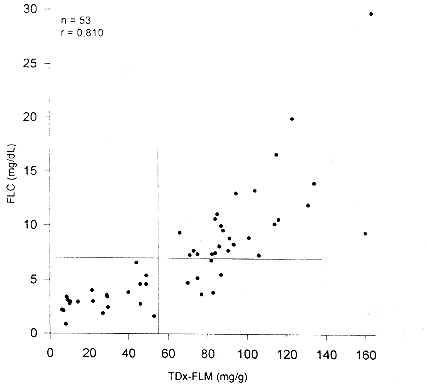
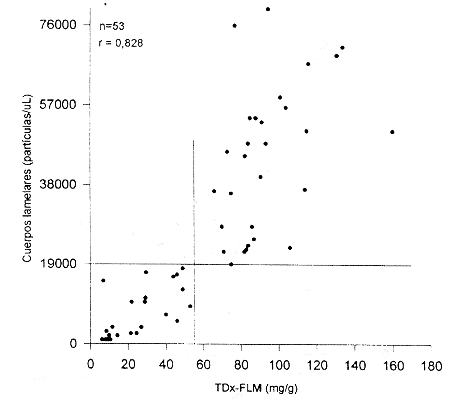
Comparación del método FLC con fluorescencia polarizada (TDx-FLM)
La comparación de método en estudio con el método del TDX-FLM se realizó con un total de 53 muestras. En la figura 2 se muestran los resultados. Como puede observarse, existe una buena correlación entre ambos métodos, presentando un coeficiente de correlación (r) de 0,810 (p<0,001). En este caso también se evaluaron diferentes niveles de decisión. Con un nivel de corte > 7,0 mgldl se presenta muy buena concordancia entre las pruebas. Tomando el valor de corte sugerido por el fabricante del TDX-FLM > 55 mg surfactante por gramo de albúmina) como indicador de madurez pulmonar fetal, el nivel de decisión de 7,0 mg/dL en el método FLC, presenta una sensibilidad de 1,0 y una especificidad de 0,81. En este grupo no se observaron falsos negativos (maduros por FLC, inmaduro por TDx-FLM), pero se observaron 6 falsos positivos (inmaduros por FLC, maduros por TDx-FLM). Cinco de estos niños nacieron en el intervalo de 72 horas desde la toma de la muestra y ninguno presentó SIR. Si el nivel de decisión se disminuye a 6,5 mg/dL, se observa un aumento en valores falsos negativos (sensibilidad 0,95) y disminución de falsos positivos (especificidad 0,84). Por el contrario, si el nivel de corte se establece en 7,5; se aumentan los falsos positivos (especificidad 0,65), aunque no cambia el número de falsos negativos (sensibilidad 1,0). De nuevo, con el nivel de corte elegido > 7,0 mg/dL) se obtiene un compromiso adecuado entre sensibilidad y especificidad.
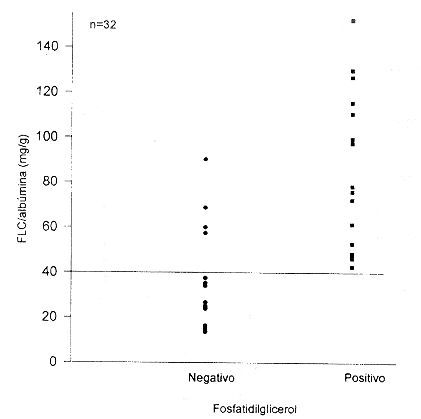
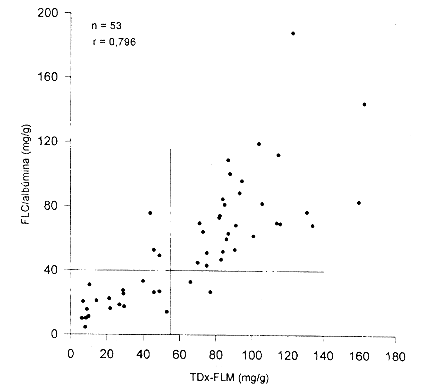
Corrección de FLC por albúmina
Buscando una forma de mejorar la eficiencia diagnostica del método de FLC, se empleó la concentración de albúmina en el líquido amniótico (que permanece relativamente constante) para corregir variaciones en FLC debidos a cambios en volumen del LA. Como puede observarse en las figuras 3 y 4, esta corrección no mejora la eficiencia diagnostica del FLC. Al corregir por albúmina, en el caso de la comparación con la presencia de FG (fig. 3), el mejor punto de corte se obtiene con 40 mg FLC/ g albúmina. Con este nivel de decisión se disminuye la sensibilidad a 0,73, aunque la especificidad no cambia (1,0). Al comparar los niveles de FLC corregidos por albúmina con la fluorescencia polarizada (fig. 4) y empleando un punto de corte de (40 mg FLC/g albúmina, se obtiene una sensibilidad de 0,86 y una especificidad de 0,94.
Comparación del FLC con la determinación de cuerpos lamelares (CL)
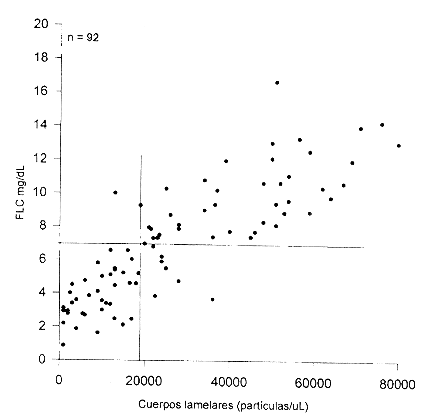
La determinación del número de CL se realizó en 92 muestras. Como el nivel de corte para CL aún no está bien definido y en la literatura se informan diferentes puntos de corte; fue necesario establecer un nivel de decisión en forma similar al FLC. Las figuras 5 y 6 muestran los estudios comparativos del recuento de CL con la presencia de FG en cromatografía de capa fina y con los resultados del TDx-FLM, respectivamente. Con un nivel de decisión para madurez pulmonar de CL > 19000 partículas/µL, se obtuvo una sensibilidad de 0,94 (un falso negativo; CL =19000; FG negativo) y una especificidad de 1,0 al compararlo con la determinación de FG por cromatografía (n =32). Mientras que al comparar con el TDx-FLM y emplear este nivel de corte, se observó concordancia en el 100 por ciento de los casos. Con base en estos resultados, se utilizó un valor de CL >19000 partículas/(L como un nivel de decisión adecuado para madurez pulmonar.
La comparación del FLC con el recuento de CL, en 92 líquidos, se muestra en la figura 7. Como puede observarse existe buena correlación entre estos dos parámetros con un r de 0,850 (p < 0,001). Empleando los niveles de decisión indicados anteriormente, se encontró discrepancia en 8 casos. Siete casos con CL > 19000 partículas/µL presentaron FLC inferiores a 7,0 mg/dL y un caso presentó un valor de FLC > 7,0 mg/dL pero CL < 19000 partículas/µL. Este último (FLC = 10,0 mg/dL; CL = 13000 partículas/µL) nació 48 horas después de la toma de muestra y no presentó SIR, lo que indica que el método errado al diagnosticar madurez pulmonar en este caso fue el recuento de CL.
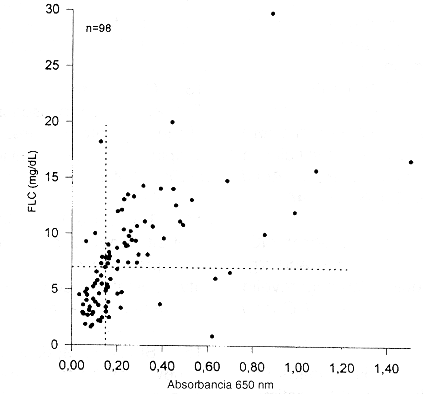
Comparación de FLC con absorbancia a 650 nm
La figura 8 muestra la comparación de los valores de FLC con la absorbancia de los líquidos amnióticos a 650 nm. De un total de 98 muestras, no hubo concordancia en 24 casos, en seis de ellos los valores de FLC fueron superiores a 7,0 mg/dL mientras la absorbancia fue inferior a 0,1 50. En 18 muestras la absorbancia fue superior a 0,150 y los valores de FLC inferiores a 7,0 mg/dL.
Discusión
Para el manejo de pacientes obstétricas de alto riesgo es esencial una exacta evaluación de la madurez pulmonar fetal. El laboratorio clínico juega un papel muy importante ayudando al médico en la determinación temprana del potencial de SIR a través de la comprobación de MPF. Generalmente los métodos de cromatografía en capa fina son los más aceptados para tal efecto. La relación L/E y la presencia de fosfatidilglicerol han demostrado tener el mayor valor predictivo para evaluar la probabilidad de SIR (3, 12, 24). Aunque estos métodos son exactos tienen varios inconvenientes: requieren mucho tiempo, emplean sustancias tóxicas y requieren de mucha experiencia personal (1, 2,12). Además no se ha logrado una adecuada estandarización y su reproducibilidad ha sido criticada (2, 12, 20). Debido a esto, se hace necesario el desarrollo de métodos que determinen madurez pulmonar fetal de una manera rápida, exacta, precisa y económica. Recientemente propusimos la determinación de FLC en líquido amniótico como un método alternativo para evaluar MPF (23). El propósito de este estudio fue comparar la utilidad clínica del nuevo método con otras técnicas ya establecidas.
La utilidad clínica de una prueba para madurez pulmonar fetal, idealmente debe evaluarse con base en la presencia o ausencia de SIR. Pero en el presente estudio esto no fue posible debido a que hubo pocos nacimientos en el intervalo de 72 horas después de la amniocentesis y ninguno presentó SIR. Sin embargo, ya que la determinación de FG por CCF es generalmente considerada "la norma de oro" y la prueba del TDx-FLM ha sido ampliamente evaluada y ha demostrado poseer una exactitud diagnostica similar a las cromatografías en capa fina (1, 15, 26, 27), se consideró razonable comparar el FLC con los resultados obtenidos por ambos métodos. Además se realizó la comparación con el recuento de cuerpos lamelares y la absorbancia a 650 nm.
El nivel de decisión para el FLC se estableció determinando el punto en el que se obtuvo mejor concordancia con la presencia de FG y con un valor del TDx-FLM de 55 mg/g. Este punto correspondió a una concentración de FLC de 7,0 mg/dL.
El estudio comparativo del FLC con la presencia de FG mostró una concordancia muy buena entre ambos métodos. De 32 muestras analizadas por ambos métodos, los resultados concordaron en 31 de ellas. Solamente una muestra presentó un valor de FLC de 9,3 mg/dL y fue negativa por FG. En este caso cabe señalar que la muestra presentaba madurez por otros parámetros (absorbancia a 650 nm y cuerpos lamelares), por lo que con mucha probabilidad existía madurez pulmonar. Es bien sabido que la aparición del FG ocurre a partir de la semana 35 (2, 12), por lo que esta determinación puede presenta falsos inmaduros. Muchos de los recién nacidos de madres cuyos líquidos amnióticos no presentan FG no desarrollan SIR (2, 12). No se presentó ningún caso de inmadurez por FLC y presencia de FG.
La comparación de la determinación de FLC con la fluorescencia polarizada de TDX-FLM mostró una excelente concordancia en 47 de 53 muestras. En 6 muestras hubo discrepancia en los resultados. Todas estas muestras tenían valores de FLC menores a 7 mg/dL (entre 3,7 y 6,8 mg/dL) pero presentaban un valor del TDX-FLM superior a 55 mg/g. Cinco de estas muestras fueron de niños nacidos en el intervalo de 72 horas después de la amniocentesis y no presentaron SIR. La muestra restante presentó un recuento de CL de 28000 partículas/(L y una absorbancia a 650 nm de 0,221. Estos datos indican que con mucha probabilidad existía madurez y en forma errada, el método de FLC la identificó como inmadura.
La concentración de albúmina en el líquido amniótico permanece relativamente constante a lo largo del embarazo. Por lo anterior tratamos de emplearla como un estándar interno, para tratar de mejorar la eficiencia diagnostica del método de FLC. Esto con el fin de corregir por variaciones en FLC debidas a cambios en volumen del LA. Sin embargo, esta corrección no mejora la eficiencia diagnóstica del FLC. Al corregir por albúmina, en el caso de la comparación con la presencia de FG, el mejor punto de corte se obtuvo con 40 mg FLC/g albúmina. Con este nivel de decisión se aumenta el número de falsos negativos, disminuyendo la sensibilidad a 0,73, aunque la especificidad no se modifica (1,0). Al comparar los niveles de FLC corregidos por albúmina con la fluorescencia polarizada y empleando un punto de corte de > 40 mg FLC/g albúmina, se disminuye el número de falsos positivos (de 6 a 2), por lo que se mejora la especificidad (0,94). Sin embargo, se aumenta el número de falsos negativos disminuyendo la sensibilidad (0,86). Con base en estos resultados no se recomienda realizar la corrección por albúmina.
La determinación del número de CL ha sido propuesta como un método para evaluar MPF (21, 22). Sin embargo, el nivel de decisión para separar maduros de inmaduros aún no está bien definido y en la literatura se informan diferentes puntos de corte (21, 22, 28, 29). Por este motivo, fue necesario establecer un nivel de decisión para CL comparándolo con la presencia de FG y los valores de TDx-FLM. Con un nivel de decisión para madurez pulmonar de CL > 19000 partículas/ µL, se obtuvo una sensibilidad de 0,94 (un falso negativo; CL =l 9000; FG negativo) y una especificidad de 1,0 al compararlo con la determinación de FG por cromatografía (n =32). Mientras que al comparar con el TDx-FLM y emplear este nivel de corte, se observó concordancia en el 100 por ciento de los casos. Con base en los resultados anteriores, se utilizó un valor de CL > 19000 partículas/ µL como indicador de madurez pulmonar. Este nivel de decisión es cercano a las 26000 partículas/ µL propuesto por Dubin (28) y concuerda con el valor de 20000 encontrado por otros autores (29).
La comparación del FLC con el recuento de CL, en 92 líquidos mostró una buena correlación entre estos dos parámetros con una r de 0,850 (p < 0,001). Empleando los niveles de decisión indicados, se encontró discrepancia en 8 casos. Siete casos con CL >19000 partículas/ µL presentaron FLC inferiores a 7,0 mg/dL (falsos positivos) y un caso presentó un valor de FLC > 7,0 mg/dL pero CL < 19000 partículas/ µL. Este último (FLC = 10,0 mg/dL; CL = 13000 partículas/ µL) nació 48 horas después de la toma de muestra y no presentó SIR, lo que indica que el método errado al diagnosticar madurez pulmonar en este caso fue el recuento de CL. De los siete falsos positivos, seis corresponden a los casos que presentaron valores en el TDx-FLM superiores a 55 mg/g (cinco de los cuales no presentaron SIR al nacimiento). El sétimo caso presentó un recuento de CL de 24000 partículas/ µL y una absorbancia a 650 nm de 0,131, por lo que podría existir duda en cuanto a su madurez.
La comparación de los valores de FLC con la absorbancia de los líquidos amnióticos a 650 nm se realizó con un total de 98 muestras. En 24 de ellas no hubo concordancia. En seis casos los valores de FLC fueron superiores a 7,0 mg/dL mientras la absorbancia fue inferior a 0,150; todos estas muestras mostraron madurez por CL y TDx-FLM o presencia de FG. En 18 muestras la absorbancia fue superior a 0,150 y los valores de FLC inferiores a 7,0 mg/dL. Quince de estas muestras mostraban inmadurez pulmonar y 3 mostraban madurez por alguno de los otros parámetros (CL, fluorescencia polarizada o presencia de FG). Los resultados concuerdan con otras publicaciones en las que se señala que la absorbancia a 650 nm presenta el problema de muchos falsos negativos (2, 12).
Es importante señalar que ninguna de las determinaciones de MPF presentan una concordancia uniforme en sus predicciones. Por ejemplo, Dubin (28) encontró que únicamente 84 % de las muestras maduras por la relación L/E fueron maduras también por presencia de FG. En forma similar, sólo 72% de aquellas maduras por FG fueron maduras por el criterio de L/E. Esta falta de concordancia, aún entre los estándares de oro para estos análisis, demuestra la dificultad existente en la evaluación de MPF.
En este estudio se demostró que la prueba de FLC presenta un alto grado de concordancia con la presencia de FG y muy buen grado de concordancia con el TDx-FLM y el recuento de CL. Es una prueba de tamizaje excelente para la presencia de surfactante y MPF, ya que con el nivel de decisión de 7,0 mg/dL no se presentaron falsos negativos (madurez falsa). Sin embargo, no es una prueba diagnóstica para la presencia de enfermedad, porque se presentaron varios falsos positivos (inmaduro falso) al compararla con otras pruebas. En este punto, debe tenerse en cuenta la importancia relativa de resultados falsos positivos y falsos negativos. Ya que la amniocentesis frecuentemente se realiza debido al inicio prematuro de contracciones uterinas y la disponibilidad actual de terapia tocolítica eficaz y segura puede hacer un resultado maduro falso más significante que un resultado inmaduro falso. Bajo estas circunstancias, se puede querer subir el valor de corte y así disminuir el riesgo de falsos negativos, aun cuando se aumenten los falsos positivos. Sin embargo, los resultados indican que un valor de FLC > 7,0 mg/dL es un buen indicador de madurez pulmonar. Si se baja el nivel de decisión a 6,8 mg/g se podría mejorar la especificidad, pero se incremento el riesgo de falsos negativos. Sin embargo, se podría pensar en una zona intermedia entre 6,8 y 7,0 mg/dL.
En la mayoría de los casos la prueba de FLC elimina la necesidad de otras técnicas más costosas, laboriosas y que consumen mucho tiempo (a menudo tres horas o más) como la cromatografía en capa fina. Los resultados de FLC pueden estar disponibles en 30-40 minutos y podrían determinarse en todos los turnos del laboratorio, debido a la disponibilidad y facilidad de la determinación.
En resumen, el método propuesto provee una serie de ventajas sobre las otras metodologías para evaluar madurez pulmonar: poco volumen de muestra, rápido, relativamente económico y reactivos estables. Los estudios comparativos con las técnicas ya establecidas muestran una buena concordancia. Por todo esto, consideramos que la determinación de FLC en líquido amniótico es una alternativa adecuada para evaluar madurez pulmonar fetal, ya sea como única prueba o en combinación con otras técnicas.
Referencias
1. Herbert WNP, Chapman JFA, Schnoor MM: Role of the TDx FLM assay in fetal lung maturity. Am J Obstet Gynecol 1993;168:808-812. [ Links ]
2. Ashwood ER: Evaluating health and maturation of the unborn: The role of the clinical laboratory. Clin Chem 1992; 38 (8):1523-1529. [ Links ]
3. Gluck L, Kulovich MV, Borer RC, Brenner PH, Anderson GG, Spellacy WN: Diagnosis of the respiratory distress syndrome by amniocentesis. Am J Obstet Gynecol 1971; 109:440-445. [ Links ]
4. Estol P: Diagnóstico de maduración pulmonar. Salud perinatal. CLAP OPS/ OMS 1987; [ Links ]
5. Bhagwanani SG, Fahmy D, Turnbull AC: Prediction of neonatal respiratory distress by estimation of amniotic fluid lecithin. Lancet 1972;i:159-163. [ Links ]
6. Gluck L, Kulovich MV: Lecithin and sphingomyelin ratios in amniotic fiuids in normal and abnormal pregnancy. Am J Obstet Gynecol 1973; 115:539-546. [ Links ]
7. Gluck L, Kulovich MV, Borer MC, Keidel WN: The interpretation and significance of the lecithin/sphingomyelin ratio in amniotic fluid. Am J Obstet Gynecol 1974;120:142-155. [ Links ]
8. Kohl HH, Telander DH, Roberts EC, Elliot HC: Modified method for estimating the lecithin/sphingomyelin ratio in amniotic fluid. Clin Chem 1978;24:174-178. [ Links ]
9. Coch E, Meyer JS, Goldman G, Kessier G: A modified procedure for evaluation of the lecithin/sphingomyelin ratio in amniotic fluid. Clin Chem 1973; 19:967-971. [ Links ]
10. Blass KG, Thibert RJ, Draisey TF: Simple, rapid determination of lecithin/sphingomyelin ratio in amniotic fluid. Clin Chem 1973; 19:1394-1397. [ Links ]
11. Sarkozi L, Kovacs HN, Fox HA, Karenyi T: Modified method for estimating phosphatidyicholine: sphingomyelin ratio in amniotic fluid, and its use in assessment of fetal lung maturity. Clin Chem 1972; 18: 956-960. [ Links ]
12. Dubin SB: The laboratory assessment of fetal lung maturity. Am J Clin Pathol 1992; 97: 836-849. [ Links ]
13. Clements JA, Platzker ACG, Tierney DF, et al.: Assessment of the risk of the respiratory distress syndrome by a rapid test for surfactant in amniotic fluid. N Engl J Med 1972;286: 1077-1081. [ Links ]
14. Turner RJ, Read JA: Practical use and efficiency of amniotic fluid OD 650 as a predictor of fetal pulmonary maturity. Obstet Gynecol 1983; 61:551-555. [ Links ]
15. Shinitzky M, Goldfisher A, Bruk R: A new method for assessment of fetal lung maturity. Br J Obstet Gynecol 1976; 83: 833-844. [ Links ]
16. Hallman PR, Gross TL:Laboratory and clinical evaluation of a rapid slide aggiutination test for PG. Am J Obstet Gynecol 1985; 151: 1061-1066. [ Links ]
17. Coapman-Hankin R, Kiechle FL, Epstein E, Artiss JD, Zak B: Three methods compared for determining phosphatidylglicerol in amnioticfluid. Clin Chem 1985;31:1374-1376. [ Links ]
18. Haruld DA, Reed A: Interference by endogenous glycerol in enzymatic assay of PG in amniotic fluid. Clin Chem 1988;34:560-563. [ Links ]
19. Artiss J, et al.: Enzymatic colorimetric determination of PG in amnioticfluid. Clin Chem 1984; 30:534-537. [ Links ]
20. Mc Gowan WM, Artiss JD, Zak B: Enzymatic colorimetric of lecithin and sphingomyelin in aqueous solution. Clin Chem 1983;29:1513-1518. [ Links ]
21. Ashwood ER, Oldroyd RG, Palmer SE: Measuring the number of lamellar body particles in amniotic fluid. Obstet Gynecol 1990;75:289-292. [ Links ]
22. Bowie LJ, Shammo J, Dohnal JCe: Lamellar body density and the prediction of respiratory distress. Am J Clin Pathol 1991;95:781-786. [ Links ]
23. Schosinsky K, Jiménez M, Dimas O. Determinación enzimática de fosfolípidos que contienen colina en líquido amniótico. Rev Cost Cienc Med 1998; 19(1,2):16-23. [ Links ]
24. Pesce AJ, Kaplan LA: Amnioticfluid phospholipid, L/S ratio and PG. Methods in Clinical Chemistry, St. Louis, Mosby Company; 1987: [ Links ]
25. Statland BE, Sher G: Reliability of amniotic fluid surfactant measurements. Am J Clin Pathol 1985;83: 382-384. [ Links ]
26. Apple FS, Bilodeau L, Preese LM, Benson P: Clinical implementation of a rapid, automated, assay for assessing fetal lung maturity. J Reprod Med 1994; 39: 883-887. [ Links ]
27. Tanasijevic MJ, Winkelman JW, Wybenga DR, Richardson DK, Greene MF: Prediction of fetal lung maturity in infants of diabetic mothers using the FLM S/A and disaturated phosphatidylchonine tests. Am J Clin Pathol 1996; 105:17-22. [ Links ]
28. Dubin SB: Characterization of amniotic fluid lamellar bodies by resistive pulse counting: Relationship to measure of fetal lung maturity. Clin Chem 1989; 34:612-616. [ Links ]
29. Anceschi MM, Garnica P, Di Pirro G, Maranghi L, Cosmi V: Density of amniotic fluid lamellar bodies: a comparison with classical methods for the assessment of fetal lung maturity. Prenat Neonat Med 1996; 1:343-348. [ Links ]
1 Laboratorio Clínico Hospital Calderón Guardia
2 Departamento de Análisis Clínicos, Facultad de Microbiología, Universidad de Costa Rica.
* Correspondencia













