Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Costarricense de Ciencias Médicas
Print version ISSN 0253-2948
Rev. costarric. cienc. méd vol.19 n.1-2 San José Jun. 1998
Las vaginitis y las vaginosis bacterianas (VB) son infecciones muy frecuentes en la mujer. La primera se asocia con agentes específicos como Candida, Trichomonas y Chamydea. Sin embargo, hay una alta frecuencia de casos etiológicamente no definidos, que en el pasado fueron considerados como "vaginitis inespecíficas". Actualmente la mayoría de esos casos se definen como VB, un síndrome común y mal diagnosticado, cuya etiología es polimicrobiana asociada con un desequilibrio de la flora vaginal. Dos de los agentes más importantes, relacionados con VB son Gardnerella vaginalis y Mobiluncus spp. El primero fue descrito en 1953 como el agente responsable de las vaginitis inespecíficas; no obstante, su prevalencia similar en casos y controles y las inoculaciones en voluntarias no confirmaron su papel en las vaginitis. Hoy, los análisis cuantitativos de la población vaginal y el hallazgo de una citotoxina en este agente confirman su acción causal en las VB. Mobiluncus es una bacteria anaerobia, toxigénica relacionada con las VB y con otras patologías, como coriomnionitis, nacimientos a pretérmino, enfermedad inflamatoria pélvica post aborto y endometritis post cesarea. Este agente es de cultivo fastidioso; sin embargo, la tinción de Gram es el método diagnóstico más común para las VB.
Palabras clave
Gardnerella vaginalis, Mobiluncus. Spp. Vaginosis Bacteriana, Vaginitis.
Abstract
Vaginitis and bacterial vaginosis (BV) are the most frequent infections in women. The former is associated with specific agents, such as Candida, Trichomonas, and Chamydea.; nevertheless, there are a high frequency of cases without defined agent, that were considered in the past as "inespecific vaginitis". Actually the majority of those cases as defined BV, common and underdiagnosed syndrome, in which etiology are associated a poly-micorobial population from the altered vaginal flora. Two of the most important agents related with BV are Gardnerella vaginalis and Mobiluncus spp. The former was described in 1953 as the agent responsible of inespecific vaginitis; however, its prevalence in cases and controls was similar and inoculations in volunteers do not confirm its role in the vaginitis. Today, the quantitative analysis of bacterial populations, cytotoxin found in this agent confirms its role in the ethiology of BV. Mobiluncus is a toxigenic anaerobic agent related with VB and with other pathologist as choriomnionitis, preterm birth, post-abortal pelvic inflammatory disease and post-caesarean endometritis. This agent is anaerobic and fastidious; nevertheless, the Gram stein is the most common diagnosis tool for BV.
Key words
Gardnerella vaginalis, Mobiluncus. Spp. Bacterial vaginosis, vaginitis.
Introducción
De acuerdo con las observaciones del tercer simposio internacional sobre vaginitis/ vaginosis bacteriana (VB), se considera que esta última entidad constituye la infección más frecuente en mujeres fértiles. Se calcula que afecta a un 10% de la población general y un 30 % o más según grupos específicos de población (Citado en 1). Esta condición presenta un espectro clínico que usualmente suele pasar inadvertido para la paciente, o que ella misma, por considerarla trivial, no consulta con el médico ya que en la mayoría de los casos las únicas molestias suelen ser prurito y una secreción blanquecina mal oliente (2). Ese espectro clínico leve, unido al hecho de que la VB es una condición cuya notificación no es obligatoria, hace que se desconozca su frecuencia real en la comunidad y que exista una nebulosa de dudas en relación con esta condición, tal como ha sido señalado por el "CDC" (3). Estos hechos obligan a prestar más atención a esta patología, ignorada o tildada de falta de importancia para algunos. Y esta revisión en un afán por divulgar el conocimiento existente en relación con las VB y en especial su importancia en Costa Rica.
¿Vaginitis o vaginosis?
Las infecciones vaginales inicialmente se definieron como cuadros de vaginitis, clasificados según el agente etiológico involucrado. Los primeros agentes señalados fueron Candida y Trichomonas (4). La primera es la causa más frecuente de vaginitis y se extrapola que el 20% de las mujeres sufren al menos una infección por Candida durante su vida; además, usualmente es la causa en la que más piensan médicos y pacientes cuando se enfrentan con un cuadro cuya manifestación más relevante es la secreción vaginal (2). En tanto la frecuencia de tricomoniasis era menor del 5% (5). Sin embargo, estudiando ambas causas, quedaba una proporción importante de casos de etiología desconocida que fueron denominados "vaginitis inespecíficas" y cuya dilucidación ha sido motivo de numerosas investigaciones.
En la década de 1950 se identificó una bacteria que más tarde sería denominada Gardnerella. En aquella época se pensó que este nuevo agente sería responsable de esos cuadros de etiología inespecífica (6). No obstante, la evidencia epidemiológica posterior no apoyó esas suposiciones.
Posteriormente se describió el género Chlamydia, involucrado con este tipo de patología y que actualmente se considera el agente infeccioso más frecuente en humanos. Las clamidias se involucran en una amplia gama de cuadros relacionados con transmisión sexual, que incluyen el linfogranuloma venéreo, uretritis no gonocóccicas que pueden evolucionar hasta epididimitis e infecciones del tracto genitourinario, en las cuales se incluyen cervicitis, síndrome uretral agudo, piuria no bacteriana, endometritis y salpingitis; a parte de las infecciones oculares y pneumonías especialmente del recién nacido, en las cuales la contaminación de origen materno es obvia (7).
Los tres agentes mencionados (Candida, Trichomonas y Chlamydia) se relacionan con cuadros vaginales preponderantemente inflamatorios en los cuales hay secreción purulenta. No obstante, aún quedaba una proporción importante de casos etiológicamente no definidos y en los cuales la inflamación no siempre se presenta, por lo que en 1984 se definió la VB (4-5), como una nueva entidad en la cual el componente inflamatorio no era importante y en cuya etiología no se involucra a un determinado germen, sino más bien se define como una trama multicausal. Esta trama obedece a un desequilibrio ecológico de la flora vaginal, en la cual desaparecen los lactobacilus, encargados de mantener un pH ácido, y restrictivo a otras bacterias, y se establece una flora variada, integrada por agentes anaerobios, anaerobios facultativos y aerobios (8).
Gardnerella vaginalis:
Como se mencionó previamente, el descubrimiento en 1953 de la bacteria que más tarde sería clasificada como Gardnerella, fue anunciado como la respuesta etiológica a las vaginitis inespecíficas (6). Sin embargo, la evolución del conocimiento llevaría a menospreciar su papel en esta condición clínica, para reestablecerlos en la década de 1990, nuevamente como una bacteria con un potencial de virulencia, que la hace capaz de inducir cuadros clínicos importantes.
Las primeras descripciones de esta bacteria datan de 1953, cuando Leopold lo aisló de 58 (27%) mujeres con cervicitis y de dos hombres con uretritis inespecífica (6). Luego en 1955 Gardner y Dukes lo aislaron de 127 (92%) mujeres con vaginitis inespecíficas y la denominan Haemophilus vaginalis, por aislarse inicialmente sólo en agar sangre. La asociaron con los requerimientos nutricionales de Haemophilus (9), pero más tarde se descartó y la relacionaron con otros géneros de bacilos Gram positivos como: Corynebacterium, Butyribacterium e incluso Lactobacillus, para finalmente clasificarla en el nuevo género Gardnerella, con una sola especia G. vaginalis (10). Este género solo tiene relación filogénetica con Bifidobacterium, y constituye un grupo taxonómicamente bien definido (11).
Gardnerella vaginalis es un bacilo inmóvil, no encapsulado, puede presentar fimbrias y es corto con una longitud de 0,5 a 1,5 µm, lo que hace que aparezca como un coco-bacilo pleomórfico, que usualmente se tiñe como Gram negativo o Gram variable (12). Ultraestructuralmente su pared corresponde a la de un Gram positivo y la discrepancia en su carácter tintorial radica en el poco espesor de su capa de peptidoglican, que hace que se decolore fácilmente durante el proceso de la tinción de Gram y que por lo tanto aparece como Gram negativo (13). Es un organismo anaerobio facultativo y se aisla en agar sangre incubado en anaerobiosis o en una atmósfera de 5% de CO2, a 35°C por 48 horas, y se originan colonias translúcidas de 0,3 a 0,5 mm de diámetro, con hemólisis tipo beta. La hemólisis se presenta en agar sangre con eritrocitos de origen humano o de conejo, pero no de otros animales. Además, es catalasa y oxidasa negativo. Estas características aunadas al carácter tintorial de formas cocobacilares Gram negativas, permiten identificarla, y también puede confirmarse mediante el sistema API-20 (12).
También se han aislado, de secreciones vaginales, otras bacterias que por su similitud con ésta se han denominado agentes similares a Gardnerella o a Corynebacterium. Recientemente estos agentes fueron clasificados genéticamente como Actinomyces y difieren de Actinomyces pyogenes (14) por lo cual se propuso la nueva especie A. turicensis (11).
Gardnerella y su relación con vaginitis/vaginosis:
Tratando de probar la virulencia de G. vaginalis, Gardner y Dukes en 1955 (15-16) intentaron satisfacer los postulados de Kock inoculando la bacteria en vagina de 13 mujeres sanas, de las cuales sólo una desarrolló la infección, aunque el agente se aisló de 10 de las mujeres inoculadas. Sin embargo, dado que en los frotis vaginales de los casos de "vaginitis inespecífica" aparecía una flora bacteriana muy variada, Criswell y colaboradores en 1969 (15-16) recurrieron a inocular secreciones de mujeres con ese cuadro clínico en la vagina de 15 voluntarias sanas, de las cuales 10 desarrollaron el cuadro, por lo que se asumió que ese agente requería la presencia de otras bacterias para manifestarse clínicamente (15-16).
Aunque con esos estudios experimentales en humanos se ignoró la multicausalidad de las VB, se estableció la importancia de G. vaginalis. No obstante, esos datos y otros que mostraban una prevalencia de G. vaginalis similar en casos y testigos llevó a restarle importancia a ese agente; y considerarlo un habitante normal de flora vaginal (17). Sin embargo, empleando medios de aislamiento más sensibles que los utilizados por Gardner y Dukes se ha aislado G. vaginalis de un 98 a 100% de las mujeres con VB y de un 40 a 50% de las mujeres sanas, lo que sí muestra una diferencia estadísticamente significativa entre casos y testigos (18). Pero el hallazgo más importante en este sentido es la cuantificación de la bacteria, pues en la VB la población de G. vaginalis es de 1000 a un millón de veces mayor que la recuperada de pacientes normales (4,19).
También se ha descrito en esta bacteria la presencia de una toxina citolítica, capaz de lisar específicamente los eritrocitos de humanos, pero no los de otras especies (20). Esta toxina ha sido considerada una "proteína similar a una perforina" y que además de los eritrocitos, rompe las células epiteliales, lo cual podría explicar las alteraciones ultraestructurales observadas en las células guía, ya que aparecen prácticamente sin citoplasma, y se hace evidente su citoesqueleto. Se han detectado anticuerpos específicos tipo IgA contra esta toxina en el 60% de los lavados vaginales de pacientes con VB, lo que demuestra que induce una respuesta inmune específica local.
Por otra parte G. vaginalis ha sido relacionada con patología como endometritis, cistitis, amnionitis, septicemia neonatal y meningitis (20), hallazgos que aunados al descubrimiento de la toxina en esta bacteria y su alta capacidad para adherirse in vivo o in vitro a células epiteliales (21) respaldan la necesidad de considerar a G. vaginalis como una bacteria potencialmente patógena, que al formar parte del complejo bacteriano involucrado con la etiología de las VB, no debe menospreciarse.
Mobiluncus spp.
En 1913 Curtis aisló una bacteria anaerobia, curva y móvil a partir de las secreciones vaginales de una mujer con una endometritis post partum y también la detectó en secreciones de pacientes con leucorrea. Posiblemente esos fueron los primeros aislamientos de un agente que en 1984 sería identificado como Mobiluncus y que sería señalado como uno de los agentes involucrados con la etiología de las VB (22).
Mobiluncus, cuyo nombre deriva de los términos griegos: móvil y gancho -uncus-, es un género de bacterias curvas, anaerobias, de cultivo lento y altamente fastidioso. Tintorialmente se comporta como Gram variable, aunque usualmente se tiñe como Gram negativo; sin embargo, ultraestructuralmente su pared corresponde a Gram positivo (23). El género comprende dos especies bien definidas y morfológicamente diferentes: M. mulieris y M. curtisii. La primera mide de 1,9 a 6 µm (x 2,9 a 3µm) de largo, aparece curvada en media luna e incluso forma semicírculos e invariablemente se tiñe como Gram negativa y tiene de 1 a 8 flagelos con origen múltiple. M. curtisii debe su nombre al doctor Curtis, quien posiblemente fue el primero en aislarla en 1913. Esta bacteria mide de 0,8 a 3µm (x 1,5 a 1,7µm) de largo, puede teñirse como Gram positiva o Gram negativa, tiene de 1 a 6 flagelos que salen de una inserción común. En esta especie se describieron dos subespecies M. curtisii curtisii y M. curtisii holmesii, basadas en la movilidad diferente que exhibían en agar suave y en la capacidad de la última para utilizar los nitratos (4-5, 22-23). Sin embargo, su caracterización bioquímica y la secuencia de su ARN 16S no apoyan tal subdivisión (24) y por el contrario el género se señala como muy complejo fenotipícamente, lo que con frecuencia lleva a la descripción de especies atípicas (24-25), o bien a una heterogeneidad antigénica tal que amerita una nueva clasificación de las especies de este género (26).
Mobiluncus como agente infeccioso:
En la década de 1980 Mobiluncus pasó a ser el candidato etiológico más importante relacionado con las VB. Se le incriminó con un 50 a 70% de los casos, en cuyo diagnóstico se incluyó la presencia de células guía, en este caso recubiertas por bacterias curvas (27), como se muestra en la figura 1. Su potencial patogénico se refleja en la causalidad de abscesos umbilicales, en mamas (28-29), en cuero cabelludo de neonatos, en heridas quirúrgicas, en membranas corioalantoideas y en septicemias (30-31), además, se asocia con ruptura de membranas, parto prematuro y prematuridad (4).
El hallazgo de una toxina citotóxica, capaz de desprender monocapas celulares o inducir la pérdida de cilios en células cultivadas de oviducto (32 Taylor-Robinson) representa un mecanismo de virulencia importante para esta bacteria. Aunque la excreción de esta toxina parece ser leve, su efecto parece potenciarse por el hecho de que la bacteria coloniza el epitelio adhiriéndose a él posiblemente mediante su flagelo.
Aislamiento e identificación de mobilunicus:
El cultivo de esta bacteria se hace en agar sangre o en medios selectivos con antibióticos (22-23), también se ha descrito que el enriquecimiento en frío por 2 a 4 horas favorece su aislamiento (33). La muestra recomendada es el líquido obtenido del lavado vaginal realizado con solución salina estéril. En nuestra experiencia no hay diferencia significativa entre su aislamiento a partir del lavado o de un frotis vaginal; en ambos casos la muestra se inocula en platos de agar sangre tratando de realizar un rayado adecuado para aislar colonias, las placas se incuban en jarras tipo GasPak con sobre generador de anaerobiosis y con catalizador, por lo menos durante 10 días a 35°C. Al cabo de ese tiempo se examinan las placas en busca de colonias de menos de 1 mm de diámetro, translúcidas e incoloras, compuestas por bacilos curvos Gram negativos; para esta tinción de Gram se sustituye la contratinción de safranina por fucsina básica (34). Sin embargo, hay una infinidad de otros agentes, tanto cocoides como bacilares rectos, con morfología colonial similar a la descrita ; además, el tamaño de esas colonias es igual o menor que el diámetro de la aguja bacteriológica, por lo cual prácticamente toda la colonia se pierde en la tinción, eso significa que una vez identificada es difícil recuperarla nuevamente del plato para un subcultivo. Ante esa situación en nuestro laboratorio recurrimos a rayar cada colonia por estría en un nuevo plato de agar sangre e incubarla nuevamente por 10 días en anaerobiosis, de manera que la tinción de Gram la hacemos de esa segunda incubación, de la cual fácilmente se recupera la bacteria para un subcultivo (35). En la figura 2 se muestra un cultivo puro de M. mulieris. A partir de esas colonias es factible hacer una tinción de flagelos siguiendo el método descrito por Kodaka (36), para corroborar la morfología y el tipo de flagelos (Fig. 3).
Obviamente el cultivo no es la forma más práctica para diagnosticar Mobiluncus, pues la obtención de la bacteria en cultivo puro puede llevar hasta más de un mes (35). Se ha empleado también inmunofluorescencia con anticuerpos monoclonales o cromatografía de las secreciones tratando de identificar los productos metabólicos de la bacteria (37). Sin embargo, la identificación de bacterias curvas Gram negativas en la tinción de Gram realizada a un frotis vaginal es prueba suficiente para su identificación, pues en la flora vaginal no se ha descrito ningún otro agente bacteriano con esta morfología (37-42). En la figura 4 se muestra un frotis vaginal en el que predomina el morfotipo de Mobiluncus.
Conclusión
La etiología de las VB o bien de las otrora denominadas vaginitis inespecíficas ha variado conforme se han identificado nuevos agentes infecciosos involucrados con este tipo de patología. Sin embargo, el concepto más nuevo en este sentido es que la VB no es un cuadro debido a un determinado agente infeccioso, sino que por el contrario obedece a una multicausalidad simultánea, debido a un desequilibrio en la flora normal de la vagina (3-4).
El enfoque de la causalidad de las VB debe ser de tipo ecológico; una alteración del ecosistema vaginal puede llevar a la desaparición de los lactobacilos acidófilos y con ello a un cambio en el pH vaginal. En consecuencia, otras bacterias, que bien pueden ser parte de una flora propia de este nicho, pero que usualmente están en baja proporción, como es el caso de G. vaginalis, pueden multiplicarse y tornarse en flora preponderante (43). También otros agentes pueden llegar de otros sitios, por ejemplo por contaminación fecal, como podría ser el caso de muchos anaerobios e incluso de enterobacterias (44).
En todo caso, las VB se caracterizan por la presencia de una flora variada e independientemente del agente o agentes involucrados, debe prestársele atención a esta condición, pues si bien la sintomatología suele ser leve, los efectos secundarios en el parto y su producto son importantes (45-47).
Referencias
1. Parent D, Bossens M, Bayot D, Kirpatrick C, Graf F, Wilkinson FE, Kaise RR. Therapy of bacterial vaginitis using exogenously-applied lactobacilli acidophili and a low dose of estriol. Arzneim Forsch Drug Res 1996;46:68-73. [ Links ]
2. O´Dowd TC, Parker S, Kelly A. Women´s experiences of general practitioner management of their vaginal symptoms. Brit J Gen Pract 1996;46:415-418. [ Links ]
3. Center for Disease Control. Non-reported sexualy transmited diseases. Morbiod Mortal Weekly Rep 1989;8:61. [ Links ]
4. Spiegel, CA. Bacterial vaginosis. Clin Microbiol Rev 1991;4:485-502. [ Links ]
5. Spiegel CA. Vaginitis/vaginosis. Sexual Transm Dis 1989;9:525-533. [ Links ]
6. Leopold S. Heretofore undescriberd organism isolated from the genitourinary system. US. Armed Forces Med J 1953 ; 4 : 263-266 [ Links ]
7. Barnes RC. Laboratory diagnosis of human chlamidial infections. Clin Microbiol Rev 1989;2:119-136. [ Links ]
8. Rosenstein IJ, Morgan DJ, Sheehan M, Lamont RF, Taylor-Robinson D. Bacterial vaginosis in pregnancy: Distribution of bacterial species in different Gram-stein categories of the vaginal flora. J Med Microbiol 1996;45:120-126. [ Links ]
9. Gardner HL, Dukes CH. Haemophilus vaginalis vaginitis : a newly defined specific infection previously classified as ¨nonspecific¨vaginitis. Am J Obstet Gynecol 1955;69:962-976.
10. Greenwod JR, Pickett MJ. Transfer of Haemophilus vaginalis Gardner and Dukes to a new genus Gardnerella :G. vaginalis (Gardner and Dukes) comb. nov. Int J Syst Bacteriol 1980; 30:170-178. [ Links ]
11. Van Esbroeck M, Vandamme P, Falsen E, Vancanney T, Moore E, Pot B, Gavini F, Kersters K, Goossens H. Polyphasis approach to the classification and identificaion of Gardnerella vaginalis and unidentified Gardnerella vaginalis-like corinefroms present in bacterial vaginosis. Int J Syst Bacteriol 46;675-682. [ Links ]
12. Pivot P. Gardnerella, Streptobacillus, Spirillum and Calymmatobacterium. p. 483-487. IN :A Balows, Hausler WJ, Herrmann KL, Isenberg HD, Shadomy HJ. (ed.). Manual of Clinical Microbiology, 5th ed. American Society for Microbiology, Washington D. C. 1991. [ Links ]
13. Harper JJ, Davis GHG. Cell wall analysis of Gardnerella vaginalis (Haemophylus vaginalis). Int Syst Bacteriol 1982;32:48-50. [ Links ]
14. Würst J, Lucchini GM, Lüthy-Hottenstin J, Brum F, Altwegg M. Isolation of Gram-positive rods that resemble but are clearly disticnt from Actinomyces pyogenes from mixed wound infections. J Clin Microbiol 1993;31:1127-1135. [ Links ]
15. Eschenbach DA. History and review of bacterial vaginosis. Amer J Obstet Gynecol 1993;169:441-445. [ Links ]
16. Ledger WJ. Historical review of the treatment of bacterial vaginosis. AM J Obstet Gynecol 1993;169:474-478. [ Links ]
17. McCormack WM, Hayes CM, Rosner B. et al. Vaginal coloniztion with Corynebacterium vaginalis (Haemophilus vaginalis). J Infect Dis 1977;136:740-745. [ Links ]
18. Totten PA, Amsel R, Hale J, et al. Selective differential human bilayer media for isolation of Gardnerella (Haemophilus) vaginalis. J Clin Microbiol 1982;15:141-147. [ Links ]
19. Blackwell AL, Fox AR, Phillips I, et al. Anaerobic vaginosis (non specific): clinical, microbiological and therapaeutic findings. Lancet 1983;2:1379-1382. [ Links ]
20. Rottini G, Dobrina A, Fargiarini O, Nardon E, Amirante GA, Patriarca P. Identification and partial characterization of a cytolitic toxin produced by Gardnerella vaginalis. Infect Immun 1990;58:3751-3758. [ Links ]
21. Lefevre JC. Donneés bacteriolgiques récentes: de la physiopathologie au traitement. Rev Fr Gynécol Obstét 1993;88:207-10. [ Links ]
22. Spiegel C A. The genus Mobiluncus. In: Prolaryotes, 2nd. Ed. Balow A, Trüer HG, Dworkin M, Harder W, Scheeifer KH. (eds). Springer Verlag, NY. 1992. p 906-917. [ Links ]
23. Spiegel, C. A. & Roberts, M. Mobiluncus gen. nov., Mobiluncus curtisii subsp. curtisii sp. nov., Mobiluncus curtisii subsp. holmesii subsp. nov., and Mobiluncus mulieris sp. nov., curved rods from the human vagina. Int Syst Bacteriol 1984; 34: 177-184. [ Links ]
24. Tiveljung A, -forsum U, Montein HJ. Classification of the genus Mobiluncus based on comparative partial 16S rRNA gene analysis. Int J Syst Bacteriol 1996;46:332-336. [ Links ]
25. Schewebke JR, Lukehart SA, Roberts C, Hiller SL. Identification of two new antigenic subgroups within the genus Mobiluncus. J Clin Microbiol 1991;29:2204-8. [ Links ]
26. Schewebke JR, Hiller SL, Fohn MJ, Lukehart SA. Demostration of herergeneity among the antigenic proteins of Mobiluncus species. J Clin Microbiol 1990;28:463-8. [ Links ]
27. DeBoer, JM, Plantema FHF. Ultrastructure of the in situ adherence of Mobiluncus to vaginal epithelial cells. Can J Microbiol 1988;34:757-766. [ Links ]
28. Sturm AW, Sikkenk PJH. Anaerobic curved rods in breast abscess. Lancet 1984;2:1216. [ Links ]
29. Bennett KW, Winstanley TG, Taylor AKM, Shorhouse AJ. Anaerobid curve rods in breast abscess and vagina. Lancet 1989;1:564. [ Links ]
30. Eschenback DA. Bacterial vaginosis and anaerobes in obstetric-gynecologic infection. Clin Infect Dis 1993;16 (Suppl 4):S282-7. [ Links ]
31. Mayer J, Hegewald S, Sartor VE, Carroll K. Extragenital infection due to a Mobiluncus mulieris. Case report and review. Diag Microbiol Infect Dis 1994;20:164-165. [ Links ]
32. Taylor-Robinson AW, Borriello SP, Taylor-Robinson D. Identification and preliminary characterization of a cytotoxin isolated from Mobiluncus spp. Int J Exp Path 1993;74:357-66. [ Links ]
33. Smith HJ, Moore HB. Isolation of Mobiluncus species from clinical specimens by using cold enrichment and selective media. J. Clin. Microbiol 1988; 26: 1134-37 [ Links ]
34. Moraga, M. & Hernández, F. Prevalencia de vaginosis bacteriana en prostitutas, San José, Costa Rica. Rev Cost Cienc Méd. 1997. En prensa. [ Links ]
35. Hernández F, Rodríguez E, Gamboa MM, Coto E, Acuña MA. Ultrastructural view of the bacterium Mobiluncus mulieris: An approach to understand some problems for its isolation. Rev Biol Trop 1994;42:101-104. [ Links ]
36. Kodaka HA, Armfield AY, Lombard GL, Dowell VR. Practical procedure for demonstrating bacterial flagella. J Clin Microbiol 1982;16:948-952. [ Links ]
37. Fohn MJ, Lukehart SA, Hillier SL. Production and characterization of monoclonal antibodies to Mobiluncus species. J Clin Microbiol 1988;26:2598-2603. [ Links ]
38. Nugent RP, Krohn MA, Hillier SL. Reliability of diagnosing bacterial vaginosis in improved by a standardized method of Gram stain interpretation. J Clin Microbiol 1991;29:297-301. [ Links ]
39. Cook RL, Redondo-López V, Schmitt C, Meriwether C, Sobel J. Clinical, microbiological, and biochemical factors in recurrent bacterial vaginosis. J Clin Microbiol 1992;30:870-7. [ Links ]
40. Joesoef MR, Hillier SL, Josodiwondo S, Linnan M. Reproducibility of a scoring system for Gram stain diagnosis of bacterial vaginosis. J Clin Microbiol 1991;29:1730-31. [ Links ]
41. Morgan DJ, About CJ, McCaffrey IM, Bhide SA, Lamont RF, Taylor-Robinson D. Comaparison of Gram-stained smears prepared form blind vaginal swabs with those obtained at speculum examination for the assesment of vaginal flora. Brit J Obstet Gynaecol 1996;103:1105-08 [ Links ]
42. Schwebke JR, Hiller SL, Sobel JD, McGregor JA, Sweet RL. Validity of the vaginal Gram stain for the diagnosis of bacterial vaginosis. Obstet Gynecol 1996;88: 573-6. [ Links ]
43. Priestley CJF, Jones BM, Dhar J, Goodwin L. What is normal vaginal flora ? Genitourin Med 1997;73:23-8. [ Links ]
44. Krohn MA, Thwin SS, Rbe LK, Brown Z, Hillier SL. Vaginal colonization by Escherichia coli arisk factor for very low birth weght delivery and other perinatal complications. J Infect Dis 1997; 175:606-10. [ Links ]
45. Hillier SL, Martius J, Krohn M, Kiviat N, Holmes K K, Eschenbach DA. A case control study of choroammioninic infection and histologic chorioamnionitis in pregnancy. N Engl J Med 1988;319:972-8. [ Links ]
46. Hillier SL, Kivia NB, Hawes S, Hasselquist MB, Hanssen PW, Eschenbach DA, Holmes KK. Role of bacterial vaginosis associated microorganisms in endometritis. Am J Obstet Gynecol 1996;175:435-41 [ Links ]
47. Larsson PG, Bergman B, Forsum U, Pahlson C. Treatment of bacterial vaginosis in women with vaginal bleeding complications or discharge and harboring Mobiluncus. Gynecol Obstet Invest 1990;29:296-300. [ Links ]
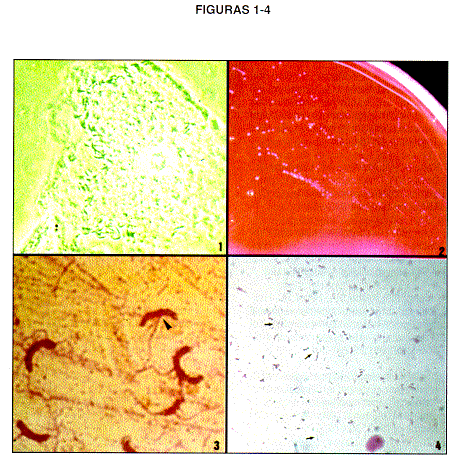
Figura 1. Micrografía de contraste de fases de una célula guía una paciente con vaginosis bacteriana. Se observa los bacilos curvos, especialmente en el borde izquierdo de la célula.
Figura 2. Micrografía de una placa de agar sangre con un cultivo de Mobiluncus mulieris de 10 días de incubación en anaerobiosis.
Figura 3. Micrografía de luz, de una tinción de flagelos(tinción de Kodaka, referencia 36) de Mobiluncus muliers, se observan bacilos curvos, algunos prácticamente en forma de " media luna". La punta de flecha muestra la inserción de los flagelos.
Figura 4. Micrografía de luz de un frotis vaginal de una paciente con vaginosis bacteriana, tinción de Gram. Las flechas señalan grupos de bacterias, Gram negativas.













