Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Costarricense de Ciencias Médicas
Print version ISSN 0253-2948
Rev. costarric. cienc. méd vol.18 n.1 San José Jul. 1997
Resumen
Se evaluó un método enzimático colorimétrico para la cuantificación de colesterol sérico, basado en la reacción de Trinder. La técnica consiste en mezclar 2,0 mL de reactivo de trabajo previamente preparado, con 20 µ L de suero. La absorbancia es leída a 500 nm contra blanco de reactivos después de 15 minutos de incubación a 37º C. El intervalo analítico es de 25 a 600mg/dL.
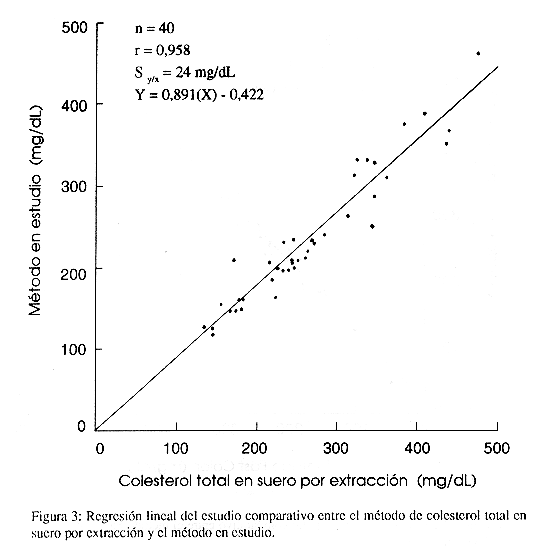
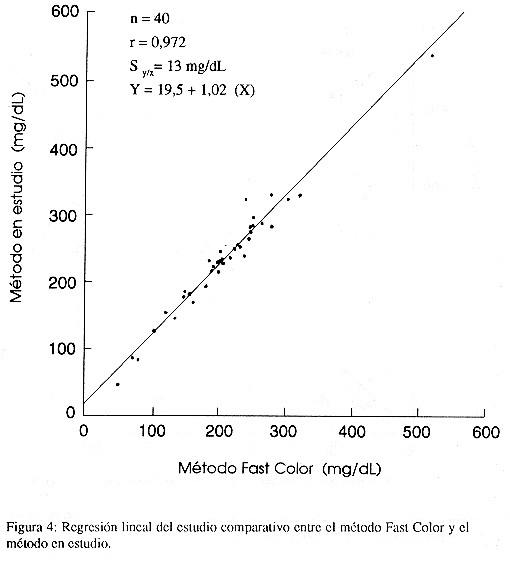
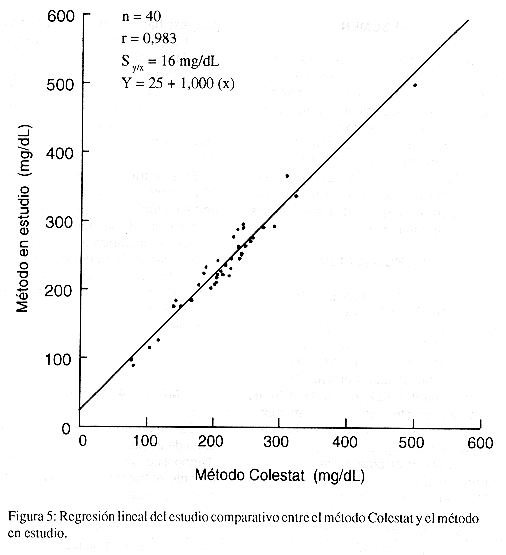
La comparación de los resultados con el método de colesterol total en suero por extracción dio una regresión lineal de Y = -0,4223 + 0,8907(X), con un coeficiente de correlación (r) de 0,958 y una desviación estándar sobre la línea de regresión (Sy/x) de 24 mg/dL. Con el método Colesterol Fast Color se obtuvo una regresión lineal de Y = 19,5 + 1,02 (X), un coeficiente de correlación (r) de 0,972 y una desviación estándar sobre la línea de regresión de 13 mg/dL. Con el método Colestat la regresión lineal fue de Y = 25 + 1,000 (X) con un coeficiente de correlación (r) de 0,983 y una desviación estándar sobre la línea de regresión lineal de 16 µg/dL.
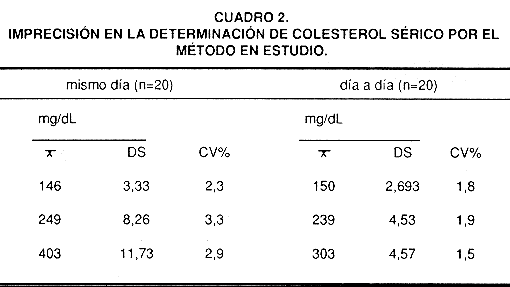
Las precisiones día a día para muestras con valores de colesterol bajos, normales y altos mostraron coeficientes de variación de 1,8; 1,9 y 1,5 por ciento y en un mismo día de 2,3; 3,3 y 2,4 por ciento respectivamente.
La hemoglobina y el ácido acetilsalicílico en concentraciones de 50 mg/dL no bilirrubina produce una interferencia de 0,42 por ciento.
El reactivo de trabajo almacenado en botella ámbar es estable por al menos 3 semanas a 2- 8º C. El reactivo es estable por lo menos un año si la solución concentrada de enzimas se almacena en congelación a –70º o en forma liofilizada, y por al menos dos meses a + 4º C.
Las concentraciones óptimas incluyen 1,5 mmol/L de 4-aminofenazona, 0,5 g/L de Triton X-100, 3 mmol/L de colato de sodio, 16 m mol/L de fenol, 1000 U/L de peroxidasa, 250 U/L de colesterol oxidasa y 500 U/L de colesterol esterasa. (Rev. Cost. Cienc. Med. 1997, 18-1: 30-43)
Palabras clave
Key word index: serum cholesterol, serum lipids, coronary artery disease.
El colesterol es un esterol encontrado en todos los tejidos animales. Participa en funciones fisiológicas muy importantes como lo son la síntesis de ácidos biliares, de hormonas esteroideas y de membranas celulares. En la sangre se transporta ligado a lipoproteíans, las LDL (lipoproteínas de baja densidad) que lo transportan hacia los tejidos y las HDL (lipoproteínas de alta densidad) que lo transportan de los tejidos hacia el hígado. El colesterol sérico se asocia con aterosclerosis y riesgo aumentado de enfermedad cardiovascular. Se consideran los valores entre 200 mg-dl y 240 mg/dl como valores de alto riesgo para población adulta (1). Su cuantificación en suero es uno de los procedimientos analíticos más comunes en el laboratorio clínico (2).
Allain et al. (3) describieron en 1974, un método enzimático basado en:
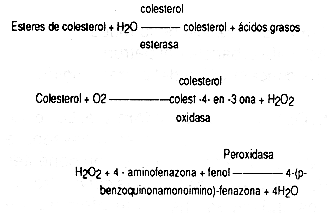
La mayoría de estos métodos vienen ya listos para usar, en juegos de reactivos suplidos por casas comerciales y cuya técnica no es presentada en detalle.
Estas técnicas han desplazado, en la rutina, a la clásica reacción de Liebermann-Burchard, que es la más usada dentro de las reacciones no enzimáticas para la cuantificación de colesterol (7). Estos métodos son afectados por muchos factores, entre ellos la concentración de cada uno de los reactivos, el solvente empleado al hacer la extracción de colesterol, la cantidad de agua en la mezcla final de reacción y la temperatura. Por lo tanto las condiciones de reacción deben ser estrictamente controladas (7).
El objetivo de este estudio es evaluar un método enzimático para la cuantificación de colesterol sérico, que sea barato y sencillo de utilizar en los laboratorios nacionales. Tal método puede adoptarse como procedimiento estándar para evaluar reactivos comerciales de fundamento semejante que ingresan al mercado costarricense. Ello favorecerá la estandarización de metodologías y la comparabilidad interlaboratorio de los resultados de colesterol.
Para esto se procedió a estudiar el efecto de diferentes reactivos reportados en la literatura y en instructivos de casas comerciales, sobre el método de colesterol enzimático basado en la reacción de Trinder.
Materiales y métodos
A. Equipo
Las lecturas espectrofotométricas se realizaron en un espectrofotómetro Shimatzu modelo UV-160 de doble haz.
B. Reactivos
Todos los reactivos utilizados fueron obtenidos de Sigma Chemical Co, St. Louis MO.
Solución amortiguadora de fosfatos 100 mmoI/L, pH 7,0.
Solución concentrada de enzimas. Reactivo único que contiene colesterol esterasa de Pseudomonas fluorescens (28 000 U/L, Sigma C-9281), colesterol oxidasa de Pseudomonas fluorescens (14 000 U/L, Sigma C-7149) y peroxidasa de rábano (56 000 U/L, Sigma P8125) disueltas en amortiguador de fosfatos 100 mmol/L pH 7,0 conteniendo 15 mmol/L de fenol como preservante. Esta solución es estable por al menos dos meses en refrigeración y por al menos un año en forma liofilizada.
Solución de hexacianoferrato de potasio II 6000 m mol/L.
Reactivo de 4-aminofenazona. En un frasco volumétrico de 1 litro disolver 1,378 g de colato de sodio, 0,325 g de 4- aminofenazona, 0,5 g de Triton X-100 (isooctifenolpolietoxietanol) y 2,67 mL de hexacianoferrato de potasio II 6000 m mol/L, en amortiguador de fosfatos 100 mmol/LpH7,0. Aforar a 1000 mL con amortiguador de fosfatos 100 mmol/L pH 7,0 y mezclar. Esta solución es estable por al menos un año a 2-8º C.
Solución concentrada de fenol 330 mmol/L.
Reactivo de trabajo. Para 1 litro de mezcla de reacción, el reactivo de trabajo se prepara mezclando 937,5 mL de reactivo de 4-aminofenazona, 44,6mL de solución concentrada de fenol 330 mmol/ K t 18 mL de la solución concentrada de enzimas. Estas cantidades se pueden variar de acuerdo al número de muestras por analizar. Este reactivo es estable en refrigeración y almacenado en botella ámbar por al menos 3 semanas.
Solución patrón de colesterol 200 mg/dL. Disolver 200 mg de coelsterol (Standard Reference Material, U.S. Department of Commerce National Bureau of Standards, Washington, D.C.) en 50 mL de isopropanol. Aforar a 100 mL con isopropanol y mezclar. Este reactivo se mantiene estable a 25º C por al menos 2 años, si se almacena en botella ámbar con tapa de rosca que contenga sello de hule.
C. Procedimiento
1. Preincubar a 37º C 2,0 mL de reactivo de trabajo
2. Añadir 20 µL de suero o patrón
3. Incubar 15 minutos a 37º C
4. Medir la absorbancia a 500 nm contra blanco de reactivos
D. Cálculos
Colesterol total (mg/dL) = Am x P
Ap
Am= absorbancia de la muestra
Ap = absorbancia del patrón
P = concentración del patrón (mg/dL)
E. Optimización de la fórmula. Los estudios de optimización fueron llevados a cabo para cada uno de los componentes del reactivo de trabajo a las concentraciones indicadas: hexacianoferrato de potasio II (0, 4, 8, 16 y 24 umol/L), 4-aminofenazona (0,5 a 3,0 mmol/L), colato de sodio (0, 5,10, 15, 20 y 30 mmol/L), triton X-100 (0,5 a 3,0 g/L), fenol (5 a 60 mmol/L), colesterol esterasa (0, 25, 50, 200, 400 y 700 U/L). Para todas las pruebas se utilizó una mezcla de sueros humanos con aproximadamente 500 mg/dL de colesterol.
F. Estabilidad a 4º C del reactivo de trabajo: Durante cinco días consecutivos se reconstituyeron 5 viales del reactivo de trabajo listo para usar, uno cada día. Se almacenaron a 4º C. El quinto día se analizaron conjuntamente los cinco viales. Seguidamente, los viales se almacenaron nuevamente a 4º C y se analizaron de igual forna a los ocho y quince días posteriores.
G. Estabilidad de la solución concentrada de enzimas. Se almacenó a 4º C, en congelación a –70º C y también se preparó en forma liofilizad.a Utilizando un ¨pool¨de sueros humanos, se evaluó la estabilidad día promedio durante un mes y luego una vez almes durante un año.
H. Efecto de componentes séricos: Se evaluó el posible efecto interferente de la bilirrubina, de la hemoglobina, del ácido acetilsalicílico y del ácido ascórbico hasta concentraciones de 20, 500, 50 y 10 mg/dL respectivamente. Para ello se prepararon soluciones concentradas de cada componente en una mezcla de sueros. Luego se mezclaron volúmenes adecuados de estas soluciones concentradas con suero basal, para obtener las concentraciones deseadas.
I. Linearidad: Se analizó el colesterol a patrones de una curva de calibración de 100, 200, 300, 400, 500 y 600 mg/dL.
J. Precisión: Se analizaron muestras de suero con 146, 249 y 403 mg/dL en un mismo día veinte veces consecutivas y durante veinte días diferentes para obtener la desviación estándar (DS) y el coeficiente de variación (CV) en un mismo día, y día a día.
K. Estudios comparativos: Se efectuó el estudio comparativo entre un método de referencia para colesterol total en suero por extracción (9) y el método en estudio. Se analizaron durante 5 días 40 muestras de suero humano con valores de colesterol de 136 a 482 mg/dL aproximadamente. Para el estudio comparativo entre el método Colesterol Fast Color (8) y el método en estudio, se analizaron 40 muestras de suero humano con valores de colesterol entre 50 y 521 mg/dL aproximadamente. Para el estudio comparativo entre el método Colestat (10) y el método en estudio se analizaron 40muestras de suero humano con valores de colesterol entre 76 y 323 mg/dL aproximadamente. En cada caso se calculó el coeficiente de correlación (r), el error estándar del estimado (Sy/x) y la línea de mejor ajuste (y=a+bx).
Optimización de la fórmula
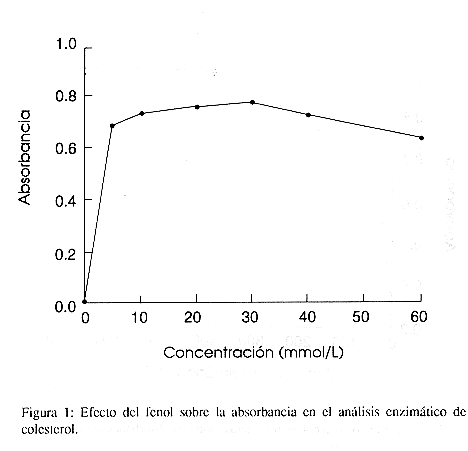
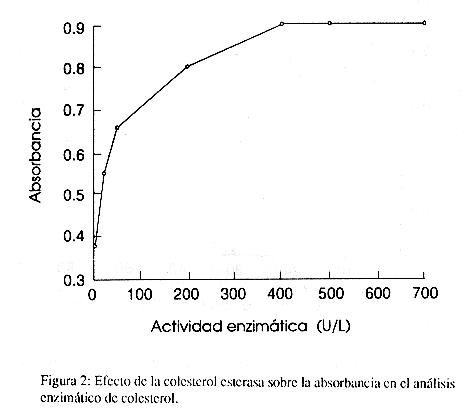
Los siguientes componentes a las concentraciones indicadas produjeron estabilidad en la absorbancia: 4-aminofenazona (0,5-3, 0mmol/L), tritón X-100 (0.5-3,0 g/L), colato de sodio (1-20 mmol/L), mientras la hexacianoferrato de potasio II produce un aumento en la absorbancia conforme aumenta la concentración. El fenol produjo una absorbancia máxima a 30 mmol/l (fig.1) y la colesterol esterasa mostró una absorbancia estable a partir de 400 U/L (fig. 2).
La estabilidad de la solución concentrada de enzimas y del reactivo de trabajo es mayor con amortiguador de fosfatos. Con Tris-HCI la reacción es aproximadamente 1,6 veces más sensible. El tiempo para lograr la estabilidad del producto coloreado es dos veces mayor con Tris-HCI que con amortiguador de fosfatos.
La fórmula final optimizada contiene colesterol esterasa (500 U/L), colesterol oxidasa (250 U/L), peroxidasa (1000 U/L), colato de sodio (3,0 mmol/L), hexacianoferrato de potasio II (16 umol/LL), 4-aminofenazona (1,5 mmol/L), tritón X-100 (0,5 g/L), y fenol (15 mmol/L).
Espectro de absorción: El espectro de absorción de la solución patrón y las muestras de suero, presenta un pico único de absorción a 500 nm.
Linealidad: El método presenta linealidad hasta 600 mg de colesterol por 100 mL de suero.
Efecto de los componentes séricos: Los valores de colesterol sérico observados al agregar cantidades crecientes de ácido acetilsalicílico, bilirrubina, hemoglobina y ácido ascórbico a una mezcla de sueros, se muestran en el cuadro 1.
Imprecisión: En el cuadro 2 se presentan los resultados del análisis de imprecisión en un mismo día y día a día, para sueros conteniendo aproximadamente 146, 245 y 403 mg/dL de colesterol.
Estudios comparativos: Los resultados del estudio comparativo entre el método en estudio y el método de colesterol total en suero por extracción se muestran en la Figura 3. Las Figuras 4 y 5 muestran los resultados de los estudios comparativos entre el método en estudio y los métodos Colesterol Fast Color y Colestar respectivamente.
La sensibilidad, la precisión y la simplicidad de las determinaciones enzimáticas de colesterol hacen de estas una excelente alternativa para los análisis de rutina en los laboratorios clínicos (11, 12). Además se adaptan fáxilmente a sistemas automatizados.
Según Deacon y Dawson (13), la máxima respuesta se produce cuando la concentración de 4-AF es igual a la de peróxido de hidrógeno generado a partir del colesteorl, en presencia de un exceso de fenol. Ellos utilizan 7,5 mmol/L de fenol y 0,5 mmol/L de 4-AF no produjo cambios en la reacción en un intervalo de 0,5 a 3,0 mmol/L y se eligió arbitrariamente una concentración de 1,5 mmol/L.
En cuanto al fenol, se determinó que la absorbancia final de la reacción aumenta conforme se eleva la concentración de éste hasta un máximo de 30 mmol/L. De 3 a 5 mmol/L el aumento en la sensibilidad es leve. Posteriormente, más bien tiene el efecto contrario (figura 1). Se escogió 15 mmol/L como la concentración adecuada, ya que favorece la velocidad de la reacción pero no es tan concentrado como para oxidar el reactivo de trabajo causando que disminuya su estabilidad.
El colato de sodio es requerido por la colesterol esterasa para hidrolizar los ésteres de colesterol (3), En el método en estudio, se encontró que entre 1 y 20 mmol/L disminuyen la absorbancia. Se eligió utilizar 3 mmol/L de este en la mezcla de reacción. Contrariamente, Allain et al (3) reportan que después de 5 mmol/L ya se da disminución en la sensibilidad y Deacon y Dawson (14) describen que la concentración óptima de colato depende de la concentración de Tritón X-100. Ellos establecen que la concentración óptima de colato es de 6 mmol/L y la de tritón X-100 es de 15 g/L. Sin embargo, esta concentración de tritón X-100 es sumamente alta si se compara con 0,5 g/L que fue la concentración elegida en el método en estudio. Se demostró que éste tiene el mismo efecto en la reacción, en un intervalo de 0,5 a 3,0 g/L. Cooper et al (14) y la casa Boehringer Mannheim GmbH Diagnóstica (15) reportan 3,0 g/L y Allain et al (3) no utilizan este reactivo.
Al evaluar el efecto de diferentes concentraciones de colesterol esterasa, se obtuvo la máxima absorbancia con concentraciones ³ 400 U/L (figura 2). Se eligió 500 U/L como la concentración óptima para asegurar que se produce una reacción de orden cero. Por otra parte, Deacon y Dawson (10) obtienen que los valores óptimos son de 160 U/L y la mayoría de las casas comerciales establecen concentraciones ³ 400 U/L.
Cooper et al (16) y Wiebe et al (17) proponen que las esterasas pueden ser una de las causas de las variaciones entre los resultados obtenidos por métodos enzimáticos y los obtenidos por métodos de referencia. Se reportan variaciones entre 4 y 6% del contenido total de colesterol (17).
Porntip et al (18), hacen un estudio comparativo de reactivos enzimáticos para cuantificación de colesterol total, en los que se usa colesterol oxidasa aislada de Nocardia, Streptomyces y Pseudomonas. Ellos reportan que la linealidad es más baja y el tiempo de reacciónes mayor, usando reactivo preparado con colesterol oxidasa de Pseudomonas con respecto a aquellos que provienen de Nocardia o Streptomyces. Además, el costo de la enzima obtenida de Nocardia es mayor, seguida de la de Pseudomonas y de último la de Streptomyces. La precisión y la correlación nos e ven afectadas por el tipo de enzima. Ellos concluyen que la colesterol oxidasa de Streptomyces es la más recomendada.
El tiempo de estabilización de la reacción aumenta conforme se incrementa la concentración de colesterol de la muestra. Para abarcar el intervalo de linealidad del método, se recomienda incubar la mezcla de reacción 30 minutos a 25º C ó 15 minutos a 37º C. Estos tiempos son los mismos que utiliza el método Colestat; sin embargo el método Colesterol Fast Color utiliza sólo 15 minutos a 25º C y 5 minutos a 37º C.
Pesce y Bodourian (19) reportan una interferencia negativa de la bilirrubina si las lecturas se llevan a cabo contra blanco de muestra. Esto se debe a que la bilirrubina en suero absorbe a 500 nm y contribuye a la absorbancia del suero antes de que la reacción haya empezado. Al final de esta, la bilirrubina ha sido consumida y la absorbancia a 500 nm es debida solamente al suero y al cromógeno. En el método en estudio se obtuvo el mismo efecto. Cada mg/dL de bilirrubina produce una interferencia de 0,42% leído contra blanco de reactivos, y de –1,15% si se lee contra blanco de muestra (Cuadro 1). Es decir, si una muestra contiene 200 mg/dL de colesterol y 5 mg/dL de bilirrubina, el colesterol de la muestra aumentará 4,2 mg/dL. El ácido acetilsalicílico no produce interferencia hasta 50 mg/dL. Nägele et al (20) utilizan el hexacianoferrato de potasio II para minimizar la interferencia por bilirrubina. El ácido ascórbico interfiere equimolecularmente disminuyendo los valores de colesterol total. Cada mg/dL de hemoglobina produce una interferencia de 0,05 por ciento (Cuadro 1).
El método en estudio no se comparó con el método de Abell y Kendall, sino con el método de colesterol total en suero por extracción (7), que correlaciona muy bien con el método de referencia.
Además, se comparó con dos métodos enzimáticos comerciales muy utilizados en rutina en los laboratorios clínicos.
Se obtuvo que la ecuación de regresión lineal para el estudio comparativo con el método de colesterol total en suero por extracción es Y= 0,8907 (X) – 0,4223, r= 0,958 y Syx = 24 mg/dL (Figura 3). De acuerdo con esta ecuación, se observa un error constante de 0,4223 mg/dL y un error proporcional de 11%, lo cual indica que los valores obtenidos por el método en estudio son menores a los obtenidos por el método de referencia. La desviación estándar sobre la línea de regresión lineal Syx = 24 mg/dL, indica que el 95% de los datos se encontraron a ± 48mg/dL alrededor de ésta línea. Por otra parte, para el estudio comparativo con el método Colesterol Fast Color, se obtuvo que Y = 19,5 + 1,02 (X), r = 0,972 y Syx= 13 mg/dL (Figura 4) y con el método Colestat se obtuvo Y = 25 + 1,000 (X), r= 0,983 y S = 16 mg/dL (Figura 5). Estos datos indican que los valores obtenidos por el método en estudio son mayores a los obtenidos por ambos métodos comerciales; sin embargo, son menores a los obtenidos por el método de colesterol total en suero por extracción. Por lo tanto, aún cuando los métodos enzimáticos tienden a presentar resultados menores que los métodos por extracción, en el presente estudio el método evaluado presentó valores mayores a métodos comerciales con el mismo fundamento. Si se usara como parámetro para evaluar métodos comerciales se disminuirían los falsos negativos en las poblaciones de pacientes.
El Programa nacional de Educación en Colesterol de los Estados Unidos (21) estableció en 1987 que la imprecisión es aceptable si el coeficiente de variación es menor o igual a 5%. Este valor debía ser reducido en un 0,5% anual hasta un 3% en 1992. El método propuesto presenta una precisión adecuada, con coeficientes de variación no mayores de 3,3 por ciento para concentraciones de colesterol total de 150 a 403 mg/dL (Cuadro 2).
En conclusión, el método evaluado presenta un desempeño analítico adecuado y bajo costo. Por lo tanto se recomienda para ser usado en un Programa de Aseguramiento de la Calidad. Además su utilización evitará el conflicto de elegir un método comercial para evaluar los reactivos disponibles en el mercado.
A colorimetric method based on the Trinder reaction for use in enzymatic determination of serum cholesterol is evaluated. Two mL of working reagent, previously prepared, is mixed with 20 µK if serum and the absorbance is read against blank reagent at 500nm, after 15 minutes of incubation al 37º C. The analytical range is 25 to 600 mg/dL.
Comparisons of results with total serum cholesterol by extraction gave a linear regression of Y= -0.4223 + 0.8907 (X), with a correlation coefficient (r) of 0.958 and a standard error (Sy/x) of 24 mg/dL. Comparisons with results by Colesterol Fast Color gave a linear regression of Y= 19.5 + 1.02 (X), a correlation coefficient (r) of 0.972 and a standard error (Sy/x) of 13 mg/dL and comparisons with results by Colestat gave a linear regression of Y = 19.5 + 1.02(X), a correlation coefficient (r) of 0.972 and standard error (Sy/x) of 13 mg/dL.
Hemoglobin and acetylsalicylic acid do not interfere up to 50 mg/dL. L-ascorbic acid interferes equimolecularly and one mg/dL of bilirrubin causes and interference of 0.42 percent.
The working reagent, stored in an amber-colored bottle, is stable for at least 3 weeks at 2-8º C. The reagent is stable for at least one year if the concentrated enzime solution is stored lyophilized or at –70º C, and ofr at least twomonths al +4º C.
The optimun reagent concentration includes 4-aminophenazone 1,5 mmol/L, Triton X-100 0.5 g/L, sodium cholate 3,0 mmol/L potassium ferrocyanide 16 µmol/L, phenol 15 mmol/L, peeroxidase 1000 U/L, cholesterol oxidase 250 U/L and cholesterol ester hydrolase 500 U/L.
1. Panel de Expertos sobre detección, evaluación y tratamiento de la hipercolesterolemia en adultos. Resumen del segundo informe del Panel de Expertos sobre detección, evaluación y tratamiento de la hipercolesterolemia en adultos del Programa Nacional de Educación sobre Colesterol (NCEP) (Panel II sobre tratamiento en adultos). JAMA 1993; 269; 3015-23 [ Links ]
2. Naito HK, Hoff HF. Nutrition and pathogenesis of the blood vessel. In Blenc J. Editor: Medical Applicaitons of Clinical Nutrition. New Canaan: Keats Publishing Inc, 1983: 178-221. [ Links ]
3. Allain CC, Poon LS, Chan CSG, Richmond W, Fu PC. Enzymatic determination of total serum cholesterol. Clin Chem 1974: 20:470-5. [ Links ]
4. Trinder P. Determination of glucose in blood using glucose oxidase with an alternative oxygen acceptor. Ann Clin Biochem 1969; 6: 24-9. [ Links ]
5. Witte DL, Barret DA, Wycoff DA. Evaluation of an enzymatic procedure for determination of serum cholesterol with the Abbott ABA-100. Clin Chem 1974; 20: 1282-1286. [ Links ]
6. Pesce MA, Bodowrian SH. Enzymatic measurement of cholesterol in serum with the CentrifiChem centrifugal analyzer. Clin Chem 1977: 23: 280-2. [ Links ]
7. Naito HK ¨Cholesterol¨, In: Pesce AJ, Kaplan LA editors. Methods in Clinical Chemistry. The C.V. Mosby Company, 1987: 1156-78.
8. Schosinsky K, Chavarría M, Lehmann HP. A simple manual micro assay procedure for serum cholesterol. Joint Meeting American Associatinf or Clinical Chemistry. Canadian Society of Clinical Chemists, Boston, 1980: 20-5. [ Links ]
9. Bayer Diagnosticos Ames. Instructivo comerical: Sera Pak, Colesterol Fast Color.
10. Wiener Laboratories. Instructivo comercial: Colestat Enzimático. [ Links ]
11. Slicker KA. Enzyme-linked assays for cholesterol. CRC Lab. Sci. 1977; 8, 193-212. [ Links ]
12. Witte DL, Brown LF, Feld RD Enzymatic analysis of serum cholesterol and triglycerides: A bried review. Lab Med 1978; 9: 39-44. [ Links ]
13. Deacon AC, Dawson P. Enzymic Assay of Total Cholesterol Involving Chemical or Enzymic Hydrolysis-A Comparison of Methods. Clin Chem 1979; 25: 976-84. [ Links ]
14. Cooper GR, Duncan P, Hazlehurst JS, Dayton M, Bayse DD. Cholesterol, Enzymic method. Faulkner, W.R. Meites (eds) Selected Methods for the Small Clinical Chemistry Laboratory, vol. 9, Washington. American Association for Clinical Chemistry 1985; 165-74. [ Links ]
15. Boehringer Mannheim GmbH Diagnostica. Instructivo comercial: Monotest Colesterol, High Perfomance 1982. [ Links ]
16. Cooper GR, Ullmann MD, Hazelhurst J. Chemical characteristics and sources of error of an enzymatic cholesterolmethod. Clin Chem 1979; 24: 1074-7. [ Links ]
17. Wiebe DA. Bernert T. Interference of incomplete cholesterol esterhydrolysis on enzymic measurements of cholesterol. Clin Chem 1984; 30: 352-6. [ Links ]
18. Porntpi H, Hantaveesirirat Y. Comparative Study of Enzymatic Reagents for Total Serum Cholesterol Assay Using Cholesterol Oxidase Isolated from Nocardia, Streptomyces and Pseudomonas Species. Clin Chem 1990; 36: 967 [ Links ]
19. Pesce MA. Bodowrian SH. Interference with thw enzymic measurement of cholesterol in serum by use of five reagent kits. Clin Chem 1977; 23: 75760. [ Links ]
20. Nägele U, Hägele EO, Sauer G. Reagent for the enzymatic determinations of serum total triglycerides wity improved liplytic efficiency. J Clim Chem Clin Biochem 1984; 22: 165-74. [ Links ]
21. Current status of Blood Cholesterol Measurement in Clinical Laboratories in the United States: A Report from the Laboratory Standarization Panel of the National Cholesterol Education Program. Clin Chem 1990; 36: 967-73. [ Links ]
* Universidad de Costa Rica, Facultad de Microbiología.
| Componentes | | |
| | | |
| ácido acetilsalicílico | | |
| bilirrubina | | |
| hemoglobina | | |
| ácido ascórbico | | |
[(valor obtenido/valor basal) x 100] - 100/agregado