Introducción
El sistema montañoso de los Andes representa un papel fundamental en el clima global y regional, actúa como refugio, barrera y tránsito para las especies. Además, allí se originan la mayoría de los ecosistemas lóticos que son cruciales para la supervivencia y sostenibilidad de múltiples comunidades humanas en América del Sur (Perrigo et al., 2020). Estos ecosistemas se caracterizan por su interacción con los ecosistemas terrestres, lo cual se evidencia en funciones clave como el procesamiento de materia orgánica terrestre, la retención de nutrientes y el soporte de la biodiversidad (Vannote et al., 1980). Por estas razones, los sistemas lóticos andinos deben ser objeto de estudio para su conservación y manejo.
El gradiente altitudinal que incide sobre los ríos altoandinos en el Neotrópico es uno de los principales impulsores del establecimiento y ensamblaje de la biota acuática, al igual que las características ambientales a escala de mesohábitat, como tipo de flujo y sustrato (Ríos-Touma et al., 2011). Estas se relacionan con la heterogeneidad de entornos y son predictores de la composición de la comunidad de macroinvertebrados acuáticos (González-Trujillo, 2016; Silva et al., 2014). Para la vertiente del río Orinoco en Colombia se distinguen varias ecorregiones de agua dulce, existen cinco clasificadas por su posición latitudinal, altitudinal, geomorfología y composición biológica (piedemonte bajillanura, bajillanura, piedemonte altillanura guayanesa, altillanura guayanesa y serranía de La Macarena) (Mesa et al., 2016). Además, se conocen diez ecorregiones bajo un enfoque ecosistémico de ambientes terrestres y acuáticos (zona de transición Orinoco-Amazonas, delta del Orinoco, corredor, medio Orinoco, corredor bajo Orinoco, corredor alto Orinoco, guayanesa, costera, andina, llanera y altillanura orinoquense) (Lasso et al., 2010). La cuenca del río Orinoco presenta presiones antrópicas que pueden generar cambios en los ciclos hidrológicos y biológicos naturales, afectando directa e indirectamente la biota acuática que se establece en los ecosistemas lóticos (Machado-Allison et al., 2011). Predominan actividades como la deforestación, construcción de embalses, agricultura, ganadería, minería, introducción de especies exóticas y sobrepesca, que afectan también a los afluentes altoandinos de la cuenca (Barletta et al., 2010; Corpochivor, 2018; Lasso et al., 2016).
Los macroinvertebrados acuáticos se utilizan para evaluar la calidad ecológica de los ecosistemas lóticos, ya que permiten evidenciar efectos de presiones ambientales y antrópicas como la modificación de caudales, el impacto de especies exóticas, los cambios en el uso del suelo y las modificaciones físicas en las cuencas hidrográficas (Fierro et al., 2019; Prat et al., 2009). La identificación de los diferentes grupos de macroinvertebrados acuáticos a una resolución taxonómica adecuada es fundamental para demostrar su respuesta a cambios en la calidad ambiental del recurso hídrico (Encalada et al., 2019; Roldán-Pérez, 2016). Además, la determinación de taxones representativos del hábitat es particularmente útil en procesos de conservación o manejo ecológico (De Cáceres et al., 2012). Por ejemplo, una especie restringida a uno o unos pocos tipos de hábitat, representa un mejor indicador ecológico del cambio ambiental que una especie generalista de hábitat, debido a la mayor susceptibilidad del especialista a la extinción local o regional (Carignan & Villard, 2002; De Cáceres & Legendre, 2009).
Sin embargo, las investigaciones desarrolladas para sistemas lóticos en Sudamérica y específicamente para Colombia de los grupos con mayor diversidad, abundancia y biomasa aún son insuficientes (Encalada et al., 2019; Roldán-Pérez, 2016). La ausencia de datos básicos sobre composición, estructura y distribución de especies limita el éxito de cualquier medida de control, manejo y/o conservación de los ecosistemas lóticos (Johnson et al., 2007; Wahl et al., 2013). Para los sistemas lóticos de la Orinoquia se destacan las investigaciones de Granados-Martínez y Batista (2017) que identificaron 74 taxones distribuidos en 43 familias en Caño Cristales (Meta) y donde los órdenes Díptera, Trichoptera y Odonata fueron los más abundantes. El trabajo de Lasso et al., (2020) en la reserva natural Bojonawi (Vichada), registra 184 morfoespecies distribuidas en 66 familias, donde los órdenes Coleoptera, Odonata, Hemiptera y Díptera fueron los más diversos. Otros estudios que recopilan valiosa información de macroinvertebrados acuáticos en esta región son Lozano et al., (2015), Granados-Martínez y Montoya (2017), Salinas-Jiménez et al., (2017) y Granados-Martínez et al., (2018).
En los sistemas lóticos andinos de Colombia que vierten hacia la cuenca del Orinoco se han desarrollado algunos estudios que informan sobre la diversidad de macroinvertebrados. Por ejemplo, Motta-Díaz y Vimos-Lojano (2020), identificaron 57 taxones para la quebrada Agua Blanca (departamento de Boyacá, subcuenca del río Meta), distribuidos principalmente dentro de los órdenes Coleoptera, Diptera y Trichoptera; las familias más abundantes fueron Simuliidae y Sericostomatidae, y dentro de los géneros, Leptohyphes, Smicridea y Helicopsyche. Por otra parte, González-Trujillo et al., (2020), reporta 74 taxones dentro de cinco quebradas altoandinas (departamento de Cundinamarca, subcuenca del río Meta) donde los géneros representativos detectados en un hábitat particular fueron Metrichia, Gigantodax, Nectopsyche, Onychelmis, Elodes, Podonomopsis, Hyalella y Microcara.
El objetivo de este trabajo fue determinar la composición de géneros de macroinvertebrados acuáticos del río Garagoa, departamentos de Boyacá y Cundinamarca, en Colombia. Al obtenerse muestras en un gradiente altitudinal amplio (500 a 2 887 m.s.n.m.) que comprende parte del piedemonte y la región andina, también se estableció la distribución altitudinal de los taxones y se identificaron géneros representativos para diferentes gradientes de altitud. Se evaluó la suficiencia taxonómica (ST), es decir el nivel de detalle taxonómico con el que se deben identificar los organismos, para reconocer la condición biológica o los patrones ecológicos con una certeza aceptable (Jones, 2008). Por último, se discute la importancia de los patrones de distribución de los taxones para explicar las diferencias que existen con respecto a la altitud.
Materiales y métodos
Área de estudio: La cuenca del río Garagoa se ubica en el margen oriental de la cordillera oriental de Colombia y pertenece a la zona hidrográfica del río Meta dentro de la macrocuenca del río Orinoco. Este ecosistema lótico nace en el páramo de Rabanal en el municipio de Samacá a una altura de 3 450 m.s.n.m. y desemboca en el río Guavio a una altura de 500 m.s.n.m. Tiene una superficie aproximada de 250 000 ha, donde el 80 % pertenece al departamento de Boyacá y el 20 % a Cundinamarca. La temperatura promedio de la cuenca varía entre 13.4 °C, en la parte alta, y 18.8 °C, en la parte baja; la precipitación presenta un régimen monomodal en gran parte de la cuenca, con precipitaciones máximas en junio (hasta 600 mm/mes) y mínimas de diciembre a febrero (< 100 mm/mes) (Corpochivor, 2018).
Métodos de muestreo: Los muestreos se realizaron entre marzo y junio de 2021, durante la transición de épocas hidroclimáticas (seca a lluvia), en 40 sitios que abarcaron la heterogeneidad de hábitat a escala de paisaje, meso y microhábitats de la cuenca (Corpochivor, 2018; Frissell et al., 1986), ubicados en un gradiente altitudinal entre 500 y 2 887 m.s.n.m. (Fig. 1, Tabla 1). La elección final de cada sitio consideró la facilidad de acceso y el consentimiento de los propietarios. Cada sitio correspondía a un segmento de 100 m de longitud de río, en el cual los macroinvertebrados acuáticos se recolectaron con red Surber (300 μm diámetro de poro), realizando un muestreo aleatorio estratificado (36 Surber por sitio) teniendo en cuenta los mesohábitats (rápido, corriente, tabla y pozo) y microhábitats (bloque, canto, grava, limo, arena y hojarasca) en cada tramo y removiendo el sustrato durante un minuto (Rodrigues-Capítulo et al., 2009; Silveira et al., 2004). Adicionalmente se recolectaron ejemplares con red de arrastre (1.5 m de alto x 3.0 m de ancho y 5 mm diámetro de poro). Las muestras se conservaron con alcohol al 70 % y posteriormente se transportaron al laboratorio.
Tabla 1 Sitios de muestreo, elevación, orden limnológico y riqueza en la cuenca del río Garagoa. / Table 1. Sampling sites, elevation, limnological order and richness in the Garagoa river basin.
| Sitios de muestreo | N | W | Elevación (m.s.n.m.) | Cuerpo de agua | Orden limnológico (Horton - Strahler)* | Riqueza |
| R01 | 5°26’48’’ | 73°20’42’’ | 2 773 | Río Teatinos | 5 | 14 |
| R02 | 5°26’19’’ | 73°29’41’’ | 2 887 | Río Teatinos | 5 | 11 |
| R03 | 5°25’08’’ | 73°16’43’’ | 2 267 | Río Juyasia | 5 | 7 |
| R04 | 5°27’35’’ | 73°28’06’’ | 2 885 | Río Teatinos | 5 | 14 |
| R05 | 5°27’44’’ | 73°26’30’’ | 2 743 | Río Teatinos | 5 | 13 |
| R06 | 5°27’02’’ | 73°25’50’’ | 2 731 | Río Teatinos | 5 | 12 |
| R07 | 5°26’40’’ | 73°22’45’’ | 2 013 | Río Teatinos | 5 | 10 |
| R08 | 5°26’03’’ | 73°21’03’’ | 2 165 | Río Teatinos | 5 | 29 |
| R09 | 5°24’45’’ | 73°20’16’’ | 2 112 | Río Juyasia | 5 | 29 |
| R10 | 5°23’14’’ | 73°21’39’’ | 2 083 | Río Tibaná | 6 | 21 |
| R11 | 5°21’16’’ | 73°22’17’’ | 2 059 | Río Tibaná | 6 | 18 |
| R12 | 5°19’16’’ | 73°23’23’’ | 2 013 | Río Tibaná | 6 | 19 |
| R13 | 5°18’30’’ | 73°25’56’’ | 2 106 | Río Turmequé | 5 | 13 |
| R14 | 5°20’11’’ | 73°27’29’’ | 2 082 | Río Turmequé | 5 | 14 |
| R15 | 5°20’52’’ | 73°29’19’’ | 2 234 | Río Turmequé | 5 | 10 |
| R16 | 5°21’50’’ | 73°30’41’’ | 2 430 | Río Turmequé | 5 | 11 |
| R17 | 5°17’19’’ | 73°23’59’’ | 1 960 | Río Garagoa | 6 | 17 |
| R18 | 5°16’00’’ | 73°24’16’’ | 1 921 | Río Garagoa | 6 | 16 |
| R19 | 5°09’28’’ | 73°20’57’’ | 1 732 | Río Garagoa | 6 | 12 |
| R20 | 5°08’44’’ | 73°22’10’’ | 1 492 | Río Garagoa | 6 | 19 |
| R21 | 5°07’59’’ | 73°21’50’’ | 1 473 | Río Garagoa | 6 | 19 |
| R22 | 5°04’24’’ | 73°23’13’’ | 1 340 | Río Garagoa | 6 | 14 |
| R23 | 5°01’04’’ | 73°23’22’’ | 1 269 | Río Garagoa | 6 | 9 |
| R24 | 5°00’34’’ | 73°23’48’’ | 1 275 | Río Súnuba | 6 | 13 |
| R25 | 5°00’21’’ | 73°25’59’’ | 1 307 | Río Súnuba | 6 | 2 |
| R26 | 4°59’03’’ | 73°28’32’’ | 1 370 | Río Súnuba | 6 | 12 |
| R27 | 5°00’29’’ | 73°31’04’’ | 1 424 | Río Súnuba | 6 | 9 |
| R28 | 5°02’23’’ | 73°37’10’’ | 2 046 | Río Súnuba | 6 | 10 |
| R29 | 5°01’12’’ | 73°37’45’’ | 2 790 | Río Súnuba | 6 | 9 |
| R30 | 4°44’55’’ | 73°18’19’’ | 500 | Río Batá | 7 | 0 |
| R31 | 4°45’35’’ | 73°17’40’’ | 523 | Río Batá | 7 | 2 |
| R32 | 4°46’37’’ | 73°16’41’’ | 559 | Río Batá | 7 | 4 |
| R33 | 4°47’23’’ | 73°16’36’’ | 573 | Río Batá | 7 | 7 |
| R34 | 4°47’54’’ | 73°16’45’’ | 620 | Río Batá | 7 | 5 |
| R35 | 4°48’36’’ | 73°15’50’’ | 659 | Río Batá | 7 | 0 |
| R36 | 4°49’37’’ | 73°15’34’’ | 711 | Río Batá | 7 | 7 |
| R37 | 4°50’32’’ | 73°16’04’’ | 958 | Río Batá | 7 | 1 |
| R38 | 4°50’50’’ | 73°16’12’’ | 861 | Río Batá | 7 | 4 |
| R39 | 4°51’40’’ | 73°16’08’’ | 1 022 | Río Batá | 7 | 2 |
| R40 | 4°53’12’’ | 73°16’22’’ | 1 030 | Río Batá | 7 | 9 |
*Información tomada de Corpochivor (2018). / *Information taken from Corpochivor (2018).
Métodos de laboratorio: La identificación taxonómica se realizó mediante uso de las claves taxonómicas McCafferty y Provonsha (1981), Roldán-Pérez (1988), Machado y Rincón (1989), Ruíz-Moreno et al., (2000)a, Ruíz-Moreno et al., (2000)b, Domínguez (2006), Valencia y Campos (2007); Domínguez y Fernández (2009), Springer et al., (2010), Campos (2014), Gutiérrez y Dias (2015), Prat et al., (2018), Hamada et al., (2018), Damborenea et al., (2020), González-Córdoba et al., (2020)a, bajo observación en estereoscopios marca Zeiss modelos STEMI 305 y 508, que permitieron obtener el menor nivel taxonómico posible. El material biológico fue depositado en la Colección Limnológica (UPTC-L) de la Universidad Pedagógica y Tecnológica de Colombia (números de catálogo M-291 a M-554). Información adicional sobre el conjunto de datos se proporciona en Barrera-Herrera et al. (2022).
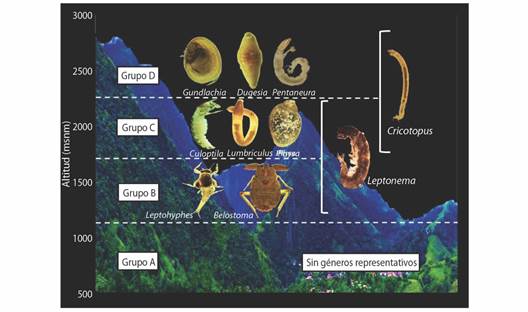
Tratamiento de datos: Para estimar la riqueza de taxones se utilizaron los estimadores no paramétricos Chao 2, Jackknife 1, Jackknife 2 y Bootstrap con datos de presencia-ausencia de los taxones (Gotelli & Chao, 2013). Posteriormente se graficaron las curvas de acumulación de especies, lo cual permitió evaluar la relación entre el esfuerzo de muestreo y el número de taxones observados y con ello obtener información sobre la confiabilidad del muestreo. Adicionalmente, se realizó un análisis de macroinvertebrados representativos del hábitat (utilizando los taxones recolectados con red Surber), con el objeto de identificar la relación entre especies y grupos de sitios mediante el coeficiente de correlación phi de Pearson que permite establecer preferencias ecológicas de las especies con respecto a los sitios (De Cáceres, 2020). Se establecieron cuatro grupos de sitios diferenciados cada uno por una escala altitudinal de 600 m; Grupo A, representado por nueve sitios y un gradiente altitudinal entre 500 y 1 100 m.s.n.m.; Grupo B, ocho sitios, 1 100-1 700 m.s.n.m.; Grupo C, 14 sitios, 1 700-2 300 m.s.n.m.; y Grupo D, siete sitios, 2 300-2 900 m.s.n.m. (Fig. 1).
Los sitios de monitoreo se compararon para evaluar disimilitudes en la composición de la comunidad de macroinvertebrados a lo largo del gradiente altitudinal, mediante la prueba no paramétrica PERMANOVA, un análisis de escalamiento multidimensional no métrico (NMDS) utilizando el índice de Sorensen (o Bray-Curtis binario) y una prueba Pairwise. Como complemento se realizó una prueba SIMPER para conocer los macroinvertebrados acuáticos que contribuyen a la disimilitud entre los grupos de sitios establecidos. En los sitios R30 y R35 no se reportaron ejemplares, por lo tanto, se excluyeron del análisis. Los análisis PERMANOVA, NMDS, Pairwise y SIMPER se realizaron tanto a nivel de género como de familia con el propósito de evaluar la suficiencia taxonómica (ST) propuesta por Ellis (1985) y corroborar si se observa el mismo patrón para la comunidad respecto al gradiente altitudinal evaluado. Los análisis se realizaron en el software de acceso libre R versión 3.5.3 (RStudio Team, 2018) con los paquetes Vegan (Oksanen et al., 2013) para NMDS, PERMANOVA, Pairwise y SIMPER; BiodiversityR (Kindt & Kindt, 2019) para estimadores de riqueza y el paquete Indicspecies (De Cáceres et al., 2016) para macroinvertebrados representativos del hábitat.
Con el propósito de identificar diferencias respecto a la riqueza de taxones se contrastaron nuestros resultados con la información obtenida en investigaciones previas realizadas en el área de estudio (Gil, 2014; González-Tuta y Gil-Padilla, 2020). Finalmente se discutieron los patrones de distribución de los grupos taxonómicos más representativos con base en diferentes reportes de investigación publicados.
Resultados
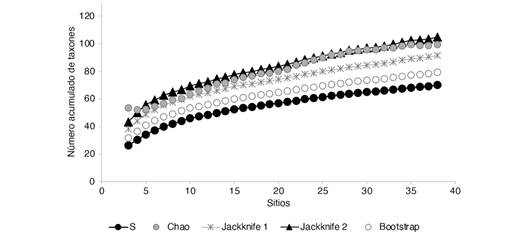
Macroinvertebrados acuáticos: En el río Garagoa se registraron un total de 70 taxones de macroinvertebrados acuáticos distribuidos en 48 familias y 16 ordenes (Tabla 2). El orden Diptera presentó el mayor número de géneros con 22, seguido de Coleoptera, Trichoptera, Ephemeroptera y Hemiptera con 11, nueve, seis y cinco géneros, respectivamente. De acuerdo con los estimadores de riqueza Chao2, Jackknife1, Jackknife2 y Bootstrap, se obtuvo una representatividad del muestreo del 70.4, 76.6, 66.7 y 88.4 %, respectivamente (Fig. 2).
Tabla 2 Macroinvertebrados acuáticos del río Garagoa, cuenca hidrográfica del Orinoco. / Table 2. Taxonomic list of aquatic macroinvertebrates of the Garagoa River, Orinoco hydrographic basin.
| TRICLADIDA | Familia Chironomidae |
| Familia Dugesiidae | Apsectrotanypus Fittkau, 1962 |
| Dugesia Girard, 1850 | Pentaneura Philippi, 1865 |
| LUMBRICULIDA | Corynoneura Winnertz, 1846 |
| Familia Lumbriculidae | Onconeura Andersen & Sæther, 2005 |
| Lumbriculus Grube, 1844 | Cardiocladius Kieffer, 1912 |
| TUBIFICIDA | Cricotopus Wulp, 1874 |
| Familia Naididae Ehrenberg, 1828 | Parachironomus Lenz, 1921 |
| SPHAERIIDA | Paracladopelma Harnisch, 1923 |
| Familia Sphaeriidae | Paratanytarsus Thienemann & Bause, 1913 |
| Pisidium C.Pfeiffer, 1821 | Familia Empididae |
| BASOMMATOPHORA | Hemerodromia Meigen, 1822 |
| Familia Physidae | Familia Psychodidae |
| Physa Draparnaud, 1801 | Clogmia Enderlein, 1937 |
| Familia Planorbidae | Maruina Muller, 1895 |
| Gundlachia L. Pfeiffer, 1849 | Familia Simuliidae |
| Drepanotrema P. Fischer & Crosse, 1880 | Simulium Latreille, 1802 |
| EPHEMEROPTERA | Familia Limoniidae |
| Familia Baetidae | Antocha Osten-Sacken, 1860 |
| Baetodes Needham & Murphy, 1924 | Limonia Meigen, 1803 |
| Camelobaetidius Demoulin, 1966 | Familia Tipulidae |
| Americabaetis Kluge, 1992 | Tipula Linnaeus, 1758 |
| Nanomis Lugo-Ortiz & McCafferty, 1999 | Familia Tabanidae |
| Familia Leptophlebiidae | Tabanus Linnaeus, 1758 |
| Farrodes Peters, 1971 | Familia Syrphidae |
| Familia Leptohyphidae | Eristalis Latreille, 1804 |
| Leptohyphes Eaton, 1882 | HEMIPTERA |
| PLECOPTERA | Familia Belostomatidae |
| Familia Perlidae | Belostoma Latreille, 1807 |
| Anacroneuria Klapálek, 1909 | Familia Gerridae |
| ODONATA | Charmatometra Kirkaldy, 1899 |
| Familia Calopterygidae | Charmatometra bakeri Kirkaldy, 1898 |
| Hetaerina Hagen, 1853 | Familia Veliidae |
| Familia Aeshnidae | Rhagovelia Mayr, 1865 |
| Aeshna Fabricius, 1775 | Familia Micronectidae |
| TRICHOPTERA | Tenagobia Bergroth, 1899 |
| Familia Hydrobiosidae | Familia Naucoridae |
| Atopsyche Banks, 1905 | Limnocoris Stål, 1860 |
| Familia Hydropsychidae | MEGALOPTERA |
| Leptonema Guerin-Meneville, 1843 | Familia Corydalidae |
| Familia Glossosomatidae | Corydalus Latreille, 1802 |
| Culoptila Mosely, 1954 | COLEOPTERA |
| Familia Helicopsychidae | Familia Cantharidae |
| Helicopsyche von Siebold, 1856 | Género cf. Rhagonycha Eschscholtz, 1830 |
| Familia Hydroptilidae | Familia Elmidae |
| Hydroptila Dalman, 1819 | Hexanchorus Sharp, 1882 |
| Metrichia Ross, 1938 | Heterelmis Sharp, 1882 |
| Familia Leptoceridae | Macrelmis Motschulsky, 1859 |
| Nectopsyche Mueller, 1879 | Neoelmis Musgrave, 1935 |
| Familia Polycentropodidae | Xenelmis Hinton, 1936 |
| Polycentropus Curtis, 1835 | Pseudodisersus Brown, 1981 |
| Familia Calamoceratidae | Familia Ptilodactylidae |
| Phylloicus Mueller, 1880 | Anchytarsus Guérin-Méneville, 1843 |
| LEPIDOPTERA | Familia Staphylinidae Latreille, 1802 |
| Familia Coleophoridae | Familia Lutrochidae |
| Coleophora Hübner, 1822 | Género cf. Lutrochus Erichson, 1847 |
| Familia Crambidae | Familia Lampyridae Latreille, 1817 |
| Petrophila Guilding, 1830 | DECAPODA |
| Familia Tortricidae | Familia Palaemonidae |
| Amorbia Clemens, 1860 | Macrobrachium Spence Bate, 1868 |
| DIPTERA | Macrobrachium cf. reyesi Pereira, 1986 |
| Familia Blephariceridae | Familia Pseudothelphusidae |
| Limonicola Lutz, 1928 | Género cf. Neostrengeria Pretzmann, 1965 |
| Familia Ceratopogonidae | AMPHIPODA |
| Bezzia Kieffer, 1899 | Familia Hyalellidae |
| Probezzia Kieffer, 1906 | Hyalella Smith, 1874 |
| Atrichopogon Kieffer, 1906 |
El estimador Jackknife2 indicó la riqueza más alta con 104.9 taxones y sin ninguna variación en los datos, mientras que Chao2 mostró una riqueza de 99.4 taxones, pero con una desviación estándar de ± 17.2. Respecto a la riqueza reportada por sitio de muestreo, se evidenció que los sitios con mayor número de taxones fueron R08 y R09, ubicados dentro de las subcuencas Teatinos y Juyasia, con un orden limnológico 5 (Tabla 1). En segundo lugar, estuvieron los sitios R10, R20 y R21 dentro de las subcuencas Tibaná y Garagoa con un orden limnológico 6. En contraste, los sitios con la menor riqueza fueron R39, R37 y R31 ubicados en la subcuenca Batá con un orden limnológico 7 (Tabla 1).
La Tabla 3 compara el número de taxones reportados con otras investigaciones realizadas en el río Garagoa. Gil (2014) evaluó 12 sitios de muestreo ubicados dentro de las subcuencas del río Tibaná y del río Garagoa de mayo a noviembre del año 2013, identificando 59 taxones de macroinvertebrados acuáticos, de los cuales, 24 no fueron encontrados en esta investigación.
Se destaca el orden Trichoptera porque incluye ocho géneros diferentes (Tabla 3). Por otra parte, González-Tuta y Gil-Padilla (2020), evaluaron tres sitios pertenecientes a la cuenca del río Garagoa (subcuencas del río Juyasía y del río Tibaná), abarcando épocas de altas y bajas precipitaciones entre el año 2011 y 2012, encontraron 26 taxones, de los cuales seis no fueron hallados por Gil (2014), ni en el presente estudio. Se resalta el orden Ephemeroptera, pues incluye cuatro géneros diferentes (Tabla 3). Es importante señalar que las investigaciones de Gil (2014) y González-Tuta y Gil-Padilla (2020), concluyen que los órdenes Diptera, Trichoptera, Ephemeroptera y Coleoptera son los de mayor riqueza observada, a pesar de la diferencia en el número de sitios, municipios y periodos hidroclimáticos evaluados. Al reunir esta información se evidencia que existen alrededor de 99 géneros de macroinvertebrados acuáticos en la cuenca del río Garagoa. Cabe aclarar que no es posible aseverar si los taxones son realmente adiciones o se trata de incongruencias en la identificación, ya que no se informa si el material de las investigaciones anteriormente mencionadas se encuentra depositado en una colección o museo para su verificación.
Distribución altitudinal: Respecto a la distribución de macroinvertebrados acuáticos a lo largo del gradiente altitudinal se observó que dentro de los grupos de sitios C (1 732 - 2 300 m.s.n.m.) y D (2 300 - 2 900 m.s.n.m.), el número de macroinvertebrados acuáticos fue mayor. Predominaron los moluscos (Pisidium y Physa), oligoquetos (Lumbriculus) y turbelarios (Dugesia), y se presentó un mayor número de géneros para el orden Diptera, encontrando taxones de la familia Ceratopogonidae como Bezzia, Probezzia y Atrichopogon y de la familia Chironomidae como Apsectrotanypus, Onconeura, Paratanytarsus, Pentaneura, Paracladopelma y Corynoneura. Además, géneros como Hyalella (Amphipoda), Pseudodisersus (Coleoptera), Hydroptila (Trichoptera), Eristalis (Diptera), cf. Neostrengeria (Decapoda) y Coleophora (Lepidoptera) estuvieron presentes únicamente en estos gradientes altitudinales.
Para zonas intermedias, en el grupo de sitios B (1 100 - 1 732 m.s.n.m.) el número de macroinvertebrados disminuyó.
Tabla 3 Comparación de riqueza de macroinvertebrados acuáticos con estudios previos realizados en el río Garagoa. / Table 3. Comparison of richness of aquatic macroinvertebrates with previous studies carried out in the Garagoa River.
| Orden | Riqueza Gil, 2014 (Sitios = 12) | Taxones Complementarios 2014 | Riqueza González-Tuta y Gil-Padilla, 2020 (Sitios = 3) | Taxones Complementarios 2020 | Riqueza Presente Estudio, 2022. (Sitios = 40) |
| Tricladida | 1 | 0 | 1 | ||
| Eunicida | 1 | 0 | 0 | ||
| Lumbriculida | 0 | 0 | 1 | ||
| Tubificida | 2 | N.id* | 1 | Tubifex | 1 |
| Sphaeriida | 1 | 0 | 1 | ||
| Basommatophora | 2 | 0 | 3 | ||
| Ephemeroptera | 7 | Mayobaetis Zelusia Thraulodes | 8 | Moribaetis Cloeodes Guajirolus Tricorythodes | 6 |
| Plecoptera | 1 | 1 | 1 | ||
| Odonata | 0 | 0 | 2 | ||
| Trichoptera | 13 | Protoptila, Smicridea, Neotrichia Alisotrichia Ochrotrichia Oxyethira Grumichella Oecetis | 4 | 9 | |
| Lepidoptera | 1 | 0 | 3 | ||
| Diptera | 13 | Chelifera Odontomyia Mansonia Limnophora | 6 | 22 | |
| Hemiptera | 5 | Mesovelia Cryphocricos Pelocoris | 1 | 5 | |
| Megaloptera | 1 | 1 | 1 | ||
| Coleoptera | 10 | Hexacylloepus Microcylloepus Cylloepus Dineutus Gyretes | 2 | 11 | |
| Decapoda | 0 | 0 | 2 | ||
| Amphipoda | 1 | 2 | Gammarus | 1 | |
| Total | 59 | 26 | 70 |
*N.id: No identificado. / *N.id: Unidentified.
Al igual que en los grupos C y D, los órdenes Trichoptera, Diptera, Ephemeroptera y Coleoptera presentaron el mayor número de taxones. Se presentaron géneros únicos como Belostoma y Charmatometra bakery (Hemiptera), Hexanchorus, Xenelmis y cf. Lutrochus (Coleoptera), Tabanus (Diptera), Petrophila (Lepidoptera), Hetaerina (Odonata) y Phylloicus (Trichoptera). Taxones como Corydalus (Megaloptera), Rhagovelia (Hemiptera), Cricotopus (Diptera), Limonicola (Diptera) y Metrichia (Trichoptera) solo se hallaron dentro de los grupos B, C y D.
Para el grupo de sitios A (500 - 1 100 m.s.n.m.) se registró el número más bajo de macroinvertebrados acuáticos. Se destacaron los órdenes Ephemeroptera con géneros como Baetodes, Leptohyphes y Farrodes; Trichoptera con el género Leptonema; Diptera con Parachironomus, Cardiocladius y Limonia, y el orden Coleoptera con la presencia de Heterelmis y Neoelmis. Para esta zona en específico se recolectaron los taxones Macrobrachium cf. Reyesi (Decapoda) y Macrelmis (Coleoptera).
Los géneros con mayor ocurrencia a lo largo del gradiente altitudinal evaluado en el río Garagoa (500 a 2 887 m.s.n.m.) fueron Simulium, Parachironomus y Cardiocladius pertenecientes al orden Díptera, y dentro del orden Trichoptera se destacó el género Leptonema (Tabla 4). Estos taxones ocurren en más de 20 sitios y están incluidos principalmente dentro de los grupos C y D con gradientes altitudinales entre 1 732 a 2 900 m.s.n.m., y en menor proporción dentro de los grupos B y A (500 a 1 732 m.s.n.m.). Para el orden Coleóptera se destacó Heterelmis en 19 sitios y Neoelmis en 15 sitios; incluidos en gran medida dentro de los grupos B y C (1 100 a 2 300 m.s.n.m.), y en menor proporción en los grupos A y D (Tabla 4). Respecto al orden Ephemeroptera, el género Baetodes se reportó en 18 sitios ubicados principalmente dentro del grupo de sitios B y C (1 100 a 2 300 m.s.n.m.).
El análisis NMDS muestra las cuatro agrupaciones relacionadas con el gradiente altitudinal a nivel de género para la comunidad de macroinvertebrados acuáticos en la cuenca del río Garagoa (Fig. 3). Se evidencia una mayor agrupación para los sitios de los grupos C y D, ubicados en zonas de mayor altitud. Los sitios de zonas intermedias representados por el grupo B se asociaron con sitios del grupo C. Por último, se destaca el grupo A (sitios con menor altitud) por presentar una mayor dispersión respecto a los demás grupos. Las estadísticas de correlación indicaron el ajuste entre las distancias de ordenación y las diferencias observadas (R2 = 0.989) y un nivel de estrés de 0.11 para una adecuada interpretación del NMDS. La prueba PERMANOVA indicó diferencias respecto a la composición de la comunidad para los diferentes grupos altitudinales evaluados (R2 = 0.306; P = 0.001). Sin embargo, la prueba Pairwise confirma la similitud entre los grupos C y D (P = 0.06). En contraste, para las demás combinaciones de grupos existen diferencias significativas, pues los valores de significancia de la prueba Pairwise oscilaron entre 0.006 y 0.012. Según los resultados del análisis SIMPER los géneros que contribuyeron en mayor medida a la disimilitud fueron Neoelmis (71 %) y Anacroneuria (69 %) para los grupos B y D, Apsectrotanypus (70 %) y Farrodes (68 %) para los grupos D y A, Pisidium (70 %) y Simulium (68 %) para los grupos C y B, Anacroneuria (71 %) y Corydalus (69 %) para los grupos C y A, Cardiocladius (72 %) y Anacroneuria (70 %) para los grupos B y A.
Tabla 4 Macroinvertebrados acuáticos con mayor ocurrencia a lo largo del gradiente altitudinal evaluado (500 a 2 887 m.s.n.m.) en el río Garagoa. / Table 4. Aquatic macroinvertebrates with highest occurrence along the evaluated altitudinal gradient (500 to 2 887 m.a.s.l.) in the Garagoa River.
| Baetodes | Leptonema | Cardiocladius | Parachironomus | Simulium | Heterelmis | Neoelmis | |
| R01 | + | + | + | + | + | + | + |
| R02 | + | + | + | ||||
| R03 | + | + | + | ||||
| R04 | + | + | + | ||||
| R05 | + | + | + | + | |||
| R06 | + | + | + | ||||
| R07 | + | + | + | + | + | + | |
| R08 | + | + | + | + | + | + | |
| R09 | + | + | + | + | + | + | + |
| R10 | + | + | + | + | + | + | + |
| R11 | + | + | + | + | + | ||
| R12 | + | + | + | + | + | + | + |
| R13 | + | + | + | + | + | + | |
| R14 | + | + | + | + | + | + | |
| R15 | + | + | + | ||||
| R16 | + | + | |||||
| R17 | + | + | + | + | + | ||
| R18 | + | + | + | + | + | ||
| R19 | + | ||||||
| R20 | + | + | + | + | + | ||
| R21 | + | + | + | + | + | + | + |
| R22 | + | + | + | + | |||
| R23 | + | + | + | + | |||
| R24 | + | + | + | + | |||
| R25 | |||||||
| R26 | + | + | + | ||||
| R27 | + | + | + | ||||
| R28 | + | + | + | ||||
| R29 | + | + | + | + | + | + | |
| R30 | |||||||
| R31 | |||||||
| R32 | + | + | |||||
| R33 | + | + | + | ||||
| R34 | + | + | + | ||||
| R35 | |||||||
| R36 | + | + | + | + | + | ||
| R37 | |||||||
| R38 | + | + | |||||
| R39 | + | + | |||||
| R40 | + | + | + | + | + |
(+): Presencia, ( ): Ausencia. / (+): Present, ( ): Absent.
A nivel de familia, el análisis NMDS evidencia una mayor agrupación entre los grupos altitudinales evaluados (Fig. 4). Se evidencia que los sitios con menor altitud (grupo A) presentaron un comportamiento similar al observado en el NMDS a nivel de género, pues fue el grupo más disperso respecto a los demás. Por otra parte, los grupos B y C con un gradiente altitudinal entre 1 100 a 2 300 m.s.n.m. presentaron una mayor agrupación, y los sitios del grupo D (2 300 a 2 900 m.s.n.m.) se agruparon en mayor medida con los sitios del grupo C (1 732 a 2 300 m.s.n.m.). Para este análisis las estadísticas de correlación indicaron el ajuste entre las distancias de ordenación y las diferencias observadas (R2 = 0.99) y un nivel de estrés de 0.10 para una adecuada interpretación del NMDS. La prueba PERMANOVA en este nivel taxonómico también evidencian las diferencias entre los grupos altitudinales evaluados respecto a la composición de la comunidad (R2 = 0.312; P = 0.001). La prueba Pairwise a nivel de familia indica que existen diferencias significativas entre todos los grupos de sitios (P < 0.05). Se destaca el grupo A por presentar los valores de significancia más bajos de la prueba Pairwise y diferir en mayor medida respecto a los demás grupos (P = 0.006). Los resultados del análisis SIMPER mostraron que las familias que contribuyeron en mayor medida a la disimilitud fueron Limoniidae (72 %) y Psychodidae (70 %) para los grupos D y C, Chironomidae (70 %) y Simuliidae (68 %) para los grupos D y B, Corydalidae (72 %) y Chironomidae (69 %) para los grupos D y A, Chironomidae (72 %) y Leptoceridae (69 %) para los grupos C y B, Veliidae (72 %) y Sphaeriidae (69 %) para los grupos C y A, Perlidae (73 %) y Helicopsychidae (70 %) para los grupos B y A.
Macroinvertebrados representativos del hábitat: Este análisis evidenció una preferencia ecológica de algunos géneros por ciertos grupos de sitios (phi-IndVal = P < 0.05; Tabla 5, Fig. 5). El grupo A (500 - 1 100 m.s.n.m.) no presentó ningún taxón significativo y muestra que no existe una exclusividad y ocurrencia marcada de macroinvertebrados acuáticos para este gradiente altitudinal. Para el grupo B (1 100 - 1 700 m.s.n.m.), Leptohyphes y Belostoma fueron los géneros representativos. El grupo C (1 700 - 2 300 m.s.n.m.) presentó tres géneros: Culoptila, Lumbriculus y Physa. El grupo D (2 300 - 2 900 m.s.n.m) mostró tres géneros significativos: Gundlachia, Dugesia y Pentaneura. Algunos géneros presentaron una preferencia ecológica por más de un grupo de sitios. En particular, el género Leptonema tuvo preferencia por los grupos B y C, Cardiocladius y Cricotopus por los grupos C y D (Tabla 5, Fig. 5).
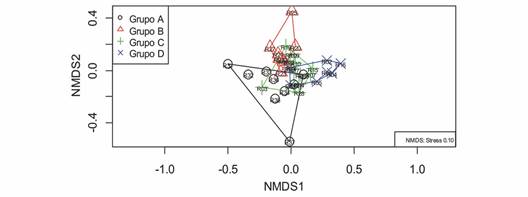
Fig. 4 Ordenación (NMDS) de los sitios de acuerdo con la composición de macroinvertebrados acuáticos a nivel de familia. Distancia: Sorensen (Bray-Curtis binario). Estrés de la ordenación: 0.10. Ajuste no métrico, R2 = 0.99. / Fig. 4. Ordination (NMDS) of the sites according to the composition of aquatic macroinvertebrates at the family level. Distance: Sorensen (Bray-Curtis binary). Stress: 0.10. Non-metric fit, R2 = 0.99.
Tabla 5 Asociación entre macroinvertebrados acuáticos y grupos de sitios del río Garagoa. / Table 5. Association between aquatic macroinvertebrates and groups of sites in the Garagoa River.
| Grupos de sitios | Género | phi-IndVal | P valor |
| Grupo B | Leptohyphes | 0.633 | 0.004 |
| Belostoma | 0.549 | 0.002 | |
| Grupo C | Culoptila | 0.518 | 0.013 |
| Lumbriculus | 0.470 | 0.017 | |
| Physa | 0.401 | 0.028 | |
| Grupo D | Gundlachia | 0.470 | 0.023 |
| Dugesia | 0.464 | 0.021 | |
| Pentaneura | 0.432 | 0.035 | |
| Grupo B + C | Leptonema | 0.545 | 0.002 |
| Grupo C + D | Cardiocladius | 0.590 | 0.002 |
| Cricotopus | 0.561 | 0.004 |
Método de correlación biserial del valor del indicador (phi-IndVal) a un nivel de significancia P < 0.05. / Biserial correlation method of the indicator value (phi-IndVal) at a significance level P < 0.05.
Discusión
Esta investigación reportó 70 taxones de macroinvertebrados acuáticos, donde el orden Diptera, específicamente la familia Chironomidae presentó el mayor número de géneros y una amplia distribución en la cuenca del río Garagoa. Los estimadores de biodiversidad sugieren que el número de taxones podría estar entre 79.2 (Boostrap) y 104.9 (Jackknife2), de modo que aún no se ha capturado toda la riqueza de la cuenca, pues se han realizado pocos estudios en la misma y en su mayoría no abarcan la heterogeneidad temporal. Además, se destacan las zonas con mayor altitud por presentar el mayor número de macroinvertebrados acuáticos. Para la zona Neotropical y específicamente en Colombia, los macroinvertebrados acuáticos de órdenes como Coleoptera, Diptera, Trichoptera y Ephemeroptera con algunas de sus respectivas familias y que fueron representativos en esta investigación, son considerados grupos megadiversos y con una amplia distribución (Díaz-Rojas et al., 2020; Roldán-Pérez, 2016; Vásquez-Ramos & Reinoso-Flórez, 2012; Walteros-Rodríguez & Castaño-Rojas, 2020). Por ejemplo, dentro del orden Coleoptera, específicamente para la familia Elmidae, los géneros Heterelmis y Neolemis exhibieron el mayor rango de altura muestreada coincidiendo con lo informado por González-Córdoba et al., (2020a), estos taxones presentan hábitos generalistas y se adaptan a una gran variedad de hábitats, lo que les permite tener una amplia distribución principalmente en la región Andina y en el piedemonte de la cordillera oriental (González-Córdoba et al., 2020b). Por otra parte, Xenelmis y Pseudodisersus aunque han sido encontrados en la región Andina y en la vertiente del Orinoco, no presentaron registros para el departamento de Boyacá, según lo reportado por González-Córdoba et al., (2020a). Sin embargo, Motta-Díaz y Vimos-Lojano (2020) y Gil (2014), sí registraron estos taxones, lo que implica una mayor distribución de estos géneros en el departamento de Boyacá.
La amplia distribución del género Leptonema (Trichoptera) se atribuye a su tolerancia a los cambios de las condiciones ambientales (López-Delgado et al., 2015; Vásquez-Ramos et al., 2010) y a la capacidad de volar en sus etapas adultas lo que les confiere una elevada capacidad de dispersión (Davis et al., 1991). Además, pertenece a la familia Hydropsychidae, la cual alberga cerca de 500 especies en el Neotrópico (Holzenthal & Calor, 2017). En los Andes colombianos se tiene el mayor registro de taxones del orden Trichoptera, a pesar que en las regiones con alturas elevadas la riqueza y abundancia tienden a disminuir (López-Delgado et al., 2015), lo cual concuerda con nuestros resultados, pues con alturas mayores a 2 800 m.s.n.m. solo se registró el género Hydroptila; el cual presenta preferencia por la hojarasca que predomina a mayor altitud debido a la incidencia de la vegetación ribereña y la menor amplitud del cauce (Vásquez-Ramos et al., 2014).
Para la familia Chironomidae se reportaron nueve géneros en total, un número relativamente bajo respecto a lo informado por otros estudios en ríos andinos de la macrocuenca hidrográfica del río Magdalena en los Andes centrales. Por ejemplo, Oviedo-Machado y Reinoso-Flórez (2018) registraron 16 géneros en 19 estaciones de muestreo dentro de un gradiente altitudinal de 230 a 936 m.s.n.m. en el departamento del Tolima, Colombia. La investigación de Rojas-Sandino et al., (2018), reportó 15 géneros en nueve estaciones, que abarcaron un gradiente altitudinal de 351 a 1 057 m.s.n.m. (Tolima, Colombia). Por otra parte, Acosta y Prat (2010) registraron 38 géneros para 35 estaciones evaluadas en el río Cañete (Lima, Perú), situadas en altitudes comprendidas entre 2 500 a 4 400 m.s.n.m. Esta comparación evidencia la presencia de la familia Chironomidae en alturas mayores y menores respecto al gradiente altitudinal evaluado en esta investigación, destacando la amplia distribución de esta familia en ecosistemas lóticos de los Andes.
Los géneros Apsectrotanypus, Pentaneura, Corynoneura, Cardiocladius y Cricotopus, se registraron en alturas superiores a 3 500 m.s.n.m. en Acosta y Prat (2010), por lo tanto, cabe la posibilidad de encontrarlos en zonas de mayor altitud del río Garagoa que no fueron evaluadas, debido a dificultades de acceso en el área de estudio. Respecto a los géneros reportados por Oviedo-Machado y Reinoso-Flórez (2018) y Rojas-Sandino et al., (2018) en zonas de bajas altitudes (230 a 1 057 m.s.n.m.), Pentaneura, Onconeura, Corynoneura, Cardiocladius, Paratanytarsus y Cricotopus presentaron una amplia distribución. Los géneros Paracladopelma y Paratanytarsus fueron los únicos que no se reportaron en las áreas geográficas de las investigaciones anteriormente mencionadas y que estuvieron presentes en el río Garagoa.
Respecto a la taxonomía y distribución de la familia Chironomidae (Diptera) en los Andes orientales colombianos existe poca información. Mendes y Pinho (2016) recopilan los registros disponibles para Colombia, mientras que Ospina et al., (1999), Ruíz-Moreno et al., (2000a) y Ruíz-Moreno et al., (2000b) presentan las características taxonómicas de los géneros en aguas corrientes de la sabana de Bogotá y sus montañas circundantes. En afluentes del río Meta (departamento de Cundinamarca), González-Trujillo et al., (2019) reportan 28 géneros para la familia Chironomidae, al respecto, el presente trabajo aporta cuatro nuevos registros (Parachironomus, Apsectrotanypus, Paratanytarsus y Paracladopelma) para esta cuenca, pero en jurisdicción del departamento de Boyacá.
Factores como la alta heterogeneidad ambiental y la variabilidad en la hidrología pueden promover una mayor biodiversidad en los ecosistemas lóticos (Heino, 2005; Heino et al., 2015a). El número de especies poco frecuentes a lo largo del río Garagoa fue considerable, en zonas con mayor altura y donde la riqueza general de macroinvertebrados acuáticos fue mayor, se presentaron 14 taxones, las zonas intermedias con cinco taxones y tan solo un taxón en zonas bajas. Este patrón se puede relacionar con procesos de intervención antrópica como expansión urbana, agricultura, deforestación, construcción de represas y minería de extracción de material de arrastre que inciden sobre el río Garagoa (Corpochivor, 2018; Lasso et al., 2016) y pueden afectar la calidad y disponibilidad de material alóctono (madera, hojas y sustratos) que pueden proporcionan refugio a la biodiversidad acuática aguas abajo (Agra et al., 2018; Gooderham et al., 2007).
Dentro de los taxones poco frecuentes se destacan los crustáceos decápodos Macrobrachium cf. reyesi y cf. Neostrengeria. El primero, se ha registrado en afluentes del río Orinoco en diferentes departamentos del país, como los ríos Cusiana y Aguazul (Casanare), en la quebrada Arenosa (Cundinamarca), en el río Duda y en el río Guayuriba (Meta) (Campos, 2014; Valencia & Campos, 2007; Vásquez & Bocanegra, 2019), en este estudio se registró para el municipio de Santa María (Boyacá). Por otra parte, cf. Neostrengeria es un género endémico de Colombia con distribución en las dos vertientes y la planicie de la cordillera Oriental (Campos, 2014; Campos & Lasso, 2015), fue registrado para este estudio a una altura de 2 773 m.s.n.m. en el municipio de Boyacá (Boyacá) y se resalta que varias de las especies de este género se encuentran en peligro de extinción, principalmente por la deforestación para agricultura, el ingreso por escorrentía de fertilizantes e insecticidas a los cuerpos de agua, el desarrollo urbano, la fragmentación del hábitat por represas y regulación de regímenes de caudales, la contaminación minera y la introducción de especies invasoras (Campos & Lasso, 2015; Ministerio de Ambiente y Desarrollo Sostenible, 2017). La presencia del cangrejo rojo invasor Procambarus clarkii en el departamento de Boyacá (Camacho-Portocarrero et al., 2021) y en la cuenca del río Garagoa (González-Ruiz et al., 2019), puede afectar a especies nativas del género Neostrengeria, principalmente por competencia, transmisión de parásitos y enfermedades (Campos & Lasso, 2015).
El análisis de macroinvertebrados representativos del hábitat evidenció la presencia de algunos taxones con diferencias notables entre zonas; estas distinciones podrían estar asociadas con cambios en las variables locales (condiciones físicas y químicas, composición de mesohábitats y vegetación de ribera) y de paisaje (uso del suelo y geomorfología) (Díaz-Rojas et al., inédito; Jacobsen, 2008; Peters et al., 2016). En zonas de mayor altitud (Grupo D) géneros como Gundlachia y Dugesia presentaron una mayor exclusividad y presencia; estos organismos aun cuando no exhiben rasgos característicos de adherencia al sustrato, poseen tamaños pequeños que les permite ubicarse en intersticios del sustrato lo cual favorece su prevalencia en sitios con velocidades de flujo moderadas (Tomanova & Usseglio-Polatera, 2007). Adicionalmente, en esta zona, los dípteros Cardiocladius, Pentaneura y Cricotopus manifestaron preferencias en sitios de elevada altitud, donde generalmente la temperatura y el oxígeno disponible tienden a disminuir; estos resultados concuerdan con trabajos previos, que relacionan la distribución de familias del orden Diptera con las características ambientales y la disponibilidad de recursos alimenticios (Acosta & Prat, 2010; Villamarín et al., 2021).
En las zonas altitudinales intermedias (Grupo C) se destacó la especificidad del género Culoptila que presenta una limitada distribución, ya que está restringido principalmente a sustratos rocosos y zonas de salpicadura que le brindan disponibilidad de perifiton como fuente de alimento, este hallazgo concuerda con otros estudios en arroyos andinos que abarcaron gradientes altitudinales similares (1 670 a 2 586 m.s.n.m.) (Duarte-Ramos & Reinoso-Flórez, 2020; Romero et al., 2006). En contraste, Belostoma y Leptohyphes fueron taxones exclusivos que se distinguen en zonas relativamente bajas (Grupo B), sin embargo, estos géneros se han reportado en un gradiente altitudinal más amplio. Leptohyphes se ha asociado con altitudes entre 340 a 3 275 m.s.n.m. y diferentes tipos de sustratos como arena, grava/guijarro, hojarasca y roca (Crespo-Pérez et al., 2016; Gutiérrez y Reinoso-Flórez, 2010; Vásquez-Ramos & Reinoso-Flórez, 2012), además, Belostoma se ha registrado en todas las regiones naturales de Colombia en gradientes altitudinales que van desde los 0 a 2 800 m.s.n.m. (Romero & Noriega, 2013). Por lo tanto, es posible que estos taxones presenten una distribución más amplia en el río Garagoa.
En cuanto a la suficiencia taxonómica se evidencia que la identificación a un nivel más amplio (familia) proporciona resultados similares a los obtenidos a nivel de género para los análisis multivariados PERMANOVA y NMDS. Investigaciones como las de Waite et al., (2004) y Feio et al., (2006), concluyen que los resultados a nivel de familia, con pocas excepciones, resultó ser similar con un nivel taxonómico más bajo. Sin embargo, los resultados obtenidos en las pruebas Pairwise y SIMPER a nivel de género mostraron diferencias sutiles respecto a lo reportado a nivel de familia para esta investigación, además la identificación taxonómica a un nivel más bajo en familias diversas como Chironomidae proporcionan información para profundizar sobre la historia natural, la ecología de los arroyos, la biodiversidad y las especies indicadoras (Jones, 2008; Waite et al., 2004). Por lo tanto, obtener información taxonómica más detallada puede evitar realizar generalizaciones e interpretaciones erradas sobre las relaciones comunidad-ambiente en estudios de ecología comunitaria, biología de la conservación y evaluación ambiental (Heino, 2014; Roldán-Pérez, 2016).
Investigaciones como las de Heino et al., (2015a)y Agra et al., (2018), concuerdan con nuestros resultados, pues señalan una relación inversa entre la latitud, altitud y el cauce de los arroyos (orden limnológico) con el número de taxones acuáticos, lo cual difiere con los patrones esperados de biodiversidad (Heino et al., 2015b; Gaston, 2000; Stevens, 1989). Vásquez-Ramos y Reinoso-Flórez (2012) señalan que encontrar una mayor riqueza de especies en tramos de zonas altas y medias en ecosistemas lóticos se puede atribuir a la variación en los factores abióticos (temperatura, pendiente, geología y tipos de coberturas del suelo) y actividades antrópicas que influyen en la colonización de macroinvertebrados acuáticos en zonas bajas de los Andes colombianos. Es importante tener en cuenta que en la cuenca del río Garagoa los procesos de expansión urbana, agricultura, deforestación, introducción de especies invasoras, construcción de represas y minería de extracción de material de arrastre (Corpochivor, 2018) pueden transformar las interacciones de las comunidades acuáticas y generar importantes consecuencias como extinción local y desplazamiento de especies, además de la pérdida de funciones y servicios ecosistémicos (Brooks et al., 2005; Ríos-Touma & Ramírez, 2019; Vimos-Lojano et al., 2019). En la actualidad, Díaz-Rojas et al., (inédito) estudian la relación del hábitat y la diversidad de macroinvertebrados acuáticos del río Garagoa utilizando predictores de la diversidad en escala espacial local y de paisaje, este tipo de investigaciones permitirán profundizar y explicar mejor los patrones de organización y distribución de esta comunidad (Agra et al., 2018; Heino et al., 2015b).
Nuestros resultados resaltan la importancia de comprender los patrones de distribución de comunidades poco previsibles como los macroinvertebrados acuáticos en ecosistemas acuáticos estratégicos, dinámicos y que sufren constantes transformaciones (Heino et al., 2015a). Considerando que los trabajos sobre biodiversidad de macroinvertebrados en la cuenca del río Garagoa y cuencas aledañas son escasos, se deben realizar más investigaciones que incluyan gradientes de altitud más extensos, períodos hidroclimáticos contrastantes y una cobertura espacial amplia. Por último, consideramos que el listado taxonómico de macroinvertebrados es una herramienta sencilla pero valiosa que ofrece numerosos beneficios para estudios ecológicos, de gestión y conservación de recursos naturales en la región.
Declaración de ética: los autores declaran que todos están de acuerdo con esta publicación y que han hecho aportes que justifican su autoría; que no hay conflicto de interés de ningún tipo; y que han cumplido con todos los requisitos y procedimientos éticos y legales pertinentes. Todas las fuentes de financiamiento se detallan plena y claramente en la sección de agradecimientos. El respectivo documento legal firmado se encuentra en los archivos de la revista.
Contribución de autores: Roa-Fuentes conceptualizó y obtuvo los fondos para la investigación; Barrera-Herrera y Díaz-Rojas realizaron la recolecta e identificación taxonómica de especímenes; Prat realizó identificación y confirmación taxonómica de especímenes. Todos los autores participaron de forma equitativa en la validación de datos, análisis formal, edición y escritura del manuscrito.












 uBio
uBio