Introducción
Melastomataceae es una de las diez familias más diversas del mundo (Christenhusz & Byng, 2016), con > 5 800 especies, entre los 1 000 y 4 000 m de elevación (Penneys et al., 2022). En el Neotrópico se encuentran ca. 3 700 especies (Ulloa et al., 2022) en Colombia 987 (Almeda et al., 2016). Las melastomatáceas presentan estrategias de vida y adaptaciones fundamentales como gran producción de semillas, dispersión eficaz de propágulos, y elevadas tasas de germinación y crecimiento, de modo que, son especies primordiales en la regeneración de los ecosistemas (de Albuquerque et al., 2013). Miconia es el género más grande de la familia con ca. 1 900 especies y el más diverso en el Neotrópico (Michelangeli et al., 2019). Los frutos de las especies de Miconia son consumidos por aves, murciélagos, marsupiales, monos, tortugas, lagartos, peces y pequeños roedores (Messeder et al., 2022), interacción que contribuye al aumento de la resiliencia ecosistémica, la autoregeneración, la reactivación de los procesos ecosistémicos y el establecimiento de otras especies (Goldenberg & Shepherd, 1998). Estas características destacan a Miconia como un importante componente en los ecosistemas, en especial aquellos en peligro con especies únicas, en donde las demandantes condiciones climáticas limitan el recurso alimenticio de la fauna (Rincón, 2015).
Los páramos, importantes refugios de biodiversidad y reguladores hídricos y climáticos, son uno de los ecosistemas con mayor diversidad y abundancia de miconias (Goldenberg et al., 2013), sin embargo, se encuentran en riesgo por actividades humanas, las cuales han provocado la reducción de área y pérdida de especies (Morales et al., 2007). El páramo de Rabanal, localizado en los departamentos de Boyacá y Cundinamarca, no es la excepción, pues la ganadería y los cultivos de papa superan el 45 % de su superficie (Morales et al., 2007), por ello, es necesario el desarrollo de investigaciones que promuevan o aporten información para su conservación y mantenimiento (Andreis et al., 2005). Desde esta problemática, la comprensión de los patrones fenológicos, permite evaluar las posibles respuestas de las comunidades vegetales frente al cambio climático, así como, entender las estrategias de supervivencia de las poblaciones, regeneración, reproducción, oferta temporal de recursos e interacción planta-animal; línea base en el planteamiento y desarrollo de estrategias de conservación de las especies y su hábitat (de Almeida & de Carvalho, 2009).
Aún con lo anterior, son pocos los estudios fenológicos que contemplan y evalúan diferencias y/o sincronías dentro de un género o familia, datos que permiten entender las estrategias reproductivas de especies con mismos polinizadores y/o dispersores (Morellato et al., 2016), como Miconia, género en el que la polinización y frugivoría podrían direccionar la fenología de sus especies. De igual forma, Miconia comprende más del 50 % de las melastomatáceas para Colombia (543 sp.) (Ulloa et al., 2022), y su fenología se ha documentado así: para algunas especies en un bosque pluvial del Pacífico y en un bosque andino de Risaralda (Hilty, 1980; Kessler & Kattan, 2012); para Miconia prasina y Miconia resima en un bosque húmedo de Cundinamarca (Sierra & López, 2021) y para M. elaeoides y Miconia cataractae en el páramo de Rabanal (Manrique et al., 2022); de modo que, este trabajo es pionero en describir y comparar aspectos feno-morfológicos de dos especies de Miconia en un páramo, resultados importantes en la biología reproductiva, manejo y conservación de M. ligustrina y M. elaeoides, y en posteriores estudios de polinización, dispersión, interacciones, conservación y restauración.
Materiales y métodos
Área de estudio: el Distrito Regional de Manejo Integrado (DRMI) Rabanal, municipio de Ventaquemada (Boyacá), comprende un área aproximada de 6 639.4 ha, desde los 2 700 a 3 500 m de elevación. La precipitación y temperatura media son de 885.1 mm y 8.1 °C, y la humedad relativa anual de 85 % (Rubio et al., 2008). Laguna Verde y sus alrededores (5°24’44’’ N & 73°32’43’’ W), área definida para el estudio, está ubicada dentro del DRMI a 3 300 m en la vereda Montoya, sector Mata Negra; la precipitación media anual es de 1 075 mm y la temperatura de 8.2 °C (Rubio et al., 2008). Es un ecosistema con especies de bosque altoandino, de bordes, de pajonales y frailejonales (Moreno-Mancilla et al., 2018), con clima semihúmedo a seco según la clasificación de Caldas-Lang (Morales et al., 2007). Presenta un régimen bimodal de lluvias, de marzo a julio, y de octubre a noviembre, con periodos secos de diciembre a febrero, y de agosto a septiembre (Fig. 1) (Morales et al., 2007).
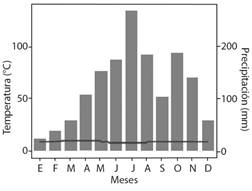
Fig. 1 Registros meteorológicos medios de precipitación y temperatura del sector Laguna Verde, páramo de Rabanal. WorldClim-Global Climate Data. (Fick & Hijmans, 2017). / Fig. 1. Average meteorological records of precipitation and temperature of the Laguna Verde sector, Rabanal paramo. WorldClim-Global Climate Data. (Fick & Hijmans, 2017).
Seguimiento fenológico en campo: se localizaron, marcaron y georreferenciaron 12 individuos por especie de M. ligustrina y M. elaeoides; fueron incluidos aquellos capaces de florecer y/o fructificar, separados entre sí por al menos 2 m (Wallace & Painter, 2003). Durante dos períodos, de septiembre 2019 a febrero 2020, y de abril 2021 a agosto del mismo año (11 meses), se contó mensualmente el número total de botones, flores y frutos (maduros e inmaduros); para ello, se promedió la cantidad de estructuras de tres inflorescencias, y se multiplicó por el total de inflorescencias de cada individuo.
Revisión de ejemplares de herbario: los datos de campo se complementaron con la fenología a partir de ejemplares en estado reproductivo y con fecha de recolecta (dd/mm/aaaa) del Herbario Universidad Pedagógica y Tecnológica de Colombia (UPTC), Herbario Universidad Nacional de Colombia (COL) y Universidad Distrital “Francisco José de Caldas” (UDBC) (Diskin et al., 2012), teniendo en cuenta características de la localidad y altitudes cercanas a 3 000 m. Con el cumplimiento de estos requerimientos, se incluyeron 109 ejemplares de M. ligustrina y 68 de M. elaeoides (Apéndice 1). En cada ejemplar se contó el número de botones, flores y frutos, además, se convirtieron las fechas de recolecta en días julianos o Day Of Year (DOY), y estos en grados circulares (Morellato et al., 2010). Finalmente, se obtuvieron y graficaron datos de precipitación y temperatura media mensual del área de estudio, utilizando las capas climáticas globales de WorldClim-Global ClimateData (Fick & Hijmans, 2017) y el software R (R Core Team, 2016) (Fig. 1).
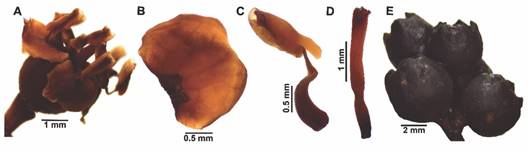
Caracterización morfométrica: con el uso de un estereoscopio y el software LASEZ v3.0, fueron medidas y fotografiadas 30 flores y 30 frutos de cada especie, obtenidos de seis plantas diferentes (n = 5/individuo). Las medidas correspondieron a longitud total y ancho externo de la flor (LTF, AEF); longitud y ancho del hipanto (LH, AH), del pétalo (LPé, APé) y del fruto (LF, AF); y longitud del estambre y pistilo (LE, LPi) (Fig. 2) (Ramírez et al., 2010).
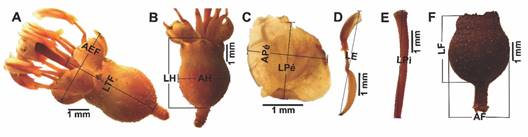
Fig. 2 Medidas morfométricas determinadas en cada especie. A. Flor. B. Hipanto. C. Pétalo. D. Estambre. E. Pistilo. F. Fruto. / Fig. 2. Morphometric measurements determined in each species. A. Flower. B. Hypanthia. C. Petal. D. Stamen. E. Pistil. F. Fruit.
Análisis de datos: los registros fenológicos se analizaron en el programa RStudio (R Core Team, 2016) mediante estadística circular (Morellato et al., 2010). Por especie, la sumatoria mensual de las observaciones realizadas en campo, fue representada en diagramas de rosas. Para la fenología de las colecciones de herbario, se generaron diagramas de densidad a partir de las fechas de recolecta convertidas a grados (Morellato et al., 2010). Se empleó el test de Rayleigh (Z) para testear la uniformidad y estacionalidad de las fenofases; conjuntamente, se halló el desvío patrón (SD), la media circular (µ) y la longitud del vector medio (r), el cual representa la concentración de los datos alrededor de la media, así, cero indica distribución uniforme y uno concentración total (Brito et al., 2017; Maruyama et al., 2019; Morellato et al., 2010). En Past (Hammer et al., 2001) las variables climáticas fueron correlacionadas con el número de flores y frutos inmaduros obtenidos en campo, mediante el coeficiente de correlación de Spearman. Finalmente, se calcularon tendencia central y dispersión en las variables morfométricas (Sánchez et al., 2013).
Resultados
Seguimiento fenológico: M. ligustrina produjo botones durante siete meses, de octubre a abril, con mayor número de estructuras reproductivas a mediados de enero (µ = 11.34°, r = 0.84). La floración inició en febrero, tuvo un pico en abril (µ = 106.76°, r = 0.94) y concluyó en junio; se registraron ~38 flores/inflorescencia. Los frutos inmaduros permanecen durante el año, con un pico entre junio y julio (µ = 179.64°, r = 0.57). En febrero, se contempla aparentemente un pico de frutos maduros, no obstante, son pocos respecto a la cantidad de frutos inmaduros, debido a que muchos no concluyen su maduración o son inmediatamente consumidos por los frugívoros (Fig. 3).
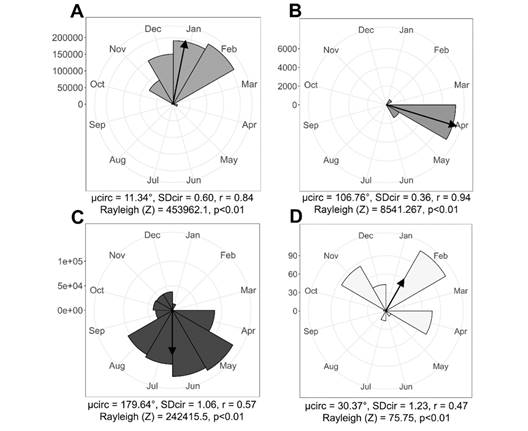
Fig. 3 Datos fenológicos de campo de M. ligustrina. A. Botones. B. Flores. C. Frutos inmaduros. D. Frutos maduros. / Fig. 3. Field phenological data of M. ligustrina. A. Buttons. B. Flowers. C. Immature fruits. D. Ripe fruits.
La fenología de herbario se registró así: la brotación acontece de noviembre a abril, con mayor cantidad de botones entre enero y febrero (µ = 33.42°, r = 0.73). La floración de diciembre a finales de junio, con el pico de mayor producción a finales de marzo (µ = 81.61°, r = 0.54). La fructificación se concentra en julio (µ = 190.28°, r = 0.29), registro que se aproxima al observado en campo.
En el caso de M. elaeoides, la producción de botones inició en julio y se mantuvo hasta febrero, siendo noviembre el mes de mayor ocurrencia (µ = 320.68°, r = 0.73). Enero fue el pico de floración, con un promedio de 44 flores/inflorescencia (µ = 16.76°, r = 0.97), aunque aumentaron también los frutos inmaduros, lo que permite plantear que, en el tiempo transcurrido entre diciembre y enero, ocurrió la floración masiva y breve, propia de las especies de Miconia (Gentry, 1974), así que, en enero los individuos ya se encontraban en fructificación. Por otra parte, la producción de frutos inmaduros aumentó gradualmente hasta mayo, pico de la fenofase (µ = 137.12°, r = 0.45). Al igual que en M. ligustrina, los frutos maduros no son informativos, debido a la frugivoría que impide su conteo (Fig. 4).
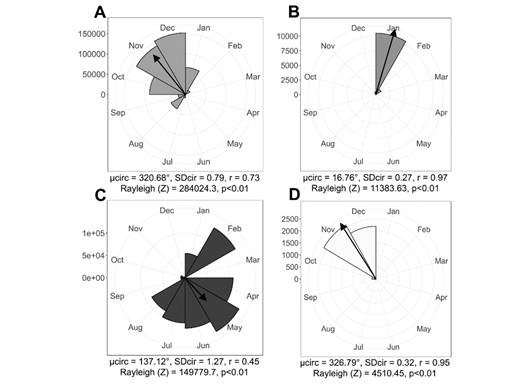
Fig. 4 Datos fenológicos de campo de M. elaeoides. A. Botones. B. Flores. C. Frutos inmaduros. D. Frutos maduros. / Fig. 4. Field phenological data of M. elaeoides. A. Buttons. B. Flowers. C. Immature fruits. D. Ripe fruits.
Los registros de herbario no presentaron una estacionalidad en la fenofase de brotación (P > 0.05). La floración va desde octubre a junio, con el pico en febrero (µ = 41.84°, r = 0.50), temporalidad similar a la observada en los individuos estudiados en campo. Finalmente, la fructificación se concentró en junio (µ = 169.52°, r = 0.45), semejante a lo evidenciado en el área de estudio.
Correlación con variables climáticas: la fructificación de M. ligustrina fue la única fenofase que presentó una correlación directa con la precipitación (Spearman = 0.75, P = 0.005), es decir que, a medida que la precipitación aumenta la cantidad de frutos también, así el pico de esta fenofase fue entre junio y julio, meses más lluviosos en el área de estudio. Respecto a la floración, aunque no correlacionada estadísticamente, se presentó en abril, mes con precipitación baja (Spearman = 0.14, P = 0.65) (Fig. 1). En M. elaeoides, la floración mostró una relación inversa con la precipitación (Spearman = -0.47, P = 0.12), ya que, aconteció en el mes más seco (enero), mientras que, la fructificación tuvo una correlación inversa con la temperatura (Spearman = -0.27, P = 0.38), evidenciando que, a menor temperatura, mayor producción de frutos. El pico de la fenofase fue en mayo, ocasión en el que las lluvias aumentan (Fig. 1).
Caracterización morfométrica: las flores de M. elaeoides son pequeñas, miden 4.88 ± 0.38 mm de largo y 3.57 ± 0.27 mm de ancho (Fig. 5A) (Tabla 1). Los pétalos son libres, suborbiculares, blanco-cremosos, ápice redondeado-obtuso, largo 1.81 ± 0.12 mm y ancho 1.97 ± 0.19 mm, membranosos y glabros (Fig. 5B, Fig. 6A). El hipanto es globoso-elongado, mide 3.12 ± 0.31 mm de largo y 2.91 ± 0.26 mm de ancho, minutamente tuberculado, con tricomas cortos y ralos (Fig. 5A). Los estambres y el pistilo son exertos, blanco-crema, con una longitud media de 4.61 ± 0.40 mm y 4.88 ± 0.24 mm respectivamente (Fig. 5C, Fig. 5D); anteras espatiformes, con las dos tecas profundamente definidas por el tabique; poro terminal ampliamente ovado hasta oblato, de gran tamaño, 0.31 ± 0.05 mm de largo y 0.49 ± 0.06 mm de ancho (Fig. 5C). Los frutos son oblatos, largo 3.75 ± 0.35 mm y ancho 3.94 ± 0.39 mm (Fig. 5E) (Tabla 1), de color verde-grisáceo cuando maduros (Fig. 6B).
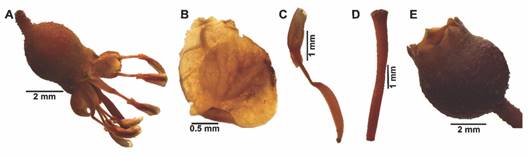
Fig. 5 Estructuras reproductivas de M. elaeoides. A. Flor en antesis. B. Pétalo. C. Estambre. D. Pistilo. E. Fruto. / Fig. 5. Reproductive structures of M. elaeoides. A. Flower in anthesis. B. Petal. C. Stamen. D. Pistil. E. Fruit.

Fig. 6 Inflorescencia e infrutescencia de A.-B. M. elaeoides y C.-D. M. ligustrina. / Fig. 6. Inflorescence and infructescence of A.-B. M. elaeoides and C.-D. M. ligustrina.
Tabla 1 Variabilidad morfológica (mm) en flores y frutos de M. elaeoides y M. ligustrina. / Table 1. Morphological variability (mm) in flowers and fruits of M. elaeoides and M. ligustrina.
| Carácter | M. elaeoides | M. ligustrina | ||||||||||
| Dmín | Dmáx | DE | CV | Dmín | Dmáx | DE | CV | |||||
| LTF | 4.18 | 5.76 | 4.88 | ± | 0.38 | 7.79 | 2.03 | 3.23 | 2.62 | ± | 0.35 | 13.19 |
| AEF | 3.01 | 4.08 | 3.57 | ± | 0.27 | 5.58 | 3.14 | 4.01 | 3.66 | ± | 0.23 | 6.35 |
| LH | 2.60 | 3.82 | 3.12 | ± | 0.31 | 9.88 | 1.87 | 2.73 | 2.29 | ± | 0.26 | 11.31 |
| AH | 2.32 | 3.36 | 2.91 | ± | 0.26 | 8.98 | 2.31 | 3.21 | 2.71 | ± | 0.24 | 8.66 |
| LPé | 1.58 | 2.04 | 1.81 | ± | 0.12 | 6.64 | 1.14 | 1.70 | 1.42 | ± | 0.16 | 11.54 |
| APé | 1.62 | 2.38 | 1.97 | ± | 0.19 | 9.56 | 1.65 | 2.24 | 1.98 | ± | 0.15 | 7.72 |
| LE | 3.63 | 5.25 | 4.61 | ± | 0.40 | 8.49 | 2.10 | 3.11 | 2.62 | ± | 0.28 | 10.51 |
| Lpi | 4.34 | 5.49 | 4.88 | ± | 0.24 | 4.97 | 2.67 | 3.97 | 3.31 | ± | 0.35 | 10.46 |
| LF | 3.13 | 4.36 | 3.75 | ± | 0.35 | 9.22 | 3.68 | 5.46 | 4.56 | ± | 0.51 | 11.29 |
| AF | 3.15 | 4.50 | 3.94 | ± | 0.39 | 9.80 | 4.19 | 6.10 | 5.11 | ± | 0.49 | 9.58 |
Dmín = dato mínimo; Dmáx = dato máximo; = media; DE = desviación estándar; CV = coeficiente de variación (%).
Las flores de M. ligustrina son más pequeñas, miden 2.62 ± 0.35 mm de largo y 3.66 ± 0.23 mm de ancho (Fig. 7A) (Tabla 1). Los pétalos son libres, subrectangulares, blancos, ápice invaginado, largo 1.42 ± 0.16 mm y ancho 1.98 ± 0.15 mm, membranosos y glabros (Fig. 6C, Fig. 7B,). El hipanto es cortamente redondeado, mide 2.29 ± 0.26 mm de largo y 2.71 ± 0.24 mm de ancho, verde claro con manchas vinotinto. Pistilo exerto, blanco, con una longitud de 3.31 ± 0.35 mm, más largo que los estambres (2.62 ± 0.28 mm) (Fig. 7D); anteras obtriangulares a cónicas, con las dos tecas definidas ligeramente por el tabique; poro terminal desde circular hasta semicircular, con una profunda muesca hacia la unión de las tecas, 0.23 ± 0.03 mm de largo y 0.36 ± 0.03 mm de ancho (Fig. 7C). Los frutos son globosos aplanados en el ápice con la proyección de los sépalos, largo 4.56 ± 0.51 mm y ancho 5.11 ± 0.49 mm de ancho, de color verde claro con líneas vinotinto cuando inmaduros (Fig. 6D, Fig. 7E).
Discusión
M. elaeoides y M. ligustrina, especies del mismo género, tienen tiempos de floración y fructificación diferentes. M. elaeoides con un pico de floración en enero, florece primero que M. ligustrina, cuya mayor producción de flores se presentó a mediados de abril. Este comportamiento de floración segregada, probablemente ocurre para evitar la competencia, debido a que las especies comparten un mismo grupo de polinizadores y/o dispersores (Manrique et al., 2022; Poulin et al., 1999). Lo anterior, conlleva a que las plantas desarrollen estrategias evolutivas como la mínima superposición de sus fenofases, a fin de reducir al máximo la competencia interespecífica (Restrepo & Bonilla, 2017).
Aunque los picos de fructificación de las dos especies ocurren en periodos de tiempo cercanos (M. ligustrina en junio-julio y M. elaeoides en mayo), se observa el patrón de fructificación segregado propuesto por Hilty (1980) y Poulin et al. (1999) en Miconia, la primera especie fructifica de abril a diciembre, y la segunda de enero a agosto, aumentando en conjunto la oferta de frutos durante el año. De abril a agosto la fructificación se solapa, y se da la mayor oferta de frutos en las dos especies, periodo que coincide con la temporada más lluviosa en el área de estudio (junio-agosto). Esta correlación con la precipitación es reportada también para Miconia albicans por Allenspach y Dias (2012), quienes evidenciaron que, la mayoría de las especies con dispersión ornitócora fructifican en época de lluvia; Maruyama et al. (2013) lo exponen para algunas especies de Miconia de la sabana de Brasil, y Santos et al. (2010) para Miconia angelana en Minas Gerais. Gran parte de los estudios han sido realizados en Brasil, por lo que, nuestros resultados amplían el reporte de esta correlación para otras especies de Miconia en un páramo de Colombia, aspecto que llama la atención porque es un comportamiento que se mantienen tanto latitudinal como altitudinalmente.
A diferencia de la fructificación, la floración de estas dos especies ocurre en las temporadas más secas del área de estudio (diciembre-abril), resultados que se corroboran con los obtenidos por Manrique et al. (2022) para M. elaeoides, y que pueden estar directamente correlacionados con una mayor abundancia y riqueza de insectos (Hymenoptera y Díptera). No obstante, Brito et al. (2017) proponen esta relación en Microlicieae y Melastomeae, cuyas especies son melitofílicas y dependen de polinizadores especializados para su reproducción, y no en Miconieae, donde los pétalos blancos no funcionan en la atracción de polinizadores, hay producción de néctar y reproducción por apomixia (Gavrutenko et al., 2020; Manrique et al., 2022). Aunque la floración de especies de Miconia en meses secos no está totalmente determinada por la abundancia de polinizadores, puede ser resultado de la alta demanda de agua para la producción de frutos; de modo que, es necesario florecer en estos tiempos, para que la fructificación coincida con las épocas más lluviosas (Brito et al., 2017), y se favorezca el desarrollo de los frutos carnosos, acuosos y ricos en azúcar propios de estas especies (Maruyama et al., 2019).
Si bien algunas especies de Miconia son apomícticas, la presencia y visita de polinizadores no se ven limitadas, por el contrario, se aumenta la fecundación (Maia et al., 2016); así la floración de M. ligustrina y M. elaeoides durante los períodos secos, también puede estar correlacionada en cierto grado con la abundancia de polinizadores. Jordano (2000) sugiere que los picos de fructificación en las plantas ocurren generalmente cuando la tasa fotosintética es baja, es decir, al final de la época seca cuando incrementa la precipitación, o luego de períodos de altas tasas de acumulación de reservas. Además, Beltran y Kattan (2001) establecen que entre marzo y mayo ocurre en los bosques andinos la temporada de reproducción de muchas especies de aves, y entre agosto-octubre la muda.
El estudio fenológico de Melastomataceae realizado por Kessler y Kattan (2012) en un bosque andino de Colombia, mostró que la fructificación de especies con frutos tipo baya de Miconia, Leandra, Ossaea y Henriettella, exhibe dos picos anuales asociados con los periodos de mayor precipitación. De Almeida y de Carvalho (2009) previamente habían validado el anterior supuesto, pues encontraron para M. albicans en el Sur de Minas Gerais, que la floración se desarrolla en la estación más seca, y la maduración de los frutos con la llegada de las lluvias (finales de diciembre), por lo que, la dispersión aconteció en el momento óptimo del año (Batalha & Mantovani, 2000). Con base en lo anterior, se plantea que los picos de fructificación de las dos especies estudiadas probablemente son resultado de varios factores: abundancia de polinizadores que direccionan la floración y, por ende, la fructificación, tiempos de lluvia que aumentan la disponibilidad, acumulación de recursos y actividad de los frugívoros.
No fue posible evidenciar en campo el pico de floración de M. elaeoides, ello se vio reflejado en el desajuste entre el número de flores y frutos inmaduros, que también fue descrito para Miconia ligustroides por Allenspach et al. (2012), quienes plantean que las flores de estas especies permanecen abiertas apenas unos cuantos días, sin observarse incluso en los seguimientos quincenales realizados. La cantidad de flores en las especies de Miconia, se ajusta a la floración de tipo “big-bang” propuesta por Gentry (1974), en la que un individuo puede producir más de 150 000 flores que se abren al mismo tiempo con episodios de corta duración (2-3 días) (Kriebel & Zumbado, 2014), suceso que probablemente representa una ventaja adaptativa frente a las condiciones extremas que caracterizan a los páramos, y que dificultan la polinización y fecundación de las plantas (Manrique et al., 2022).
Las flores y frutos de las dos especies objeto de estudio presentan diferencias en su forma y tamaño, sin embargo, al igual que en otras especies de Miconia miden ~5 mm, con pétalos y anteras blanco-amarillas (Dellinger et al., 2022), característica aparentemente ancestral, que dio lugar a flores más coloridas polinizadas por abejas (Gavrutenko et al., 2020). Las flores de M. elaeoides tienen una longitud (4.88 ± 0.38 mm) mayor que las de M. ligustrina (2.62 ± 0.35 mm), en M. elaeoides las flores son más largas que anchas, en M. ligustrina más anchas que largas. Los poros de las anteras, más largos que anchos en las dos especies, son más grandes en M. elaeoides. Estas diferencias morfométricas entre las dos especies, junto con las variaciones en la forma e indumento, probablemente sean cambios evolutivos direccionados por presiones selectivas como competencia por polinizadores y modos de polinización, que permitieron la diversificación actual de Miconia (Gavrutenko et al., 2020; Goldenberg et al., 2008). Asimismo, la variación morfológica observada entre las especies de estudio demuestra las múltiples interacciones con polinizadores sin síndrome de zumbido, que posiblemente están ocurriendo al interior del género (Gavrutenko et al., 2020).
Goldenberg y Shepherd (1998) al estudiar la morfología floral de Miconia y Leandra, muestran que en Miconia con frecuencia ocurren flores pequeñas que no superan los 5 mm, al igual que Manrique et al. (2022), autores que señalan que las flores de M. elaeoides en promedio tienen una longitud total de 10.97 mm (incluye estambres) y en M. cataractae de 9.61 mm, además, los pétalos de M. elaeoides presentan longitudes alrededor de los 3 mm, similares a las registradas en este estudio. Los resultados obtenidos corroboran que las especies estudiadas tienen anteras cortas con poros grandes, propias de la sección Cremanium, las cuales han sido relacionadas con polinización generalizada, ya que, poros grandes facilitan la extracción de polen a insectos no vibratorios en zonas altas donde las abejas no son muy abundantes (Manrique et al., 2022; Melo et al., 2022).
Los resultados de este estudio se ajustan a los encontrados por Hilty (1980), que reporta, que frutos de las especies de Miconia oscilan entre 4 y 15 mm, así Barbosa et al. (2013) encontraron que los frutos de Miconia prasina tienen un promedio de 5.30 x 6.66 mm, frutos un poco más grandes que los de M. elaeoides. Mendonça et al. (2007) señalan igualmente que, los frutos de especies de Miconia tienen dimensiones cercanas al centímetro, y resaltan que la mayor diferencia entre las especies es el color. Los resultados evidencian diferencias en la longitud, forma y color de las dos especies estudiadas, ratificando la importancia de la combinación de estos caracteres en la separación de especies del mismo género.
La mayoría de las especies de Miconia tienen flores < 5 mm de largo, como documentan Dellinger et al. (2022) y los resultados de este trabajo, de manera que, la longitud de las flores puede ser definida como un carácter del género con excepciones. Flores de tamaño reducido y con antesis corta y simultánea, resultan en una floración masiva, abundante y con alta oferta de polen, rasgo evolutivo que se presume surgió para aumentar la visita de polinizadores y la producción de frutos, garantizando la dispersión (Manrique et al., 2022). Es así como, la producción masiva de pequeñas flores posiblemente sea la causa del éxito evolutivo, amplia distribución y colonización de diferentes ecosistemas del género Miconia (Michelangeli et al., 2022), pues en otros grupos con dispersión zoocora, como las tribus Blakeeae y Henrietteae, en las que se producen pocas flores grandes o muy grandes y pocos frutos, la diversidad es baja respecto al género Miconia (Dellinger et al., 2022).
Los resultados obtenidos para las especies de Miconia en el presente estudio y los reportados por todos los autores anteriores son concordantes. Las fenofases de floración se asocian a periodos secos, y las de fructificación a periodos más lluviosos. El tamaño de las flores y su arquitectura se ajusta con las de otras especies del género. Igualmente, los datos de este estudio demuestran que las dos especies de Miconia altoandinas, presentan inflorescencias con numerosas flores, pequeñas, blanquecinas y con anteras cortas, y entran en antesis en temporadas secas. Se recomienda incrementar los estudios morfométricos en el género, ya que, como se demuestra en este trabajo junto con la investigación de Manrique et al. (2022), las especies de Miconia altoandinas han evolucionado y diversificado su morfología floral, presentando sistemas de polinización generalizada que garantizan su éxito reproductivo, por lo que, estudiarlas contribuirá a entender estas radiaciones adaptativas en Melastomataceae.
Declaración de ética: los autores declaran que todos están de acuerdo con esta publicación y que han hecho aportes que justifican su autoría; que no hay conflicto de interés de ningún tipo; y que han cumplido con todos los requisitos y procedimientos éticos y legales pertinentes. Todas las fuentes de financiamiento se detallan plena y claramente en la sección de agradecimientos. El respectivo documento legal firmado se encuentra en los archivos de la revista.












 uBio
uBio