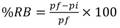Introducción
A través de los años, la obtención de nuevos fármacos ha procurado mejorar los problemas de salud. Especialmente, se han analizado extractos de distintas fuentes vegetales, las cuales han mostrado ser recursos medicinales prometedores para obtener compuestos naturales con la capacidad de tratar distintas enfermedades (Navarro et al., 2017). Se estima que, más del 60% de los fármacos que existen en la actualidad, proceden de fuentes naturales (Alvarado et al., 2013).
De manera natural, las concentraciones de estos compuestos dentro de la planta son bajas o fluctúan debido a variaciones geográficas, estacionales y ambientales (Murthy et al., 2014). Esta situación hace que el uso de las plantas en campo no sea económicamente viable, ya que se tendría que recuperar las grandes extensiones de tierra utilizadas para obtener una cantidad adecuada del compuesto de interés (Pérez, 2008). Es entonces que, el cultivo de órganos in vitro mediante ingeniería genética evidencia una alternativa factible para producir estos fitoquímicos (Tian, 2015).
En este sentido, las plantas del género Phyllanthus destacan por su uso distinguido debido a que cuentan con gran número de metabolitos secundarios presentes en sus especies (Mao et al., 2016). Algunas investigaciones han mostrado la presencia de diferentes metabolitos y se ha encontrado que estos poseen actividad antibacterial, antioxidante, antiviral, antidiabética, antidiarreica, entre otras (Mao et al., 2016; Pettit, 2001; Rondón et al., 2015; Sekaran et al., 2014; Von Keudell & van der Giessen, 2002).
En el caso de la especie P. acuminatus, se le atribuye gran capacidad antitumoral, anticáncer, antimalárica, antihepatotóxica y antimicrobiana (de García et al., 1995; Navarro et al., 2017; Sekaran et al., 2014). Además, estudios fitoquímicos exponen el contenido de lignanos, alcaloides, flavonoides, fenoles, taninos y terpenoides en P. acuminatus, lo cual representa una inmensa fuente de compuestos terapéuticos e industriales (Abhyankar et al., 2013; Makhzoum et al., 2013).
Recientemente, Alvarado et al. (2013) explica que del Instituto Nacional contra el Cáncer (NCI), descubrieron compuestos anticancerígenos en la raíz de P. acuminatus, los cuales son importantes debido a que pueden ser utilizados para el tratamiento de enfermedades como el cáncer de mama. Asimismo, estudios realizados por el Laboratorio de Fitoquímica de la Universidad Nacional de Costa Rica, han logrado identificar cualitativamente, la presencia de filantósidos, lignanos y otros compuestos fenólicos en extractos de la raíz de P. acuminatus.
Sin embargo, a pesar de la anterior literatura, en lo que respecta al estudio del cultivo de las raíces de P. acuminatus como fuente de metabolitos secundarios, es escaso y limitado (Bhattacharyya & Bhattacharyya, 2004; Navarro et al., 2017), ya que hasta el momento no se ha realizado investigación de producción de compuestos de interés para la especie P. acuminatus.
Para lograr la producción de metabolitos secundarios de interés medicinal, se han utilizado distintos sistemas biológicos como lo es el cultivo in vitro de células y órganos (de la Cruz & Gonzalez, 2017). El cultivo de raíces pilosas ha ganado preferencia, ya que este cuenta con la ventaja de ser genética y bioquímicamente estable, tiene potencial enzimático similar a la planta madre y los requerimientos de cultivo son relativamente baratos (Banerjee et al., 2012). Las raíces pilosas consisten en órganos que pueden crecer de manera aislada gracias a la presencia de genes de la bacteria A. rhizogenes, los cuales son transmitidos mediante el proceso de transformación genética (Matveeva & Sokornova, 2016).
Entonces, es trascendental contar con un protocolo que permita el óptimo desarrollo de las raíces pilosas en un cultivo, donde se tomen en cuenta los factores físicos y químicos que influyen en el crecimiento y productividad de estas, lo cual debe ser evaluado de manera experimental (Sevón & Oksman, 2002). Algunos de estos factores de importancia son: densidad del inóculo al iniciar el cultivo, temperatura, composición del medio de cultivo, velocidad de agitación, luz y fotoperiodo, entre otros (Bhattacharyya & Bhattacharyya, 2004; Garro et al., 2012). Por lo anterior, la optimización de condiciones óptimas mediante ingeniería genética y el escalamiento de los cultivos de raíces pilosas son necesarios para la más adecuada producción de biomasa y metabolitos secundarios (Arias et al., 2009; Ooi et al., 2013).
De esta forma, el objetivo de este estudio fue determinar las condiciones óptimas del cultivo líquido, de acuerdo con el porcentaje de inóculo, porcentaje de sales en el medio de cultivo y velocidad de agitación, necesarias para el establecimiento de raíces pilosas de P. acuminatus a nivel de matraz, y también, evaluar el desarrollo de las raíces pilosas en medio líquido mediante el rendimiento del crecimiento de biomasa y la caracterización morfoanatómica.
Materiales y métodos
Material vegetal: El material vegetal utilizado fue cultivos de raíces pilosas de Phyllanthus acuminatus Vahl obtenidos del proceso de transformación genética mediante A. rhizogenes realizado y establecido en el Centro de Investigación en Biotecnología del Instituto Tecnológico de Costa Rica, Costa Rica (Garro et al., 2018).
Optimización para el establecimiento de raíces pilosas en medio líquido
Porcentaje de inóculo y de nutrientes en el medio de cultivo: Para el ensayo de porcentaje de inóculo se probaron dos cantidades de inóculos de 0.10 % y 0.5 %, correspondientes a un peso de 25 mg y 125 mg respectivamente, lo cual se basa en los estudios de Bhattacharyya & Bhattacharya (2004) y Gai et al. (2015). El medio de cultivo utilizado fue la mezcla de sales M&S (Murashige & Skoog, 1962) al 100 % con 3 % de sacarosa a un pH de 5.7. En total para cada porcentaje de inóculo (0.10 % y 0.50 %) se usaron 15 matraces de 125 ml (n = 15).
Para esta parte, se tomaron segmentos de las raíces y se colocaron en papel filtro para remover el exceso de medio de cultivo viejo. Después, se pusieron las raíces en la balanza hasta alcanzar los pesos mencionados. Las raíces pilosas se mantuvieron durante cuatro semanas en el medio líquido con una agitación de 90 min-1, luz difusa, temperatura de 25 ± 2 °C, durante cuatro semanas (Bhattacharyya & Bhattacharya, 2004; Garro et al., 2012).
Transcurrido el tiempo de cuatro semanas, se siguió con la medición del peso fresco final de las raíces en cada matraz (Bansal et al., 2014). Para esto, se dejó secar el conjunto de raíces de los matraces durante 5 min con el flujo de aire de la cámara en papel filtro y luego se determinó el peso.
Del anterior procedimiento, resultó que las mejores condiciones fueron para el porcentaje de inóculo de 0.10 % de raíces pilosas (25 mg). Entonces, se utilizó este inóculo para proceder a determinar el porcentaje de nutrientes. Para esto, se probó el medio de cultivo de acuerdo con el porcentaje de sales, para lo cual se utilizó M&S al 100 %, 50 % y 25 % de sus nutrientes con 3 % de sacarosa y un pH de 5.7 (Bhattacharyya & Bhattacharya, 2004). En total para cada porcentaje de nutrientes (100 %, 50 % y 25 %) se usaron 15 matraces de 125 ml (n = 15).
Luego del pesaje inicial de las raíces pilosas y al ponerlas en el porcentaje de medio correspondiente, se mantuvieron con una agitación a 90 min-1, luz difusa y a una temperatura de 25 ± 2 °C, durante cuatro semanas. Seguidamente, se determinó el peso final de cada uno de los matraces, tal y como se describió anteriormente.
Velocidad de agitación: La definición del porcentaje de inóculo inicial y de nutrientes para el crecimiento de las raíces pilosas, fueron 0.10 % y 25 % respectivamente. Entonces, empleando ambas condiciones, se pasó a definir la velocidad de agitación adecuada para el cultivo líquido de las raíces pilosas. Las velocidades de agitación utilizadas fueron: 90, 100 y 110 min-1, considerando los estudios de Bhattacharyya & Bhattacharya (2004), Garro et al. (2012), Pérez (2008) y Sabater (2013). En total para cada velocidad de agitación (110, 100 y 90 min-1) se usaron 15 matraces para cada valor de agitación (n = 15).
Al igual que los ensayos anteriores, para la medición del peso fresco inicial se tomaron segmentos de raíces y se colocaron en papel filtro para remover el exceso de medio de cultivo viejo. Después, se pusieron las raíces en la balanza hasta alcanzar 25 mg de raíces para cada uno de los matraces. Las condiciones de crecimiento empleadas fueron: luz difusa, a una temperatura de 25 ± 2 °C, durante cuatro semanas. El peso fresco final se realizó igualmente que los ensayos anteriores.
Para calcular la cantidad de biomasa obtenida de las muestras de cada una de las pruebas de optimización (porcentaje de inóculo, porcentaje de nutrientes en el medio y velocidad de agitación) se utilizó ecuación 1, basada en el estudio de Urbanska et al. (2014):
Donde, %RB es el porcentaje de rendimiento de biomasa, pf es peso fresco final y pi es peso fresco inicial, del cúmulo de raíces cada matraz.
Comparación de las condiciones óptimas y condiciones estándar para las raíces pilosas: Se realizó una comparación del crecimiento basado en el porcentaje de rendimiento de biomasa, de las raíces pilosas cultivadas en medio de cultivo M&S al 100 %, agitación 90 min-1 e inóculo de 0.02% (5 mg) (Bhattacharyya & Bhattacharya, 2004; Garro et al., 2012; Pérez, 2008; Sabater, 2013); y raíces pilosas cultivadas bajo las condiciones seleccionadas después de los ensayos de optimización.
En la preparación de las raíces pilosas de ambas condiciones, se pesaron 25 mg para cada matraz de las condiciones optimizadas y 5 mg para cada matraz de las condiciones estándar, tal y como se llevó a cabo en los ensayos de optimización. En total, para cada uno de los dos tratamientos se utilizó un n = 30, donde cada unidad correspondió a un matraz de 125 ml. Las condiciones de cultivo para estos tratamientos fueron: luz difusa, temperatura de 25 ± 2 °C, durante cuatro semanas (Bhattacharyya & Bhattacharya, 2004; Garro et al., 2012).
Transcurrido el tiempo de cuatro semanas, se tomaron las raíces de cada matraz, dejando secar el conjunto de raíces de los matraces durante cinco minutos con el flujo laminar en papel filtro y se pesaron (Bansal et al., 2014). Asimismo, para calcular el porcentaje de rendimiento de biomasa obtenida de las muestras de cada uno de los dos tratamientos (condiciones optimizadas y condiciones estándar) se utilizó nuevamente la ecuación 1.
Comparación morfoanatómica de raíces pilosas versus raíces sin transformar in vitro: El análisis de la morfoanatomía de las raíces pilosas de P. acuminatus se llevó a cabo mediante una comparación de raíces in vitro no transformadas (normales) provenientes de plántulas in vitro y raíces pilosas establecidas del tratamiento de condiciones optimizadas.
Para la visualización de la morfología se utilizó un estereoscopio con un aumento de 40X. Se tomaron las raíces normales no transformadas y las raíces pilosas del medio líquido, y se lavaron con agua destilada para eliminar el medio de cultivo. Luego, todas las raíces fueron colocadas en papel filtro para secarlas. Después, estas se observaron al estereoscopio y se tomaron fotografías para las comparaciones.
Adicionalmente, se realizó un análisis de la morfoanatomía de las raíces in vitro no transformadas y las raíces pilosas, a través de un microscopio electrónico de barrido. Para esto, las muestras de las raíces (sin transformar y transformadas) fueron colocadas en una cinta de carbono con doble cara adhesiva para observarlas en el equipo y realizar las microfotografías de estas.
Análisis estadístico: Los datos del diseño completamente aleatorizado de la optimización fueron analizados teniendo en cuenta el cumplimiento de supuestos estadísticos (normalidad de residuos, igualdad de varianzas, aleatorización y valores atípicos), se establecieron las diferencias de medias y/o medianas por una prueba de t-student de dos muestras para el porcentaje de inóculo y una prueba de Kruskal-Wallis para el porcentaje de nutrientes y velocidad de agitación; con una significancia P < 0.05. Para los datos de las pruebas de condiciones optimizadas vs. condiciones estándar, se hizo uso de un ANDEVA para la comparación de medias por el método de Tukey con una significancia P < 0.05. Todos los análisis fueron realizados a través del programa Minitab® (Minitab, 2021).
Resultados
Optimización para el establecimiento de raíces pilosas en medio líquido
Porcentaje de inóculo y de nutrientes en el medio de cultivo: El efecto del porcentaje de inóculo sobre las raíces pilosas puede ser observado en la Fig. 1A, donde se obtuvo un rendimiento de biomasa mayor para el porcentaje de inóculo de 0.10 % en comparación con el de 0.50 % y estas diferencias fueron significativas (P < 0.05). Por otro lado, el efecto del porcentaje de nutrientes en el medio de cultivo sobre el rendimiento de biomasa es presentado en la Fig. 1B; el rendimiento de biomasa fue mayor para el porcentaje de 25 % de nutrientes en comparación con los porcentajes de 50 % y 100 % (P < 0.05), los cuales resultan ser mucho menores.
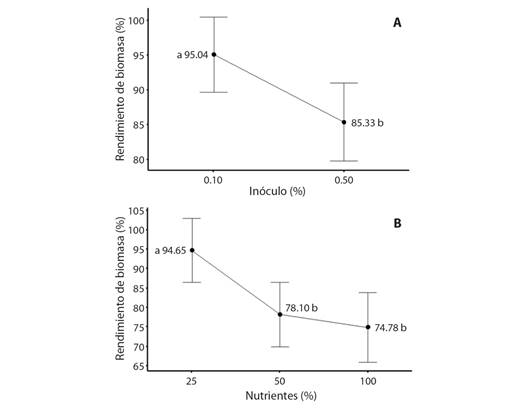
Fig. 1 Porcentajes de rendimiento de biomasa de raíces pilosas de P. acuminatus en medio de cultivo líquido después de cuatro semanas de crecimiento. A. variaciones del porcentaje de inóculo; B. variaciones del porcentaje de nutrientes. Medias/medianas con letras diferentes, difieren significativamente. / Fig. 1. Percentages of P. acuminatus hairy root biomass yield in liquid culture medium after four weeks of growth. A. variations of inoculum percentages; B. variations of nutrients percentages. Means/medians with different letters differ significantly.
Velocidad de agitación: A diferencia de los tratamientos anteriores, los resultados del rendimiento de biomasa según distintos valores de agitación (90, 100, 110 min-1) no mostraron diferencias significativas (P > 0.05) con respecto a sus medias (Fig. 2). No obstante, se puede observar que el rendimiento de biomasa se encontró por encima de un 93 %.
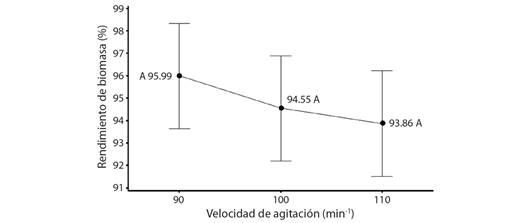
Fig. 2 Porcentajes de rendimiento de biomasa de raíces pilosas de P. acuminatus en medio de cultivo líquido después de cuatro semanas de crecimiento para los tratamientos de velocidad de agitación. Medianas con letras distintas difieren significativamente. / Fig. 2. Percentages of P. acuminatus hairy root biomass yield in liquid culture medium after four weeks of growth for agitation rate treatments. Medians with different letters differ significantly.
Comparación de las condiciones óptimas y condiciones estándar para las raíces pilosas: En la Fig. 3A se muestra el crecimiento de las raíces pilosas en el tratamiento de condiciones optimizadas en las pruebas anteriores (inóculo al 0.10 %, porcentaje nutrientes al 25 % y velocidad de agitación a 90 min-1), donde se observa gran presencia de vellos radiculares, sin callo evidente. Por su parte, la Fig. 3B presenta el crecimiento de las raíces pilosas bajo el tratamiento de condiciones reportadas en literatura (inóculo al 0.02 %, porcentaje nutrientes al 100 % y velocidad de agitación a 90 min-1), las cuales no exponen vellos radiculares, pero sí varias formaciones de callo. Para ambas figuras se puede notar que el crecimiento y morfología es claramente diferente, donde el análisis estadístico comprobó estas diferencias con un P < 0.05.
Fig. 3 Tratamientos de condiciones optimizadas vs. condiciones reportadas de raíces pilosas de P. acuminatus en medio de cultivo líquido después de cuatro semanas a simple vista (1X). A. raíces pilosas bajo condiciones optimizadas; B. raíces pilosas bajo condiciones reportadas. / Fig. 3. Optimized conditions vs. standard conditions treatments of P. acuminatus hairy roots in liquid culture medium after four weeks of growth. A. hairy roots from optimized conditions; B. hairy roots from standard conditions.
Comparación morfoanatómica de raíces pilosas versus raíces sin transformar in vitro: Como se puede observar en la Fig. 4A, las raíces pilosas bajo estereoscopio muestran las siguientes características: presencia de muchas vellosidades, poco callo presente y un comportamiento de geotropismo alterado, es decir, un crecimiento de raíces hacia todas direcciones. Por otro lado, las raíces sin transformar de la Fig. 4C, presentan una raíz principal de la cual salen raíces secundarias, pero con la característica del gravitropismo positivo o bien, crecimiento de raíces hacia abajo. Anatómicamente, se observa en las Fig. 4B y Fig. 4D, que los sistemas vasculares de ambos tipos de raíces son parecidos; sin embargo, existen ciertas excepciones en sus células epidérmicas, pues las raíces pilosas están colocadas de forma más suelta (Fig. 4B), lo cual no sucede para las raíces sin transformar (Fig. 4D).

Fig. 4 Comparación morfoanatómica de raíces de P. acuminatus bajo estereoscopio (40X arriba) y microscopio electrónico de barrido (400X abajo). A.-B. raíces pilosas en medio líquido; C.-D. raíces in vitro sin transformar. / Fig. 4. Morphoanatomical comparison of P. acuminatus roots under stereoscope (40X above) and under scanning electron microscope (400X below). A.-B. hairy roots in liquid culture; C.-D. in vitro un-transformed roots.
Discusión
Optimización para el establecimiento de raíces pilosas en medio líquido
Porcentaje de inóculo y de nutrientes en el medio de cultivo: Las diferencias del rendimiento de la biomasa en las variaciones del porcentaje de inóculo (Fig. 1A) son atribuidas a que, con cantidades de inóculo altas, como las que se presentan en el porcentaje de 0.50 % con menor crecimiento de las raíces, estas entran en senescencia más rápido, manifestando baja capacidad biosintética (Thakore et al., 2017). Con respecto a lo anterior Huang et al. (2004), indican que, con un porcentaje de inóculo adecuado, se puede obtener una distribución uniforme de las raíces y que su comportamiento en matraz sea el más eficiente, justo como sucedió en este estudio cuando se probó el 0.10 % de inóculo. De acuerdo con los rendimientos de biomasa obtenidos en la Fig. 1B, Bhattacharyya & Bhattacharya (2004) y Gai et al., (2015) explican que hay una relación inversamente proporcional entre el tamaño de las raíces y la cantidad de sales presentes, ya que, a menor concentración de nutrientes en el medio, hubo mayor peso de raíces pilosas en el cultivo.
Velocidad de agitación: En las diferentes velocidades utilizadas, se presentaron porcentajes de rendimiento de biomasa por encima de 93 % (Fig. 2), rendimiento favorable en este tipo de tratamiento. En todas las condiciones de velocidad de agitación empleadas en la etapa de matraz probablemente se logra una mezcla adecuada del cultivo, lo que provoca una mayor transferencia de nutrientes del medio a los órganos y la difusión de burbujas para la oxigenación (Baque et al., 2012; Murthy et al., 2008; Murthy et al., 2014) y así un mejor crecimiento. A pesar de lo anterior, se sugiere que, al no haber encontrado diferencias significativas entre los tratamientos, se podría realizar ensayos por fuera del rango de 90-110 rpm.
Comparación de las condiciones óptimas y condiciones estándar para las raíces pilosas: Se puede observar en la Fig. 3A que las raíces desarrolladas en las condiciones optimizadas cuentan con gran cantidad de vellosidades y proliferación de raíces principales y secundarias, de color blanquecino y poca formación de callo, a diferencia de las condiciones estándar, las cuales presentan mucha formación de callo y una morfología muy inusual, mostrando solamente raíces principales muy gruesas sin proliferación de vellos radiculares, tal y como se muestra en la Fig. 3B. Este mismo comportamiento inusual fue reportado en el estudio de Kai et al. (2012), donde las raíces pilosas de Anisodus acutangulus también tuvieron esas dos morfologías, las cuales fueron cultivadas en medio M&S y crecieron a una agitación de 100 min-1 y a una temperatura de 25 °C.
Es importante mencionar que existe una densidad mínima crítica de inóculo por debajo de la cual el crecimiento organogénico puede no tener tanto éxito en la formación y crecimiento de raíces (Murthy et al., 2014). Entonces, al haber usado un inóculo de apenas 0.02 % (5 mg) para las condiciones estándar, resultó en morfologías anormales como se observa en la Fig. 3B. Esta variabilidad morfológica en la que el explante falla en el desarrollo de raíces pilosas normales y en su lugar produce mucha cantidad de callo, se debe a una alteración relacionada con la posición del ADN-T en el genoma de la planta, lo cual puede variar entre especies e incluso entre clones de la misma especie con la que se trabaje (Saravanakumar et al., 2012), como sucedió en este caso, ya que en las condiciones optimizadas (inóculo al 0.10 %, porcentaje nutrientes al 25 % y velocidad de agitación a 90 min-1) el crecimiento fue mejor y normal en comparación con las condiciones estándar.
Comparación morfoanatómica de raíces pilosas versus raíces sin transformar in vitro: La presencia de gran cantidad de vellosidades, poca formación de callo y geotropismo alterado de las raíces pilosas de la Fig. 4A, se ha visto en estudios como el de Ooi et al. (2013), los cuales utilizaron raíces pilosas de Solanum mammosum que fueron cultivadas en medio M&S, crecieron a una agitación de 60 min-1 y a una temperatura de 25 °C; para estas raíces se mostró crecimiento plagiotrópico con alto grado de ramificaciones y abundancia de pelos radiculares. Este crecimiento plagiotrópico se debe probablemente a la ausencia de amiloplastos en los granos de almidón en las raíces pilosas (Setamam et al., 2014); por tanto, llevan al crecimiento de las raíces en distintas direcciones como sucede en P. acuminatus.
En el caso de las raíces sin transformar, se obtuvo de la Fig. 4C, la presencia de raíz principal más raíces secundarias con gravitropismo positivo, lo cual se presenta en raíces naturales sin transformar (Setamam et al., 2014). Además, se observa la formación de callo en la raíz principal, donde la raíz está en contacto con el tallo de la plántula.
Anatómicamente, las diferencias encontradas en las células epidérmicas de los sistemas vasculares de ambos tipos de raíces de las Fig. 4B y Fig. 4D, se debe a que, las células epidérmicas de las raíces pilosas se encuentran situadas de forma suelta y presentan muchos pelos radiculares (Fig. 4B); por otro lado, las raíces sin transformar cuentan con un mayor empacamiento de las células epidérmicas con pocas extensiones de raíz (Fig. 4D), tal y como explican Makhzoum et al. (2013) en raíces de Eschscholzia californica y Papaver somniferum.
Según lo discutido anteriormente, se concluye que la producción de raíces pilosas de P. acuminatus está influenciado significativamente por factores como el porcentaje de inóculo, porcentaje de nutrientes y velocidad de agitación para el rendimiento de biomasa de raíces pilosas a nivel de matraz. Acorde con las condiciones probadas, la mayor cantidad de biomasa se logró con una cantidad de inóculo al 0.10 %, porcentaje de nutrientes en el medio al 25 % y velocidad de agitación a 90 min-1. Estas condiciones de producción in vitro resultan en raíces pilosas con diferencias en morfología con respecto a las raíces sin transformar, específicamente, por la presencia de proliferación de vellos radiculares y comportamiento de gravitropismo negativo. Las condiciones evaluadas en este estudio crean una opción para la producción a mayor escala de la biomasa de las raíces de P. acuminatus.
Declaración de ética: los autores declaran que todos están de acuerdo con esta publicación y que han hecho aportes que justifican su autoría; que no hay conflicto de interés de ningún tipo; y que han cumplido con todos los requisitos y procedimientos éticos y legales pertinentes. Todas las fuentes de financiamiento se detallan plena y claramente en la sección de agradecimientos. El respectivo documento legal firmado se encuentra en los archivos de la revista.












 uBio
uBio