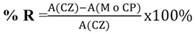Introducción
Durante millones de años, la vida marina ha producido una inmensa variedad de compuestos químicos de exclusivas estructuras y sofisticación (Fernández, Balmaseda, & Regueira, 2015). Desde esta perspectiva y teniendo en cuenta que los mares cubren la mayor parte del planeta, la bioprospección marina en comparación con la terrestre, puede considerarse como la forma más efectiva y prometedora en cuanto al posible descubrimiento de nuevos compuestos bioactivos (Rizzo & Lo Giudice, 2018). Los invertebrados marinos registran una gran diversidad de metabolitos secundarios, alrededor de 10 000 nuevos compuestos químicos son nombrados, estudiados y descritos anualmente (Valdés, Pérez, & Colom, 2010; Birks, 2015). En las últimas décadas se evidenció un continuo desarrollo de fármacos derivados de sustancias aisladas de organismos marinos (Sima & Vetvicka, 2011; Piñón, García, Mendiola, Pérez, & Monzote, 2015). Un gran número de invertebrados viven en íntima asociación con otros animales o plantas o microorganismos, factor que contribuye al incremento de una gran variedad de metabolitos secundarios biológicamente activos (Ramasami et al., 2016).
Como parte de los invertebrados, los holoturoideos, son organismos que habitan todos los ambientes marinos, algunas especies pueden desplegar capacidades natatorias (permanentes o facultativas) en el ambiente pelágico, mientras que otras ocupan distintos sustratos en hábitats bentónicos (Martins, 2012). Estos organismos, mezclan y consumen el material orgánico de los sedimentos, permitiendo así, la entrada del oxígeno, contribuyendo a la estructuración del hábitat y el reciclaje de la materia orgánica (Schneider et al., 2011; Purcell, Conand, Uthicke, & Byrne, 2016). A lo largo de la historia, la pesca de holoturoideos ha sido extensiva, debido principalmente a su amplio uso en la medicina tradicional asiática dadas las numerosas aplicaciones contra la hipertensión, el asma, el reumatismo y otras lesiones (Wang et al., 2012). Estos beneficios biomedicinales se atribuyen a la presencia de componentes químicos, como esteroles, triterpenos, sulfatos de condroitina y glicosaminoglicanos (Baharara, Amini, Kerachian, & Soltani, 2014).
Otros compuestos de interés sintetizados por los pepinos de mar, son los péptidos y los ácidos grasos. Los primeros, son importantes compuestos naturales biológicamente activos que tienen un alto potencial de valores nutracéuticos y medicinales debido a su amplio espectro de bioactividades, como son las actividades antimicrobiana, antiviral, antitumoral, antioxidante, entre otras (Chi, Cheung, Ng, & Wong, 2015). Por su parte, los ácidos grasos se encuentran entre los principales componentes de las membranas celulares y son fundamentales en el mantenimiento de señales nerviosas a lo largo del sistema neuronal (Giménez, 1998). Estos compuestos están involucrados en varias vías bioquímicas y son una fuente importante de energía, son componentes estructurales de las membranas celulares e influyen en la permeabilidad y tráfico de compuestos celulares, la actividad de las proteínas y las rutas de señalización bioquímica (Goncalves et al., 2016).
Antes del descubrimiento y la utilización de los antimicrobianos por parte de la sociedad, las enfermedades infecciosas eran la principal causa de muerte del ser humano, y continúan siéndolo en países en vías de desarrollo (Aties, Duret, Tabío, & Pérez, 2017). Los microorganismos han desarrollado nuevas estrategias que les proveen resistencia a la acción de fármacos, por lo que existe una prioridad de salud pública para explorar y desarrollar agentes antimicrobianos naturales más efectivos, con menores efectos secundarios, buena biodisponibilidad y de toxicidad mínima (Pérez, Falqué, & Dominguez, 2016). Por lo anterior, muchos organismos marinos constituyen una potencial fuente de antimicrobianos capaces de combatir infecciones (Cusimano et al., 2019), en ese sentido, los extractos de especies de pepinos de mar, han demostrado una importante bioactividad (Sellem, Brahmi, Mnasser, Rafrafi, & Bouhaouala-Zahar, 2017).
A pesar de la gran cantidad de compuestos químicos aislados en las últimas décadas a partir de pepinos de mar (Costa Leal, Puga, Serôdio, Gomes, & Calado, 2012; Santafé, Guzmán, & Torres, 2014; Boufridi & Quinn, 2018), en muchas especies como Holothuria (Theelothuria) princeps Selenka, 1867, son muy pocos los reportes acerca de su composición química y estudios de bioprospección. Es por eso, que en este trabajo se identificaron los ácidos grasos presentes en especímenes de H. princeps recolectados en la bahía de Cispatá, Colombia, mostrando los resultados encontrados al cuantificar la actividad antimicrobiana de su extracto metanólico.
Materiales y métodos
Área de estudio: Los especímenes de Holothuria princeps fueron recolectados en el sector Banco de Arena, bahía de Cispatá en el Caribe Colombiano (09°25’26.15” N & 75°47’33.6” W) a profundidades menores a 3 m. El sector se caracteriza por presentar un sustrato arenoso y fango arenoso, lo cual brinda disponibilidad de sustrato importante para el establecimiento de gran variedad de invertebrados marinos, entre los que destacan equinodermos, moluscos, tunicados y esponjas (Nisperuza-Pérez, Quirós-Rodríguez, & Solís-Marín, 2019).
Los 10 ejemplares encontrados, fueron empacados individualmente en frascos de vidrio, con agua de mar y sal Epsom. Luego fueron almacenados en neveras de icopor y transportados al Laboratorio de Productos Naturales Marinos de la Universidad de Córdoba, donde se fotografiaron y observaron al estereoscopio, llevando a cabo un análisis detallado de su morfología.
Identificación del material biológico: La identificación taxonómica de la especie se realizó teniendo en cuenta la forma y combinación de los osículos calcáreos que constituyen el endoesqueleto de los pepinos de mar. Para esto, se realizó un corte de la piel usando una cuchilla de disección en la región ventral, dorsal y en los tentáculos, estos se ubicaron en portaobjetos separados, agregando varias gotas de hipoclorito de sodio hasta disolver la muestra de tejido (Ríos-Jara et al., 2013), posteriormente las muestras fueron observadas al microscopio ocular Leica Dm300 a un aumento de 10-40X. Uno de los ejemplares se determinó como material de referencia, el cual fue depositado en el Laboratorio de Zoología de la Universidad de Córdoba (LZUC-ECH 00112).
Preparación del material biológico: De los especímenes recolectados de H. princeps, 8 fueron cortados enteros en pequeños trozos (350 g peso vivo) y se sometieron a maceración en frío con Metanol en ausencia de luz por 72 horas, luego se filtró y concentró bajo el principio de destilación a presión reducida a 48 °C, obteniendo el extracto metanólico (2.5 g).
Fraccionamiento cromatográfico: El extracto metanólico (1.5 g) fue sometido a cromatografía de columna (CC) usando sistema de elución Bencina: Acetato de Etilo (7:1), las subfracciones obtenidas se monitorearon por cromatografía de capa delgada (CCD), usando patrones de ácido oleico, revelándose con luz ultravioleta y vapores de Yodo (Pastrana, Santafé, & Quirós, 2016). Las subfracciones con Rf similar al ácido oleico se reunieron y se concentraron a presión reducida, logrando la fracción de ácidos grasos (C. Pérez et al., 2016).
Derivatización de ácidos grasos: 100 mg de ácidos grasos se sometieron a reflujo con 5 ml de solución al 12 % de Trifluoruro de Boro en Metanol (BF3/MeOH) por 3 horas a 80 °C. Luego se verificó la esterificación por CCD usando el mismo sistema anterior. La mezcla de reacción se extrajo con Diclorometano y se concentró a 38 °C (Guzmán, Quiroz, Angulo Ortiz, Torres, & Santafé, 2014). Los ésteres metílicos obtenidos se purificaron por CC y posteriormente se analizaron por cromatografía de gases acoplado a espectrometría de masas (CG-EM) (Fuentes et al., 2013)
Identificación de los compuestos aislados: Los compuestos aislados fueron identificados a partir de los análisis de los espectros de masas, obtenidos por impacto electrónico, los cuales fueron estudiados, elucidados y comparados con los reportados en la bibliografía especializada (Pastrana Franco, Santafé Patiño, & Sánchez Romero, 2019).
Ensayos de la actividad antimicrobiana: La actividad antimicrobiana de los extractos a concentraciones entre 25 y 2 500 ppm (diluidos en Dimetilsulfóxido al 10 %), se evaluó frente a cepas de referencia de Escherichia coli (ATCC 25 922), Pseudomona aeruginosa (ATCC 27 852), Staphylococcus aureus (ATCC 29 213), Klebsiella pneumoniae (ATCC 10 031), Enterococcus faecalis (ATCC 29 212) y Candida albicans (ATCC 10 231); además de aislados clínicos de Candida albicans (Sangre) y Candida krusei (Catéter). Se empleó el método de microdilución, para lo cual se utilizaron microplacas ELISA de 96 pozos, sobre los que se adicionaron 50 μl de los extractos y 50 μl de la suspensión microbiana previamente estandarizada. Las microplacas fueron selladas con adhesivos e incubadas a 36 °C para bacterias y 27 °C para hongos, durante 24 horas. Tras la incubación, el crecimiento microbiano se evaluó midiendo los valores de absorbancia a 630 nm en el lector de ELISA. Como control positivo se utilizó Fluconazol a 500 ppm, para hongos y Ciprofloxacina a 500 ppm para bacterias (Méndez, Angulo, & Contreras, 2016). Se calculó el porcentaje de reducción del crecimiento microbiano por parte del extracto y del control positivo (% R) utilizando la ecuación 1, para determinar el grado de inhibición de los extractos y del control positivo, donde A(CZ) es la absorbancia del control de crecimiento, A(M) es la absorbancia de la muestra y A(CP) la absorbancia del control positivo (Mohammadi & Rohloff, 2016).
Ecuación 1: % de Reducción del crecimiento bacteriano.
Análisis estadístico: Para la determinación de la actividad antimicrobiana por el método de microdilución, se realizó una prueba de Shapiro-Wilk para la determinación de la normalidad y la homogeneidad de varianza. Además, se realizó un análisis de varianza no paramétrico de Kruskal Wallis haciendo partición por extractos y por concentración usando el software estadístico InfoStat versión 2018e.
Resultados
Identificación de ácidos grasos: A partir de la cromatografía de gases, y por medio del análisis de los espectros de masas de impacto electrónico de los compuestos encontrados, se identificaron de 16 compuestos en la especie Holothuria princeps, los cuales son mostrados en la Tabla 1.
Tabla 1 TABLE 1 Ácidos grasos identificados Identified fatty acids
| No | Compuesto | M+ |
| 1 | Ester metílico del ácido tetradecanoico | 242 |
| 2 | Ester metílico del ácido 13-metiltetradecanoico | 256 |
| 3 | Ester metílico del ácido pentadecanoico | 256 |
| 4 | Ester metílico del ácido 9-Hexaddecenoico | 268 |
| 5 | Ester metílico del ácido hexadecanoico | 270 |
| 6 | Ester metílico del ácido 10-metilhexadecanoico | 284 |
| 7 | Ester metílico del ácido 10-heptadecenoico | 282 |
| 8 | Ester metílico del ácido heptadecanoico | 284 |
| 9 | Ester metílico del ácido 11-octadecenoico | 296 |
| 10 | Ester metílico del ácido octadecanoico | 298 |
| 11 | Ester metílico del ácido 2-undecilciclopropanopentanoico | 310 |
| 12 | Ester metílico del ácido nonadecanoico | 312 |
| 13 | Ester metílico del ácido 11-eicosenoico | 324 |
| 14 | Ester metílico del ácido eicosanoico | 326 |
| 15 | Ester metílico del ácido 2-octilciclopropanodecanoico | 340 |
| 16 | Ester metílico del ácido heneicosanoico | 340 |
La composición de los ácidos grasos lineales (75 %) se encuentran en mayor proporción que los ramificados (25 %) en la subfracción lipídica. En cuanto a las insaturaciones, es evidente la prevalencia de ácidos grasos saturados (AGS) (68.75 %) sobre los monoinsaturados (AGMI) (31.25 %), no se encontraron compuestos poliinsaturados.
Actividad antibacteriana: Las concentraciones del extracto metanólico de H. princeps más efectivas frente a cada uno de los microorganismos tratados se muestran en la Tabla 2, el porcentaje de reducción del crecimiento microbiano a esas concentraciones y su comparación con el control positivo a 500 ppm se presenta en la Fig. 1.
Tabla 2 TABLE 2 Concentración más efectiva del extracto en metanol de H. princeps frente a cada uno de los microorganismos utilizados Most effective concentration of methanolic extract of H. princeps against each of the microorganisms used
| Microrganismo | Concentración (ppm) | Absorbancia | ||
| M | C | Cf | ||
| K. pneumoniae | 25 | 0.44 | 1.34 | 0.09 |
| E. faecalis | 25 | 0.63 | 1.44 | 0.24 |
| E. coli | 50 | 0.54 | 0.94 | 0.71 |
| P. aeruginosa | 750 | 0.62 | 1.18 | 0.10 |
| S. aureus | 750 | 0.49 | 0.87 | 0.20 |
| C. krusei (catéter) | 1 750 | 0.55 | 1.21 | 0.57 |
| C. albicans (sangre) | 2 250 | 0.60 | 1.26 | 0.71 |
| C. albicans ATCC 10231 | 2 250 | 0.70 | 1.04 | 0.64 |
M: absorbancias de las muestras, C: absorbancias del control de crecimiento y Cf: absorbancias del control positivo.
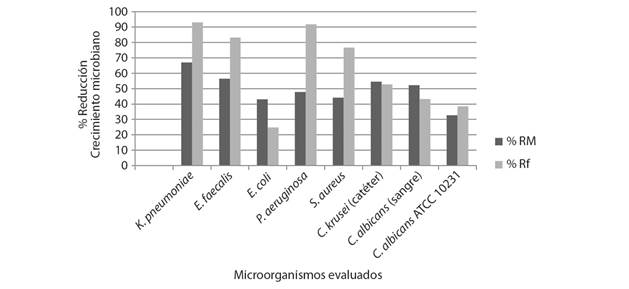
Fig. 1 Fig. 1 Porcentaje de reducción del extracto y del control positivo frente a cada una de los microorganismos tratados (% RM: es el porcentaje de reducción del crecimiento microbiano de H. princeps; % Rf: porcentaje de reducción del control positivo a 500 ppm). Percentage reduction of the extract and positive control against each of the microorganisms treated (% RM: percentage of reduction of the microbial growth of H. princeps; % Rf: percentage of reduction of the positive control at 500 ppm).
Todos los tratamientos bacterianos respondieron distinto ante diferentes concentraciones del extracto metanólico de ácidos grasos de Holothuria princeps y se observó que los resultados no siguieron un comportamiento normalizado (Shapiro-Wilk, valor-P: 0.04144). Se resaltan la inhibición del 67 y 56 % del crecimiento de las cepas de K. pneumoniae y E. faecalis respectivamente, por parte del extracto a 25 ppm, así como la inhibición a 50 ppm frente a E. coli en donde el efecto es casi el doble del control positivo. En cuanto a los hongos, se observó que, en ninguna concentración del extracto, el porcentaje de reducción de la cepa de referencia de C. albicans (ATCC 10 231) supera al Fluconazol a 500 ppm; también se evidenció que a más altas concentraciones se presentan menores absorbancias. Además, se pudo establecer que, en la mayoría de las concentraciones utilizadas, el aislado clínico de C. albicans (sangre) fue el hongo más susceptible al efecto del extracto.
Discusión
Los ácidos grasos en los pepinos de mar son componentes esenciales, responsables de la reparación de tejidos y las propiedades de regeneración (Ibrahim, Wong, Mohamed, & Mohamed, 2018). La composición de los ácidos grasos en los pepinos de mar puede variar por diferentes factores, por la disponibilidad de los ingredientes de la dieta y las fuentes alimenticias (Al Azad, Shaleh, & Siddiquee, 2017), por la temperatura ambiente del hábitat (Taboada, Gonzalez, & Rodriguez, 2003), e incluso por la profundidad en la que viven, donde su síntesis está relacionada con el mantenimiento de la fluidez de la membrana a altas presiones y bajas temperaturas (Mehmet, Sevgili, Tufan, Emre, & Ko, 2011). A diferencia de estudios anteriores realizados en especies del género Holothuria, en la subfracción lipídica estudiada de H. princeps se encontró la prevalencia de ácidos grasos saturados sobre los monoinsaturados y no se evidenciaron ácidos grasos poliinsaturados. Es de resaltar, que los componentes dominantes entre los ácidos grasos saturados y monoinsaturados de H. princeps, fueron el ácido hexadecanoico (palmítico) y el ácido 11-eicosenoico respectivamente, lo que coincide con otras especies de pepinos de mar (Bordbar, Anwar, & Saari, 2011).
Investigaciones recientes, demuestran que productos naturales extraídos de pepinos de mar como saponinas, triterpenos y ácidos grasos, han sido probados en varios estudios como posibles agentes antimicrobianos (Nazemi et al., 2020). En este trabajo se evidenció una disminución del crecimiento bacteriano a concentraciones bajas del extracto, siendo el efecto en algunos casos, mayor que el mostrado por la Ciprofloxacina a 500 ppm, resultados que coinciden con extractos orgánicos de otras especies del género, como H. parva (Ebrahimi et al., 2018), H. scabra, H. leucospilota y H. atra (Abdallah & Ibrahim, 2013). Sin embargo, en el extracto metanólico de H. princeps, Enterococcus faecalis y Pseudomonas aeruginosa fueron las bacterias más susceptibles, lo que contrasta con los resultados obtenidos por (Mashjoor & Yousefzadi, 2016), donde la inhibición de estas bacterias fue mínima.
En estudios previos llevados a cabo con otras especies de Holothurios (Ismail et al., 2008; Santafé, Guzmán, & Torres, 2014; Santos et al., 2016), se ha evidenciado que los extractos orgánicos poseen actividad fungicida contra ciertas cepas de hongos. En este sentido, el extracto metanólico de H. princeps logró reducir el crecimiento de los hongos C. albicans (ATCC 10 231), C. albicans (muestra de sangre) y C. krusei (muestra de catéter), principalmente a las concentraciones más altas (mayores a 1 500 ppm), lo que sugiere la presencia de compuestos antifúngicos dentro del extracto.
Declaración de ética: los autores declaran que todos están de acuerdo con esta publicación y que han hecho aportes que justifican su autoría; que no hay conflic-to de interés de ningún tipo; y que han cumplido con todos los requisitos y pro-cedimientos éticos y legales pertinentes. Todas las fuentes de financiamiento se detallan plena y claramente en la sección de agradecimientos. El respectivo do-cumento legal firmado se encuentra en los archivos de la revista.












 uBio
uBio