Introducción
Hasta el 2014, las principales causas de morbilidad han sido las enfermedades infecciosas, los tres primeros lugares los han ocupado las infecciones respiratorias agudas, las infecciones intestinales por otros organismos y las de vías urinarias (Soto, Moreno, & Pahua, 2016). El uso excesivo de antibióticos para tratar estas infecciones ha traído el aumento de resistencia de los microorganismos reduciendo las posibilidades de tratamientos eficaces y aumento en el riesgo de mortalidad de los pacientes (Andersson & Hughes, 2011; Serra, 2017). Por lo consiguiente, la búsqueda de nuevas estrategias naturales y no convencionales se ha vuelto constante (Morroni et al., 2018). Estudios recientes han demostrado que los propóleos son una fuente de compuestos bioactivos con distintas actividades; antibacterial, fungistática, antiviral, antioxidante, antiinflamatoria, citotóxica y anticancerígena (Sartori et al., 2012, Popova, Chinou, Marekov, & Bankova, 2013, Choudhari, Haghniaz, Rajwade, & Paknikar, 2013, Inui et al., 2014, Wang et al., 2014, Nina et al., 2015).
Los propóleos es una substancia que las abejas utilizan para construir y proteger la colmena. Es elaborado a partir de savias, resinas, gomas y mucílagos de plantas mezcladas con cera y secreciones bucales (Massaro, Simpson, Powell, & Brooks, 2015). Se ha encontrado que algunas especies de abejas neotropicales recolectan barro para agregarlo a la mezcla (Araújo et al., 2015). Por lo tanto, la zona geográfica y las plantas de origen determinarán la composición química de los propóleos (Santos et al., 2017). En diversos estudios enfocados en su caracterización química, se han reportado aproximadamente 300 compuestos, destacando los flavonoides, terpenos y fenoles (Huang, Zhang, Wang, Li, & Hu, 2014).
Por otro lado, existen otras fuentes naturales para la obtención de compuestos bioactivos que también pudieran combatir resistencias microbianas como es el caso de ajo (Allium sativum) y otras plantas de la familia Allium. La alicina, alina y otros compuestos ricos en azufre, incluyendo compuestos fenólicos de alta reactividad, son componentes principales de A. sativum con propiedades antibacterianas (Guillamón, 2018).
Una de las posibilidades para mejorar el espectro de acción de las terapias actuales es el uso combinado de antibióticos, convencionales y no convencionales, con fuentes naturales (Amber, Aijaz, Immaculata, Luqman, & Nikhat, 2010, Chanda & Rakholiya, 2011, Ushimaru, Barbosa, Fernández, Stasi, & Júnior, 2012, Lozano et al., 2013).
En ensayos in vitro con Staphylococcus aureus meticilina resistente (SARM), en la combinación de extracto de propóleos de Apis mellifera con ajo (Allium sativum) se han encontrado efectos inhibitorios sinérgicos (Rajic-Savic & Valovic; 2009, Moreno-Cruz et al., 2014).
Sin embargo, dado que no hay reportes de estudios del efecto que tienen los propóleos producidos por abejas sin aguijón en combinación con ajo sobre SARM, el presente estudio tiene como objetivo evaluar la actividad antimicrobiana de propóleos producidos por abejas sin aguijón en combinación con extractos de ajo (Allium sativum), específicamente contra Staphylococcus aureus resistente a meticilina (SARM).
Materiales y métodos
Propóleos: Se obtuvieron nueve muestras de propóleos a través de la “Asociación de Meliponicultores del Soconusco S.C. de R. L.”, ubicados en los municipios de la región del Soconusco en: Tapachula (Rancho “San Juan” Viva México (RSJ): (14°54’00” N & 92°19’01” O), Cantón la pita rancho agroecológico “Ayol” (TAP) (14°49’46” N & 92°17’42” W), Tuxtla Chico (Izapa I; TCIa e Izapa II; TCIb) (14°54’19” N & 92°11’19” W), Cacahoatán (CAC): (15°0’13” N & 92°10’6”W) y Mazatán (MAZ): Rancho “El cocal II” (14°50’22.2” N & 92°10’58.6” W).
Las especies de abejas sin aguijón y el sitio de muestreo fueron los siguientes: Melipona beecheii (MbTAP, MbTCIa), M. solani (MsTCIa), Tetragonisca angustula (TaRSJ) y Scaptotrigona mexicana (SmTAP, SmRSJ, SmCAC, SmMAZ, SmTCIb). Las muestras se colectaron con herramientas de acero inoxidable previamente esterilizadas, tomando aproximadamente 50 g de propóleos. Las muestras fueron trasladadas al laboratorio y conservadas en refrigeración a 4-8 °C.
Extractos: A todas las muestras de propóleos se les retiraron, manualmente, los residuos de plantas, insectos y trozos de maderas desprendidos de la caja al momento de la recolecta. Se pesaron 30 g de propóleos y se depositaron en frascos estériles protegidos de la luz con 100 mL de etanol grado HPLC (Fermont®) (99.5 %). Se agitaron manualmente por un lapso de 15 min durante 8 días. Posteriormente, el contenido de los frascos se filtró a través de papel Whatman No. 41. Para la elaboración de los extractos de ajo, los frutos se adquirieron en el mercado local. Una vez retirada la cáscara fueron cortados en trozos de 1 cm. Se pesaron 30 g de ajo y fueron depositados en frascos protegidos de la luz con 100 mL de etanol (99.5 %) por ocho días. Luego fueron filtrados tal como se describe para los propóleos. Todos los extractos se almacenaron en refrigeración a 4-8 °C (Lozano et al., 2013, Moreno et al., 2014).
Caracterización química: La caracterización química de los propóleos se determinó por medio de Cromatografía Líquida de Alta Resolución en un equipo Agilent 1 200 (con bomba binaria y autoinyector). Las condiciones de operación fueron: temperatura de columna 25 °C, flujo de fase móvil de 1 mL/min, en relación 35:65 v/v. Volumen de inyección 2 µL. Fragmentador a 135 V. Modo Scan. Rango de masas de 100 a 1 000. Polaridad positiva y negativa. Modo de ionización electroespray ESI. Temperatura de gas secante a 200 °C. Flujo de gas de 13 L/min y nebulizador a 2 atm. Tiempo de corrida de 20 min. Cada 5 min se realizó la lectura correspondiente para obtener los compuestos de los propóleos hasta completar una corrida total de 20 min.
Preparación del inóculo: Se utilizaron cultivos de SARM provenientes del laboratorio de la Facultad de Ciencias Químicas de la UJED previamente caracterizadas con base a lo establecido por el Clinical and Laboratory Standards Institute (2013). Al momento del estudio, las cepas se encontraban preservadas a -20 °C en medio Skim Milk. Las cepas se activaron resembrándolas en caldo Mueller-Hinton durante 24 h a 35 ºC. Posteriormente se sembró por extensión en placas de Petri con agar Mueller-Hinton adicionadas con 2 % de NaCl para aumentar la selectividad del medio y se incubaron por 24 h a 35 ºC. Finalmente, se tomaron cinco colonias y se suspendieron en 100 mL de caldo Mueller-Hinton adicionado con NaCl al 2 %. La determinación de la concentración celular se realizó por conteo al microscopio en cámara de Neubauer.
Estudio de inhibición: Se siguió el método de macrodilución (Taroco, Seija, & Vignoli, 2006). Con base a trabajos previos (Lozano et al., 2013; Moreno et al., 2014), se ensayaron seis rangos de dilución: 1:4, 1:8, 1:16, 1:32, 1:64 y 1:128 (v/v) para los extractos de propóleos y para el extracto de ajo se ensayaron siete rangos de dilución: 1:2, 1:4, 1:8, 1:16, 1:32, 1:64 y 1:128 (v/v). Se depositó 1 mL de caldo Mueller-Hilton estéril como diluyente en cada tubo. Posteriormente se depositó 1 mL del extracto correspondiente en el primer tubo de la serie, se agitó y se transfirió 1 mL al siguiente tubo hasta llegar al sexto tubo. Al último tubo de la serie se le extrajo 1 mL y se desechó. Al final, se depositó 1 mL de inoculo en cada tubo para lograr las concentraciones de los extractos antes mencionadas. Se agitaron los tubos y se dejaron reposar durante 20 min para que el extracto funcionara. Posterior a esto, se sembraron 10 μL de cada tubo en placas con agar Mueller-Hinton adicionadas con NaCl al 2 %. Tanto los tubos como las placas. Para descartar el efecto inhibitorio del etanol, se realizó el mismo proceso sustituyendo tanto los extractos de propóleos como de ajo, por etanol. Todas las pruebas se hicieron por triplicado. Después del tiempo de incubación se contabilizaron las colonias crecidas en placas para determinar la población expresada como UFC x 106.
Concentración mínima inhibitoria, concentración mínima bactericida y concentración efectiva 50: Para determinar la Concentración Mínima Inhibitoria (CMI) se leyó la absorbancia a los tubos inoculados por espectrometría a una longitud de onda de 625 nm, usando como “blanco” caldo estéril. Esto se realizó para cada una de las repeticiones.
Por otra parte, se realizó el conteo de colonias en placa y se reportó como UFCx106 mL-1. Se estableció como Concentración Mínima Bactericida (CMB) aquella concentración a la cual no hubiera crecimiento en placa.
La concentración efectiva 50 (CE50) se calculó de la siguiente forma: a) en cada caso se determinó la mortalidad como la diferencia entre la población inicial (inóculo) y la contabilizada en la placa a cada concentración de antibiótico. b) se denominó al porcentaje de efecto (PE) como la relación entre la media de la mortalidad para las tres corridas en cada concentración y el inóculo expresado en porcentaje. c) Para obtener la curva dosis-respuesta se realizó un gráfico del log de las concentraciones en el eje de las abscisas y el PE en el eje de las ordenadas obteniéndose una recta. Con ello, se determinó la ecuación de la recta correspondiente. d) Finalmente, con dicha ecuación se calculó la concentración a la cual se obtendría el 50 % de efecto (CE50). Para expresar las CMI, CMB Y CE50 en mg mL -1, se colocaron 5 mL de cada extracto en una termobalanza a 36 °C durante 90 min. Se realizaron lecturas cada 10 min hasta observar que ya no había cambios en el peso. Esto se realizó por triplicado.
Análisis de datos: Las medias de la concentración mínima inhibitoria (CMI) para la combinación de extractos de propóleos y ajo, y concentración mínima bactericida (CMB) de los diferentes tratamientos fueron sometidos a un ANOVA para determinar diferencia entre las medias de los tratamientos y en los que hubo diferencia se realizó un contraste de dichas medias con prueba Tukey a través del Software estadístico Infostat 2015.
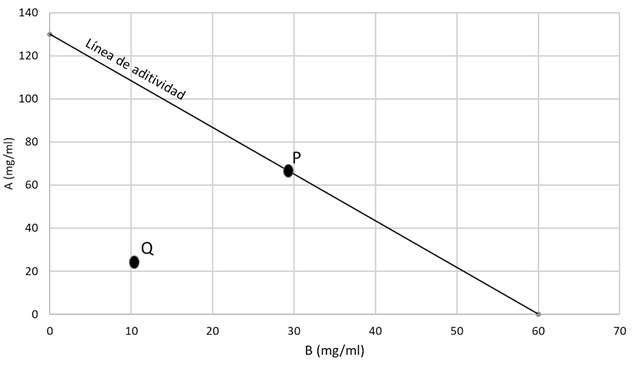
Combinaciones: Se utilizó la técnica para estudios isobolográficos descrita por Tallarida en 2001. La línea se estableció con base a la CE50 promedio de la cepa SARM, como se describió líneas arriba. Según la técnica citada, al combinar un antimicrobiano A, la dosis de 50 % (CE50 - punto A en la Fig. 1) con una dosis igual de 50 % de otro antimicrobiano B (punto B), se obtiene un efecto conjunto del 100 %, es decir, equivalente al obtenido por cualquiera de ellos si se administrara de forma independiente. La línea que une ambos puntos se denomina “línea de aditividad” o “isobola” (Fig. 1).
Para evaluar un posible efecto sinérgico se ensayaron las combinaciones descritas en la Tabla 1. Con los resultados obtenidos, se determinaron las CE50e de las mezclas, así como las concentraciones individuales (Tabla 2). Las medias de las CE50 calculadas se compararon con las CE50e para verificar si fueron diferentes mediante la prueba “t” Student para datos independientes. Posteriormente se calculó el índice de interacción (ɤ) con estos datos, mediante la siguiente ecuación:
ɤ = a/A + b/B
Donde: A = Concentración de propóleos administrado en forma individual que presenta el 100 % de inhibición.
B = Concentración de Allium sativum administrado en forma individual que presenta el 100 % de inhibición.
a y b = Concentraciones de cada antimicrobiano usadas en la combinación.
Tabla 1 TABLE 1 Combinaciones teóricas usadas en el estudio Isobolográfico expresados en mg mL-1 Theoretical combinations used in the Isobolographic study expressed in mg mL-1
| A.s. | SmRSJ | A.s. | SmMAZ | A.s. | SmTCIb | A.s. | MsTCla | ||||
| Combinación | zt | Combinación | zt | Combinación | zt | Combinación | zt | ||||
| 4.2 | 1.7 | 4.2 | 2.7 | 4.2 | 1 | 4.2 | 1.40 | ||||
| 2.1 | 0.85 | 2.95 | 2.1 | 1.35 | 3.45 | 2.1 | 0.5 | 2.6 | 2.1 | 0.70 | 2.8 |
| 1.05 | 0.425 | 1.47 | 1.05 | 0.33 | 1.72 | 1.05 | 0.25 | 1.3 | 1.05 | 0.35 | 1.4 |
A.s.: Allium sativum; zt: suma de ambos extractos.
zt: sum of both extracts.
Tabla 2 TABLE 2 Combinaciones experimentales expresadas en mg mL-1 e índice de interacción ɤ Experimental combinations expressed in mg mL-1 and interaction index ɤ
| A.s. | SmRSJ | A.s. | SmMAZ | |||||||||||
| CE50 | Zmix | Zt | ɤ | CE50 | Zmix | Zt | ɤ | |||||||
| 0.0021 | 0.0008 | 0.0029 | 2.95 | 1 | 1.0174 | 1.5826 | 2.6 | 3.45 | 1 | |||||
| A.s. | SmTClb | A.s. | MsTCla | |||||||||||
| CE50 | Zmix | zt | ɤ | CE50 | Zmix | Zt | ɤ | |||||||
| 0.0113 | 0.0027 | 0.014 | 2.6 | 1 | 4.6385 | 1.5615 | 6.2 | 2.8 | 0.3 | |||||
A.s.: Allium sativum.
Zmix: Combinación efectiva 50 experimental; Zt: Combinación efectiva 50 teórica; Índice de interacción (ɤ): ɤ = 1, efecto aditivo, ɤ < 1, efecto sinérgico y ɤ > 1, efecto antagónico.
Zmix: Experimental effective combination 50; Zt: Theoretical 50 effective combination; Interaction index (ɤ): ɤ = 1, additive effect, ɤ < 1, synergistic effect and ɤ > 1, antagonistic effect.
Si ɤ es igual a 1, se tiene un efecto simple aditivo, si es mayor que 1 el efecto se considera antagónico. Finalmente, si ɤ es menor que 1 y la prueba “t” arroja diferencias significativas, se considera un efecto sinérgico.
Resultados
Caracterización química de los propóleos: Los resultados de análisis por HPLC/MS/MS de los distintos propóleos se muestran en la Tabla 3. Se tomó como ion de referencia el ácido ferúlico debido a que presentó la mayor abundancia iónica. Los propóleos de abejas sin aguijón llegaron a contener alrededor de 16 compuestos, los cuales pertenecen a los ácidos orgánicos y derivados de los terpenos, y se presentaron en mayor proporción respecto al ion de referencia. El ácido ferúlico fue identificado en todas las muestras, mientras que la naringenina y totarolona fueron detectados en siete de las nueve muestras recolectadas.
Tabla 3 Table 3 Compuestos identificados en las nueve muestras de propóleos a través de HPLC-QQQ/MS/MS Compounds identified in the nine propolis samples via HPLC-QQQ / MS / MS
| Grupo | Masa | IP m/z1 | Compuesto | Ocurrencia2 |
| ÁCIDO | ||||
| 1 | 149 | (-)148.8 | Ácido cinámico; Ácido (E)-3-fenil-2-propenoico | 9 |
| 2 | 181 | 181 | Ácido cafeíco; Ácido (E)-3-(3,4-dihidroxifenil)prop-2-enoico | 2, 8, 9 |
| 3 | 193 | (+)194.20 | Ácido ferúlico; Ácido (E)-3-(4-hidroxi-3-metoxi-fenil)propil-2-enoico | 1,2,3,4,6,7,8,9 |
| CUMARINA | ||||
| 4 | 244 | 244.29 | Suberosina; 7-Metoxi-6- (3-metilbut-2-enil) cromen-2-ona | 4,6 |
| FLAVONOIDE | ||||
| 5 | 253 | (+)254.20 | Crisina; 5,7-Dihidroxi-2-fenil-4H-cromen-4-ona | 9 |
| 6 | 422 | 422.47 | Macarangina; 6-[(2E)-3,7-dimetilocta-2,6-dienil]-3,5,7-trihidroxi-2-(4-hidroxifenil)cromen-4-ona | 4,7,8,9 |
| FLAVANONA | ||||
| 7 | 255 | 255.30 | Pinocembrina; 5,7-Dihidroxi-2-fenil-2,3-dihidro-4H-cromen-4-ona | 2,3,6,8,9 |
| 8 | 272 | 272.20 | Naringenina; 5,7-Dihidroxi-2-(4 hidroxifenill)croman-4-ona | 2,3,5,6,7,8,9 |
| FLAVONA | ||||
| 9 | 269 | (+)271.8 | Apigenina; 5,7-dihidroxi-2-(4-hidroxifenil)cromen-4-ona | 3,9 |
| DITERPENO | ||||
| 10 | 301 | (-)300.70 | Totarolona; 7-hidroxi-1,1,4a-trimetil-8-propan-2-il-4,9,10,10a-tetrahidro-3H-fenantren-2-ona | 1,2,5,7,8,9 |
| TERPENOIDE | ||||
| 11 | 314 | 314.29 | Odoratina; 7-hidroxi-3-(3-hidroxi-4-metoxifenil)-6-metoxicromen-4-ona | 4,8,9 |
| NO IDENTIFICADO | ||||
| 12 | 550.3 | 1,3,4,6,7,8,9 | ||
| 13 | 633.1 | 1,3,4,6,7,8,9 | ||
| 14 | 702.5 | 2,3,6,9 | ||
| 15 | 727.70 | 1,3,4,6,7,8,9 | ||
| 16 | 734.70 | 1,3,4,6,7,8,9 |
1. Iones principales m/z: positivo [M+H]+ y negativo [M+H]-; 2 Presencia: Los números representan la presencia del compuesto en los extractos de propóleos. Las claves son las siguientes; MbTAP (1), MbTCIa (2), MsTCla (3), TaRSJ (4), SmTAP (5), SmRSJ (6), SmCAC (7), SmMAZ (8) y SmTCIb (9).
1. Principal m / z ions: positive [M + H] + and negative [M + H] -; 2 Occurrence: The numbers represent the presence of the compound in the propolis extracts. The keys are as follows: MbTAP (1), MbTCIa (2), MsTCla (3), TaRSJ (4), SmTAP (5), SmRSJ (6), SmCAC (7), SmMAZ (8) y SmTCIb (9).
Estudio de inhibición: Los resultados muestran que cuatro de los nueve extractos evaluados contra SARM fueron eficaces para inhibir el crecimiento de la bacteria durante las 24 h de la prueba (Tabla 4). Estos extractos pertenecen a las abejas sin aguijón Melipona solani (MsTCla) y Scaptotrigona mexicana (SmRSJ, SmMAZ y SmTCIb). El análisis estadístico no mostró diferencias entre los cuatro propóleos que resultaron positivos para inhibir a SARM (P > 0.05).
Tabla 4 Table 4 Porcentaje de inhibición de los extractos de propóleos contra Staphylococcus aureus resistente a meticilina (SARM), concentración mínima inhibitoria (CMI) y concentración efectiva 50 (CE50) expresada en mg mL-1 Inhibition percentage of propolis extracts against methicillin-resistant Staphylococcus aureus (MRSA), minimum inhibitory concentration (MIC) and effective concentration 50 (EC50) expressed in mg mL-1
| [Ext] | MbTAP | MbTCIa | TaRSJ | SmTAP | SmCAC | MsTCla | SmRSJ | SmMAZ | SmTCIb | As |
| 20 % | X | X | X | X | X | 100 | 100 | 100 | 100 | |
| CMI | 4 | 5 | 8 | 3 | 9 | |||||
| CE50 | 1.41 | 1.7 | 2.7 | 1 | 4.2 |
La ‘‘X’’ representa que no hubo inhibición contra SARM; [Ext]: Concentración del extracto; As: Allium sativum; M. solani (MsTCla) y S. mexicana (SmMAZ, SmTClb, SmTClb).
The ‘‘X’’ represents that there was no inhibition against MRSA; [Ext]: Concentration of the extract; As: Allium sativum; M. solani (MsTCla) and S. mexicana (SmMAZ, SmTClb, SmTClb).
Todos los propóleos a la dilución 1:4 tuvieron una concentración mínima inhibitoria (CMI) de 4 mg mL-1 (MsTCla), 5 mg mL-1 (SmRSJ), 8 mg mL-1 (SmMAZ) y 3 mg mL-1 (SmTClb). La concentración efectiva 50 (CE50) fue de 1.41, 1.7, 2.7 y 1 mg mL-1 respectivamente. En el caso de Allium sativum, se registró una CMI de 9 mg mL-1 y la CE50 de 4.2 mg mL-1 (Tabla 4) de acuerdo a lo descrito en la sección de materiales y métodos.
Combinaciones: Como se observa en los isobologramas (Fig. 2), para los cuatro extractos existe diferencia entre la combinación efectiva 50 teórica (CE50t) y la experimental (CE50e). El punto P representa la CE50t mientras que el punto Q representa la CE50e. Para el caso de la CE50e de los extractos de SmRSJ, SmMAZ, SmTClb, esta se encuentra por debajo de la línea de aditividad lo que significaría que la combinación de ambos extractos. Sin embargo, la CE50e de MsTCla se encontró por encima de la línea de aditividad, esto significaría que la combinación de ambos extractos produciría un efecto adverso en comparación de la aplicación individual tanto del propóleos como de Allium sativum.
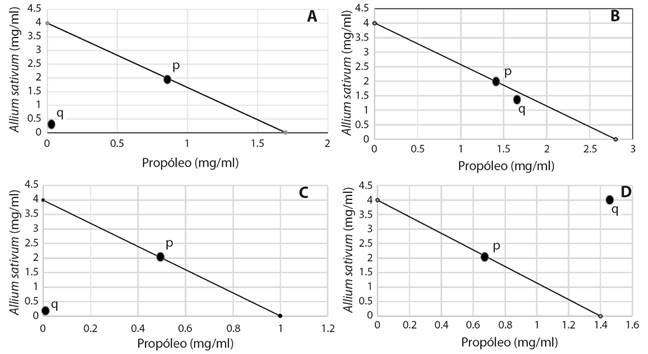
Fig. 2 Fig. 2 Isobologramas de los extractos de propóleos. Punto rojo: Concentración efectiva 50 teórica (zt). Punto negro: Concentración efectiva experimental (zmix). Isobolograms of propolis extracts. Red dot: Theoretical effective concentration 50 (zt). Black point: Experimental effective concentration (zmix).
Discusión
Los compuestos encontrados en los propóleos de abejas sin aguijón han sido reportados con actividad antimicrobiana y descritos mayoritariamente para propóleos de Apis mellifera (Bankova, De Castro, & Marcucci, 2000; Marcucci et al., 2001; Ristivojević et al., 2016).
El ácido cinámico, cafeíco y ferúlico se encuentran como constituyentes habituales en la composición química de los propóleos, principalmente los que se producen en regiones tropicales como Brasil (Dos Santos, Bicalho, & de Aquino Neto, 2003; Salomão et al., 2004; Sawaya, Souza, Marcucci, Cunha, & Shimizu, 2004). Además de estos ácidos aromáticos, también se encuentran los flavonoides y sus derivados tales como la crisina, macarangina, naringenina, pinocembrina y apigenina, compuestos recurrentes en la mayoría de los propóleos de A. mellifera y las abejas sin aguijón (Silici & Kutluca, 2005, Ahn, Kumazawa, Hamasaka, Bang, & Nakayama, 2004, Kumazawa, Hamasaka, & Nakayama, 2004, Lotti et al., 2010).
Los terpenos y sus derivados son otra clase de compuestos que comúnmente se encuentran dentro del perfil químico. La totarolona y odoratina han sido reportados en propóleos griegos (Popova, Dimitrova, Al-Lawati, Tsvetkova, Najdenski, & Bankova, 2009) y de Népal (Shrestha, Narukawa, & Takeda, 2007). Estos resultados concuerdan con los obtenidos en este trabajo, ya que la mayoría de los propóleos cuentan con la presencia de uno o más compuestos similares. Sin embargo, la relación en la que están dentro de la composición química de cada propóleos resulta en características específicas para cada uno (Bonvehí & Coll, 1994). Del compuesto doce al dieciséis no lograron ser identificados, sin embargo, se encuentran en la mayoría de todos los extractos, por lo que la identificación podría llevarse a cabo en futuras investigaciones. La suberosina, una lactona del ácido hidroxicinámico, ha sido reportada en propóleos de zonas como Argelia (Boutabet, Kebsa, Alyane, & Lahouel, 2011), Brasil (De Castro, 2001) e Irán (Trusheva et al., 2010).
Los valores de CMI encontrados en este estudio son similares a los reportados por otros autores, tanto para propóleos de A. mellifera como para las abejas sin aguijón. Estos valores van desde los 0.0025 mg mL-1 hasta los 9 mg mL-1 (Fernandes, Leomil, Fernades, & Sforcin, 2001, Miorin, Levy Junior, Custodio, Bretz & Marcucci, 2003, Castro et al., 2009). Tal es el caso del estudio realizado con M. orbignyi donde reportan una CMI de 3.1 mg mL-1 contra S. aureus (Campos et al., 2014), este resultado es similar a lo encontrado en el presente estudio y que además se encuentra dentro del rango de concentración reportado para otras especies de Melipona como es el caso del trabajo realizado con propóleos de M. scutellaris contra S. aureus así como la cepa resistente a meticilina el cual resultó en una CMI de 6.25-12.5 mg mL-1 (Da Cunha et al., 2013). Para el caso de Scaptotrigona, se realizó un trabajo con abejas del género Trigona encontrándose con valores de CMI en el rango de 1.21 a 4.87 µg mL-1 contra tres cepas del S. aureus (Choudhari, Punekar, Ranade, & Paknikar, 2012). Concentraciones menores en comparación con las CMI encontradas en este estudio.
El efecto antibacteriano de los propóleos evaluados en este estudio puede deberse a la vegetación en la zona de pecoreo de las abejas la cual influye tanto en la composición química así como la CMI de cada propóleos (Uzel, Önçağ, Çoğulu, & Gençay, 2005). La actividad de los propóleos tanto en extractos acuosos como alcohólicos puede deberse a la disolución de los compuestos con actividad antimicrobiana así como la volatilidad la que facilita el contacto con la pared celular de las bacterias, logrando así la reducción de los factores de virulencia de estas cepas (Hazem et al., 2017). Se ha demostrado que los propóleos son capaces de inhibir enzimas como coagulasa y lipasa, los cuales facilitan a la bacteria patógena poder infectar al huésped (Sprin & Bankova, 2011). Así mismo, los propóleos son capaces de actuar a nivel de ADN, inhibiendo la replicación e indirectamente la división celular, evitando así la proliferación de la bacteria (Takaisi-Kikuni & Schilcher, 1994).
Aunque existen datos sobre la actividad antimicrobiana de los propóleos de abejas sin aguijón, los resultados obtenidos pueden considerarse como los primeros datos reportados para M. solani y S. mexicana. Estos resultados se deben a que los propóleos han demostrado sinergismo entre sus componentes como se reporta en trabajos donde se analizaron tanto de forma integral, así como sus fracciones (Sforcin, Fernandes, Lopes, Bankova, & Funari, 2000, Santos et al., 2002).
Algo similar ocurre con el ajo ya que el mecanismo de A. sativum se basa principalmente en la acción de la Alicina que actúa parcialmente a nivel de ADN inhibiendo la síntesis de proteínas e inhibiendo totalmente la síntesis de ARN como su principal objetivo (Eja et al., 2007). Para el caso de Allium sativum, La CMI se encuentra dentro del rango de valores reportados por otros autores que trabajaron tanto con extractos etanolicos como acuosos. Estos valores pueden llegar hasta los 75 mg mL-1 (Iwalokun, Ogunledun, Ogbolu, Bamiro, & Jimi-Omojola, 2004, Betoni, Mantovani, Barbosa, Di Stasi, & Fernandes, 2006, Abubakar, 2009). Sin embargo, la actividad antimicrobiana de A. sativum dependerá de la relación entre sus componentes bioactivos como la alicina y los sulfuros. Un estudio realizado con alicina liquida reportó que concentraciones bajas (< 62.5 μg mL-1) de dicho compuesto, no mostró actividad antimicrobiana contra S. aureus; mientras que a 250 μg mL-1 o cercano a esta concentración fueron las más activas (Cutler & Wilson, 2004). En el caso de los sulfuros, a mayor número de puentes disulfuros, mayor actividad antimicrobiana reflejan los compuestos. Un trabajo realizado con aceite de ajo reveló que una concentración alta de tetrasulfuro de dialilo puede conllevar a una mayor actividad antimicrobiana (Tsao & Yin, 2001). Dichos trabajos realizados pueden dar dilucidar porqué A. sativum demostró una actividad antimicrobiana débil.
El análisis del índice de interacción mostró un efecto aditivo para los 3 propóleos de S. mexicana en combinación con A. sativum. Trabajos donde se ha combinado el propóleos con otras sustancias orgánicas como Lippia graveolens y el propio A. sativum han resultado en efectos sinérgicos (ɤ < 1) (Noori, Al-Ghamdi, Ansari, Al-Attal, & Salom, 2012, Moreno et al., 2014). Aunque el resultado que se obtuvo no sea de carácter sinérgico, podemos decir que la acción individual del propóleos es igual de efectiva que en su combinación. Incluso podría utilizarse en cantidades menores a la CE5O de ambos materiales vegetales. Por otro lado, también se han realizado trabajos de combinación del propóleos con antibióticos como Ciprofloxacino y Levofloxacino donde la actividad antibacterial se vio afectada (Lozano, López, Luis, Pacheco, & Guillén, 2014). Algo similar ocurrió en nuestro estudio dado que la combinación del propóleos de M. solani y A. sativum dio como resultado un índice de interacción menor a la unidad (0.3). Una explicación a esto sería que el propóleos solo actúa de manera positiva con otros compuestos que actúen a nivel de pared celular y el mecanismo de acción del propóleos de M. solani sea distinto al de A. sativum o existan otros factores propios de dicho material que disminuyen su actividad al estar presente a los compuestos de A. sativum. Estas aseveraciones están basadas en la poca información que existe con base a la combinación del propóleos con otras sustancias orgánicas por lo que se requiere seguir investigando los mecanismos de acción en este tipo de estudios.
El efecto aditivo en las combinaciones demostró que de forma individual cada compuesto es igual de efectivo que en al realizar la combinación, y este representa un potencial para inhibir cepas de Staphylococcus aureus resistente a meticilina.
Declaración de ética: los autores declaran que todos están de acuerdo con esta publicación y que han hecho aportes que justifican su autoría; que no hay conflicto de interés de ningún tipo; y que han cumplido con todos los requisitos y procedimientos éticos y legales pertinentes. Todas las fuentes de financiamiento se detallan plena y claramente en la sección de agradecimientos. El respectivo documento legal firmado se encuentra en los archivos de la revista.












 uBio
uBio